Los diferentes puntos de referencia óseos y de tejidos blandos y las estructuras micro y macroscópicas de la rodilla siguen siendo objeto de estudio y análisis. Al revisar la literatura más reciente observamos el amplio espectro de estudios que buscan definir los diferentes aspectos anatómicos del ligamento anterior cruzado (LAC).
ObjetivoEl objetivo de este trabajo es revisar las publicaciones más recientes sobre el LAC y su morfología en las que se aborda su composición microscópica y su anatomía macroscópica.
ResultadosEl LAC está formado por matriz colágena tipoI (90%) y tipoIII (10%). Su longitud oscila entre 27 y 38mm y su anchura, entre 10 y 12mm. El área de sección transversal del LAC mide una media de 44mm2 y su forma se asemeja a la de un reloj de arena o una pajarita. Los haces del LAC se han definido como anteromedial, intermedio y posterolateral. Se ha observado que las huellas femoral y tibial presentan un alto grado de variabilidad en cuanto a forma y tamaño. Además, el riego sanguíneo viene dado por la arteria genicular medial, y la inervación, por las ramas del nervio tibial. Además, el LAC impide funcionalmente la traslación anterior de la tibia y estabiliza frente a la rotación interna de la tibia y la angulación en valgo de la rodilla.
ConclusionesExiste una gran variabilidad en la anatomía del LAC, así como en sus lugares de fijación. Al mismo tiempo, la forma y el tamaño de su huella se han convertido en un factor determinante a la hora de individualizar la reconstrucción del LAC. La persistencia de la variabilidad morfológica en el envejecimiento del LAC y los aspectos importantes de la planificación quirúrgica y la toma de decisiones con respecto a los factores de riesgo anatómicos sugieren la necesidad de realizar más estudios.
The different bony and soft tissue reference points and the micro and macroscopic structures of the knee continue to be the object of focused study and analysis. Upon reviewing the most recent literature, we saw the wide spectrum of studies that seek to define the different anatomical aspects of the anterior cruciate ligament (ACL).
PurposeThe purpose of this paper is to review the most recent publications on the ACL and its morphology in which its microscopic composition and macroscopic anatomy are addressed.
ResultsThe ACL consists of typeI (90%) and typeIII (10%) collagen matrix. Its length ranges from 27 to 38mm and its width from 10 to 12mm. The ACL cross-section area measures an average of 44mm2, and its shape resembles that of an hourglass or a bow tie. ACL bundles have been defined as anteromedial, intermediate, and posterolateral. Femoral and tibial footprints were seen to present a high degree of variability in shape and size. Furthermore, the blood supply is given by the medial genicular artery and innervation by the tibial nerve branches. Additionally, the ACL functionally prevents anterior translation of the tibia and stabilizes against the internal rotation of the tibia and valgus angulation of the knee.
ConclusionsThere is great variability in the anatomy of the ACL as well as its attachment sites. At the same time, the shape and size of its footprint has become a factor in determining individualized ACL reconstruction. The persistence of morphological variability in the aging of the ACL and important aspects of surgical planning and decision making with respect to anatomical risk factors suggest that further studies are called for.
Las primeras descripciones conocidas de las estructuras ligamentosas y los tejidos blandos de la rodilla se encuentran en los rollos de papiros egipcios de alrededor de 3000a.C. Más tarde, en la era romana, Galeno (129-216 d.C.) utilizó el término ligamenta genucruciate para referirse a lo que denominamos actualmente el ligamento anterior cruzado (LAC)1. Históricamente, los anatomistas han seguido proponiendo continuamente descripciones morfológicas y biomecánicas. En 1836, Wilhelm y Eduard Weber2 publicaron un artículo sobre la anatomía y la fisiología de la extremidad inferior. Casi un siglo después, en 1921, Testut y Jacob describieron la sustancia media grasa del LAC y su relación con el cuerno anterior del menisco lateral y la inserción tibial del LAC. En el último caso, se enfatizó la relación de la fisiología normal de las estructuras de la rodilla y las complicaciones funcionales de esta articulación tras las lesiones3.
Hoy en día, siguen describiéndose y analizándose los diferentes puntos de referencia óseos y del tejido blando y las estructuras micro y macroscópicas de los elementos articulares de la rodilla. Esto se refleja en el hecho de que en los últimos diez años se han publicado más de 2.700 artículos sobre la anatomía del LAC, y cerca de 14.900 artículos que cubren las diferentes cuestiones relacionadas con el mismo. También se ha estudiado ampliamente durante décadas la complejidad de su biomecánica en los individuos sanos, tras una lesión, o tras el tratamiento quirúrgico. Además, también se han examinado los posibles factores de riesgo, debido a la predisposición anatómica en ciertos grupos de individuos, junto con las modificaciones resultantes de las técnicas de reconstrucción tras las lesiones del LAC4.
El propósito de este trabajo fue revisar las publicaciones más recientes, durante los últimos cinco años, sobre el LAC y su morfología. El objetivo se centró en el examen de su composición microscópica y anatomía macroscópica, sus puntos de inserción femoral y tibial, los puntos de referencia óseos más relevantes, su biomecánica, así como el riego sanguíneo y la innervación de esta estructura anatómica.
Mientras revisábamos la literatura más reciente pudimos ver el amplio espectro de estudios en curso que tratan de definir cada una de las características anatómicas del LAC, sus diferencias en poblaciones específicas y la creciente consensualización de la terminología y las características específicas del LAC. Ello incluye la estructura, la forma y la localización de los sitios de inserción femoral y tibial, el número de haces y características de la sustancia media, el riego sanguíneo y la inervación entre las diferentes variantes anatómicas de este ligamento, y sus porcentajes reportados.
Características anatómicas generalesComo definición amplia, el LAC ha sido descrito como una estructura única que conecta la articulación tibial y femoral5. Tiene su origen en la meseta tibial, en posición anterior y entre las eminencias intercondíleas, prosiguiendo posteriormente para unirse a la porción posteromedial del cóndilo femoral lateral6,7.
El LAC tiene su propia membrana sinovial, pero sigue considerándose una estructura intraarticular6. Caracterizado por su singularidad, el LAC está inmanentemente sujeto a variaciones tanto anatómicas como morfológicas, así como al envejecimiento fisiológico8,9.
Anatomía microscópicaEn cuanto a su histología, el LAC está formado por matrices colágenas de tipoI (90%) y de tipoIII (10%) altamente organizadas, que representan aproximadamente el 75% de su peso seco. Dicho colágeno se ordena en múltiples haces de fibra de 20lm, formados por grupos que oscilan entre 20lm y 400lm de diámetro. Existen otras sustancias que componen el 25% restante del peso seco del LAC. El agua supone el 60% de su peso neto, en condiciones fisiológicas1.
Las inserciones ligamentosas y tendinosas en el hueso tienen una estructura distintiva que consiste en fibrillas colágenas colindantes con las fibrillas óseas10. Estos sitios de inserción se dividen en una estructura de cuatro capas de histología mixta, que se compone de células de tipo condrocítico integradas con tenocitos de apariencia típica. Dichas capas incluyen también fibrocartílagos ligamentosos, fibrocartilaginosos y mineralizados, así como la placa ósea subcondral1.
Haces del LACEn un primer momento, el LAC se consideró una estructura homogénea individual. En 1938, Ivar Palmer realizó la primera descripción del LAC de dos haces11. Sin embargo, esta descripción de doble haz no fue bien conocida durante varias décadas1. Dichos dos haces se definen de manera clásica como los haces anteromedial (AM) y posterolateral (PL)5,6,10. A menudo se distinguen por una vaina de tejido entre los haces, y las localizaciones dispares de sus sitios de inserción5. Ambos haces son denominados de acuerdo con su fijación relativa a la tibia. De manera específica, los tubérculos intercondilares medial y lateral de la tibia han sido descritos como los sitios de fijación distal para ambos haces del LAC6.
A pesar de que la existencia de los haces anteromedial y posterolateral del LAC está ampliamente aceptada, los hallazgos de la investigación reciente sugieren que el LAC es una estructura con haces triples4-6,10,12. En dichos estudios, los haces han sido definidos habitualmente como anteromedial, intermedio y posterolateral. La investigación previa ha encontrado que hasta el 26% de las rodillas tienen un único haz12, mientras que los resultados de MacKay et al.13 reflejaron el hallazgo de un haz intermedio mediante visualización de imagen de resonancia magnética (IRM) en cerca del 20% de los 73 pacientes estudiados5. Sin embargo, diversos estudios no fueron capaces de confirmar (anatómica o histológicamente) la presencia de un haz intermedio distintivo en muestras de humanos12.
Longitud del LACLa longitud es una de las métricas más comúnmente reportadas de la morfología del LAC. Los primeros estudios de la longitud del LAC implicaron el uso de radiografías, agujas de Kirschner o un digitalizador para recopilar medidas. Recientemente ha emergido la IRM como estándar de medida5,8.
Los estudios anatómicos del LAC y sus haces han reflejado que su longitud fluctúa entre 27 y 38mm (longitud que puede variar dependiendo de la posición de la rodilla) y de 10 a 12mm de anchura, mientras que la longitud de los haces anteromedial y posterolateral fluctúa de 6 a 7mm y de 5 a 6mm de anchura, respectivamente1,6,8,14.
Morfología de la sustancia mediaEn 2012, el ACL Study Group describió el LAC como una estructura con un aspecto «parecido a una cinta»4. La sustancia media del ligamento tiene una sección cruzada redondeada o elíptica, con un ismo oval y áreas mayores de inserción. Por tanto, el LAC ha sido también descrito como estructura con forma de reloj de arena o pajarita en estudios realizados en cadáveres de muestras de pacientes mayores5. Cuando está flexionado y se contempla desde el frente, el LAC tiene un aspecto retorcido, destrenzándose este giro a medida que se extiende la rodilla4.
Las áreas transversales del ligamento varían con respecto a la longitud del LAC, con una medida de la sección cruzada de la sustancia media de aproximadamente 44mm2, mientras que el tamaño de los sitios de origen e inserción del LAC puede casi triplicar el tamaño de dicha área1. En diversos estudios con datos combinados de hombres y mujeres, el área transversal media del LAC ha oscilado de 30 a 53mm25.
También se han descrito cambios histopatológicos degenerativos de los haces del LAC con el envejecimiento en rodillas con osteoartritis, presentando dichos pacientes un ligamento más débil y delgado8.
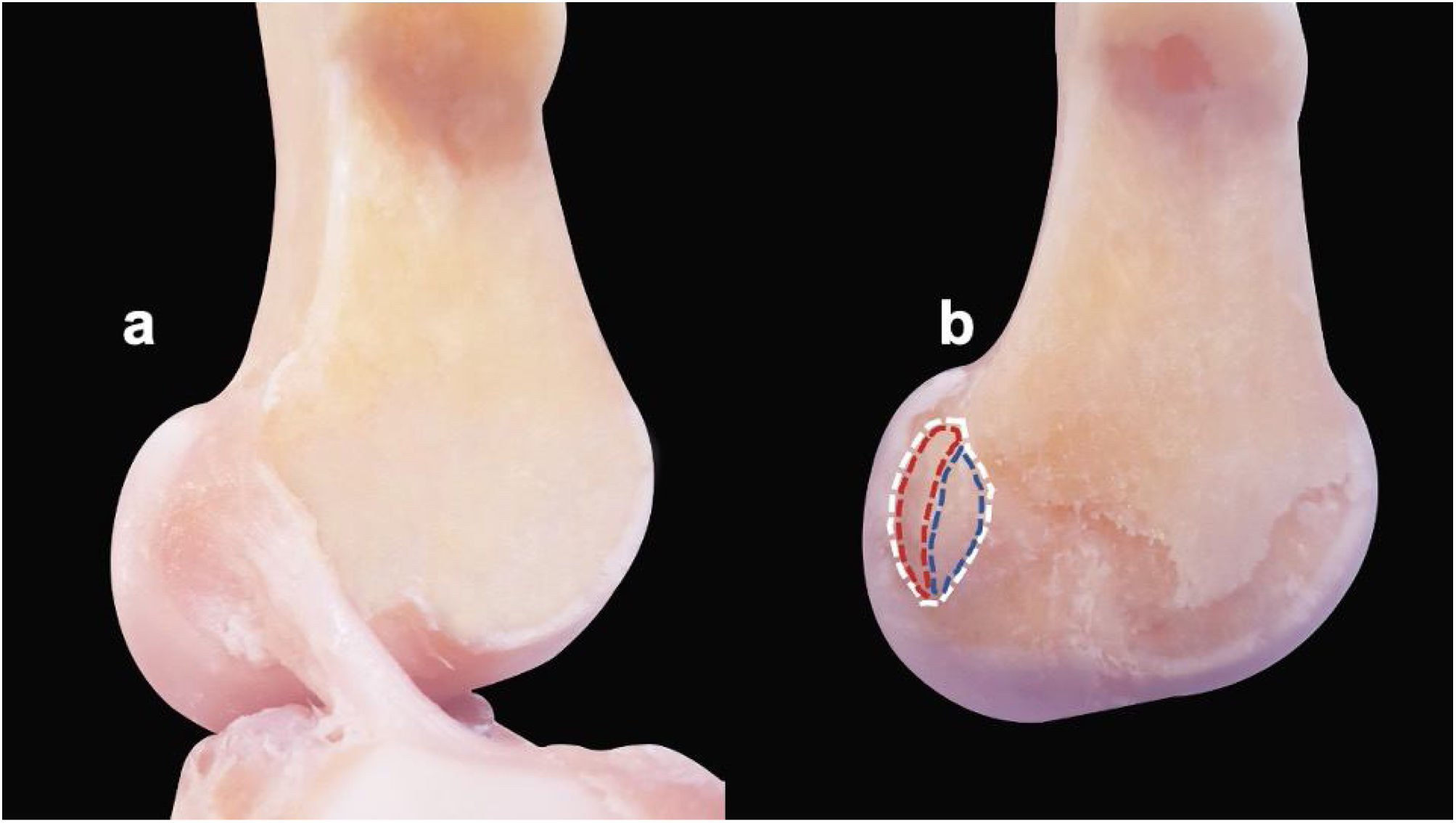
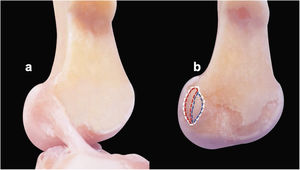
Huellas femoral y tibialExiste una gran variación de las huellas del LAC a nivel tibial y femoral entre individos8. En el fémur, la cresta intercondílea lateral (también denominada cresta del residente) y la cresta bifurcada lateral (también denominada cresta cruzada) pueden utilizarse para identificar los puntos de fijación precisos de ambos haces en el cóndilo femoral lateral. Dichos sitios de fijación de ambos haces están separados por la cresta bifurcada lateral, que se localiza justamente en posición posterior a la cresta intercondílea lateral6 (fig. 1).
Sitios de inserción femoral del LAC en los especímenes, antes y después de cortar el ligamento. a)LAC con morfología oval/elíptica y fijaciones tibial y femoral intactas. b)LAC extraído, que muestra la huella femoral (línea discontinua blanca) con su borde anterior formado por la cresta intercondílea lateral (cresta del residente) y margen articular posterior del cóndilo femoral lateral que forma su borde posterior en la misma línea de la cortical femoral posterior. La línea discontinua azul marca la inserción directa y la línea discontinua roja representa la inserción indirecta de tipo abanico.
Las revisiones sistemáticas que incluyen estudios anatómicos, cadavéricos y radiológicos han ayudado a esclarecer de manera independiente la anatomía de las huellas femoral y tibial del LAC12.
Huella femoralLa localización central de la huella femoral es de aproximadamente el 43% de la longitud de proximal a distal del cóndilo femoral lateral dentro de la escotadura intercondílea12. Los estudios del sitio de inserción femoral han mostrado que el tamaño de esta área transversal fluctúa entre 60 y 130mm8.
La huella femoral del LAC tiene forma de media luna. Su borde anterior está delineado por la cresta intercondílea lateral (cresta del residente). El margen articular posterior del cóndilo femoral lateral delinea su borde posterior, en la misma línea de la cortical femoral posterior4. Se han descrito dos tipos de inserciones de las fibras del LAC en su fijación femoral. Existen el «tipo directo», formado por fibras densas de sustancia media que se fijan a un área oval estrecha en el cóndilo lateral, permitiendo la disipación gradual de fuerzas con una unión mucho más fuerte, y el «tipo indirecto». Se trata de una fijación de fibras delgadas, membranosas y periféricas que se despliegan hacia el cóndilo posterolateral, en el que el ligamento se inserta en el hueso mediante fibras colágenas sin una zona transicional que incremente el sitio del área de inserción (extensión de tipo abanico). De este modo, realiza una conexión más débil9,15. Las fibras del haz intermedio forman una espiral alrededor del centro del LAC, y seguidamente se estrechan y aplanan mediolateralmente cerca de la huella femoral14.
En un estudio previo establecimos que la inserción femoral del LAC presenta variaciones de su morfología con el tiempo. Pasa de tener una forma grande y semicircular en los sujetos jóvenes a una forma más pequeña y aplanada con aspecto de cinta en los sujetos mayores9. Este hallazgo, así como los hallazgos de otras publicaciones diversas, destaca la necesidad de investigación futura en muestras de sujetos jóvenes8,9,16,17.
Huella tibialEl centro de la huella tibial del LAC se sitúa a una distancia de 15mm anterior al ligamento posterior cruzado y a dos quintos de la anchura de medial a lateral de la distancia interespinosa12. El sitio de inserción tibial es más grande, y los hallazgos de estudios recientes describen el área transversal con un tamaño de entre 100 y 160mm28.
Se han descrito tres formas principales del sitio de inserción tibial (oval/elíptica, triangular y con forma deC), siendo más amplio posteriormente y situado anteriormente en el área intercondílea. También se han reportado otros tipos de morfologías, tales como forma de bota, forma deL, forma deJ y forma deC doble. Sin embargo, la mayoría de los individuos presentan formas del sitio de inserción elípticas, seguidas de triangulares y con forma deC4,8,16.
La fijación tibial está orientada en dirección oblicua. Es más amplia que la fijación femoral, y se inserta en una tira bien marcada, adyacente al cuerno anterior del menisco lateral10,14.
El haz anteromedial está situado en el aspecto anteromedial de la inserción tibial, en el que su borde medial es el margen anteromedial de la superficie articular del cóndilo tibial medial. Se piensa que el haz posterolateral está situado en el aspecto posterolateral del área intercondílea, siendo su borde lateral el margen medial de la superficie articular del cóndilo tibial lateral4. El haz intermedio tiene su fijación en la región central de la huella tibial14.
Se ha encontrado que la medida de la anchura de la huella de inserción tibial es de 12,6mm (7,7-16,3) de media, con un espesor medio de 3,3mm (2,5-3,9)4.
La huella tibial del LAC muestra también variaciones morfológicas entre especímenes cadavéricos jóvenes y mayores16.
Riego sanguíneoLa arteria genicular media es la irrigación sanguínea primaria del LAC. Sin embargo, también contribuyen en cierta medida las dos arterias geniculares inferiores y la difusión a través de la vaina sinovial del LAC6,10.
Un tabique de tejido conectivo que contiene células madre vasculares separa los haces AM y PL. Esta membrana contiene vasos periligamentosos que penetran transversalmente en el ligamento y se anastomizan con una red longitudinal de vasos endoligamentosos que vascularizan el LAC1.
InervaciónEl LAC está inervado por el nervio tibial, que presenta terminaciones nerviosas que perforan la cápsula posterior y recorren la vía ligamentosa cercana a la membrana sinovial. También contribuyen a la inervación los vasos que aportan mecanorreceptores que contribuyen a la función propioceptiva del LAC6,18,19. Existen fibras del dolor mínimas en el LAC, lo cual explica por qué raramente existe dolor tras un desgarro del LAC agudo si no se desarrolla hemartrosis6.
BiomecánicaFuncionalmente, el LAC cumple diversas funciones. Previene la traslación anterior de la tibia al fémur, actúa como estabilizador secundario frente a la rotación interna de la tibia y la angulación en valgo de la rodilla. Sostiene el movimiento biomecánico normal de la rodilla para impedir el daño meniscal. Los dos haces que incluye el LAC tienen funciones únicas que permiten la biomecánica normal del mismo. El haz anteromedial está tirante en la flexión, mientras que el haz posterolateral lo está en la extensión6. Las propiedades anatómicas y biomecánicas del haz intermedio son similares a las del haz AM1.
En extensión total, el LAC absorbe el 75% de la carga de traslación anterior, y el 85% entre 30 y 90grados de flexión. La pérdida del LAC causa una reducción de la magnitud de esta rotación acoplada durante la flexión y la rodilla inestable. La fuerza de tensión media del LAC es de ∼2.200N, pero se ve alterada con la edad y las cargas repetitivas6.
Relevancia clínica de los estudios anatómicos actuales del LACReconstrucción anatómica individualizada del LACEl objetivo quirúrgico de la reconstrucción anatómica del LAC es imitar, de la mejor manera posible, la anatomía original del ligamento para recuperar la función de la rodilla. Ello significa la restauración de las dimensiones, la orientación colágena y los sitios de inserción originales9,20.
La reconstrucción anatómica del LAC se basa en cuatro principios fundamentales: 1)restaurar los haces anteromedial y posterolateral; 2)restaurar los sitios de inserción del LAC originales alineando los túneles en las posiciones anatómicas adecuadas; 3)tensionar cada haz debidamente, y 4)adaptar la reconstrucción a cada paciente, garantizando la definición del diámetro del túnel y el tamaño del injerto de acuerdo con las características de sus sitios de inserción originales1.
La forma de los sitios de inserción se ha convertido en un factor definitorio individualizado de la reconstrucción del LAC. Existen diversos estudios que sugieren que las diferentes formas pueden requerir diferentes tipos de reconstrucción para garantizar la restauración de la huella adecuada8,16. Una huella tibial «con forma deC» puede restaurarse mejor utilizando una técnica de doble haz, mientras que la huella tibial «elíptica» puede restaurarse suficientemente utilizando una técnica de haz simple16.
Dimitris et al. afirmaron que el origen femoral del haz AM está localizado más posteriormente en la misma dirección próximo-distal, mientras que el origen del haz PL se localiza más distalmente en aproximadamente la misma dirección anterior-posterior en las rodillas con rotura del LAC, en comparación con las rodillas con LAC intacto. El túnel femoral para la reconstrucción del LAC deberá ser profundo (proximal) y alto (anterior) en la escotadura intercondílea dentro de la región del haz anteromedial de la huella femoral del LAC, ya que las fibras que integran el resto de la huella femoral tienen una fijación más débil y asumen menor carga9.
La reconstrucción anatómica con técnica de doble haz ha ganado popularidad durante la última década. Como resultado, diversos estudios biomecánicos, con seguimiento a corto plazo, reportan que esta técnica restaura más estrechamente la cinemática de la rodilla. Además, los estudios clínicos han demostrado resultados superiores en términos de laxitud de la rodilla y fracaso del injerto, en comparación con la reconstrucción con técnica de haz simple21. Requiere un conocimiento detallado de la anatomía de los haces anteromedial y posterolateral en los pacientes con rotura del LAC, ya que pueden existir diferencias potenciales entre las rodillas con rotura del LAC y las rodillas sanas. Sin embargo, los estudios más recientes con al menos cinco años de seguimiento han mostrado resultados similares a medio y a largo plazo. No se ha observado que la reconstrucción anatómica con técnica de doble haz fuera más efectiva a la hora de prevenir la progresión de osteoartrosis u obtener un resultado clínico mejor que la técnica de haz simple22–24.
Envejecimiento del LACSe están incrementando la vida media y la esperanza de vida, así como el nivel de actividad física en la población mayor. Esto ha originado un aumento de las lesiones relacionadas con el deporte en poblaciones mayores, con altas expectativas de retornar al nivel de actividad previo a la lesión17.
Caracterizado por su carácter único individual, el LAC está inherentemente sujeto a variaciones anatómicas y morfológicas, así como al envejecimiento fisiológico8,9,16. Por tanto, la reconstrucción quirúrgica del LAC se aplica de manera más amplia. Hoy en día, los pacientes mayores de 50años de edad que requieren reconstrucción quirúrgica del LAC representan una cuota significativa, concluyendo los estudios que este procedimiento muestra buenos resultados en términos de alivio sintomático, restauración de la función y retorno a la actividad deportiva17.
Factores morfológicos importantes relacionados con el envejecimiento del LAC son sus huellas femoral y tibial, así como la degeneración de los haces. Las fibras femorales indirectas de tipo abanico se incrementan con la edad, debido a la degeneración de las directas, favoreciendo una fijación más débil en los pacientes de mayor edad9. Ambos haces del LAC experimentan envejecimiento, con cambios degenerativos en el 53% de los haces AM y el 78% de los haces PL. Dado que estos últimos muestran cambios más severos, se ha sugerido la presencia de estenosis de la escotadura intercondílea y osteófitos de la escotadura intercondílea9,25.
Algunas técnicas de reconstrucción del LAC han modificado los túneles redondos femorales convencionales, sustituyéndolos con formas que se asemejan a un túnel plano y rectangular, utilizando un injerto de tendón del cuádriceps o bien un injerto de tendón de la corva «plano», al objeto de proporcionar una ventaja biomecánica26. Sin embargo, es importante considerar los cambios de configuración de la morfología del LAC de acuerdo con la edad de los pacientes, ya que las diferentes características del LAC relacionadas con la edad pueden no ajustarse a la técnica de reconstrucción propuesta.
ConclusiónExiste gran variabilidad en cuanto a la anatomía del LAC y sus sitios de fijación. Al mismo tiempo, la forma y el tamaño de la huella se han convertido en un factor para establecer la reconstrucción individualizada del LAC. La persistencia de la variabilidad morfológica relativa al envejecimiento del LAC y los aspectos importantes de la planificación y de la toma de decisión quirúrgica entre los factores de riesgo anatómico dejan una puerta abierta a estudios futuros.
FinanciaciónLos autores certifican la ausencia de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.