La infección por el coronavirus SARS-CoV-2, causante de la enfermedad denominada COVID-19, provoca alteraciones fundamentalmente en el sistema respiratorio. En los pacientes graves, con frecuencia la enfermedad evoluciona a un síndrome de distrés respiratorio agudo que puede predisponer a los pacientes a un estado de hipercoagulabilidad, con trombosis tanto a nivel venoso como arterial. Esta predisposición presenta una fisiopatología multifactorial, relacionada tanto con la hipoxia como con el grave proceso inflamatorio ligado a esta patología, además de los factores trombóticos adicionales presentes en muchos de los pacientes.
Ante la necesidad de optimizar el manejo de la hipercoagulabilidad, los grupos de trabajo de las sociedades científicas de Anestesiología-Reanimación y Terapéutica del Dolor (SEDAR) y de Medicina Intensiva, Crítica y de Unidades Coronarias (SEMICYUC) han desarrollado un consenso para establecer unas pautas de actuación frente a las alteraciones de la hemostasia observadas en los pacientes graves COVID-19. Estas recomendaciones incluyen la profilaxis de la enfermedad tromboembólica venosa en pacientes graves y en el periparto, el manejo de los pacientes en tratamiento crónico con fármacos antiagregantes o anticoagulantes, de las complicaciones hemorrágicas en la evolución de la enfermedad y de la interpretación de las alteraciones generales de la hemostasia.
The infection by the coronavirus SARS-CoV-2, which causes the disease called COVID-19, mainly causes alterations in the respiratory system. In severely ill patients, the disease often evolves into an acute respiratory distress syndrome that can predispose patients to a state of hypercoagulability, with thrombosis at both venous and arterial levels. This predisposition presents a multifactorial physiopathology, related to hypoxia as well as to the severe inflammatory process linked to this pathology, including the additional thrombotic factors present in many of the patients.
In view of the need to optimise the management of hypercoagulability, the working groups of the Scientific Societies of Anaesthesiology-Resuscitation and Pain Therapy (SEDAR) and of Intensive, Critical Care Medicine and Coronary Units (SEMICYUC) have developed a consensus to establish guidelines for actions to be taken against alterations in haemostasis observed in severely ill patients with COVID-19. These recommendations include prophylaxis of venous thromboembolic disease in these patients, and in the peripartum, management of patients on long-term antiplatelet or anticoagulant treatment, bleeding complications in the course of the disease, and the interpretation of general alterations in haemostasis.
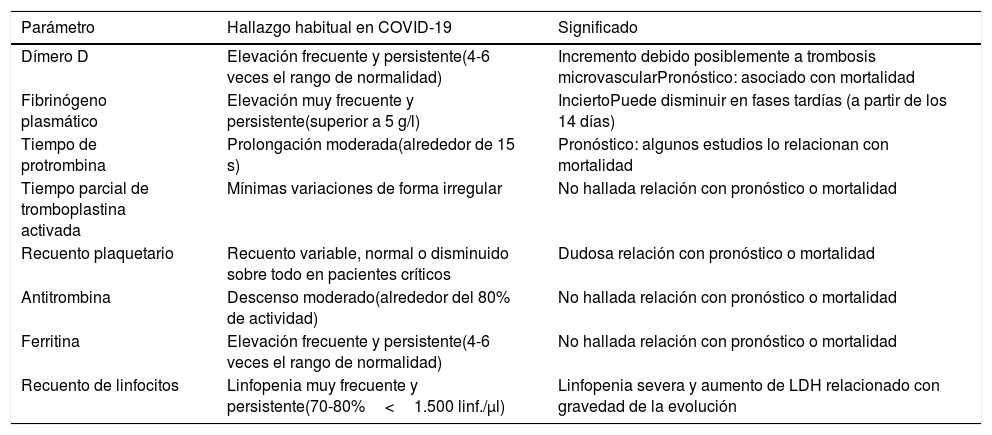
La infección por el coronavirus SARS-CoV-2 se asocia con frecuencia a alteraciones de determinados parámetros hematológicos cuando evoluciona a COVID-19, con un patrón típico descrito en la tabla 11-7.
Alteraciones hematológicas frecuentes en los pacientes con COVID-19
| Parámetro | Hallazgo habitual en COVID-19 | Significado |
|---|---|---|
| Dímero D | Elevación frecuente y persistente(4-6 veces el rango de normalidad) | Incremento debido posiblemente a trombosis microvascularPronóstico: asociado con mortalidad |
| Fibrinógeno plasmático | Elevación muy frecuente y persistente(superior a 5 g/l) | InciertoPuede disminuir en fases tardías (a partir de los 14 días) |
| Tiempo de protrombina | Prolongación moderada(alrededor de 15 s) | Pronóstico: algunos estudios lo relacionan con mortalidad |
| Tiempo parcial de tromboplastina activada | Mínimas variaciones de forma irregular | No hallada relación con pronóstico o mortalidad |
| Recuento plaquetario | Recuento variable, normal o disminuido sobre todo en pacientes críticos | Dudosa relación con pronóstico o mortalidad |
| Antitrombina | Descenso moderado(alrededor del 80% de actividad) | No hallada relación con pronóstico o mortalidad |
| Ferritina | Elevación frecuente y persistente(4-6 veces el rango de normalidad) | No hallada relación con pronóstico o mortalidad |
| Recuento de linfocitos | Linfopenia muy frecuente y persistente(70-80%<1.500 linf./μl) | Linfopenia severa y aumento de LDH relacionado con gravedad de la evolución |
Se han planteado diversas hipótesis para justificar este patrón de comportamiento hematológico8. En ellas se han implicado un estado de hipercoagulabilidad, una reactividad propia de la inflamación grave con endotelitis como consecuencia directa de la acción del virus y la propia situación de hipoxia derivada del distrés frecuentemente presente9,10. En todo caso, parece cierto que los pacientes con COVID-19 grave presentan un riesgo elevado de desarrollo de complicaciones cardiovasculares. Destacan en particular los eventos trombóticos, habiéndose descrito una incidencia global de tromboembolia venosa de alrededor del 25%11 y una incidencia de complicaciones trombóticas en pacientes críticos del 31%12. Además, se ha objetivado que un incremento de la trombosis microvascular a nivel pulmonar podría tener un papel importante en el curso de la insuficiencia respiratoria11,13.
Por otro lado, la presencia de enfermedad cardiovascular previa es un factor de riesgo de enfermedad grave y de mortalidad. Además, para el manejo de estos pacientes se debe tener en cuenta la interacción potencial de su tratamiento habitual con fármacos utilizados en el tratamiento de la COVID-19, por lo que se pueden requerir modificaciones del tratamiento habitual.
En estas circunstancias, es importante establecer la terapia anticoagulante profiláctica o terapéutica que pueda beneficiar a estos pacientes. El objetivo de los autores, con la limitación que la falta de evidencia supone, es ofrecer recomendaciones de manejo para estos pacientes, que deberán ser revisadas y modificadas según la experiencia clínica y la aparición de nuevas evidencias.
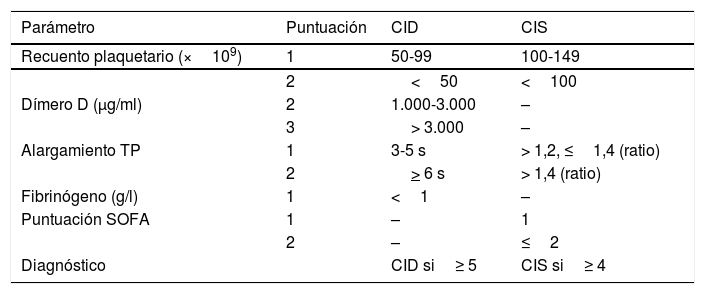
Riesgo trombótico de los pacientes con COVID-19Analizando el patrón característico de aumento de DD y de fibrinógeno, se puede inferir la sospecha de una situación de incremento de la actividad procoagulante que conlleva como consecuencia un incremento de la actividad fibrinolítica. Fisiopatológicamente, pueden coexistir una situación de coagulación intravascular diseminada (CID) junto a lo que se ha denominado «coagulopatía inducida por la sepsis» (CIS)14-16 (tabla 2). A este respecto, la literatura es escasa y, aplicando los puntos de corte del DD previamente propuestos para pacientes críticos17, se ha descrito la presencia de CID en solo el 8,7% de casos (16 de 183 pacientes). Sin embargo, se encontró en el 71% de los pacientes que fallecieron2. El aumento de DD se ha visto relacionado, no solo con mayor gravedad clínica (deterioro de la insuficiencia respiratoria), sino también a un aumento de la vascularización pulmonar y el desarrollo de microtrombos en su interior18.
Escala de valoración adaptada para el diagnóstico de CID y de CIS (14-16), con los puntos de corte definidos para pacientes críticos (17)
| Parámetro | Puntuación | CID | CIS |
|---|---|---|---|
| Recuento plaquetario (×109) | 1 | 50-99 | 100-149 |
| 2 | <50 | <100 | |
| Dímero D (μg/ml) | 2 | 1.000-3.000 | – |
| 3 | > 3.000 | – | |
| Alargamiento TP | 1 | 3-5 s | > 1,2, ≤1,4 (ratio) |
| 2 | > 6 s | > 1,4 (ratio) | |
| Fibrinógeno (g/l) | 1 | <1 | – |
| Puntuación SOFA | 1 | – | 1 |
| 2 | – | ≤2 | |
| Diagnóstico | CID si≥ 5 | CIS si≥ 4 |
Los pacientes con enfermedad grave relacionada con la infección por SARS-CoV-2, particularmente los ingresados en las unidades de críticos (UCC), se encuentran habitualmente en reposo, conectados a ventilación mecánica, bajo sedación y, con frecuencia, en tratamiento con bloqueantes neuromusculares. Además, la hipoxia y la actividad inflamatoria propia de esta enfermedad pueden determinar una situación procoagulante, con implicación de múltiples mediadores, que se ha documentado en casos de sepsis19. Por ello, se puede decir que estos pacientes presentan un riesgo particularmente elevado de desarrollo de enfermedad tromboembólica venosa (ETEV), siendo necesario que se evalúe este en todos los casos11,20. En el momento actual, los resultados publicados en algunos trabajos hacen suponer una tendencia al aumento de la ETEV en los pacientes con COVID-1912,21-24. Algunas referencias publicadas hasta el momento sugieren que la administración de las heparinas de bajo peso molecular (HBPM) puede ser beneficiosa en estos pacientes2,12, aunque quizás no de forma indiscriminada y no en todos los pacientes, con un mayor beneficio conforme aumentan los niveles de DD, independientemente de que cumplieran o no criterios de CID25. En este estudio, el análisis multivariante concluyó que los 3factores de riesgo independientes de mortalidad a los 28 días eran el aumento de DD, el alargamiento del TP y la disminución del recuento plaquetario. Además, se observó una menor mortalidad en los pacientes tratados con HBPM o heparina no fraccionada (HNF) a los 28 días, en aquellos con DD más de 6 veces el límite superior de normalidad o con coagulopatía asociada a sepsis (escala CIS ≥ 4).
En relación con las dosis de HBPM recomendadas, no hay evidencias que demuestren superioridad de unas sobre otras, pendientes de los resultados de los estudios que están en marcha en el momento actual.
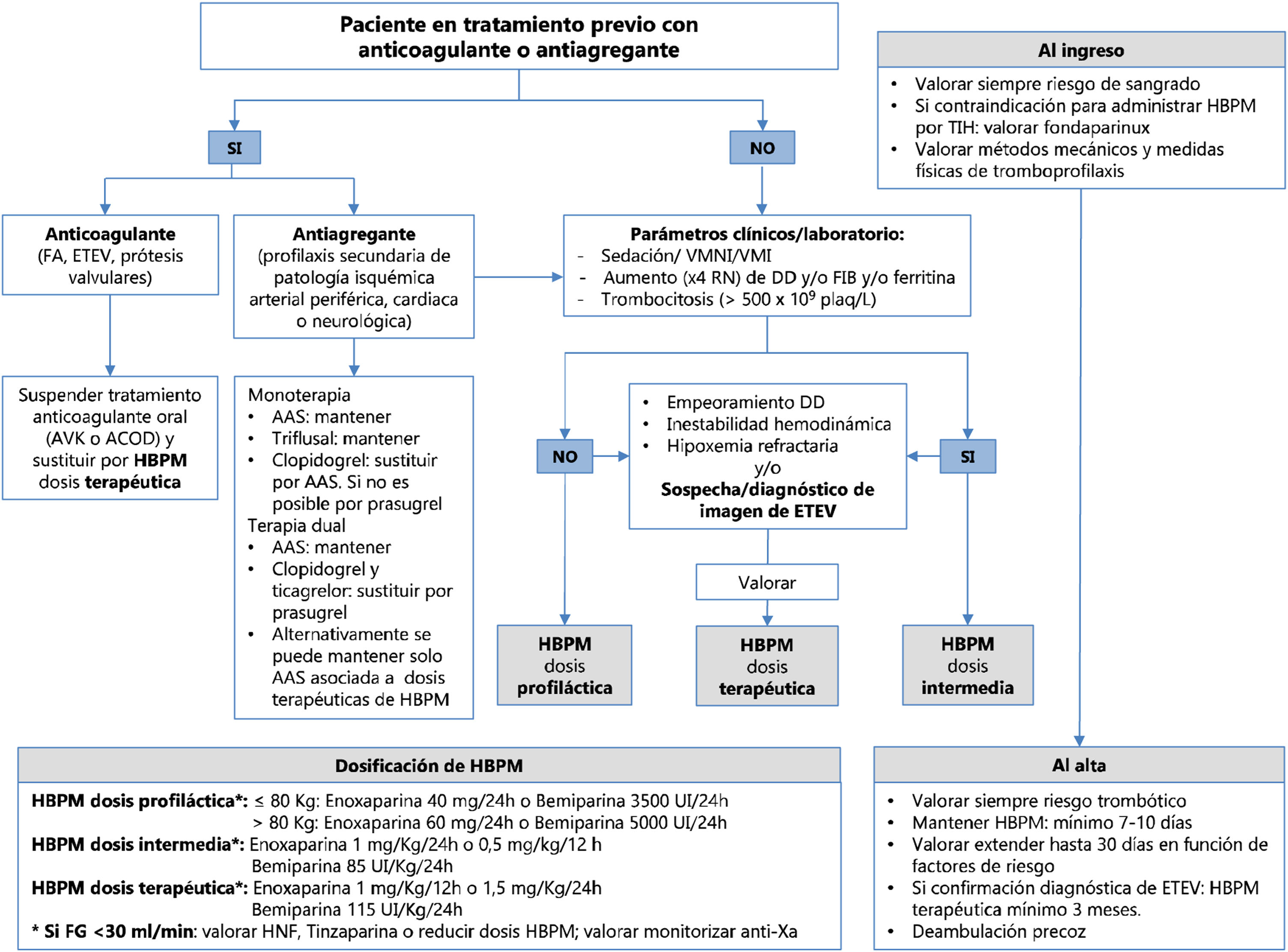
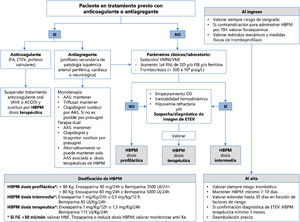
Recomendaciones (fig. 1)- -
En los pacientes con COVID-19, ingresados en las plantas de hospitalización, se recomienda la administración de tromboprofilaxis farmacológica, siendo de elección la HBPM. Se sugiere ajustar la dosis según el peso y la función renal.
Figura 1.Esquema resumido de la tromboprofilaxis y el manejo de los fármacos anticoagulantes y antiagregantes en los pacientes con infección por COVID-19.
AAS: ácido acetilsalicílico; ACOD: anticoagulante oral directo; AVK: antivitamina K; DD: dímero D; ETEV: enfermedad tromboembólica venosa; FA: fibrilación auricular; FG: filtrado glomerular; FIB: fibrinógeno; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; RN: rango de normalidad; TIH: trombocitopenia inducida por heparina; VMI: ventilación mecánica invasiva; VMNI: ventilación mecánica no invasiva.
(0,57MB). - -
En los casos con antecedentes de trombocitopenia inducida por heparina, se sugiere plantear como alternativa la administración de fondaparinux (2,5mg/24h por vía subcutánea) (fuera de indicación de ficha técnica).
- -
En los pacientes graves ingresados en las UCC, cuando el nivel plasmático de algunos marcadores de riesgo se encuentre claramente elevado respecto a valores de referencia (DD o fibrinógeno o ferritina:×4 el rango de normalidad, o recuento de plaquetas >500×109/l), se sugiere incrementar la dosis de HBPM a dosis extendidas o intermedias (100 UI/kg/24h).
- -
Si bien con los datos actuales no se puede recomendar el inicio de la administración de dosis de anticoagulación terapéutica (150 UI/kg/24h o 100 UI/kg/12h) a todos los pacientes, se sugiere valorarla en los casos en los que se asocian varios de los marcadores previamente citados, o cuando existen datos indicativos de trombosis, sin que sea posible realizar pruebas diagnósticas que la confirmen.
- -
Se recomienda considerar la posibilidad de tromboembolia pulmonar en los pacientes con deterioro súbito de la oxigenación o caída brusca de la presión arterial sin causa aparente.
- -
Se recomienda realizar pruebas diagnósticas (angio-TAC torácica, ecocardiografía, ecodoppler arterial o venoso) para el diagnóstico de trombosis arterial o venosa cuando exista un aumento significativo, progresivo o brusco, del DD o cuando existan criterios clínicos de sospecha siempre que sea posible.
- -
Se recomienda iniciar anticoagulación a dosis terapéuticas, preferiblemente con HBPM (100 UI/kg/12h o 1,5mg/kg/24h) a los pacientes con diagnóstico confirmado de eventos trombóticos.
- -
Se recomienda el ajuste de dosis y la monitorización de los niveles de anti-Xa si hay disminución del filtrado glomerular (FG) estimado (FG<30ml/min/1,73 m2). En estos casos, se recomienda valorar el uso de HNF o se sugiere utilizar tinzaparina a dosis equivalentes.
- -
Se sugiere la monitorización de los niveles de anti-Xa en los pacientes con obesidad mórbida (índice de masa corporal>30).
- -
Se recomienda el seguimiento analítico de los valores de DD, fibrinógeno, recuento de plaquetas y ferritina, así como la realización de las puntuaciones de CID y de CIS, según protocolo establecido en cada centro (a intervalos de 24-72h como máximo).
- -
Se recomienda no suspender la profilaxis antitrombótica por las alteraciones analíticas de la coagulación a menos que exista sangrado activo o un descenso del recuento plaquetario (< 30×109/l).
- -
En los casos de alto riesgo hemorrágico, la tromboprofilaxis se realizará preferentemente con métodos mecánicos (compresión neumática intermitente). En estas circunstancias, se sugiere valorar la realización de test viscoelásticos como complemento de la monitorización de la hemostasia.
- -
En los casos de alto riesgo trombótico, se sugiere asociar los métodos mecánicos (compresión neumática intermitente) a la profilaxis farmacológica.
Las gestantes tienen un riesgo 4-5 veces superior de presentar ETEV que la no gestante, debido a cambios hormonales, mecánicos (por el aumento del útero grávido con dificultad del retorno venoso en miembros inferiores y pelvis) y a la disminución de la movilidad secundaria a la ganancia ponderal. Por ello, habitualmente se evalúan los riesgos de trombosis durante la gestación y el puerperio, y se establece el tratamiento profiláctico con HBPM según la presencia de estos.
Existen muy pocos datos referentes a la infección por SARS-CoV-2 durante el embarazo. Sin embargo, los existentes acerca de la infección por otros coronavirus similares (severe acute respiratory syndrome [SARS-CoV] o middle east respiratory syndrome [MERS-CoV]) hacen extrapolable el posible efecto de la COVID-19 en la mujer embarazada.
Se sugiere que la infección por SARS-CoV-2 se asocia a un estado de hipercoagulabilidad y, a pesar de que no existe ningún estudio que aporte evidencia suficiente para establecer recomendaciones en las pacientes embarazadas infectadas, se ha propuesto plantearlas teniendo en cuenta los factores de riesgo trombótico y los datos analíticos que se han mostrado predictores de mala evolución. Sin embargo, por razones obvias, no es posible considerar el DD en el contexto del periparto, por lo que los parámetros que se deben tener en cuenta como predictores de un estado de hipercoagulabilidad se restringen en este contexto al fibrinógeno (dado que en la gestante y sobre todo en la puérpera los niveles suelen ser más elevados, el punto de corte de riesgo trombótico podría situarse en 7g/l en lugar de en 5g/l), la ferritina plasmática y el recuento de plaquetas.
Para la redacción de las recomendaciones de tromboprofilaxis en la mujer gestante con COVID-19, se han valorado las recomendaciones existentes en el contexto de las trombofilias en mujeres embarazadas26-28, dado que en las publicaciones específicas del manejo de la paciente embarazada no se contempla el manejo de la terapia antitrombótica29-31.
En relación con la finalización del embarazo, se considera que tanto la vía como el momento del parto deben ser evaluados de forma individual y multidisciplinar28. De acuerdo con el documento técnico multidisciplinar sobre el «Manejo de la mujer embarazada y el recién nacido con COVID-19»31, ante la posibilidad de finalizar el embarazo mediante cesárea, de no haber contraindicación, la anestesia neuroaxial (espinal, epidural o combinada) es la técnica recomendada para su realización.
Tromboprofilaxis en pacientes embarazadas con COVID-19- -
Se recomienda valorar los factores de riesgo trombóticos durante la gestación y el puerperio.
- -
Se recomienda la administración de HBPM a dosis profilácticas ajustadas a peso a toda paciente con infección confirmada por SARS-CoV-2, sin factores de riesgo trombótico, incluidas las pacientes asintomáticas.
- -
Se sugiere valorar la administración de HBPM a dosis extendidas o intermedias, ajustadas a peso, a toda gestante con infección confirmada por SARS-CoV-2 con marcadores de riesgo trombótico (aumento de ferritina plasmática, fibrinógeno> 7g/l o trombocitosis), según el riesgo estimado.
- -
En las pacientes que precisen ingreso hospitalario, se recomienda seguir las mismas recomendaciones sobre tromboprofilaxis propuestas para cualquier paciente ingresada por COVID-19. Se debe ajustar el tratamiento en cada caso según el riesgo o posibilidad de finalización del embarazo (decisión multidisciplinar).
- -
En el caso de indicación de cesárea, se recomienda emplear una técnica anestésica neuraxial. Si se realiza una técnica epidural, se recomienda la retirada del catéter tras la finalización de la cesárea para un mejor manejo de la anticoagulación, garantizando en todos los casos una adecuada vigilancia para detectar precozmente signos indicativos de compresión medular.
- -
Se recomienda reiniciar la profilaxis antitrombótica con HBPM tras el parto, administrando la primera dosis a las 6-8 h (dependiendo del riesgo de sangrado y de la dificultad en la punción neuraxial).
- -
Tras el parto, se sugiere ajustar la dosis de HBPM, en función de los marcadores de riesgo trombótico señalados anteriormente.
- -
Se recomienda hacer un seguimiento de los marcadores de riesgo trombótico (ferritina plasmática, fibrinógeno y recuento de plaquetas). En el caso de un nivel plasmático de fibrinógeno superior a 7g/l o trombocitosis (plaquetas> 500×109/l), se sugiere valorar el incremento de dosis de HBPM a dosis terapéuticas (100 UI/kg/12h o 150 UI/kg/24h).
- -
Se sugiere una duración de la profilaxis de al menos 7-10 días tras el parto, valorando su prolongación hasta la normalización de los marcadores de riesgo trombótico citados anteriormente.
- -
Se sugiere valorar la prolongación de la administración de HBPM a dosis profilácticas hasta 6 semanas posparto en las gestantes con factores de riesgo trombótico que hayan desarrollado infección por SARS-CoV-2 con datos de gravedad en el tercer trimestre.
- -
En los casos de ingreso en una UCC tras el parto, se recomienda seguir las pautas de tratamiento establecidas en el resto de las pacientes.
- -
En los casos de contraindicación de profilaxis farmacológica, se recomienda el empleo de métodos mecánicos (compresión neumática intermitente).
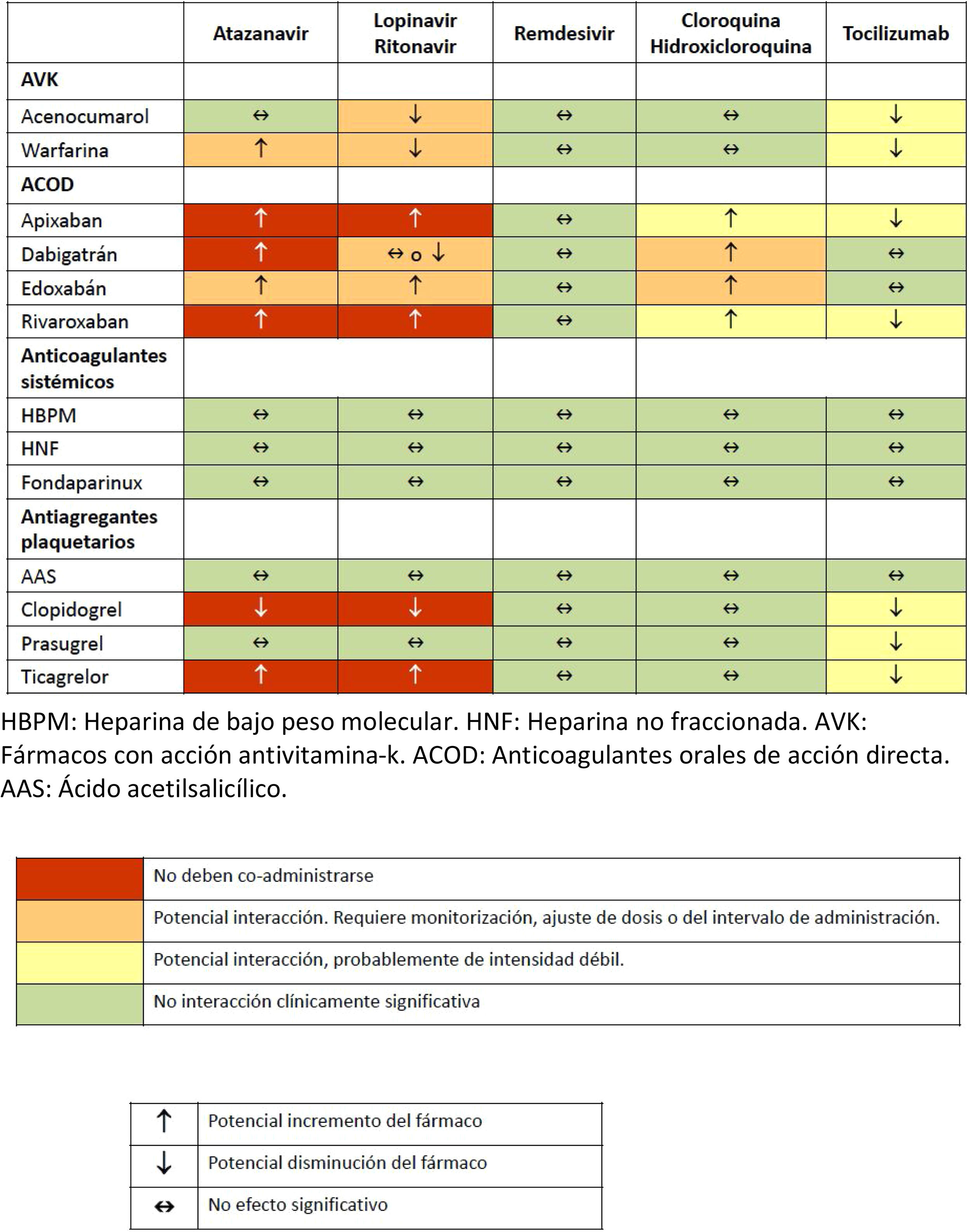
Se han descrito diversas interacciones farmacológicas entre los fármacos anticoagulantes o antiagregantes con los fármacos que se administran habitualmente en el tratamiento para el control de la COVID-19. En la tabla 3 se recogen los que se consideran más significativos, si bien para una información más extensa se puede consultar la página web de la referencia32.
Interacciones medicamentosas de anticoagulantes y antiagregantes con los fármacos empleados habitualmente en el tratamiento de pacientes graves con infección por COVID-19
AAS: ácido acetilsalicílico; ACOD: anticoagulantes orales de acción directa; AVK: fármacos con acción antivitamina K; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; ACOD: anticoagulantes orales de acción directa;.
Fuente: Interactions with Experimental COVID-19 therapies32.
Las indicaciones de anticoagulación crónica son bien conocidas e incluyen fibrilación auricular, ictus, antecedentes recientes de ETEV o portadores de válvulas cardíacas mecánicas33. En los pacientes con infección por COVID-19 que estuvieran en tratamiento con un fármaco anticoagulante por vía oral, ya sea del tipo antivitamina K o anticoagulante por vía oral directo, se debe mantener la anticoagulación independientemente del curso de la enfermedad, siempre que no se asocien eventos hemorrágicos, proponiéndose el cambio a anticoagulación parenteral34. Sin embargo, dado el gran número de interacciones de los fármacos anticoagulantes administrados por vía oral con la medicación necesaria en este proceso y las modificaciones en su biodisponibilidad en los pacientes críticos, el régimen de anticoagulación debe basarse en la administración de fármacos parenterales. Si bien es posible el empleo tanto de HNF como de HBPM, se prefiere HBPM por la facilidad de los regímenes terapéuticos y la no necesidad de monitorización de la anticoagulación excepto en situaciones de insuficiencia renal.
Recomendaciones (tabla 4)- -
Se recomienda mantener laanticoagulación en los pacientes que la precisen según sus indicaciones.
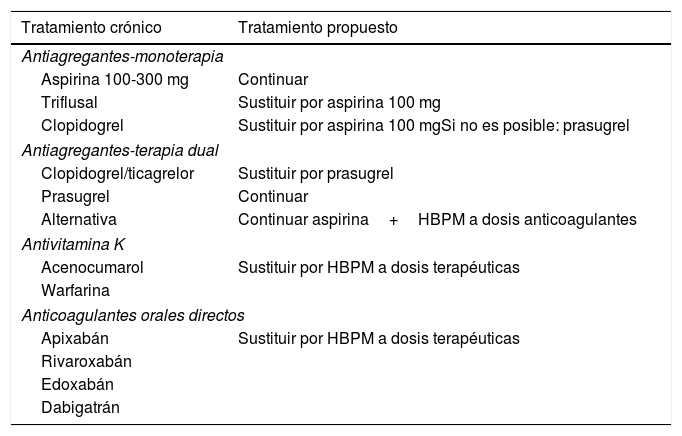
Tabla 4.Manejo de los fármacos antiagregantes plaquetarios y anticoagulantes orales
Tratamiento crónico Tratamiento propuesto Antiagregantes-monoterapia Aspirina 100-300 mg Continuar Triflusal Sustituir por aspirina 100 mg Clopidogrel Sustituir por aspirina 100 mgSi no es posible: prasugrel Antiagregantes-terapia dual Clopidogrel/ticagrelor Sustituir por prasugrel Prasugrel Continuar Alternativa Continuar aspirina+HBPM a dosis anticoagulantes Antivitamina K Acenocumarol Sustituir por HBPM a dosis terapéuticas Warfarina Anticoagulantes orales directos Apixabán Sustituir por HBPM a dosis terapéuticas Rivaroxabán Edoxabán Dabigatrán - -
Para el mantenimiento de la anticoagulación no se recomienda el empleo de fármacos con acción antivitamina K o de anticoagulantes orales directos, ya sea por las interacciones que presentan o por la dificultad de manejo o monitorización de la actividad anticoagulante.
- -
Se recomienda el empleo de HBPM para la anticoagulación de estos pacientes, a dosis terapéuticas (10.000 UI/24h, 150 UI/kg/24h o 100 UI/kg/12h). No es posible recomendar un protocolo de dosificación óptimo, sugiriéndose que se elija el más habitual en cada caso.
Se debe recomendar la continuación del tratamiento antiagregante con ácido acetilsalicílico (AAS) en aquellos pacientes que lo estuvieran tomando previamente o que desarrollen una enfermedad que lo requiera. No se han descrito interacciones importantes de AAS con los fármacos de uso habitual en estos enfermos.
Por el contrario, debido a las interacciones con lopinavir/ritonavir32, se desaconseja la administración de clopidogrel (disminución de la conversión del fármaco a su metabolito activo y, por tanto, disminución de su efecto farmacológico), así como de ticagrelor (aumento de la concentración plasmática). En los pacientes en los que sea necesaria la terapia dual (AAS más un inhibidor del receptor P2Y12), se recomienda el prasugrel por tener menor número de interacciones.
Recomendaciones (tabla 4)- -
AAS:se recomienda continuar el tratamiento con AAS en los casos indicados de prevención secundaria instaurados con anterioridad a la enfermedad.
- -
Clopidogrel:no se recomienda su empleo por la potencial disminución de su efecto al interaccionar con lopinavir/ritonavir. En caso necesario, valorar sustitución por prasugrel.
- -
Ticagrelor: no se recomienda su empleo por el potencial aumento de su efecto al interaccionar con lopinavir/ritonavir. Si se administra en monoterapia y no existe contraindicación, valorar su sustitución por AAS o por prasugrel.
- -
Prasugrel: se recomienda su empleo frente a clopidogrel o ticagrelor en los casos en los que sea necesaria la administración de un antiagregante tipo inhibidor del receptor P2Y12.
- -
Terapia dual: en los pacientes en los que se precise administrar una terapia dual (AAS+inhibidor de P2Y12), se sugiere como alternativa a la asociación AAS+prasugrel el mantenimiento de AAS junto con la administración de dosis terapéuticas de HBPM.
En la infección por SARS-CoV-2 no se ha descrito una incidencia significativa de complicaciones hemorrágicas a pesar de las alteraciones referidas en los test de hemostasia que se emplean habitualmente en clínica.
En relación con el TP, las alteraciones podrían calificarse en general de menores, dado que el alargamiento que se produce es de escasa significación clínica. Cabe destacar la normalidad en los resultados obtenidos en el TPTa que se observa en la gran mayoría de pacientes críticos con COVID-19. Estos resultados sugieren que la capacidad hemostática se encuentra dentro de la normalidad, no existiendo tendencia hemorrágica y, por lo tanto, no precisando de la corrección de dichos test de hemostasia de forma empírica.
Se ha observado un descenso moderado en la concentración plasmática de antitrombina, alcanzando niveles de alrededor del 80% de actividad2. Dado que este descenso no implica en general una alteración clínicamente significativa, no recomendamos su sustitución de forma sistemática.
La fibrinólisis que se observa en este escenario clínico, determinada por un aumento casi sistemático de los niveles plasmáticos de DD, como se ha señalado anteriormente, parece proceder de la lisis de los microtrombos formados a nivel de la microvasculatura, en el contexto de una reacción inflamatoria con implicación de múltiples mediadores celulares y bioquímicos. En ausencia de experiencia de uso en este contexto, parece prudente desaconsejar el empleo de cualquier antifibrinolítico en los casos de sangrado en pacientes con COVID-19.
No existe experiencia en el empleo de test viscoelásticos para el manejo de las complicaciones hemorrágicas de los pacientes graves con COVID-19, por lo que no es posible establecer ninguna recomendación en este escenario. Sin embargo, en los casos de hemorragia aguda grave, pueden servir de apoyo en la toma de decisiones, aplicando parámetros similares a casos de pacientes con hemorragia aguda grave en otros contextos clínicos.
Con estos antecedentes, proponemos las recomendaciones que se desarrollan a continuación, modificadas a partir de las publicadas recientemente20,35.
Recomendaciones- -
Se recomienda no administrar hemostáticos para corregir los resultados de los test de hemostasia, en ausencia de hemorragia significativa.
- -
En el caso de sangrado, se sugiere la administración de plasma como primera opción en el manejo de la hemorragia (10-15ml/kg), siempre que el TP-ratio sea superior a 1,5.
- -
Se recomienda no administrar concentrado de complejo protrombínico como primera opción de tratamiento en la corrección del sangrado en estos pacientes debido a la ausencia de experiencia y falta de datos de seguridad.
- -
En los pacientes con hemorragia aguda, se recomienda mantener niveles plasmáticos de fibrinógeno ≥ 1,5g/l, administrando preferentemente concentrado de fibrinógeno o crioprecipitado frente a plasma fresco.
- -
En los pacientes con hemorragia aguda, se recomienda mantener un recuento de plaquetas de al menos 50×109/l, suficiente habitualmente para conseguir la competencia hemostática, recomendándose la transfusión de plaquetas para obtener dicha cifra.
- -
No se recomienda la administración de antitrombina en el contexto de la infección por SARS-CoV-2.
- -
No se recomienda la administración de ácido tranexámico en este contexto, excepto en circunstancias de hemorragia grave y confirmación de hiperfibrinólisis mediante test viscoelásticos.
- -
En situaciones de hemorragia aguda grave, se sugiere que la administración de derivados hemostáticos se apoye en los resultados obtenidos en los test viscoelásticos cuando estén disponibles.
- -
No se recomienda el uso de factor viia en los pacientes con COVID-19.
La infección grave por SARS-CoV-2 afecta con mayor frecuencia a pacientes con diversas comorbilidades, entre las que cabe destacar las enfermedades cardiovasculares, por lo que un porcentaje no desdeñable de pacientes estarán en tratamiento con fármacos antiagregantes o anticoagulantes, cuya gestión es imprescindible para su buen manejo. Además, las alteraciones de la hemostasia que se observan en los pacientes con COVID-19 pueden implicar un riesgo mayor de desarrollo de enfermedad trombótica, por lo que la administración precoz de HBPM debe formar parte del tratamiento habitual.
Finalmente, las complicaciones hemorrágicas que eventualmente pueden aparecer en estos pacientes deben tratarse con sumo cuidado, dado el estado protrombótico y la etiología multifactorial que pueden presentar.
Julián Álvarez (Anestesiología-Reanimación), M. Ángeles Ballesteros (Medicina Intensiva), Misericordia Basora (Anestesiología-Reanimación), Ricard Ferrer (Medicina Intensiva), Inocencia Fornet (Anestesiología-Reanimación), Emilia Guasch (Anestesiología-Reanimación), Manuel Herrera-Gutiérrez (Medicina Intensiva), M. Cruz Martín (Medicina Intensiva), Pablo Monedero (Anestesiología-Reanimación), Pilar Paniagua (Anestesiología-Reanimación), Azucena Pajares (Anestesiología-Reanimación), Juan Carlos Ruiz-Rodríguez (Medicina Intensiva), Gabriel Tirado (Medicina Intensiva).