El tratamiento quirúrgico durante la pandemia de COVID-19 es controvertido. Actualmente, la mayoría de las guías clínicas recomiendan posponer la cirugía a los pacientes durante la pandemia de COVID-19, aunque los datos de apoyo son escasos. Asumimos que un hospital sin COVID-19, apoyado en fuertes medidas de aislamiento y exámenes de detección específicos, podría reducir las complicaciones y nos permitiría continuar tratando a pacientes de alto riesgo.
MétodosEstudio prospectivo con análisis retrospectivo de 355 pacientes sometidos a cirugía oncológica no diferible entre el 16 de marzo de 2020 y el 14 de abril de 2020 en nuestra institución. El objetivo del estudio fue valorar la reestructuración hospitalaria y de los protocolos quirúrgicos para poder manejar con seguridad las cirugías no diferibles durante la primera ola de pandemia por COVID-19. Implementamos cambios estructurales y un protocolo anestésico-quirúrgico actualizado para aislar a los pacientes con COVID-19 de otros pacientes quirúrgicos. Se realizó una evaluación exhaustiva dirigida a detectar pacientes con COVID-19. Se solicitaron pruebas de PCR para pacientes sospechosos de COVID-19. Analizamos la mortalidad y las complicaciones relacionadas tanto con la cirugía como con la COVID-19 durante el ingreso hospitalario y también a los 15 días y al mes de la cirugía. Comparamos nuestros resultados con una muestra de pacientes similar en el periodo pre-pandemia.
ResultadosDe los 355 pacientes incluidos en nuestro estudio, 21 fueron eliminados debido a la infección por COVID-19, lo que deja un total de 334 pacientes en nuestro análisis final. Se encontraron complicaciones postoperatorias en 37 pacientes (11,07%). Dos pacientes fallecieron tras la cirugía (0,6%). Al final del estudio se detectaron resultados adversos relacionados con COVID-19 en 6 pacientes (1,79%). Al comparar las complicaciones de nuestra muestra original con las que ocurrieron en la era pre-COVID-19, no encontramos diferencias estadísticamente significativas.
ConclusionesNuestros resultados muestran que el tratamiento quirúrgico de los pacientes oncológicos durante la pandemia de COVID-19 es seguro, siempre que el hospital realice cirugías bajo estrictas medidas de aislamiento y un método de detección robusto. Es necesario seleccionar hospitales libres de COVID-19 con este objetivo en esta y futuras pandemias.
Surgical treatment during COVID-19 pandemic is controversial. Currently, most clinical guidelines advise to defer surgical patients during the COVID-19 pandemic, although the supporting data is sparse. We assumed that a COVID-19-free hospital, on the back of strong isolation measures and targeted screening, could reduce complications and enable us to continue treating high-risk patients.
MethodsProspective study with retrospective analysis of 355 patients who had undergone nondeferrable oncological surgery between March 16th, 2020, and April 14th, 2020, at our institution. The aim of the study was to assess the hospital restructuring and surgical protocols to be able to safely handle non-deferrable surgeries during the first wave of the COVID-19 pandemic. We implemented structural changes and an updated surgical-anesthetic protocol in order to isolate COVID-19 patients from other surgical patients. Comprehensive targeted screening for COVID-19 patients was made. PCR tests were requested for suspected COVID-19 patients. We analyzed mortality and complications related to both surgery and COVID-19 during hospital admission and also 15 and 30 days after surgery. We compared it with a sample of similar patients in the pre-pandemic period.
ResultsOf the 355 patients enrolled in our study, 21 were removed due to COVID-19 infection, leaving a total of 334 patients in our final analysis. Post-operative complications were found in 37 patients (11.07%). Two patients died after surgery (0.6%). At the end of the study, COVID-19-related adverse outcomes were detected in six patients (1.79%). When comparing the complications of our original sample with the complications that occurred in the pre-COVID era, we found no statistically significant differences.
ConclusionsOur results show that the surgical treatment of oncologic patients during the COVID-19 pandemic is safe, as long as the hospital performs surgeries under strict isolation measures and a robust screening method. It is necessary to select COVID-19 free hospitals for this matter in this and future pandemics.
En diciembre de 2019 se informaron de los primeros casos de infección por COVID-19 en Wuhan, China, convirtiéndose la situación en una epidemia a principios de 2020, y posteriormente en pandemia en marzo de 20201. El periodo de incubación de esta infección es de hasta 2 semanas, siendo el virus extremadamente contagioso durante ese tiempo, lo que hace muy difícil identificar y aislar portadores asintomáticos2.
El 15 de marzo de 2020, el gobierno español declaró el estado de alarma3. Casi todos los hospitales del país recibieron la orden de priorizar las infecciones por COVID-19, quedando solo camas para COVID y enfermedades con urgencia vital. A medida que la situación empeoraba, el gobierno designó unidades de cuidados intensivos (UCI) y quirófanos para manejar el tratamiento de casos complicados de COVID-19. En este escenario, la cirugía oncológica fue diferida ya que la mortalidad a corto plazo de la infección por COVID-19 no se podía comparar con otras enfermedades.
Se demoraron tratamientos de quimioterapia, radioterapia, cirugía oncológica y pruebas diagnósticas y de seguimiento, poniendo en peligro diagnósticos oncológicos y posibles tratamientos efectivos4.
La evidencia actual sugiere que los síntomas de COVID-19 son más graves en pacientes oncológicos, por lo que debería valorarse la relación riesgo-beneficio en este tipo de pacientes5. No existía un consenso sobre si los tratamientos oncológicos debían aplazarse o no, y no existían estudios concluyentes. Un estudio reciente mostraba una alta mortalidad en pacientes asintomáticos que se sometían a cirugía programada6.
El riesgo de transmisión de COVID-19 se puede minimizar mediante medidas de contención intrahospitalaria eficientes. Un buen método de cribado es clave para detectar pacientes con COVID-19 antes de la cirugía, así como para identificar posibles vectores entre el personal del hospital. Igualmente importante es un buen circuito hospitalario y un pequeño y experimentado equipo quirúrgico y anestésico para el éxito de este proceso. La estrecha colaboración entre anestesiólogos y cirujanos es esencial en este proceso. Como tal, necesitamos establecer protocolos para que los pacientes puedan cumplir con sus tratamientos, incluyendo las cirugías no diferibles, sin contraer COVID-19.
MétodosDiseñoEl estudio se planteó cuando la Consejería de Sanidad decidió que nuestro centro debía ser un hospital de referencia para la cirugía oncológica no diferible en nuestra ciudad, ya que muchos hospitales habían sido designados exclusivamente para el tratamiento de COVID-19. Este estudio prospectivo observacional fue aprobado por el comité de ética del hospital (MD20/004 20 de abril de 2020). Todos los pacientes firmaron el consentimiento informado aceptando el tratamiento de sus datos con fines de investigación. Todos los autores revisaron el texto, así como la precisión de los datos y el cumplimiento del protocolo. Los pacientes fueron incluidos desde el 16 de marzo de 2020, 2 días después del decreto del estado de alarma en España, hasta el 14 de abril de 2020. Este período resultó ser un gran desafío, ya que abarcó las semanas con mayor incidencia de la enfermedad. Los datos se recopilaron después de revisar los registros médicos. Se realizaron modificaciones estructurales en el hospital, estableciéndose un doble circuito hospitalario, de manera que se aisló una planta de hospitalización para la atención de pacientes oncológicos con COVID-19, y se reservaron 4 camas aisladas en la UCI con el mismo propósito. Cabe mencionar que el personal clínico y de enfermería de esta planta se dedicó exclusivamente al tratamiento de los pacientes COVID-19 y no tuvo contacto con otras zonas. El resto de plantas de hospitalización se dedicaron a la atención de pacientes posquirúrgicos sin COVID-19.
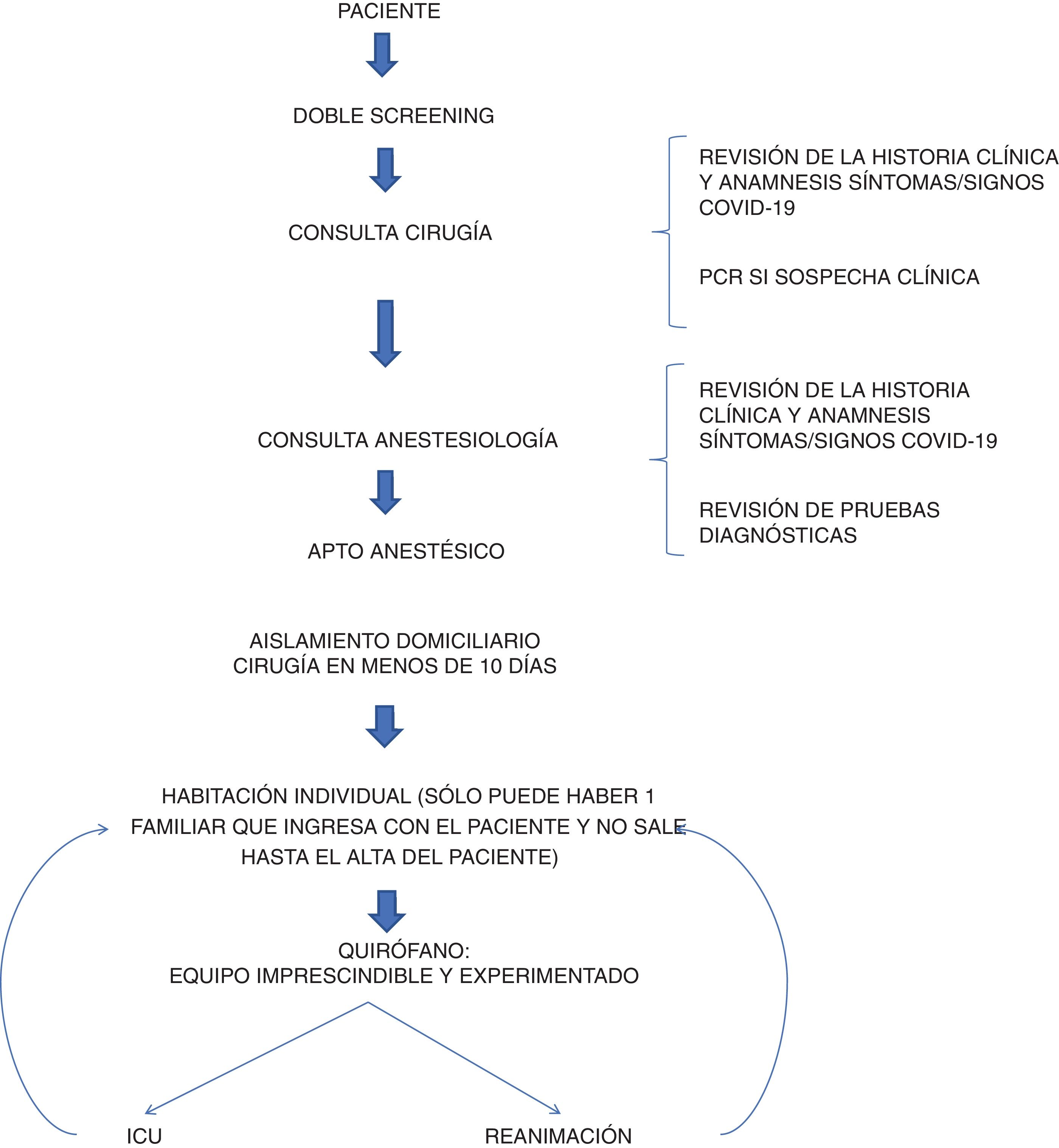
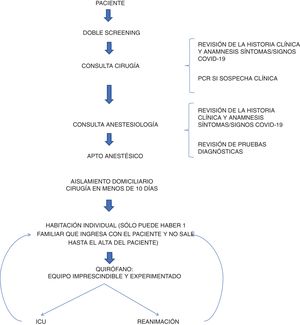
Se estableció un protocolo quirúrgico para los pacientes operados durante la epidemia. Para la selección de pacientes se estableció un «doble cribado» de pacientes en la consulta de cirugía y anestesia para detectar pacientes con síntomas de COVID-19. El cirujano estableció la indicación quirúrgica tras revisar la historia y realizar una anamnesis rigurosa de una posible infección por COVID-19. Todas las pruebas y consultas se realizaron el mismo día para minimizar las visitas innecesarias al hospital. Todos los pacientes debían tener un análisis preoperatorio (hemograma, bioquímica y coagulación) y una radiografía de tórax, la cual era informada por un radiólogo de tórax especializado. Si existían dudas sobre la radiografía, se solicitaba una tomografía computarizada (TC) de tórax, la cual era informada por el propio radiólogo. En caso de dudas se solicitó evaluación a otro radiólogo, especialista en tórax. Finalmente, los resultados se evaluaron en la consulta de anestesia en la que se volvió a interrogar al paciente por síntomas de infección o factores de riesgo epidemiológico para COVID-19 y se estableció el apto anestésico. En ese momento, la escasez de kits de reacción en cadena de la polimerasa (PCR) en España limitaba las pruebas solo a aquellos pacientes que generaban fuertes sospechas de infección. Se realizaron medidas de aislamiento. Los pacientes debían tener un aislamiento domiciliario estricto en los días previos a la prueba. Se buscó acortar el tiempo entre la consulta y la cirugía, con una media de menos de 10 días.
El protocolo quirúrgico fue el siguiente (fig. 1): el paciente ingresaba el mismo día de la cirugía y era aislado en una habitación hasta su ingreso al quirófano. Todos los pacientes debían llevar mascarilla y guantes desde el ingreso hasta el inicio de la anestesia. El paciente era monitorizado y anestesiado por un equipo con un equipo de protección personal (EPP) que se cambiaba entre paciente y paciente. La intubación orotraqueal se realizó con videolaringoscopio, evitando la ventilación manual, así como el uso de mascarillas laríngeas y dispositivos que pudieran aerosolizar partículas. Si era posible, se utilizaba anestesia espinal/epidural con el mismo propósito. Tanto el personal médico como el de enfermería disponían de un equipo de protección personal adecuado, intentando intervenir el menor número de personas posible en cada acto. Cuando se realizó laparoscopia se utilizó un sistema de aspiración cerrada hasta el final de la cirugía para evitar la aerosolización de partículas. En el caso de cirugías de alto riesgo de infección como la de otorrinolaringología (ORL) el equipo quirúrgico utilizó mascarilla FPP2, en el resto de las cirugías se utilizaron mascarillas quirúrgicas convencionales. La limpieza del quirófano entre paciente y paciente fue minuciosa y estricta. Para ello se utilizó una solución de lejía a 1:10 para desinfectar el quirófano antes y después de las cirugías, y también se limpió toda la instalación cada 4h con el mismo producto. Después de la cirugía, el paciente se trasladaba a una unidad de reanimación, y lo antes posible a la planta de hospitalización quirúrgica o permanecía en la UCI durante 24h según el tipo de cirugía. Una vez en la planta de hospitalización, se intentó aplicar un protocolo recuperación (protocolo ERAS) en todos los pacientes que cumplían con los requisitos. Si el paciente sufría alguna complicación tras el alta hospitalaria, se le indicaba que acudiera al servicio de urgencias de nuestro centro para su evaluación.
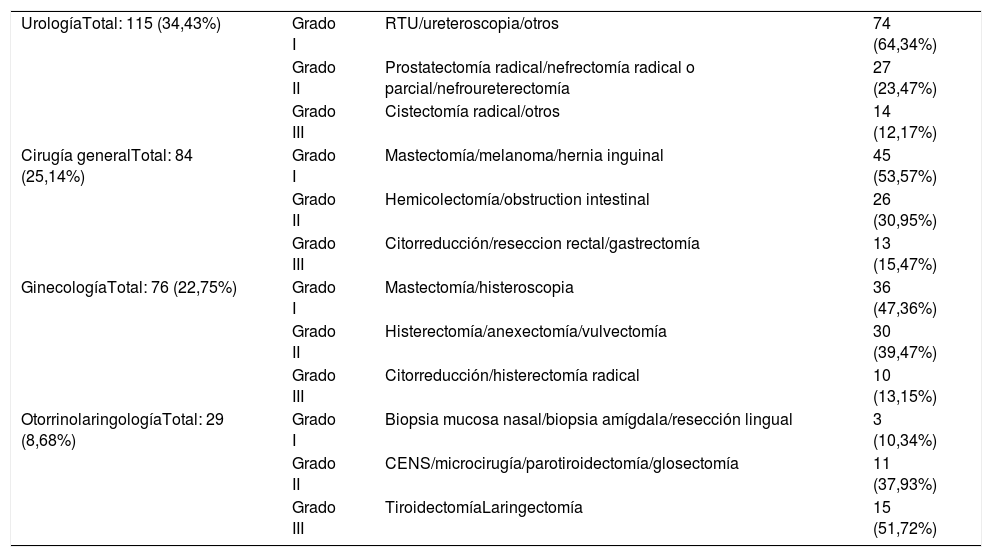
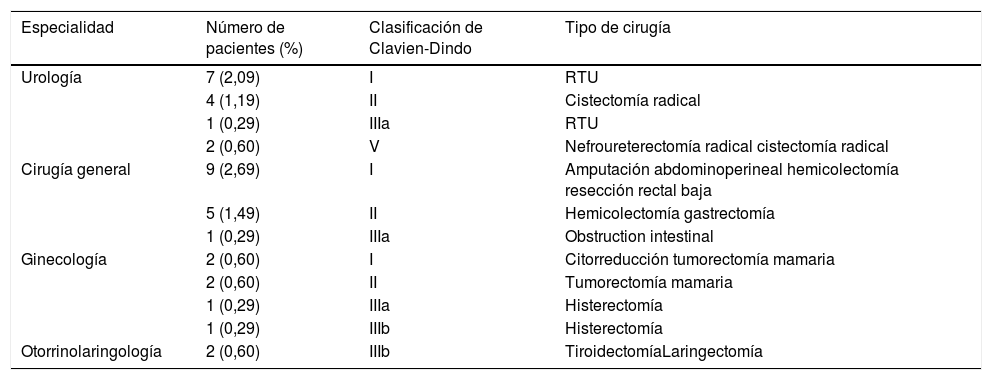
Clasificación de las cirugías: las cirugías se clasificaron según su complejidad utilizando 3 niveles: El nivel 1 incluye procedimientos que tienen riesgos leves y dificultades técnicas generales. El nivel 2 incluye procedimientos complejos que tienen un riesgo moderado y dificultades técnicas. El nivel 3 incluye procedimientos muy complejos con altas dificultades técnicas. La tabla 1 resume las cirugías por especialidad.
Procedimientos quirúrgicos
| UrologíaTotal: 115 (34,43%) | Grado I | RTU/ureteroscopia/otros | 74 (64,34%) |
| Grado II | Prostatectomía radical/nefrectomía radical o parcial/nefroureterectomía | 27 (23,47%) | |
| Grado III | Cistectomía radical/otros | 14 (12,17%) | |
| Cirugía generalTotal: 84 (25,14%) | Grado I | Mastectomía/melanoma/hernia inguinal | 45 (53,57%) |
| Grado II | Hemicolectomía/obstruction intestinal | 26 (30,95%) | |
| Grado III | Citorreducción/reseccion rectal/gastrectomía | 13 (15,47%) | |
| GinecologíaTotal: 76 (22,75%) | Grado I | Mastectomía/histeroscopia | 36 (47,36%) |
| Grado II | Histerectomía/anexectomía/vulvectomía | 30 (39,47%) | |
| Grado III | Citorreducción/histerectomía radical | 10 (13,15%) | |
| OtorrinolaringologíaTotal: 29 (8,68%) | Grado I | Biopsia mucosa nasal/biopsia amígdala/resección lingual | 3 (10,34%) |
| Grado II | CENS/microcirugía/parotiroidectomía/glosectomía | 11 (37,93%) | |
| Grado III | TiroidectomíaLaringectomía | 15 (51,72%) |
CENS: cirugía endoscópica nasosinusal; RTU: resección transurethral.
La evaluación posquirúrgica se llevó a cabo con especial atención a los síntomas de COVID-19. Los pacientes fueron examinados en la consulta de cirugía dentro de los 10 a 20 días posteriores al alta.
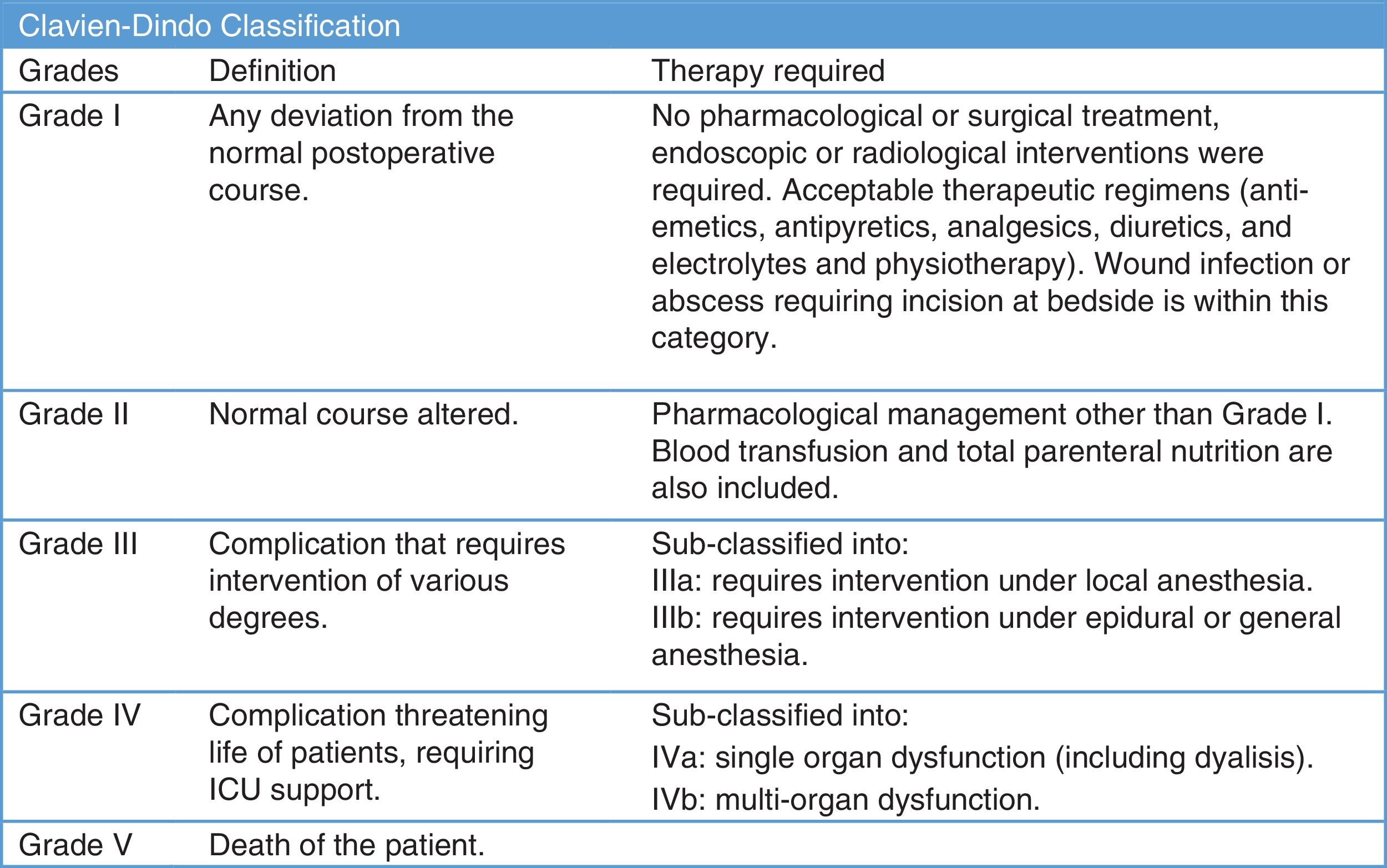
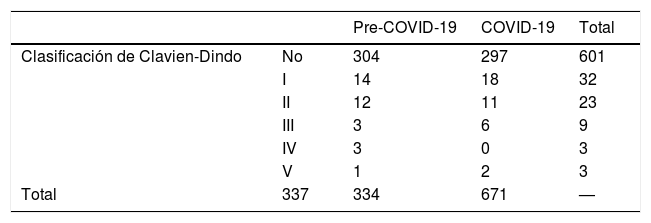
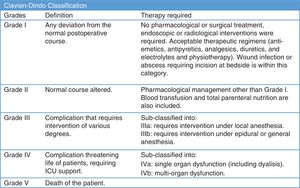
Las complicaciones quirúrgicas se monitorizaron siguiendo la clasificación de Clavien-Dindo7 (fig. 2). Se analizó la mortalidad perioperatoria, así como las complicaciones por COVID-19 durante la hospitalización, y también a los 15 y 30 días después de la cirugía.
Estos resultados los comparamos con una muestra similar sometida a cirugías similares en la era pre-COVID. También se midió la incidencia de infección por COVID-19 en nuestro personal quirúrgico.
Análisis estadísticoLas variables continuas se presentaron como mediana con rango intercuartílico (IQR). Las variables categóricas se expresaron como frecuencias y porcentajes. Las diferencias entre la variables categóricas se analizaron mediante la prueba Chi-cuadrado o la prueba exacta de Fisher. Las diferencias entre las variables continuas se analizaron mediante la prueba de la t de Student. Se consideró un valor de p<0,05 estadísticamente significativo. Todos los análisis estadísticos se realizaron con el SPSS® (versión 25.0) software (SPSS Inc., Chicago, IL, EE. UU.).
ResultadosUn total de 355 pacientes fueron incluidos originalmente en este estudio. Veintiuno de estos pacientes fueron rechazados por presentar criterios de infección por COVID-19 o pruebas radiológicas compatibles (infiltrados intersticiales en radiografía de tórax o TC de tórax) y PCR positiva para COVID-19. El número final de pacientes incluidos en este estudio fue, por lo tanto, de 334.
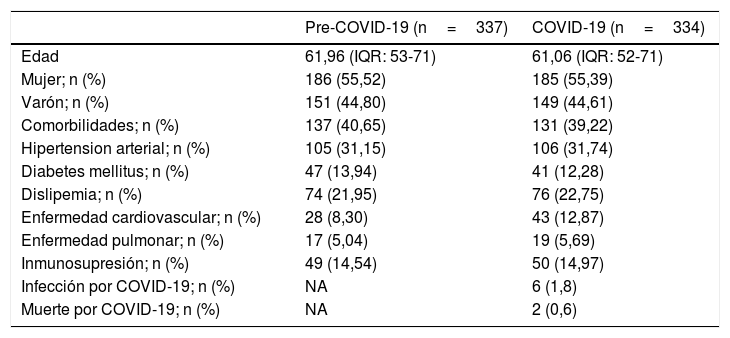
Características clínicasLas características basales de los pacientes se resumen en la tabla 2.
Datos demográficos
| Pre-COVID-19 (n=337) | COVID-19 (n=334) | |
|---|---|---|
| Edad | 61,96 (IQR: 53-71) | 61,06 (IQR: 52-71) |
| Mujer; n (%) | 186 (55,52) | 185 (55,39) |
| Varón; n (%) | 151 (44,80) | 149 (44,61) |
| Comorbilidades; n (%) | 137 (40,65) | 131 (39,22) |
| Hipertension arterial; n (%) | 105 (31,15) | 106 (31,74) |
| Diabetes mellitus; n (%) | 47 (13,94) | 41 (12,28) |
| Dislipemia; n (%) | 74 (21,95) | 76 (22,75) |
| Enfermedad cardiovascular; n (%) | 28 (8,30) | 43 (12,87) |
| Enfermedad pulmonar; n (%) | 17 (5,04) | 19 (5,69) |
| Inmunosupresión; n (%) | 49 (14,54) | 50 (14,97) |
| Infección por COVID-19; n (%) | NA | 6 (1,8) |
| Muerte por COVID-19; n (%) | NA | 2 (0,6) |
IQR: rango intercuartílico.
Los 334 pacientes incluidos en este estudio residían en Madrid, uno de los epicentros mundiales, en ese momento de la pandemia. El rango de edad fue de 17 a 92 años, y la mediana de edad de 61 (RIQ: 52-71); El 55,4% de los pacientes eran mujeres y 41 (39,4%) pacientes ingresaron en la UCI por tratarse de una cirugía de alto riesgo con una estancia media en la misma de 1,06 días.
La hipertensión arterial 106 (31,7%), diabetes mellitus 41 (12,2%), dislipidemia 76 (22,7%) y enfermedad cardiovascular 43 (12,8%) fueron las comorbilidades más comunes. Se encontró EPOC en 19 (5,6%) pacientes, mientras que 50 (14,9%) tenían cierto grado de inmunosupresión.
Resultados quirúrgicosDe las 334 cirugías, 115 fueron urológicas (34,43%), 84 correspondieron a cirugía general (25,14%), 76 a ginecología (22,75%), 29 a otorrinolaringología (8,68%) y 30 a otras especialidades (neurocirugía, cirugía plástica, traumatología, cirugía torácica (8,98%). Se realizó cirugía de alta complejidad en 94 pacientes de nivel 2 (28,14%) y 52 de nivel 3 (15,56%).
Complicaciones perioperatoriasUsamos la clasificación de Clavien-Dindo7 para analizar las complicaciones perioperatorias (tabla 3). Treinta y siete pacientes tuvieron complicaciones postoperatorias (11,07%), 29 de ellos experimentaron complicaciones menores que no requirieron reintervención; 8 pacientes tuvieron que ser sometidos a exploración quirúrgica; 5 pacientes (1,49%) reingresaron en la UCI; 2 de ellos fallecieron tras la cirugía (0,6%) tras evidenciarse infección por COVID-19.
Complicaciones
| Especialidad | Número de pacientes (%) | Clasificación de Clavien-Dindo | Tipo de cirugía |
|---|---|---|---|
| Urología | 7 (2,09) | I | RTU |
| 4 (1,19) | II | Cistectomía radical | |
| 1 (0,29) | IIIa | RTU | |
| 2 (0,60) | V | Nefroureterectomía radical cistectomía radical | |
| Cirugía general | 9 (2,69) | I | Amputación abdominoperineal hemicolectomía resección rectal baja |
| 5 (1,49) | II | Hemicolectomía gastrectomía | |
| 1 (0,29) | IIIa | Obstruction intestinal | |
| Ginecología | 2 (0,60) | I | Citorreducción tumorectomía mamaria |
| 2 (0,60) | II | Tumorectomía mamaria | |
| 1 (0,29) | IIIa | Histerectomía | |
| 1 (0,29) | IIIb | Histerectomía | |
| Otorrinolaringología | 2 (0,60) | IIIb | TiroidectomíaLaringectomía |
RTU: resección transuretral.
Dos pacientes (ORL) tuvieron que ser explorados bajo anestesia general por sangrado; otro paciente (ginecología) presentó síntomas de abdomen agudo a los 11 días de la cirugía. La laparotomía exploradora no encontró ningún hallazgo. La PCR para COVID-19 fue negativa. La paciente posteriormente se recuperó sin incidencias.
Dos pacientes (urología) fallecieron, uno durante la hospitalización y el otro tras el alta.
El primer fallecimiento fue un paciente que se había sido sometido a una nefroureterectomía. A los 3 días de la cirugía se tuvo que realizar una exploración quirúrgica urgente por signos de obstrucción intestinal; los hallazgos intraoperatorios fueron líquido peritoneal purulento y distensión intestinal sin identificar una clara causa. El paciente ingresó en la UCI tras la reintervención con distrés respiratorio e insuficiencia renal aguda.
La radiografía de tórax postoperatoria mostró un infiltrado intersticial bilateral sugestivo de edema pulmonar. El paciente falleció 3 h después de ingresar en la UCI. Una autopsia hubiera sido necesaria para determinar claramente la causa de la muerte, pero desafortunadamente estaba prohibidas al principio de la pandemia8. Sin embargo, su tórpida clínica respiratoria y los hallazgos radiológicos sugerían infección por COVID-19.
La segunda muerte fue un paciente (cistectomía radical) que desarrolló síntomas de COVID-19 (fiebre, disnea) 9 días después del alta hospitalaria y fue reingresado con el diagnóstico de neumonía asociada a COVID-19. El paciente falleció 48h después de su admisión.
Se realizó, además, una evaluación retrospectiva de cohortes de 337 pacientes operados en nuestro hospital en los meses anteriores a la pandemia de COVID-19 para comprobar la seguridad y el valor de nuestro protocolo (entre el 1 de diciembre de 2019 y el 17 de febrero de 2020)
Comparamos la variable «Complicaciones de Clavien Dindo» de nuestra serie con una muestra de pacientes oncológicos que se habían sometido a una cirugía oncológica similar en los meses anteriores a la pandemia. El valor de Chi-cuadrado (p=0,339), confirma que no hubo diferencias entre los 2 muestras a pesar de que las cirugías se realizaron en diferentes períodos (tabla 4).
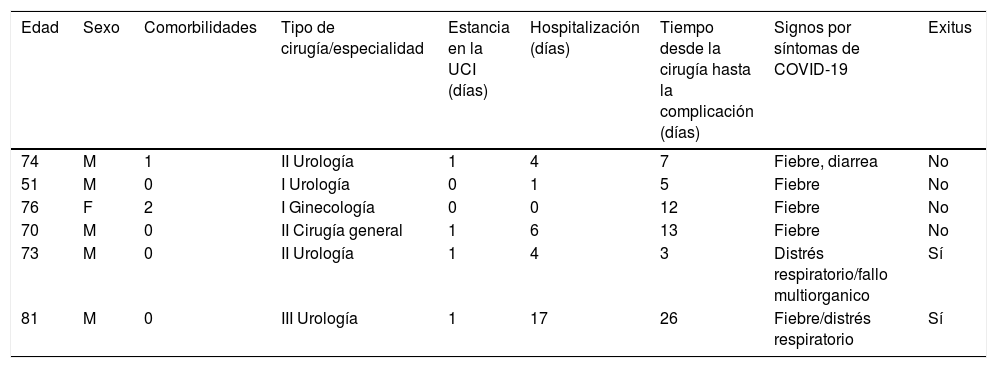
Seguimiento y seguridadLa estancia hospitalaria media fue de 3,31 días (IQR: 2-4). Se realizó seguimiento evolutivo, en consulta, en un promedio de 10 días. El seguimiento se realizó nuevamente un mes después de la cirugía. Seis pacientes (1,80%) mostraron signos de infección por COVID-19 (tabla 5). La mortalidad perioperatoria fue de 2 pacientes (0,6%). Se infectaron con COVID-19, 3 (6,81%) de 44 profesionales del bloque quirúrgico que intervinieron en el protocolo.
Pavientes infectados por COVID-19
| Edad | Sexo | Comorbilidades | Tipo de cirugía/especialidad | Estancia en la UCI (días) | Hospitalización (días) | Tiempo desde la cirugía hasta la complicación (días) | Signos por síntomas de COVID-19 | Exitus |
|---|---|---|---|---|---|---|---|---|
| 74 | M | 1 | II Urología | 1 | 4 | 7 | Fiebre, diarrea | No |
| 51 | M | 0 | I Urología | 0 | 1 | 5 | Fiebre | No |
| 76 | F | 2 | I Ginecología | 0 | 0 | 12 | Fiebre | No |
| 70 | M | 0 | II Cirugía general | 1 | 6 | 13 | Fiebre | No |
| 73 | M | 0 | II Urología | 1 | 4 | 3 | Distrés respiratorio/fallo multiorganico | Sí |
| 81 | M | 0 | III Urología | 1 | 17 | 26 | Fiebre/distrés respiratorio | Sí |
F: femenino; M: masculino; UCI: unidad de cuidados intensivos.
El tratamiento del cáncer durante la pandemia de COVID-19 ha sido controvertido. La mayoría de sociedades médicas recomendaban el uso de telemedicina, la administración oral o subcutánea de tratamientos sistémicos, así como el aplazamiento del tratamiento no urgente9. Los pacientes con cáncer son un grupo de alto riesgo. Son pacientes vulnerables a la infección debido a la inmunosupresión y a su enfermedad subyacente y, además, corren el riesgo de sufrir complicaciones graves cuando se infectan por COVID-1910. En reportes iniciales, la proporción de complicaciones debidas a la infección por COVID-19 en los pacientes oncológicos oscila entre el 44 y el 53%, y la tasa de mortalidad entre el 20-28%.
Así mismo, la incidencia de infección intrahospitalaria por COVID-19 entre los pacientes con cáncer también es alta, afectando al 28-41% de los pacientes6,11,12.
Las cirugías oncológicas se suspendieron en este tiempo en la mayoría de países debido a estos datos alarmantes, y las sociedades médicas y las autoridades de salud pública de todo el mundo instaron a la priorización de la cirugía oncológica según intención curativa. A raíz de este asunto el Servicio Nacional de Salud del Reino Unido (NHS) estableció 4 niveles de prioridad: emergencias, casos urgentes, cirugía electiva con expectativa de curación y cirugía electiva que puede ser diferida de 10 a 12 semanas13. La Sociedad de Oncología Quirúrgica recomendó en aquel momento que las cirugías debían aplazarse cuando fuera posible favoreciendo la neoadyuvancia previa a la cirugía como medida temporal14. La Asociación Europea de Urología publicó un informe clínico que priorizaba el tratamiento en 4 grupos: bajo, intermedio, alto y urgencia15. Sin embargo, las decisiones debían tomarse paciente a paciente.
Teniendo en cuenta la alta mortalidad y la tasa de complicaciones comunicadas anteriormente, diseñamos en este periodo un protocolo anestésico-quirúrgico para identificar a los pacientes infectados por COVID-19 y aislar a los pacientes quirúrgicos, dentro y fuera del hospital, tanto como fuera posible.
La precocidad del alta hospitalaria con una estancia hospitalaria media de 3,31 días fue un logro significativo considerando la importancia, en ese momento, de que los pacientes tuvieran el menor contacto posible con el entorno hospitalario. Cabe mencionar la importancia de tener un equipo quirúrgico altamente capacitado como parte fundamental del protocolo, lo cual se evidencia en la baja tasa de complicaciones graves (Clavien-Dindo mayor que III) que fue del 2,39%, estancia en la UCI (1,06 días) y reingreso en la UCI (1,49%).
Al comparar nuestros resultados con una muestra similar de 337 pacientes operados entre diciembre de 2019 y febrero de 2020, los resultados son muy similares. En ese período, la tasa de complicaciones graves (Clavien-Dindo mayor que III) fue de 2,07%, estancia en la UCI 1,31 días y reingreso en la UCI 1,29%.
Creemos que nuestro sistema de «doble detección», junto con el protocolo quirúrgico, el confinamiento estricto del paciente, las modificaciones estructurales hospitalarias y la utilización de equipos reducidos, pero altamente calificados, ha sido fundamental para evitar infecciones y complicaciones en nuestros pacientes quirúrgicos.
Nuestro estudio muestra que es seguro realizar cirugías durante la pandemia COVID-19 con una incidencia razonable de complicaciones y mortalidad (0,6%). Aún así, la decisión de someterse a una cirugía debe hacerse considerando la relación riesgo-beneficio. Considerando la constante exposición del personal quirúrgico en esa época de la pandemia, creemos que solo el 6,8% de personal infectado y que desarrolló síntomas leves es un resultado fuerte.
Nuestro estudio tiene algunas limitacionesPor ejemplo, la PCR de COVID-19 preoperatoria solo se realizó en pacientes con factores de riesgo clínicos o epidemiológicos compatibles y en aquellos con pruebas radiológicas sospechosas. No se realizó RT-PCR en todos los pacientes porque en el inicio de la primera oleada (marzo de 2020) hubo escasez de reactivos en España. Para superar este problema, establecimos un protocolo para utilizar estos reactivos en pacientes en los que había sospecha de infección por COVID-19. Actualmente, hay suficientes reactivos en España para descartar la infección por COVID-19 en pacientes asintomáticos, por lo que esta variable se ha agregado a nuestro protocolo.
Otra limitación es que no se pudo realizar una autopsia a uno de los pacientes fallecidos, ya que esto no estaba permitido en el momento del estudio.
Creemos que nuestro protocolo ha demostrado ser eficaz en el mundo real y podría ser útil en países que tienen acceso limitado a las pruebas de COVID-19.
Un objetivo futuro debería ser medir las consecuencias de diferir las cirugías oncológicas en pacientes con infección por COVID-19 en este periodo y de si esto altera claramente su pronóstico.
Basado en la serie quirúrgica más grande de pacientes oncológicos durante la primera ola de la pandemia por COVID-19 en Madrid (España), nuestros resultados muestran que es seguro realizar cirugías con un aislamiento estricto y haciendo una buena detección de los casos. Esto refleja que la relación riesgo-beneficio debe ser calculada antes de aplazar el tratamiento. El «doble cribado» y nuestro protocolo quirúrgico han sido eficaces en nuestro medio. Creemos que este protocolo quirúrgico y de detección puede ser útil en países con recursos limitados o acceso reducido a las pruebas de COVID-19.
Creemos que los resultados de nuestro estudio son muy importantes y han mejorado ahora que se realiza la PCR para COVID-19 en pacientes asintomáticos sometidos a cualquier cirugía, teniendo en cuenta los esperados brotes de COVID-19 este otoño y la muy probable recurrencia del brote en el próximos 1-2 años.
Concluimos que se debe hacer un esfuerzo para dejar hospitales limpios de COVID-19 para el tratamiento de cirugías no diferibles en esta emergencia de salud global actual, así como en futuras pandemias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los profesionales que intervinieron en este estudio y fueron imprescindibles para el mismo: Yelo; Fernandez-Chereguini, M; Alonso S; Lista-Mateos, F; Ortega, G; Alonso, O; Conde A; Barberá, R; Delgado B; Prieto, I; Gonzalez-Moreno, S; Raboso, E; De Santiago, J; Nuñez-Mora C. Así cómo a las enfermeras, auxiliares, celadores, limpiadoras, administrativos y todo el personal que trabajó encomiablemente en este periodo.