La arteritis de células gigantes es una vasculitis que afecta de manera predominante a vasos de gran calibre y aparece en personas mayores de 50 años. Su presentación clínica incluye cefalea, alteraciones auditivas o síntomas similares a polimialgia reumática. En su forma más grave puede causar pérdida de visión uni- o bilateral, secundaria a neuropatía óptica isquémica de tipo arterítico. En la actualidad, el estándar de referencia para su diagnóstico es la biopsia de arterias temporales, procedimiento que no es inocuo y que puede tener como complicaciones infección, lesión nerviosa o sangrado, entre otras. Entre las técnicas no invasivas de diagnóstico, el ultrasonido y el Doppler de arterias temporales han tomado un rol cada vez más importante en el diagnóstico de esta entidad, dado que son pruebas benignas, con nulos efectos adversos y, a través de estrategias como las clínicas fast-track apoyadas en este método diagnóstico, se ha logrado reducir las complicaciones isquémicas de la enfermedad.
Giant cell arteritis is a vasculitis that predominantly affects large calibre vessels, and usually appears in people over 50 years-old. Its clinical presentation includes headache, hearing impairment, or polymyalgia rheumatica-like symptoms. In its most severe form, it can cause uni- or bilateral vision loss secondary to arteritic ischaemic optic neuropathy. Currently, the gold standard for its diagnosis is the temporal artery biopsy, a procedure that is not harmless and may have complications such as infection, nerve injury, bleeding, among others. Among non-invasive diagnostic methods, the ultrasound and temporal artery Doppler have gained a predominant role in the diagnosis of giant cell arteritis, as it is a benign test with no adverse effects. Through strategies such as «fast-track» clinics, supported by this diagnostic method, a reduction has been achieved in ischaemic complications of the disease.
La arteritis de células gigantes (ACG) es una vasculitis que afecta a los vasos de mediano y gran calibre (la aorta y sus ramas proximales), predominantemente en personas mayores de 50 años. Su prevalencia es baja y se ha estimado en un 2,2 por cada 10.000 pacientes en el Reino Unido1, con una incidencia en poblaciones de ascendencia escandinava de hasta 19,8 por cada 100.0002. En Colombia no se han establecido estos datos. En el estudio de Ochoa et al., de 2009, de 857 casos de vasculitis reportados en Colombia, solo 9 correspondían a ACG3. La inflamación de la pared de los vasos lleva a un engrosamiento de la íntima que ocasiona la reducción del flujo sanguíneo con fenómenos isquémicos secundarios.
Histológicamente, se caracteriza por la infiltración vascular de células T CD4+y macrófagos que con posterioridad se fusionan para formar las denominadas células gigantes4.
Clínicamente, se han definido 2fenotipos de presentación de acuerdo con las arterias afectadas y el territorio irrigado por ellas: un fenotipo craneal, en el que los síntomas característicos son cefalea, sobre todo en el área temporal, hipersensibilidad del cuero cabelludo y claudicación mandibular. Este subtipo es el que con mayor frecuencia presenta, como manifestación grave y catastrófica, pérdida visual secundaria a neuritis óptica isquémica (anterior o posterior) de tipo arterítico y suele afectar al grupo de mayor edad. Por otro lado, el fenotipo extracraneal, también llamado ACG de grandes vasos, afecta a la aorta y sus ramas proximales principales, especialmente de extremidades superiores; cursa con síntomas constitucionales, fiebre, claudicación de miembros superiores y aortitis, y los pacientes suelen ser más jóvenes en comparación con el intracraneal5.
La polimialgia reumática está estrechamente relacionada con la ACG, se asocia hasta en el 40-50% de los pacientes, mientras que en un 10% de los pacientes con diagnóstico previo de polimialgia reumática se puede encontrar ACG6. El diagnóstico y el tratamiento tempranos y oportunos de los pacientes con ACG son fundamentales para prevenir complicaciones vasculares graves de la enfermedad, en particular, la ceguera. Si bien se puede sospechar clínicamente, el estándar de oro para el diagnóstico sigue siendo la biopsia de arteria temporal; sin embargo, esta puede ser negativa en un porcentaje importante de pacientes y no está exenta de complicaciones, lo que hace necesario el uso de métodos diagnósticos no invasivos, como el ultrasonido Doppler de arterias temporales7.
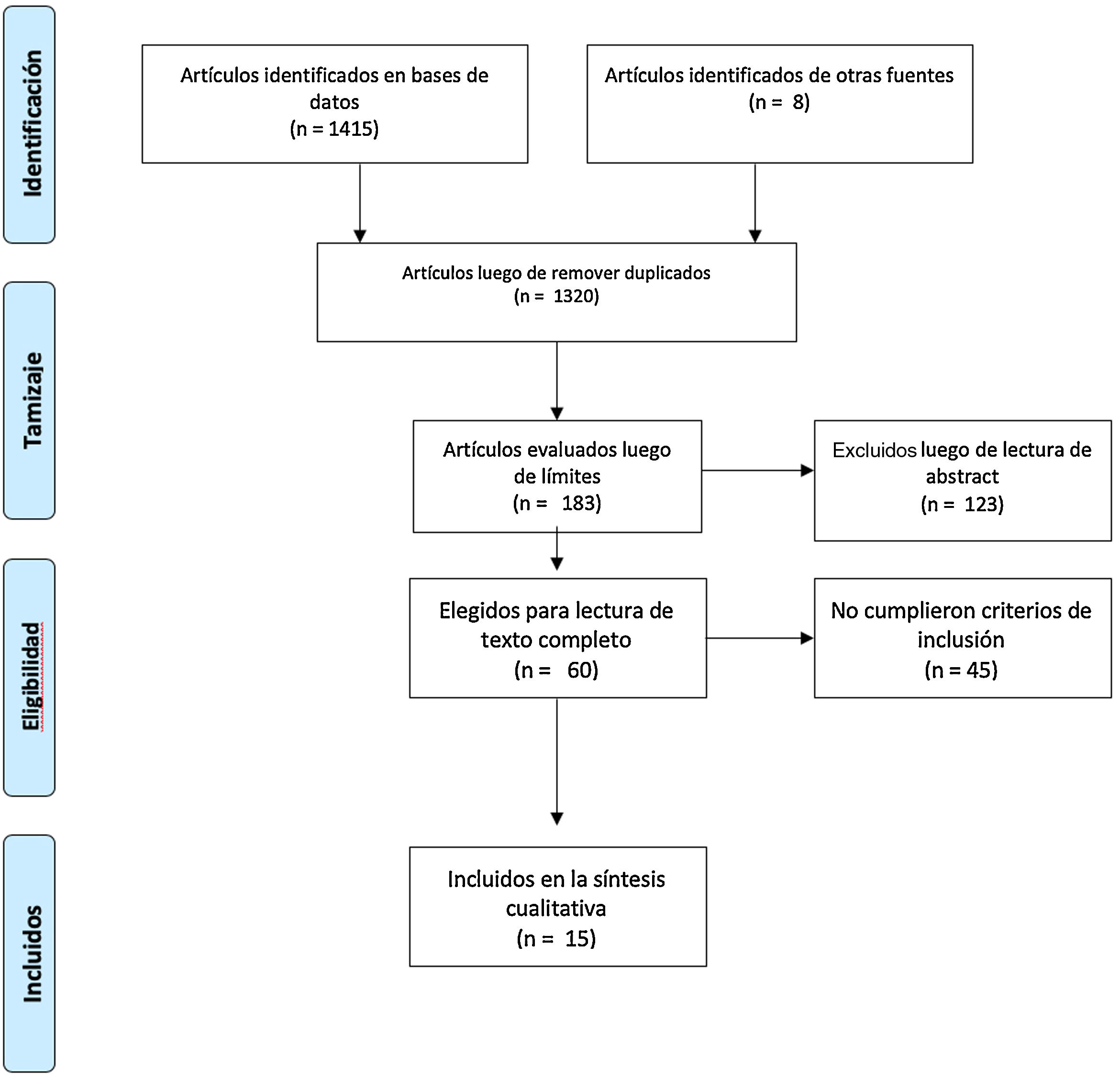
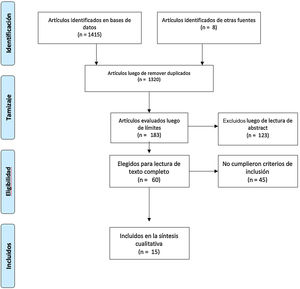
Material y métodosSe sistematizó una búsqueda bibliográfica para responder, de manera cualitativa, a la pregunta sobre la utilidad de la ultrasonografía y el Doppler en el diagnóstico de ACG (Anexo 1). La búsqueda se realizó en PubMed, Embase, Web of Science, Google Scholar, Cochrane y Epistemonikos, utilizando los términos de búsqueda definidos para cada base de datos y los diferentes conectores booleanos (Anexo 2). Se limitó al inglés y al español. Los estudios incluidos debían comparar idealmente la ultrasonografía con el estándar de referencia (biopsia de arteria temporal), o bien evaluar las características operacionales de esta prueba diagnóstica con respecto a otras estrategias diagnósticas, como la imagen por resonancia nuclear magnética, o criterios clínicos.
El tiempo definido fue desde el 1.o de enero de 1990 hasta el 31 de marzo del 2020. La búsqueda fue realizada por 4de los autores de manera autónoma (DJA, AV, CHMV, MPT). En caso de discordancias estas fueron dirimidas por uno de los autores (DJA) con experticia temática y metodológica (fig. 1)8. Para la evaluación del riesgo de sesgo de las publicaciones se consideraron los 6 dominios de la herramienta para la evaluación del riesgo de sesgo de la colaboración Cochrane (tabla 1).
Extracción de datos sobre rendimiento de ultrasonido de arterias temporales
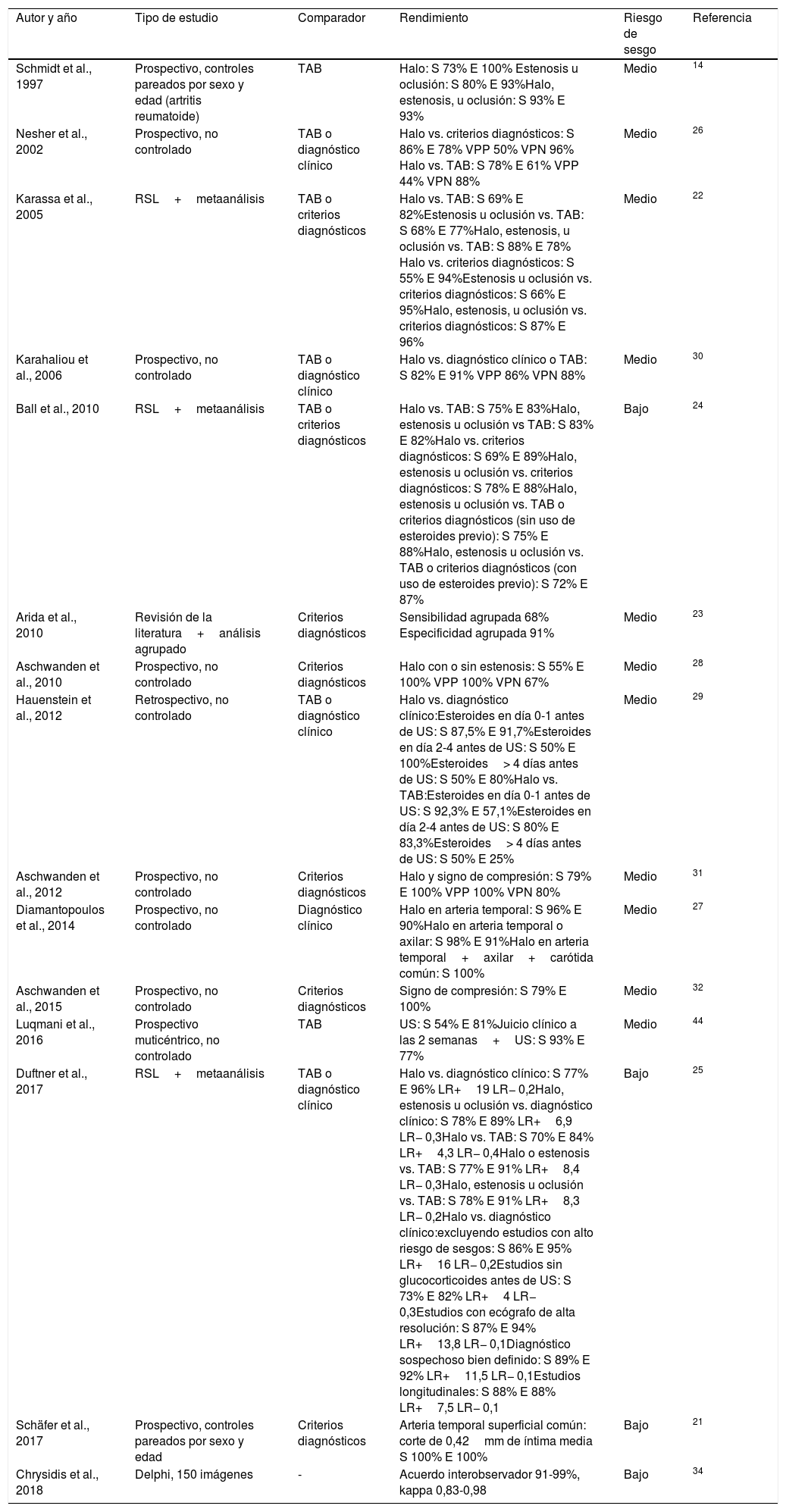
| Autor y año | Tipo de estudio | Comparador | Rendimiento | Riesgo de sesgo | Referencia |
| Schmidt et al., 1997 | Prospectivo, controles pareados por sexo y edad (artritis reumatoide) | TAB | Halo: S 73% E 100% Estenosis u oclusión: S 80% E 93%Halo, estenosis, u oclusión: S 93% E 93% | Medio | 14 |
| Nesher et al., 2002 | Prospectivo, no controlado | TAB o diagnóstico clínico | Halo vs. criterios diagnósticos: S 86% E 78% VPP 50% VPN 96% Halo vs. TAB: S 78% E 61% VPP 44% VPN 88% | Medio | 26 |
| Karassa et al., 2005 | RSL+metaanálisis | TAB o criterios diagnósticos | Halo vs. TAB: S 69% E 82%Estenosis u oclusión vs. TAB: S 68% E 77%Halo, estenosis, u oclusión vs. TAB: S 88% E 78% Halo vs. criterios diagnósticos: S 55% E 94%Estenosis u oclusión vs. criterios diagnósticos: S 66% E 95%Halo, estenosis, u oclusión vs. criterios diagnósticos: S 87% E 96% | Medio | 22 |
| Karahaliou et al., 2006 | Prospectivo, no controlado | TAB o diagnóstico clínico | Halo vs. diagnóstico clínico o TAB: S 82% E 91% VPP 86% VPN 88% | Medio | 30 |
| Ball et al., 2010 | RSL+metaanálisis | TAB o criterios diagnósticos | Halo vs. TAB: S 75% E 83%Halo, estenosis u oclusión vs TAB: S 83% E 82%Halo vs. criterios diagnósticos: S 69% E 89%Halo, estenosis u oclusión vs. criterios diagnósticos: S 78% E 88%Halo, estenosis u oclusión vs. TAB o criterios diagnósticos (sin uso de esteroides previo): S 75% E 88%Halo, estenosis u oclusión vs. TAB o criterios diagnósticos (con uso de esteroides previo): S 72% E 87% | Bajo | 24 |
| Arida et al., 2010 | Revisión de la literatura+análisis agrupado | Criterios diagnósticos | Sensibilidad agrupada 68% Especificidad agrupada 91% | Medio | 23 |
| Aschwanden et al., 2010 | Prospectivo, no controlado | Criterios diagnósticos | Halo con o sin estenosis: S 55% E 100% VPP 100% VPN 67% | Medio | 28 |
| Hauenstein et al., 2012 | Retrospectivo, no controlado | TAB o diagnóstico clínico | Halo vs. diagnóstico clínico:Esteroides en día 0-1 antes de US: S 87,5% E 91,7%Esteroides en día 2-4 antes de US: S 50% E 100%Esteroides> 4 días antes de US: S 50% E 80%Halo vs. TAB:Esteroides en día 0-1 antes de US: S 92,3% E 57,1%Esteroides en día 2-4 antes de US: S 80% E 83,3%Esteroides> 4 días antes de US: S 50% E 25% | Medio | 29 |
| Aschwanden et al., 2012 | Prospectivo, no controlado | Criterios diagnósticos | Halo y signo de compresión: S 79% E 100% VPP 100% VPN 80% | Medio | 31 |
| Diamantopoulos et al., 2014 | Prospectivo, no controlado | Diagnóstico clínico | Halo en arteria temporal: S 96% E 90%Halo en arteria temporal o axilar: S 98% E 91%Halo en arteria temporal+axilar+carótida común: S 100% | Medio | 27 |
| Aschwanden et al., 2015 | Prospectivo, no controlado | Criterios diagnósticos | Signo de compresión: S 79% E 100% | Medio | 32 |
| Luqmani et al., 2016 | Prospectivo muticéntrico, no controlado | TAB | US: S 54% E 81%Juicio clínico a las 2 semanas+US: S 93% E 77% | Medio | 44 |
| Duftner et al., 2017 | RSL+metaanálisis | TAB o diagnóstico clínico | Halo vs. diagnóstico clínico: S 77% E 96% LR+19 LR− 0,2Halo, estenosis u oclusión vs. diagnóstico clínico: S 78% E 89% LR+6,9 LR− 0,3Halo vs. TAB: S 70% E 84% LR+4,3 LR− 0,4Halo o estenosis vs. TAB: S 77% E 91% LR+8,4 LR− 0,3Halo, estenosis u oclusión vs. TAB: S 78% E 91% LR+8,3 LR− 0,2Halo vs. diagnóstico clínico:excluyendo estudios con alto riesgo de sesgos: S 86% E 95% LR+16 LR− 0,2Estudios sin glucocorticoides antes de US: S 73% E 82% LR+4 LR− 0,3Estudios con ecógrafo de alta resolución: S 87% E 94% LR+13,8 LR− 0,1Diagnóstico sospechoso bien definido: S 89% E 92% LR+11,5 LR− 0,1Estudios longitudinales: S 88% E 88% LR+7,5 LR− 0,1 | Bajo | 25 |
| Schäfer et al., 2017 | Prospectivo, controles pareados por sexo y edad | Criterios diagnósticos | Arteria temporal superficial común: corte de 0,42mm de íntima media S 100% E 100% | Bajo | 21 |
| Chrysidis et al., 2018 | Delphi, 150 imágenes | - | Acuerdo interobservador 91-99%, kappa 0,83-0,98 | Bajo | 34 |
E: especificidad; LR: LR: Likelihood ratio. El resto de siglas son correctas; RSL: revisión sistemática de la literatura; S: sensibilidad; TAB: biopsia de arteria temporal; US: ultrasonido de arterias temporales; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
En 1990 el Colegio Americano de Reumatología definió 5 criterios para la clasificación de la enfermedad: edad mayor de 50 años, cefalea nueva localizada, sensibilidad en la arteria temporal o pulso de la arteria temporal disminuido, eritrosedimentación superior a 50mm/h y hallazgos sugestivos en la biopsia de arteria temporal: infiltrado mononuclear o proceso granulomatoso con células gigantes multinucleadas. Si se cumplían 3de ellos se clasificaba al paciente como con ACG, con una sensibilidad del 93,5% y una especificidad del 91,2%9.
La enfermedad se puede sospechar con los síntomas descritos en un paciente mayor de 50 años con elevación de los reactantes de fase aguda; sin embargo, el estándar de oro para el diagnóstico es la biopsia de arteria temporal, a pesar de su variable sensibilidad entre 49 y 85% dependiendo de la longitud de la muestra, de la afectación de arterias diferentes de la temporal, del carácter segmentario de la inflamación y del tiempo de tratamiento con glucocorticoides10,11. Las complicaciones de este procedimiento no son frecuentes, pero pueden incluir sangrado arterial o venoso, infección del sitio quirúrgico y lesión del nervio auriculotemporal o de ramas del nervio facial12.
Papel del ultrasonido Doppler de arterias temporalesDesde la década de los 70 se ha usado el ultrasonido Doppler de las arterias temporales, inicialmente para localizarlas antes de la biopsia13. En 1997, Schmidt et al. propusieron este examen como herramienta diagnóstica14 para esta enfermedad en vista de que era una técnica no invasiva, rápida, de bajo costo, usualmente bien tolerada, sin exposición a medio de contraste, que suministra información sobre la presencia del edema de la pared del vaso y permite una evaluación dinámica alrededor de toda su extensión, lo que supone una ventaja sobre la biopsia, ya que supera el inconveniente de que la afección sea segmentaria15; además permite la evaluación tanto de la arteria temporal superficial como de otras ramas craneales y vasos extracraneales, como las arterias axilares16.
Su principal desventaja es que se trata de una técnica dependiente del operador. La experticia del operador, especialmente una adecuada curva de aprendizaje en casos positivos, y la calidad óptima del ecógrafo influyen en el rendimiento del estudio. La Liga Europea Contra el Reumatismo (EULAR) recomienda el ultrasonido de arterias temporales como la primera técnica de imagen en pacientes con sospecha de ACG con afección principalmente craneal y resalta la importancia de una evaluación ecográfica óptima realizada por un especialista entrenado y con un equipo técnico apropiado17.
TécnicaEl ultrasonido y la técnica Doppler para evaluar arterias temporales y axilares se debe hacer con transductor lineal; existen 3técnicas de Doppler: Doppler espectral, que consiste en una curva de velocidad en el eje Y y tiempo en el eje X, que representa la variación de flujo; Doppler color, que, de acuerdo con la velocidad media del flujo asigna un color en una escala predeterminada, y que se sobrepone al modo B; finalmente, el Doppler poder observa la intensidad del flujo, a diferencia de los anteriores que determinan velocidad. La técnica Doppler más usada en la evaluación del flujo de las arterias temporales es el Doppler color.
Con respecto al Doppler color, se debe hacer a una frecuencia de al menos 10MHz con pre-set vascular. La evaluación de las arterias temporales debe efectuarse en decúbito supino. La primera porción de la arteria temporal se visualiza en el trago. El transductor debe estar en un plano transverso y, después, longitudinal. Tras completar un barrido inicial con un plano, se rota el transductor 90 grados para evaluar el plano opuesto. El nivel de la bifurcación entre las ramas frontal y parietal se utiliza como punto de referencia para definir el origen de las 2ramas. Se debe evaluar todo el recorrido de la arteria temporal común y sus ramas.
La arteria axilar se evalúa con el transductor sobre la línea medio axilar y se realiza un barrido siguiendo su recorrido anatómico. El transductor debe ser aplicado tanto en un plano longitudinal como transverso. Esta técnica puede ser utilizada por reumatólogos, radiólogos y medicina vascular, con la particularidad de que quien lo haga debe tener la capacitación adecuada en ecografía y ultrasonido, especialmente de arterias temporales. A continuación, se detallan las mínimas características técnicas del equipo recomendadas (cabe resaltar que dichas especificaciones han sido planteadas por consensos de expertos)15,17,18.
Escala de grisesFrecuencia: ≥ 15MHz para arterias temporales y entre 7-15MHz para arterias extracraneales.
Enfoque: debe ser en la arteria. En general, 5mm para arterias temporales, 20-30mm para arterias axilares.
Profundidad: en general, 10-20mm para arterias temporales, 30-40mm para arterias axilares.
Ganancia de modo B: en promedio, 35-45dB.
Densidad lineal: 3.
Rango dinámico: 40-60dB.
Doppler colorFrecuencia: Entre 7 y 12MHz para arterias temporales y entre 4 y 8MHz para arterias extracraneales.
Frecuencia de repetición de pulso: 2-3,5kHz para arterias temporales y entre 3 y 4kHz para arterias extratemporales.
Filtro de pared: el menor filtro posible.
Caja de color: debe estar a un ángulo de insonación de ≤ 60°.
Ganancia del color: entre 2 y 18.
Hallazgos ultrasonográficos patológicos en el paciente con arteritis de células gigantesPueden documentarse 4 hallazgos patológicos en el ultrasonido de arterias temporales de un paciente con ACG16:
- 1.
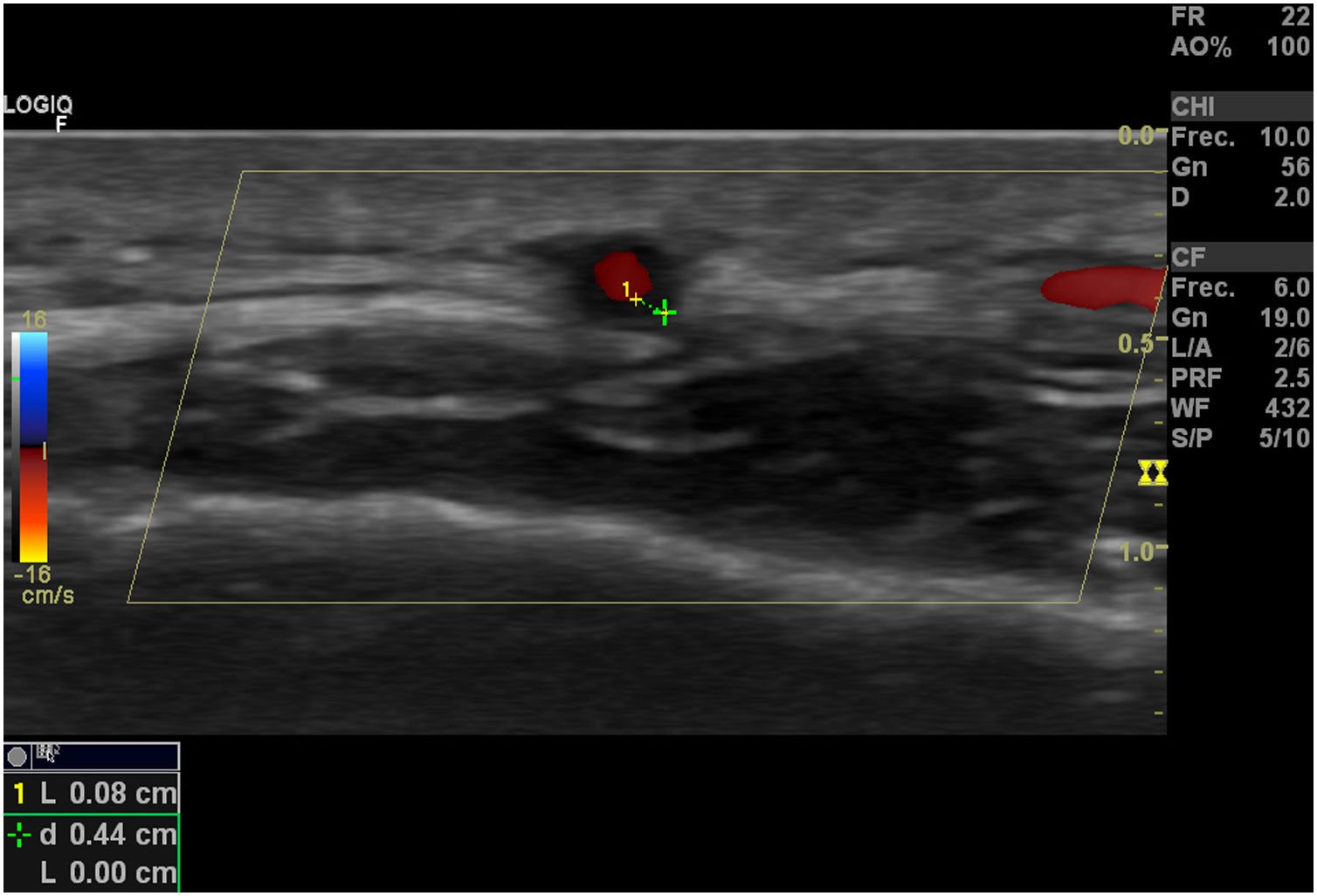
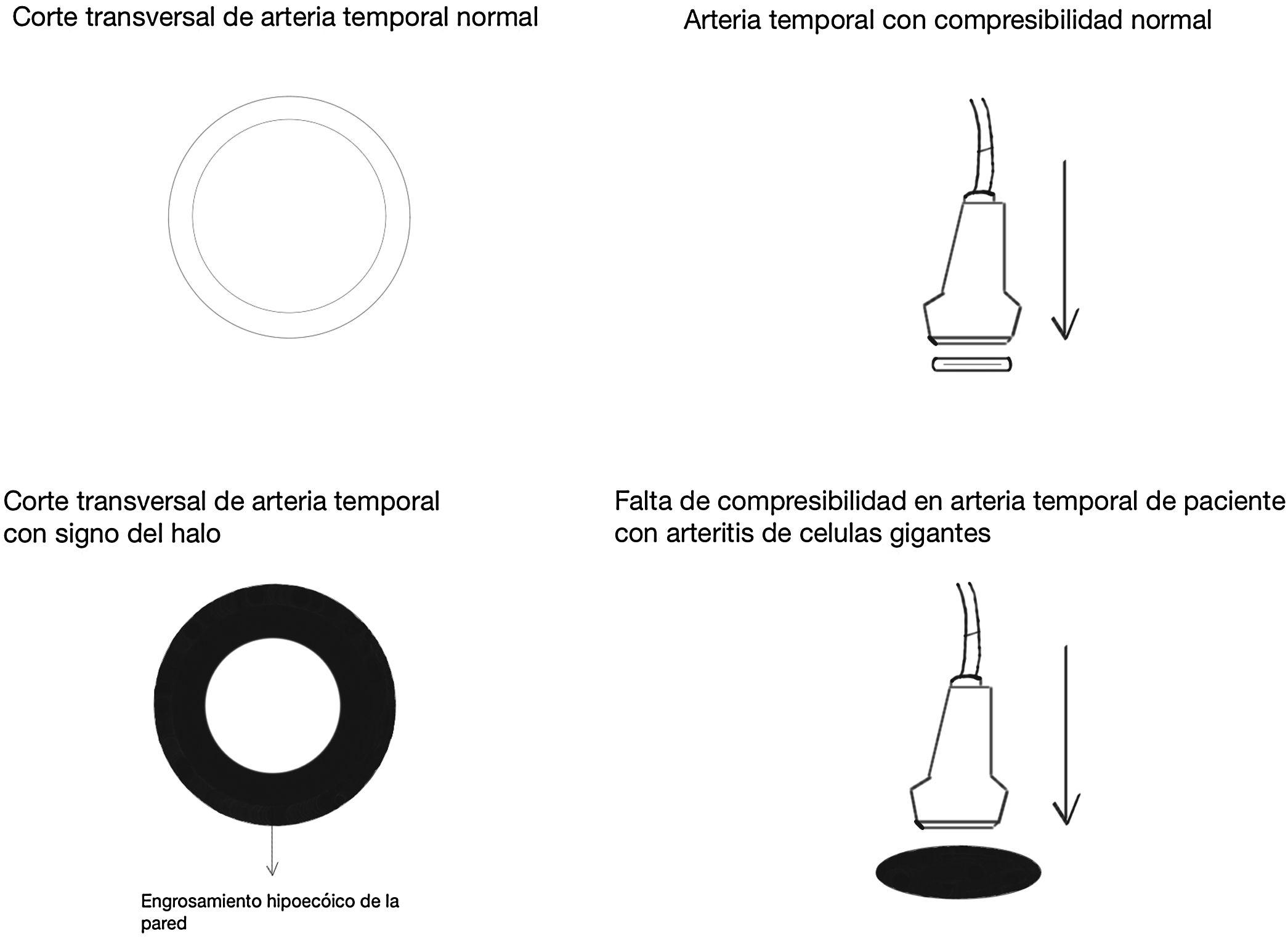
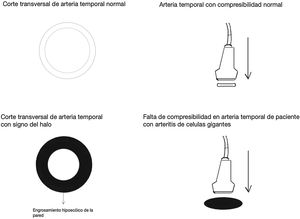
Signo del halo (fig. 2): es un engrosamiento homogéneo de la pared, hipoecoico (en el modo B), de bordes definidos (se logra delimitar el tejido adyacente al vaso), visible en el plano transverso (usualmente concéntrico) y longitudinal. Refleja el edema de la pared del vaso y es el hallazgo más relevante para esta enfermedad. Algunos estudios definieron puntos de corte del diámetro del halo para arterias temporales entre 0,3 y 1,0mm y para arterias axilares entre 1,0 y 2,0mm19,20. Schafer et al., en un estudio prospectivo de 40 pacientes con ACG comparados con controles sanos, encontraron que el diámetro del grosor íntima-media (GIM) normal era en promedio de 0,2mm en arterias temporales y de 0,6mm en arterias axilares, y establecieron puntos de corte para el GIM de los pacientes con ACG en las arterias temporales superficiales comunes de 0,65mm (sensibilidad y especificidad del 100%), en la rama frontal de 0,54mm (sensibilidad y especificidad del 100%), en la rama parietal de 0,50mm (sensibilidad del 97,2% y especificidad del 98,7%), en la arteria facial de 0,53mm (sensibilidad del 87,5% y especificidad del 98,8%) y en las arterias axilares de 1,7mm (sensibilidad y especificidad del 100%)21. Varios metaanálisis han reportado una sensibilidad del 68-77% y especificidad del 83-96% para el signo del halo unilateral y una sensibilidad del 43% y especificidad del 100% para el signo del halo bilateral22-25, con un valor predictivo positivo del 50% y un valor predictivo negativo del 96%26. La sensibilidad del ultrasonido Doppler solo se incrementa en un 2% cuando se adiciona la evaluación de las arterias axilares al estudio de las arterias temporales27. Diferentes estudios han mostrado que en la mayoría de los pacientes el signo del halo no es visible luego de 2-4 semanas después del inicio de la terapia con glucocorticoides, debido a que los cambios inflamatorios desaparecen y la sensibilidad del estudio disminuye al 50% a partir del 4.° día de tratamiento, por lo que se recomienda la evaluación temprana con el ultrasonido Doppler en los primeros 2 días después del inicio del tratamiento28-30.
- 2.
Signo de compresibilidad de la arteria temporal (fig. 3): es la persistencia del halo hipoecoico a pesar de la compresión extrínseca de la luz arterial con el transductor de ultrasonido («signo de compresibilidad»); es una variante del halo con una sensibilidad del 77-79% y una especificidad del 100%31,32.
- 3.
Estenosis: se produce cuando la velocidad del flujo sanguíneo es más del doble de la registrada en el área inmediatamente anterior, con formas de onda que demuestran turbulencia y reducción de la velocidad detrás del área de la estenosis16.
- 4.
Oclusión: ausencia completa del flujo. En el estudio de Schmidt et al. tanto la estenosis como las oclusiones tuvieron una sensibilidad del 80% y una sensibilidad del 93%16. El hallazgo de estenosis u oclusión arterial no incrementa el rendimiento diagnóstico del signo del halo25.
Con el fin de estandarizar y evaluar el rendimiento del ultrasonido Doppler en el diagnóstico de las vasculitis de grandes vasos, se constituyó el grupo de trabajo de ultrasonido en vasculitis de vaso grande OMERACT LV-US (Outcome Measures in Rheumatology Large Vessel Ultrasound), en el marco del congreso anual del Colegio Americano de Reumatología en Boston en el 201416. Con base en esta estrategia se publicó un primer estudio, cuyo objetivo fue definir los hallazgos fundamentales en ultrasonido de ACG y evaluar su rendimiento de acuerdo con estos. Participaron 25 expertos en ultrasonido Doppler de ACG y se obtuvo un total de 9 definiciones sobre hallazgos consistentes en apariencia normal, vasculitis y aterosclerosis de arterias craneales y extracraneales. Se encontró que los signos del halo y la compresión son los hallazgos clave en el ultrasonido Doppler de pacientes con ACG.
Las definiciones de arterias temporales y axilares normales, signo del halo y compresibilidad mostraron un acuerdo interobservador del 91-99%, con un valor promedio de kappa de 0,83-0,98 entre los evaluadores expertos33. En un estudio reciente de casos y controles se demostró una adecuada concordancia inter- e intraobservador del signo del halo y la compresibilidad entre operadores previamente entrenados (más de 300 estudios), con un protocolo de estudio estandarizado de al menos 15-20 min por estudio y usando transductores de más de 15 MHz34.
Falsos positivos del signo del halo en el ultrasonido DopplerSe han descrito falsos positivos del signo del halo en otras formas de vasculitis (como la poliarteritis nodosa y las vasculitis asociadas con anticuerpos citoplasmáticos antineutrófilos [ANCA]), amiloidosis, neoplasias, infecciones y aterosclerosis26,35-38. En la tabla 2 se resumen los posibles mecanismos implicados en la presencia del signo del halo en enfermedades diferentes de la ACG.
Falsos positivos del signo del halo en el ultrasonido Doppler
| Enfermedad | Mecanismo propuesto | Arterias afectadas |
| Aterosclerosis | Depósito de material en la pared vascularAumento del GIM | Axilar, temporal |
| Vasculitis ANCA | Infiltración celular y edema | Temporal |
| Osteomielitis de la base del cráneo | Infiltración celular y edema | Temporal |
| Neurosífilis | Infiltración celular y edema | Temporal |
| Linfoma de células T | Infiltración celular y edema | Temporal |
| Mieloma múltiple | Depósito de material en la pared vascular | Temporal |
| Amiloidosis | Depósito de material en la pared vascular | Temporal |
ANCA: anticuerpos citoplasmáticos antineutrófilos.GIM: grosor íntima-media.
Lo anterior exige que los resultados del ultrasonido Doppler sean interpretados en el contexto de los hallazgos clínicos y de laboratorio, al igual que se requiere la optimización y estandarización de los protocolos de imagen en el proceso diagnóstico y establecer puntos de corte (ojalá en las diferentes poblaciones) para reducir las tasas de falsos positivos18,20,21,39.
Tanto la aterosclerosis como la ACG aumentan su frecuencia con la edad. En la aterosclerosis se producen placas cálcicas de apariencia hiperecoica o se genera un aumento del GIM, que se visualiza hiperecoico en el ultrasonido Doppler40,41. Hasta ahora no existe consenso para diferenciar de forma apropiada la afección inflamatoria de la pared vascular y los cambios ateroscleróticos, especialmente cuando no hay un componente cálcico predominante. Algunos autores plantean que el GIM carotídeo muestra una correlación significativa con el GIM temporal: un GIM carotídeo>0,9mm se asoció con un GIM temporal> 0,3mm, simulando un signo del halo, por lo que propone un punto de corte de GIM>0,34 en al menos 2ramas de la arteria temporal para disminuir el número de falsos positivos42. Se necesitan más estudios para validar estos hallazgos.
¿Se podría reemplazar la biopsia de arteria temporal por el ultrasonido Doppler en el diagnóstico de pacientes con arteritis de células gigantes?La biopsia de arterias temporales guiada por ultrasonido parece no incrementar la sensibilidad del estudio histológico para el diagnóstico de la enfermedad. En presencia de un signo de halo positivo, la probabilidad de tener una biopsia positiva es igualmente alta, con independencia de que la biopsia sea guiada por ultrasonido o por evaluación clínica30. Se ha planteado el uso del ultrasonido Doppler como posible herramienta diagnóstica para prescindir de la biopsia en pacientes seleccionados14,43, aunque algunos estudios reportan resultados contradictorios en los que el ultrasonido Doppler no supera a la evaluación clínica39 y tiene un mejor rendimiento cuando sale negativo para descartar la enfermedad, debido a su alto valor predictivo negativo26. Sin embargo, trabajos publicados después del 2010 en los que se utilizaron ecógrafos de mayor resolución demostraron rendimientos comparables con la biopsia de arteria temporal para el diagnóstico de ACG25.
El estudio TABUL evaluó el rendimiento y la costoefectividad del ultrasonido Doppler de arterias temporales y axilares en comparación con la biopsia de arteria temporal en el diagnóstico de la ACG en 381 pacientes. Los resultados mostraron una sensibilidad del ultrasonido Doppler del 54% y de la biopsia de arteria temporal del 39%, con especificidades del 81% y el 100%, respectivamente. La correlación interobservador de los ecografistas en una evaluación post hoc fue comparable con los patólogos (coeficiente de correlación intraclase 0,61 vs. 0,62, respectivamente)44.
EULAR recomienda evaluar inicialmente las arterias temporales; si el estudio es negativo y persiste la sospecha clínica, se deben evaluar vasos adicionales como las arterias axilares y otras arterias craneales o extracraneales17. Los pacientes con signos clínicos de ACG y un signo del halo positivo en el ultrasonido Doppler podrían ser tratados sin necesidad de la biopsia de arteria temporal, a no ser que exista la sospecha de otro tipo de vasculitis (como las asociadas a ANCA, que mostrarían una histopatología diferente). Aquellos que tienen fuerte evidencia clínica de ACG, pero solo tienen estenosis u oclusiones, deben someterse a la biopsia de arteria temporal. Pacientes con signos clínicos de polimialgia reumática sin síntomas de ACG pero que tienen hallazgos anormales en el ultrasonido Doppler (halo, estenosis u oclusión) deben someterse a una biopsia y recibir tratamiento con glucocorticoides mientras se conocen los resultados de esta para evitar la pérdida visual14.
Las clínicas de ultrasonido fast-track para el diagnóstico temprano de ACG nacieron con el fin de reducir las complicaciones isquémicas de la enfermedad, especialmente la pérdida visual permanente, pues está demostrado que la detección e instauración temprana del tratamiento con glucocorticoides mejora los desenlaces45. A los pacientes ambulatorios con sospecha clínica de ACG se les realiza una evaluación clínica y ecográfica rápida por especialistas entrenados y se inicia de forma rápida la terapia con glucocorticoides si está indicada. En un centro de referencia que utiliza esta modalidad de atención la evaluación por un modelo de ultrasonido fast-track en pacientes con ACG demostró una reducción del 88% del riesgo de pérdida visual permanente, en comparación con el modelo convencional (RR 0,12; IC 95%: 0,01-0,97; p=0,01) y la diferencia promedio en días de hospitalización entre los pacientes evaluados de forma convencional y los pacientes evaluados por ultrasonidos fast-track fue de 3 días (3,6 vs. 0,6 días; p<0,0005)46.
ConclusionesLa arteritis de células gigantes, aunque infrecuente, es una entidad que genera alta morbilidad. El reconocimiento oportuno y el tratamiento temprano pueden evitar complicaciones graves, como la pérdida visual. El reto clínico que representan su diagnóstico y las limitaciones del estándar de oro han abierto la puerta a nuevas técnicas de imagen. El doppler color es una herramienta económica, rápida, fácilmente disponible y con un buen rendimiento diagnóstico. Sin embargo, es fundamental disponer de personal entrenado, de los equipos de ultrasonido adecuados y utilizar la programación adecuada.
Hallazgos del Doppler, como el signo del halo, la falta de compresibilidad de la arteria temporal, la estenosis y la oclusión son evidencias potentes para el diagnóstico de la ACG. Entre tales hallazgos, el signo más estudiado es el del halo, el cual tiene un buen rendimiento diagnóstico. Sin embargo, dicho signo tiene hallazgos que pueden llevar a falsos positivos y que se deben tener en cuenta en un diagnóstico diferencial. Por último, las clínicas fast-track apoyadas en ultrasonido y Doppler han logrado disminuir las complicaciones isquémicas de la enfermedad. Es esencial que en nuestro medio se fomente la investigación y el entrenamiento del personal que estará encargado de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.