Guía de práctica clínica 2022 para la detección temprana, el diagnóstico, el tratamiento y el seguimiento de los pacientes con artritis reumatoide (AR) desarrollada por el grupo de estudio de artritis reumatoide de la Asociación Colombiana de Reumatología. La AR es la enfermedad autoinmune más frecuente en adultos. A nivel mundial, la AR tiene una prevalencia de entre el 0,5 y el 1%, con una tasa de prevalencia estandarizada por edad de 246,6 por cada 100.000 habitantes, siendo más frecuente en mujeres que en varones y con un pico de presentación entre los 60 y los 64 años. Esta enfermedad se caracteriza por dolor e inflamación articular, y en algunos casos puede causar manifestaciones extraarticulares como síndrome seco, vasculitis, pericarditis, pleuritis y escleritis, entre otras. La AR produce gran morbilidad, afectación de la calidad de vida, discapacidad grave, altos costos directos e indirectos para los sistemas de salud, incapacidad y ausentismo laboral. Esta guía ha sido desarrollada para reumatólogos, médicos de atención primaria, especialistas de áreas afines y otros actores del sistema con el objetivo de brindar la información más relevante relacionada con la detección temprana de la enfermedad, así como su correcto diagnóstico, tratamiento y seguimiento.
Clinical practice guideline 2022 for the early detection, diagnosis, treatment, and follow-up of patients with rheumatoid arthritis developed by the rheumatoid arthritis study group of the Colombian Association of Rheumatology. Rheumatoid arthritis (RA) is the most common autoimmune disease in adults. Worldwide, RA has a prevalence of .5%-1%, with an age-standardised prevalence rate of 246.6 per 100,000 population, being more common in women than in men and with peak presentation between the ages of 60 and 64 years. The disease is characterised by joint pain and inflammation and in some cases can cause extra-articular manifestations such as dry syndrome, vasculitis, pericarditis, pleuritis, scleritis, among others. RA causes great morbidity, impairment of quality of life, severe disability, high direct and indirect costs to health systems, disability, and absenteeism from work. This guideline was developed for rheumatologists, primary care physicians, specialists in related areas, and other actors in the system with the aim of providing the most relevant information on the early detection of the disease, and its correct diagnosis, treatment, and follow-up.
La artritis reumatoide (AR) es la enfermedad autoinmune más frecuente en adultos. A escala mundial, tiene una prevalencia de entre el 0,5 y el 1%, con una tasa de prevalencia estandarizada por edad de 246,6 por cada 100.000 habitantes, es más frecuente en mujeres que en varones, en tanto que su un pico de presentación se encuentra entre los 60 y los 64 años1,2. En Colombia, se ha estimado una prevalencia de entre el 0,52 y el 1,49%, lo que la convierte en la enfermedad autoinmune con compromiso articular inflamatorio más frecuente en el país, con una relación mujer: varón de 4,2:1 y una mayor prevalencia en el rango de edad de 70 a 74 años3,4.
Esta enfermedad se caracteriza por dolor e inflamación articular, y en algunos casos puede presentar manifestaciones extraarticulares como síndrome seco, vasculitis, pericarditis, pleuritis y escleritis, entre otras. Conlleva gran morbilidad, afectación de la calidad de vida, discapacidad grave, altos costos directos e indirectos para los sistemas de salud, incapacidad y ausentismo laboral5. El manejo de los pacientes comprende intervenciones no farmacológicas y farmacológicas con el objetivo de mejorar la calidad de vida a través de la reducción de los síntomas y la prevención o disminución del daño articular y de las complicaciones de la enfermedad6.
La evidencia científica ha demostrado que la progresión de la enfermedad puede retrasarse con un tratamiento oportuno y adecuado. En los últimos años, han aparecido nuevas estrategias terapéuticas que permiten impactar positivamente la calidad de vida de los pacientes y mejorar su funcionalidad5. En este contexto, la Asociación Colombiana de Reumatología (Asoreuma) desarrolló esta guía de práctica clínica (GPC) con el objetivo de brindar recomendaciones basadas en la evidencia con respecto al diagnóstico temprano, el tratamiento integral (farmacológico y no farmacológico) y el seguimiento de adultos con diagnóstico o sospecha diagnóstica de AR, con independencia del tiempo de evolución y el estado clínico de la enfermedad.
Esta guía se dirige principalmente a todos los profesionales de la salud involucrados en la atención de los pacientes con AR en los diferentes niveles de atención: médicos generales, médicos especialistas y otros profesionales sanitarios. Del mismo modo, puede constituir una herramienta de apoyo para los diferentes actores del sistema de salud en Colombia, incluidos los tomadores de decisiones.
MetodologíaEl desarrollo de esta GPC contó con la participación de expertos clínicos en reumatología, pacientes con AR y un equipo técnico metodológico de la consultora EpiThink (la lista de participantes y la declaración de intereses pueden consultarse en el material suplementario 1). Las recomendaciones aquí planteadas se construyeron siguiendo la metodología Grade-Adolopment7 (los detalles metodológicos se encuentran en el material suplementario 2). En general, el grupo desarrollador formuló las preguntas clínicas y los desenlaces de interés para el abordaje de la GPC (material suplementario 3), llevó a cabo una búsqueda sistemática de guías e hizo una evaluación de la calidad con el instrumento Agree II8. Por su alta calidad, adaptabilidad y conveniencia, se escogió la Guía de práctica clínica para el manejo de pacientes con artritis reumatoide de la Sociedad Española de Reumatología9 como fuente para la actualización de las búsquedas de la literatura.
Una vez se identificaron las recomendaciones coincidentes para cada pregunta planteada, se reprodujeron las estrategias originales en las bases de datos Medline (a través de PubMed), Embase (Elsevier) y Cochrane. Adicionalmente, se utilizó la base Lilacs a fin de incluir evidencia latinoamericana. Para la búsqueda de literatura de las preguntas no planteadas en la guía fuente se crearon estrategias que combinaron términos de lenguaje libre y controlado según el tesauro correspondiente a cada base de datos (las estrategias y los resultados de la búsqueda pueden consultarse en el material suplementario 4). La selección de las referencias identificadas estuvo a cargo dos revisores que de manera independiente evaluaron los documentos bajo los criterios de elegibilidad, tamizando inicialmente las referencias por título y resumen, y luego con la revisión del texto completo de los artículos potencialmente relevantes (véase Prisma en el material suplementario 5). A los artículos seleccionados se les realizó una evaluación de calidad y la evidencia se resumió en tablas siguiendo la metodología Grade (el resumen de evidencia se encuentra en el material suplementario 6).
Cada experto del grupo desarrollador, conformado por 9 especialistas en reumatología, revisó las recomendaciones originales de la guía fuente junto con la nueva evidencia resultante de la actualización, y definió a su criterio si la recomendación original debía adoptarse o adaptarse. Posteriormente, en múltiples sesiones de discusión, se llevó a cabo la construcción de las recomendaciones. Finalmente, en sesión con 23 médicos especialistas en reumatología y 2 representantes de pacientes con AR, se presentaron las preguntas planteadas, la evidencia de soporte de cada tema y las recomendaciones formuladas para cada cuestión clínica. Los participantes del panel votaron cada una de las recomendaciones y discutieron con respecto al balance riesgo-beneficio, la factibilidad de la implementación y el posible impacto en el uso de los recursos. Una versión preliminar del manuscrito de la guía fue revisada y ajustada por todos los miembros del grupo desarrollador y posteriormente se envió a revisión por pares externos.
Todos los aspectos contemplados en esta guía están sujetos a revisión periódica según lo justifiquen la evolución del conocimiento, la tecnología y la práctica médica (véase el proceso de actualización en el material suplementario 2).
Definiciones clave y principios generalesLas recomendaciones presentadas en esta guía son orientadoras, pero no constituyen un lineamiento rígido de atención de pacientes con AR. Los médicos deben tomar decisiones individualizadas, idealmente a través de un proceso compartido que considere los valores y las preferencias del paciente. Las decisiones terapéuticas pueden estar limitadas por las realidades de un entorno clínico específico y disponibilidad de recursos, entre otros.
En las tablas 1 y 2 se describen las definiciones clave y los principios generales aplicables a esta guía.
Principios generales en el manejo de los pacientes con artritis reumatoide
| 1. Los médicos deben tomar decisiones individualizadas, idealmente a través de un proceso de decisión compartida que considere los valores y las preferencias del paciente. |
| 2. Todos los pacientes con AR deben ser evaluados por el reumatólogo, con el fin de mejorar la probabilidad de lograr modificaciones en el curso de la enfermedad. |
| 3. El abordaje de los pacientes con AR debe realizarse con un equipo multidisciplinario liderado por el reumatólogo, con el fin de mejorar su calidad de vida y su funcionalidad. |
| 4. La identificación temprana de la enfermedad es fundamental para mejorar su pronóstico. En todos los casos debe promoverse la evaluación especializada y la prescripción oportuna del tratamiento. |
| 5. En el paciente con AR se deben promover cambios en pro de un estilo de vida vida saludable, incluyendo actividad física, cese de tabaquismo, control de peso y gestión de factores de riesgo con el objetivo de prevenir comorbilidad cardiovascular. |
| 6. Las decisiones de tratamiento se deben basar en la actividad de la enfermedad y otros factores del paciente, como las comorbilidades y la progresión del daño estructural. |
| 7. Las decisiones de manejo de pacientes con AR deben considerar los costos médicos y sociales asociados. |
| 8. Los cambios entre tratamientos para pacientes en remisión clínica o baja actividad de la enfermedad deberán ser realizados exclusivamente por el reumatólogo, en una decisión compartida con el paciente. |
| 9. Una recomendación de tratamiento que favorece un medicamento sobre otro significa que el medicamento preferido sería la primera opción, sin embargo, esto no implica que el medicamento no favorecido esté contraindicado para su uso en esa situación, por lo que todavía puede ser una opción potencial bajo ciertas condiciones. |
AR: artritis reumatoide.
Definiciones en el contexto de artritis reumatoide
| Medicamentos y conceptos | Descripción |
|---|---|
| FARME convencionales | LEF, MTX, SSZ CQ o HCQ (excluye azatioprina, ciclosporina, minociclina y sales de oro) |
| FARME sintético dirigido | Baricitinib, tofacitinib, upadacitinib y filgotinib |
| Terapia doble FARME | MTX+SSZ, MTX+HCQ o CQ, SSZ+HCQ o CQ o combinaciones con LEF |
| Terapia triple FARME | MTX+SSZ+HCQ o CQ o LEF+SSZ+HCQ o CQ |
| Terapia combinada FARME | Terapia FARME convencional doble o triple |
| Productos biológicos | Biológico anti-FNT o biológico no anti-FNT |
| Productos biológicos anti-FNT | Adalimumab, certolizumab pegol, etanercept, golimumab o infliximab |
| Productos biológicos no anti-FNT | Abatacept, rituximab o tocilizumab |
| Glucocorticoide en dosis bajas | ≤10 mg/día de prednisolona (o equivalente) |
| Glucocorticoide en dosis altas | >10 mg/día de prednisolona (o equivalente) |
| Glucocorticoide a corto plazo | <3 meses de tratamiento |
| AR temprana | AR con duración de la enfermedad/síntomas (con independencia de la fecha del diagnóstico) de menos de 6 meses |
| AR establecida | AR con una duración de la enfermedad/síntomas ≥6 mesesa |
| Actividad de la enfermedad | Categorizada como en remisión, baja, moderada o alta actividad según escalas validadas10–12 |
| Remisión de la AR | Paciente que logra la remisión según una herramienta validada de clinimetría para valorar la actividad de la enfermedad. Entre los instrumentos de clinimetría más utilizados se encuentran el DAS28, CDAI, SDAI y RAPID3 |
| Dosificación óptima de los tratamientos para AR | El tratamiento seleccionado debe utilizarse en una dosis terapéutica eficaz, por lo menos durante 3 meses antes de considerarse como falla y escalar o modificar la terapia |
| Falla primaria a FARME | Fracaso de los FARME convencionales, biológicos o inhibidores JAK debido a la falta de eficacia/respuesta desde el inicio del tratamiento |
| Falla secundaria a FARME | El tratamiento fue eficaz al inicio, pero después se volvió ineficaz |
| Factores de mal pronóstico13 | • Actividad de la enfermedad persistentemente moderada o alta a pesar del tratamiento con FARMEsc, según medidas compuestas que incluyen recuentos de articulaciones• Altos niveles de reactantes de fase aguda (VSG o PCR)• Recuento elevado persistente de articulaciones inflamadas• Presencia de FR o ACPA en títulos altos• Presencia de erosiones óseas tempranas en las radiografías de manos o pies• Tabaquismo• HAQ inicial elevado• Falta de respuesta a metrotexato |
| Infección grave | Infección que requiere terapia antimicrobiana intravenosa u hospitalización14 |
| Biosimilares | Los productos biosimilares aprobados por el Invima se consideran equivalentes a los productos biológicos de referencia |
ACPA: anticuerpos antiproteína citrulinada; anti-FNT: inhibidor del factor de necrosis tumoral: AR: artritis reumatoide; CDAI: Clinical Disease Activity Index; CQ: cloroquina; DAS28: Disease Activity Score 28; FARME: fármaco antirreumático modificador de la enfermedad; FARMEsc: FARME sintético convencional; FR: factor reumatoide; HAQ: Health Assesment Questionnaire; HCQ: hidroxicloroquina; JAK: quinasas de Janus; LEF: leflunomida; MTX: metotrexato; PCR: proteína C reactiva; RAPID3: cuestionario de evaluación del estado de salud; SDAI: Simplified Disease Activity Index; SSZ: sulfasalazina; VSG: velocidad de sedimentación globular.
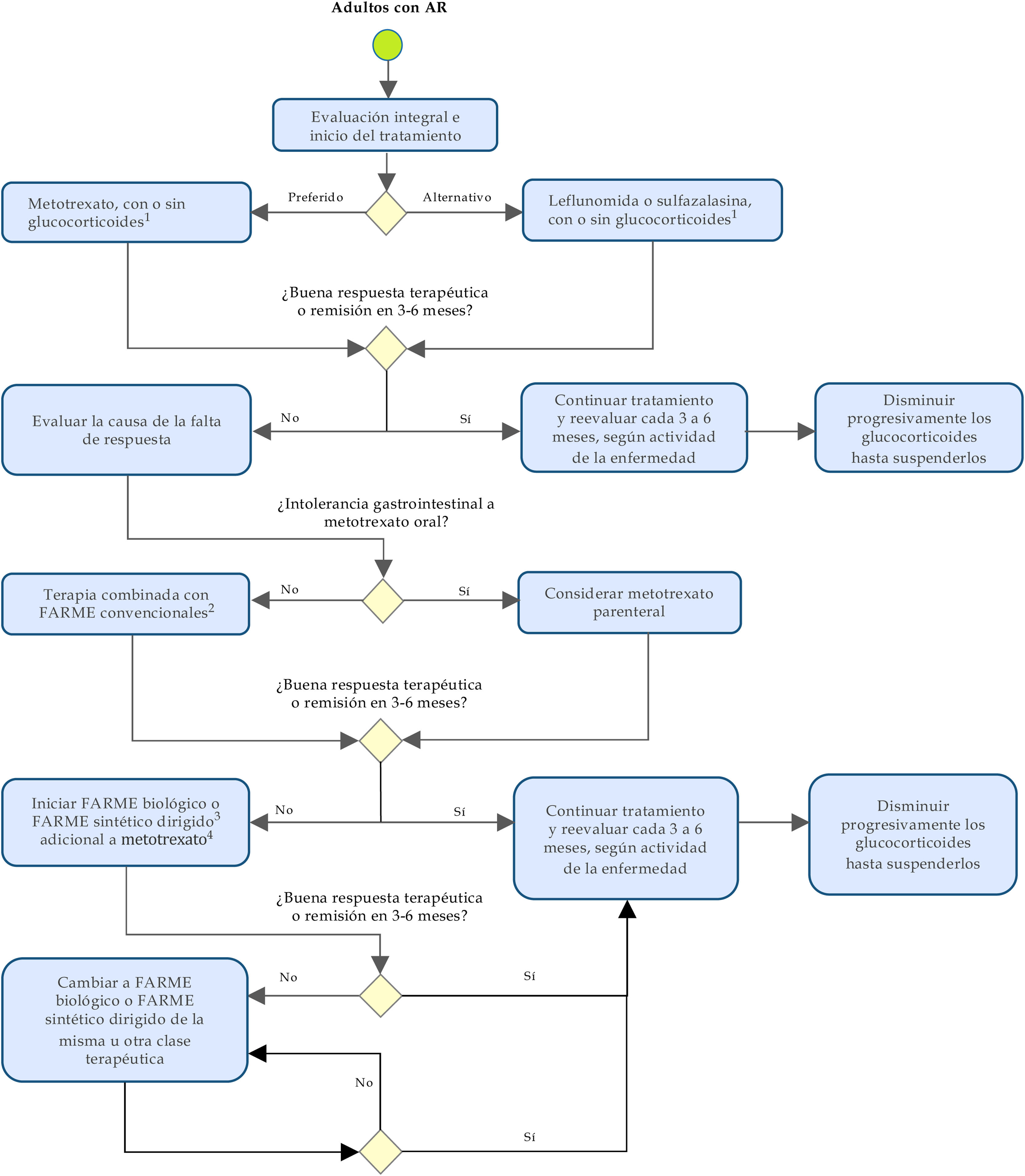
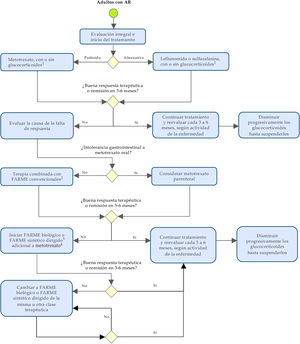
En la tabla 3 y en la figura 1 se resumen y esquematizan las recomendaciones formuladas para la detección temprana, el tratamiento y el seguimiento de los pacientes con AR.
Recomendaciones para la detección, el tratamiento y el seguimiento de pacientes con AR en Colombia
| Recomendación | PICO |
|---|---|
| Diagnóstico y clasificación de la AR | |
| Recomendación 1: en pacientes con AR seropositiva se recomienda utilizar los criterios de clasificación ACR/EULAR 2010 para respaldar la impresión diagnóstica del médico tratanteRecomendación fuerte a favor, calidad de la evidencia baja a moderada | 1 |
| Recomendación 2: en pacientes con AR seronegativa, para factor reumatoide y ACPA, y en quienes no cumplan los criterios ACR/EULAR 2010, el diagnóstico de AR dependerá de la impresión diagnóstica del reumatólogoRecomendación condicional a favor, calidad de la evidencia baja a moderada | 1 |
| Recomendación 3: el diagnóstico de AR es eminentemente clínico, basado en la historia de dolor articular inflamatorio y la presencia de articulaciones inflamadas (sinovitis) o dolorosas al examen físico. Las pruebas complementarias recomendadas son: VSG, PCR, FR y ACPARecomendación fuerte a favor, calidad de la evidencia baja a moderada | 2 |
| Recomendación 4: se recomienda realizar radiografía convencional de manos y pies para todos los pacientes con AR. El uso de otras imágenes diagnósticas como ecografía articular y resonancia magnética no se recomienda de manera rutinaria para el diagnóstico de AR. Su uso debe determinarse según criterio del reumatólogoRecomendación condicional en contra, calidad de la evidencia baja | 2 |
| Tratamiento farmacológico de primera línea | |
| Recomendación 5: en pacientes con AR que requieran el uso de glucocorticoides, se recomienda que se utilice en dosis equivalentes a 5-20mg/día de prednisolona como terapia de inicio en combinación con uno o varios FARME convencionales, seguida de una reducción gradual y posterior suspensión tan rápido como clínicamente sea posible. Para tiempos de uso mayores de dos semanas se recomiendan dosis menores o iguales a 10mg/díaRecomendación fuerte a favor, calidad de la evidencia moderada a alta | 3 |
| Recomendación 6: para el manejo sintomático del dolor asociado a la actividad de la AR, se recomienda el uso de antiinflamatorio no esteroideo (AINE) durante el menor tiempo posibleRecomendación fuerte a favor, calidad de la evidencia baja | 4 |
| Recomendación 7: en pacientes con AR se recomienda iniciar tratamiento con metotrexato. En caso de contraindicación, se recomienda utilizar leflunomida o sulfasalazina, de acuerdo con el criterio médicoRecomendación fuerte a favor, calidad de la evidencia baja | 5 |
| Recomendación 8: no se recomienda el uso de medicamentos como azatioprina, micofenolato de mofetil, ciclosporina y d-penicilamina para el tratamiento de las manifestaciones articulares de la artritis reumatoideRecomendación fuerte en contra, calidad de la evidencia baja | |
| Recomendación 9: en pacientes con AR y falla al metotrexato en monoterapia se recomienda el uso de terapia combinada con FARME convencionalesRecomendación fuerte a favor, calidad de la evidencia baja | 5 |
| Tratamiento del paciente con falla terapéutica a FARME convencionales | |
| Recomendación 10: en pacientes con AR y falla a la terapia combinada con FARME convencionales se recomienda el tratamiento con un biológico o un FARME sintético dirigido, en combinación con metotrexatoRecomendación fuerte a favor, calidad de la evidencia baja | 8,9 |
| Recomendación 11: en pacientes con AR y falla a la terapia combinada con FARME convencionales no es posible recomendar un determinado agente biológico o FARME sintético dirigido sobre otro, con independencia de si se usa asociado o no a metotrexatoRecomendación fuerte a favor, calidad de la evidencia alta | 6 |
| Recomendación 12: en los pacientes con AR e indicación de tratamiento con un agente biológico o FARME sintético dirigido y que presentan contraindicación o intolerancia al metotrexato, se aconseja la leflunomida en combinación con terapia biológica o un FARME sintético dirigidoRecomendación fuerte a favor, calidad de la evidencia moderada | 7 |
| Tratamiento del paciente con falla terapéutica a FARME biológicos o FARME dirigidos | |
| Recomendación 13: en pacientes con AR después de una respuesta inadecuada al primer FARME biológico o FARME sintético dirigido puede usarse un segundo FARME biológico o sintético dirigido de la misma u otra clase terapéutica, en función del tipo de ineficacia y de las características del pacienteRecomendación fuerte a favor, calidad de la evidencia moderada | 10 |
| Poblaciones especiales | |
| Recomendación 14: en pacientes con AR que sufren una infección durante el tratamiento con un agente biológico o FARME sintético dirigido se recomienda suspender el tratamiento temporalmente. Este podría ser reiniciado con precaución una vez la infección esté completamente resueltaRecomendación fuerte a favor, calidad de la evidencia moderada | 11 |
| Recomendación 15: en pacientes con AR y antecedente de cáncer en quienes vaya a iniciarse el tratamiento biológico se recomienda consensuar las decisiones de manejo con el paciente, el médico tratante de la enfermedad oncológica y otros especialistas implicadosRecomendación fuerte a favor, calidad de la evidencia moderada | 12 |
| Tratamiento no farmacológico | |
| Recomendación 16: no se recomienda el uso de terapias complementarias tales como acupuntura, taichí, balneoterapia, moxibustión, fitoterapia, yoga, entre otras, para el tratamiento de los pacientes con ARRecomendación fuerte en contra, calidad de la evidencia baja a moderada | 13 |
| Seguimiento | |
| Recomendación 17: se recomienda realizar el seguimiento de los pacientes con índices clinimétricos por lo menos cada 6 meses, o más frecuentemente si la condición clínica del paciente lo ameritaRecomendación fuerte a favor, calidad de la evidencia moderada | 14 |
| Recomendación 18: no se recomienda la realización rutinaria de radiografías de manos o pies, ecografía articular y resonancia magnética en el seguimiento de pacientes con AR. Su uso queda a discreción del reumatólogoRecomendación condicional en contra, calidad de la evidencia moderada | 14 |
| Recomendación 19: se recomienda realizar periódicamente hemograma, transaminasas, creatinina y reactantes de fase aguda. Otros paraclínicos podrían ser necesarios a criterio del reumatólogo o médico tratanteRecomendación fuerte a favor, calidad de la evidencia moderada | 14 |
ACPA: anticuerpos antiproteína citrulinada; AR: artritis reumatoide; FARME: fármaco antirreumático modificador de la enfermedad; FR: factor reumatoide; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
Algoritmo para la prevención, la evaluación y el manejo de la artritis reumatoide en adultos.
FARME: fármaco antirreumático modificador de la enfermedad.
1 Los glucocorticoides deben ser usados a la menor dosis posible y suspenderse tan pronto como sea posible.
2 Leflunomida o sulfasalazina.
3 Se recomienda realizar una apropiada evaluación del riesgo cardiovascular, infección y malignidad en pacientes.
4 En caso de contraindicación o intolerancia al metotrexato considerar el uso de leflunomida.
Nota: en la evaluación del paciente con AR se deben incluir consideraciones no farmacológicas respecto a adherencia terapéutica, educación y autocuidado, terapia física y rehabilitación, entre otras.
Recomendación 2: en pacientes con AR seronegativa, para factor reumatoide y ACPA, y en quienes no cumplan los criterios ACR/EULAR 2010, el diagnóstico de AR dependerá de la impresión diagnóstica del reumatólogo.
Recomendación condicional a favor, calidad de la evidencia baja a moderada
Punto de buena práctica: los criterios de clasificación son empleados en el ámbito de la investigación clínica y pueden servir para apoyar el diagnóstico de AR en los pacientes que los cumplan. En todo caso, el reumatólogo deberá realizar un análisis individualizado para confirmar o descartar el diagnóstico.
Resumen de la evidencia y discusión del panel
La evidencia obtenida a partir de 16 estudios observacionales15–34 que comparaban el rendimiento de los criterios de 1987 con los criterios del 2010 para la clasificación de la AR, en general, coincide en que los criterios del 2010 aplicados en pacientes con artritis de inicio son más sensibles, pero menos específicos que los criterios de 1987. No obstante, su sensibilidad se reduce enormemente en pacientes con FR y ACPA negativos, lo que puede generar falsos negativos en estos pacientes. A su vez, pueden clasificarse erróneamente como AR los pacientes con pocas articulaciones inflamadas, pero que tienen un FR positivo y una discreta elevación de la VSG. Los expertos anotan que el uso de los criterios de 1987 hace parte del juicio clínico del médico tratante, y que es posible que haya pacientes con enfermedad establecida que cumplan los criterios de 1987 y no los del 2010, por lo que no debe descartarse su uso en ciertas situaciones clínicas.
Recomendación 3: el diagnóstico de AR es eminentemente clínico, basado en la historia de dolor articular inflamatorio y la presencia de articulaciones inflamadas (sinovitis) o dolorosas al examen físico. Las pruebas complementarias recomendadas son: VSG, PCR, FR y ACPA.
Recomendación fuerte a favor, calidad de la evidencia baja a moderada
Punto de buena práctica: la técnica recomendada para la medición del FR es la nefelometría; para los ACPA, la técnica de ELISA (al menos de segunda generación); para la VSG, el método de Westergren, y para la PCR, los métodos cuantitativos.
Recomendación 4: se recomienda realizar radiografía convencional de manos y pies para todos los pacientes con AR. El uso de otras imágenes diagnósticas como ecografía articular y resonancia magnética no se recomienda de manera rutinaria para el diagnóstico de la AR. Su uso debe determinarse según criterio del reumatólogo.
Recomendación condicional en contra, calidad de la evidencia baja
Puntos de buena práctica:
- •
La ecografía y la resonancia magnética nuclear pueden ser útiles en pacientes con sospecha de AR en quienes el diagnóstico no es claro.
- •
El uso de la ecografía y la resonancia magnética nuclear debe ser exclusivo del médico reumatólogo.
Se identificaron 5 estudios observacionales35–39 que evaluaron el rendimiento de los ACPA y el FR para el diagnóstico de la AR. En general, la evidencia respalda el uso del FR y los ACPA de manera conjunta y asocia la presencia de títulos altos de ACPA con un peor pronóstico. El panel de expertos considera que las pruebas de laboratorio son complementarias al examen físico. En la actualidad se respalda el uso del FR y los ACPA acompañados de estudios de imágenes en los casos en que se considere pertinente. No obstante, estos estudios no son de uso obligatorio y no deben retrasar el diagnóstico ni el inicio del tratamiento40,41. Sin embargo, es importante tener en cuenta que los pacientes que presenten lesiones típicas de AR en las imágenes diagnósticas, como erosiones óseas, compromiso estructural o manifestaciones extraarticulares características, pueden ser diagnosticados directamente como AR42.
En cuanto al uso de imágenes diagnósticas, se identificaron 5 estudios43–47 que evaluaban el rendimiento de la ecografía articular y la resonancia magnética nuclear en el diagnóstico de la AR. Con respecto a la ecografía articular, aunque es útil para la detección de la inflamación subclínica, no se identificaron diferencias en relación con la radiografía convencional para la detección de erosión ósea. Si bien algunos estudios han reportado que el uso de ecografía articular se relaciona con un diagnóstico e inicio de FARME más temprano, los estudios no son concluyentes al respecto y, en general, la calidad de la evidencia es baja. El panel de expertos considera que en nuestro medio el uso de la ecografía está limitado por la baja disponibilidad de personal entrenado para la realización de este examen, además de ser un estudio dependiente del operador.
La evidencia de la utilidad de la resonancia magnética en el diagnóstico de los pacientes con AR proviene de una revisión sistemática46 que concluye que la sinovitis, la osteítis y las erosiones obtenidas con imágenes de resonancia magnética de 1,5 teslas son válidas y útiles para evaluar la inflamación y el daño articular para la AR de la muñeca/mano. Sin embargo, esta evidencia proviene de estudios con alta heterogeneidad. Debido a la calidad de la evidencia y la posible utilidad de esta imagen diagnóstica, los expertos consideran que la resonancia magnética solo debe usarse en casos seleccionados y a criterio del reumatólogo.
Tratamiento farmacológico de primera líneaRecomendación 5: en pacientes con AR se recomienda el uso de glucocorticoides en dosis equivalentes a 5-20mg/día de prednisolona como terapia de inicio en combinación con uno o varios FARME convencionales, seguida de una reducción gradual. Para tiempos de uso mayores de 2 semanas se recomiendan dosis menores o iguales a 10mg/día.
Recomendación fuerte a favor, calidad de la evidencia moderada a alta
Puntos de buena práctica:
- •
Los glucocorticoides deben utilizarse durante el menor tiempo posible y en la menor dosis que sea eficaz, por lo que el médico tratante debe considerar en cada visita del paciente la posibilidad de reducir y suspender estos medicamentos.
- •
En pacientes en quienes se contemple el uso de glucocorticoides durante 3 o más meses, debe indicarse suplemento de calcio más vitamina D y evaluarse el riesgo de fractura.
La evidencia sobre el uso de glucocorticoides en AR proviene de ensayos clínicos de moderada y alta calidad, en los cuales las intervenciones están combinadas con FARME en distintos regímenes48–57. Todos los regímenes que combinaron FARME con glucocorticoides fueron eficaces en pacientes con AR temprana hasta los 2 años. El uso de dosis bajas (<10mg/día de prednisolona o su equivalente) en el tratamiento de inicio de la AR ha demostrado mejorar los signos, los síntomas y la progresión radiológica de la enfermedad, asociándose con menos efectos secundarios que el uso de dosis superiores48. En todos los ensayos clínicos revisados se hace una reducción gradual de la dosis inicial de glucocorticoides con la intención de suspenderlos49. Para más información puede consultarse la guía de práctica clínica de osteoporosis inducida por glucocorticoides de Asoreuma.
Recomendación 6: para el manejo sintomático del dolor asociado a la actividad de la AR, se recomienda el uso de antiinflamatorio no esteroideo (AINE) durante el menor tiempo posible.
Recomendación fuerte a favor, calidad de la evidencia baja
Puntos de buena práctica:
- •
En la decisión de administrar un AINE clásico o un inhibidor de la ciclooxigenasa 2 (COX-2) deben considerarse los factores de riesgo gastrointestinales, renales o cardiovasculares, con especial precaución en pacientes que reciben simultáneamente AINE y glucocorticoides, por el riesgo de sangrado y perforación gastrointestinal.
- •
Evite el uso combinado de AINE.
- •
En pacientes con riesgo gastrointestinal considere la asociación de un inhibidor de la bomba de protones por tiempo limitado.
La evidencia en torno a los analgésicos convencionales en AR es escasa y proviene, en general, de estudios de baja calidad, con pequeño tamaño de muestra y corta duración, con un alto riesgo de sesgo. Los reportes evalúan el diclofenaco y el celecoxib en comparación con otros manejos analgésicos. El perfil reportado de riesgo-beneficio del diclofenaco es comparable al de otros tratamientos analgésicos58. En cuanto al celecoxib, este puede mejorar los síntomas, aliviar el dolor y contribuir a una diferencia mínima o nula en la función física en comparación con el placebo. Los resultados para eventos adversos graves a corto plazo y eventos cardiovasculares son inciertos59. Los panelistas recalcan la necesidad de evaluar los beneficios y considerar los riesgos en cada individuo para tomar decisiones terapéuticas y vigilar a aquellos pacientes manejados con AINE y glucocorticoides o con múltiples medicamentos por el riesgo de sangrado gastrointestinal. Así mismo, se hace énfasis en el uso racional de los inhibidores de bomba de protones pues, aunque estos medicamentos son seguros y ampliamente utilizados, no están exentos de eventos adversos.
Recomendación 7: en pacientes con AR se recomienda iniciar tratamiento con metotrexato. En caso de contraindicación, se recomienda utilizar leflunomida o sulfasalazina, de acuerdo con el criterio médico.
Recomendación fuerte a favor, calidad de la evidencia baja
Puntos de buena práctica:
- •
La dosis de inicio recomendada de metotrexato es de 15mg/semana, vía oral, en una sola toma o fraccionada en dos tomas con un intervalo máximo de 24h; con ajuste del tratamiento según la respuesta hasta una dosis máxima de 25mg/semana. En adultos mayores puede ser necesario disminuir las dosis.
- •
En caso de intolerancia gastrointestinal y en algunos casos de falta de efectividad al metotrexato oral, considere el uso de la presentación parenteral aprobada en Colombia.
- •
Realice la suplementación con ácido fólico o ácido folínico.
A partir de la evidencia de calidad moderada a alta, se reporta beneficio clínico significativo (mejoría en la respuesta ACR50 y funcionalidad) del metotrexato (dosis semanales entre 5 y 25mg) en comparación con placebo en el tratamiento a corto plazo (12 a 52 semanas) de los pacientes con AR, aunque su uso se asoció con una tasa de interrupción del 16% debido a los eventos adversos60. Con respecto al uso de leflunomida, una revisión sistemática que evaluó la eficacia y los efectos secundarios de esta y del metotrexato en pacientes con AR como primer FARME reportó un odds ratio [OR] de 0,88, con un IC 95% de 0,74-1,06 para la probabilidad de alcanzar respuesta ACR 20, con una tendencia a favor del metotrexato, y una mayor reducción del recuento de articulaciones inflamadas para metotrexato (diferencia de medias=0,82; IC 95%: 0,24-1,39). No se observaron diferencias en cuanto al recuento de articulaciones dolorosas, la evaluación global del médico, el HAQ-DI y los niveles séricos de PCR61. El panel considera que la primera opción terapéutica en un paciente con AR temprana es el metotrexato. En caso de estar contraindicado, puede administrarse leflunomida o sulfasalazina.
Con respecto al uso de metotrexato parenteral, la evidencia proviene de un metaanálisis que comparó su eficacia con la del metotrexato oral en pacientes con AR y reportó que la presentación parenteral tenía más probabilidad de alcanzar una reducción en la actividad de la enfermedad que la presentación oral62. Por la conveniencia en la administración del metotrexato oral, los expertos consideran que este fármaco es el medicamento de elección para el inicio del tratamiento en pacientes con AR; en cuanto al metotrexato parenteral, resaltan que es una opción en los casos de intolerancia gastrointestinal al metotrexato oral y no necesariamente como un paso previo al escalamiento de la terapia.
Recomendación 8: no se recomienda el uso de medicamentos como azatioprina, micofenolato de mofetil, ciclosporina y d-penicilamina para el tratamiento de las manifestaciones articulares de la AR.
Recomendación fuerte en contra, calidad de la evidencia baja
Puntos de buena práctica:
- •
Considere el uso de antimaláricos en monoterapia solamente en pacientes con baja actividad inflamatoria que no tengan factores de mal pronóstico.
- •
En pacientes en tratamiento con antimaláricos con remisión de la enfermedad, podría continuarse la monoterapia con estos medicamentos.
Con relación a la azatioprina, el micofenolato de mofetil, la ciclosporina y la d-penicilamina, no se identificó evidencia que demuestre que mejoran la progresión de la enfermedad en cuanto al compromiso articular. Una revisión sistemática, cuyo objetivo era evaluar la eficacia clínica de la hidroxicloroquina en las articulaciones de pacientes con AR, reportó una eficacia inferior a la de metotrexato o la sulfasalazina en monoterapia. La hidroxicloroquina combinada con otros FARME podría aumentar la eficacia clínica63. El panel de expertos considera que, debido a su uso extendido en Colombia, este medicamento puede considerarse en pacientes con baja actividad inflamatoria que no tengan factores de mal pronóstico, tales como: FR positivo con títulos altos, ACPA positivos con títulos altos, moderada o alta actividad al inicio de la enfermedad, falla a 2 FARME convencionales previos o daño estructural temprano. Adicionalmente, aquellos pacientes con AR con baja actividad inflamatoria en tratamiento actual con hidroxicloroquina y control de la enfermedad pueden continuar con el uso de este medicamento.
Recomendación 9: En pacientes con AR y falla al metotrexato en monoterapia se recomienda el uso de terapia combinada con FARME convencionales.
Recomendación fuerte a favor, calidad de la evidencia baja
Punto de buena práctica: en casos seleccionados, cuando el reumatólogo considere un alto riesgo de progresión de la enfermedad, podría considerarse el uso de un medicamento biológico o un FARME sintético dirigido, una vez se documente la falla al metotrexato utilizado en una dosis terapéutica adecuada por lo menos durante 3 meses. El uso de agentes biológicos o de FARME sintéticos dirigidos en este escenario debe ser exclusivo de los médicos reumatólogos.
La evidencia con respecto al uso de combinaciones de FARME proviene de ensayos clínicos64–66, con certeza de la evidencia de baja a moderada, principalmente por imprecisión. Los hallazgos sugieren una mejoría en la actividad de la enfermedad a largo plazo de la terapia combinada; sin embargo, no es concluyente en torno a los desenlaces funcionales y la remisión, comparada con la monoterapia con FARME convencionales. Teniendo en cuenta el contexto socioeconómico y del sistema de salud colombiano, la estrategia de preferencia incluye intervenciones combinadas con FARME convencionales en distintos regímenes y con un inicio precoz dentro de la «ventana de oportunidad»67,68. Solo en casos seleccionados, como en aquellos pacientes con intolerancia a metotrexato y leflunomida, puede considerarse el uso de un biológico o FARME sintético dirigido en este escenario.
Tratamiento del paciente con falla terapéutica a FARME convencionalesRecomendación 10: en pacientes con AR y falla a la terapia combinada con FARME convencionales se recomienda el tratamiento con un biológico o un FARME sintético dirigido, en combinación con metotrexato.
Recomendación fuerte a favor, calidad de la evidencia baja
Puntos de buena práctica:
- •
En pacientes mayores de 50 años (especialmente en mayores de 65 años), el reumatólogo debe tener en cuenta factores de riesgo cardiovascular, eventos tromboembólicos y de malignidad, cuando considere el tratamiento con inhibidores JAK. En caso de que este riesgo se considere elevado, se recomienda evaluar el uso de medicamentos con otros mecanismos de acción.
- •
Previamente al inicio de terapias biológicas, es necesario realizar una adecuada gestión del riesgo que incluye esquema de vacunación y tamizaje de infecciones endémicas.
En cuanto a eficacia y seguridad, los FARME biológicos y los FARME sintéticos dirigidos han demostrado un beneficio clínico en pacientes con AR, tanto en monoterapia como en combinación con metotrexato. Los ensayos clínicos que comparan FARME biológicos con placebo en pacientes previamente tratados con FARME convencionales mostraron una reducción eficaz de los signos y los síntomas, con independencia del mecanismo de acción (anti-FNT o no anti-FNT). En cuanto a los inhibidores JAK, el tofacitinib ha sido estudiado en múltiples ensayos clínicos y ha demostrado su eficacia en monoterapia o en combinación con placebo en pacientes con AR sin respuesta a FARME convencionales; el baricitinib demostró eficacia en comparación con placebo en pacientes con falta de respuesta a FARME convencionales y en AR temprana como monoterapia o en combinación con metotrexato; el upadacitinib demostró ser eficaz frente a placebo en pacientes con AR sin metotrexato previo o con falta de respuesta/ a FARME convencionales; y el filgotinib demostró ser eficaz para reducir los signos y los síntomas de la AR en combinación con metotrexato y como monoterapia69.
En cuanto a la seguridad de los inhibidores JAK, en un estudio poscomercialización —ORAL Surveillance (ORALSURV)— se evaluó la seguridad de tofacitinib en comparación con terapia anti-FNT en pacientes con AR mayores de 50 años (especialmente en mayores de 65 años) con factores de riesgo cardiovascular y se observó una tasa de incidencia de neoplasias malignas de 1,13 (IC 95%: 0,87-1,14) para los pacientes tratados con tofacitinib en 5mg/2 veces al día, y de 1,13 (IC 95%: 0,86-1,14) para los tratados con tofacitinib en 10mg/2 veces al día, en comparación con 0,77 (IC 95%: 0,55-1,04) para los pacientes tratados con inhibidores del FNT (hazard ratio [HR]: 1,48; IC 95%: 1,04-2,09). A partir de estos resultados, la Administración de Medicamentos y Alimentos de los Estados Unidos (FDA) generó una alerta que recomienda a los médicos tratantes evaluar los riesgos y los beneficios del uso de inhibidores JAK en pacientes con AR, especialmente aquellos con antecedente de tabaquismo, cáncer y riesgo cardiovascular70,71.
Los expertos consideran que la elección del tratamiento con un FARME biológico o un FARME sintético dirigido hace parte del criterio del reumatólogo, quien debe hacer un balance riesgo-beneficio especialmente en pacientes con factores de riesgo cardiovascular o antecedentes oncológicos.
Recomendación 11: en pacientes con AR y falla a la terapia combinada con FARME convencionales no es posible recomendar un determinado agente biológico o FARME sintético dirigido sobre otro, con independencia de si se asocia o no a metotrexato.
Recomendación fuerte a favor, calidad de la evidencia alta
Punto de buena práctica: En pacientes mayores de 50 años, el reumatólogo debe tener en cuenta factores de riesgo cardiovascular, eventos tromboembólicos y de malignidad, cuando considere el tratamiento con inhibidores JAK. En caso de que este riesgo se considere elevado, se recomienda evaluar el uso de medicamentos con otros mecanismos de acción.
Con respecto a la superioridad de unos medicamentos biológicos sobre otros, la evidencia de alta calidad, a partir de ensayos clínicos que compararon adalimumab vs. abatacept72–74, rituximab vs. etanercept y adalimumab75, certolizumab pegol vs. adalimumab76, etanercept vs. adalimumab77, sarilumab vs. adalimumab78,79 y tocilizumab vs. adalimumab80, no es concluyente, por lo que no es posible recomendar un determinado agente biológico sobre otro.
La evidencia directa para la comparación entre los inhibidores JAK y los anti-FNT no reveló diferencias clínicamente importantes en cuanto a la eficacia81–83. La evidencia indirecta, a partir de metaanálisis en red, reportó una eficacia similar de los FARME biológicos y los inhibidores JAK. La preferencia de los medicamentos puede estar determinada por el perfil de seguridad y la costoefectividad de estos69.
Recomendación 12: en los pacientes con AR e indicación de tratamiento con un agente biológico o FARME sintético dirigido y que presentan contraindicación o intolerancia al metotrexato, se aconseja la leflunomida en combinación con terapia biológica o un FARME sintético dirigido.
Recomendación fuerte a favor, calidad de la evidencia moderada
La evidencia con respecto al uso de combinaciones de FARME biológicos con FARME convencionales distintos a metotrexato proviene de estudios observacionales84–90 con calidad moderada. Los hallazgos sugieren que no hay diferencias en actividad de la enfermedad, funcionalidad y eventos adversos en combinaciones de leflunomida y anti-FNT en comparación con metotrexato más anti-FNT o monoterapia. La leflunomida ha demostrado eficacia y adecuada tolerancia en ensayos clínicos en pacientes con AR intolerantes al metotrexato.
Tratamiento del paciente con falla terapéutica a FARME biológicos o dirigidosRecomendación 13: en pacientes con AR después de una respuesta inadecuada al primer FARME biológico o FARME sintético dirigido puede usarse un segundo FARME biológico o sintético dirigido de la misma u otra clase terapéutica, en función del tipo de ineficacia y de las características del paciente.
Recomendación fuerte a favor, calidad de la evidencia moderada
Punto de buena práctica: si la falla/ineficacia del FARME biológico o FARME sintético dirigido se consideró primaria, sería recomendable utilizar otro FARME biológico o FARME sintético dirigido con una diana terapéutica diferente.
La evidencia de calidad moderada proviene de 2 revisiones sistemáticas91,92 que evaluaban la eficacia de los diferentes FARME biológicos y FARME sintéticos dirigidos en pacientes que habían presentado respuesta inadecuada al primer anti-FNT. Se encontró una mayor eficacia de todos los biológicos (anti-FNT y no anti-FNT) y FARME sintéticos dirigidos comparados con placebo. Existe una tendencia a observar una mayor eficacia de los no anti-FNT sobre los anti-FNT tras la falla a anti-FNT.
En cuanto a la eficacia del abatacept comparado con un anti-FNT u otros no anti-FNT, se encontraron resultados contradictorios con respecto a la superioridad del abatacept en pacientes que fracasaron con un anti-FNT. No se identificaron estudios que compararan FARME biológicos con FARME sintéticos dirigidos en el contexto de falla terapéutica. Con la evidencia disponible no es posible recomendar un FARME biológico o FARME sintético dirigido sobre otro para el tratamiento de los pacientes con AR con falla a anti-FNT.
Los expertos indican que debe evaluarse la causa de la falla terapéutica para determinar la conducta con respecto a la modificación del tratamiento. En la elección del tratamiento en el contexto de falla terapéutica a un primer FARME biológico o FARME dirigido, debe tenerse en cuenta, además de la eficacia, el perfil de seguridad y la disponibilidad del medicamento.
Así mismo, en el caso de los pacientes con enfermedad activa e intolerancia a FARME convencionales y que requieran tratamiento con FARME biológico o FARME sintético dirigido, hay cierta evidencia que puede favorecer la elección del uso de inhibidores de IL-6 o inhibidores JAK en este contexto, pero de acuerdo con el grupo desarrollador de la GPC no se consideró lo suficientemente concluyente para elaborar una recomendación estándar para todos los pacientes que se encuentren en monoterapia.
Poblaciones especialesRecomendación 14: en pacientes con AR que sufren una infección durante el tratamiento con un agente biológico o FARME sintético dirigido se recomienda suspender el tratamiento temporalmente. Este podría ser reiniciado con precaución una vez la infección esté completamente resuelta.
Recomendación fuerte a favor, calidad de la evidencia moderada
Punto de buena práctica: si el paciente y el reumatólogo consideran que el biológico fue el principal causante de la infección y existen temores sobre su reinicio, podría contemplarse el uso de una molécula o esquema de tratamiento diferentes.
La evidencia sobre el reinicio del tratamiento en pacientes con AR tratados con medicamentos biológicos es escasa y proviene de estudios observacionales14,93–96 con baja calidad de la evidencia. En los estudios seleccionados se reporta que la tasa de infección grave en pacientes tratados con anti-FNT después de un evento de infección grave es de 18% paciente/año comparado con FARME no biológico (21,4% paciente/año)14. En estos estudios de vida real se observó que, tras una infección que requirió hospitalización en pacientes con AR que estaban en tratamiento con anti-FNT, la mayoría de los pacientes continuaba con el mismo anti-FNT y tan solo una minoría cambiaba de medicamento. Los medicamentos con menores tasas de infecciones graves posteriores son abatacept y etanercept95.
El panel de expertos concuerda en que los pacientes con condiciones especiales como infecciones graves deben suspender temporalmente el tratamiento biológico y reiniciarlo una vez se resuelva la infección. También puede contemplarse el cambio de tratamiento si se considera la infección como consecuencia del uso del biológico.
Recomendación 15: en pacientes con AR y antecedente de cáncer en quienes vaya a iniciarse el tratamiento biológico se recomienda consensuar las decisiones de manejo con el paciente, el médico tratante de la enfermedad oncológica y otros especialistas implicados.
Recomendación fuerte a favor, calidad de la evidencia moderada
Punto de buena práctica: en pacientes con AR y cáncer que se encuentran en tratamiento oncológico, este prima sobre el uso del biológico para el tratamiento de la AR. El medicamento biológico podría ser utilizado en pacientes con antecedentes de cáncer si junto con el médico tratante de la enfermedad oncológica se está de acuerdo en que la neoplasia está controlada y no requerirá más intervenciones que influyan sobre la decisión terapéutica.
La evidencia, de calidad moderada, con respecto a la seguridad del tratamiento con medicamentos biológicos en pacientes con AR y cáncer proviene de estudios de cohorte97–103. En general, no se observaron diferencias significativas en la supervivencia global entre los pacientes que recibieron medicamentos biológicos y los que no. Sin embargo, no existe suficiente información en torno a otros desenlaces del cáncer, como la recurrencia y la progresión, y no hay datos que permitan definir la influencia de cada fármaco en particular en la reincidencia o supervivencia del cáncer en poblaciones de pacientes con cáncer avanzado. Esta evidencia no permite recomendar tratamiento biológico específico alguno.
En pacientes en tratamiento oncológico (quimioterapia, radioterapia, entre otros), las decisiones de tratamiento deben tomarse en conjunto con el médico tratante de la enfermedad oncológica de base. Hasta el momento no existe evidencia para recomendar un tratamiento biológico específico en pacientes oncológicos. Anteriormente se tenía precaución de usar anti-FNT en esta población, ya que se consideraba que aumentaba la proliferación de células tumorales; sin embargo, esta información ha sido reevaluada104.
Tratamiento no farmacológicoRecomendación 16: no se recomienda el uso de terapias complementarias tales como acupuntura, taichí, balneoterapia, moxibustión, fitoterapia, yoga, entre otras, para el tratamiento de los pacientes con AR.
Recomendación fuerte en contra, calidad de la evidencia baja a moderada
Punto de buena práctica: en el tratamiento de los pacientes con AR debe considerarse el manejo conjunto con medicina física y rehabilitación, terapia física, terapia ocupacional y salud mental (psicología y psiquiatría) y la realización de seguimiento farmacoterapéutico.
Se realizó una búsqueda de evidencia que incluyó múltiples terapias no farmacológicas y no quirúrgicas, entre ellas actividad física, dieta, acupuntura, taichí, yoga, moxibustión, balneoterapia, entre otras105–110. La única intervención con evidencia de calidad moderada a alta que mostró beneficios en cuanto a dolor y funcionalidad fue la realización de actividad física110. Para las otras terapias no farmacológicas, en general, la evidencia es escasa, de baja calidad y con resultados no concluyentes106–109. El panel de expertos considera que es necesario hacer énfasis en el manejo multidisciplinario de los pacientes con AR, teniendo en cuenta no solo la rehabilitación, sino también el cuidado de la salud mental y la vigilancia de la adherencia e interacciones medicamentosas.
SeguimientoRecomendación 17: se recomienda realizar el seguimiento de los pacientes con índices clinimétricos por lo menos cada 6 meses, o más frecuentemente si la condición clínica del paciente lo amerita.
Recomendación fuerte a favor, calidad de la evidencia moderada
Puntos de buena práctica:
- •
El seguimiento puede hacerse con mayor frecuencia de acuerdo con las características del paciente (funcionalidad y comorbilidades), la actividad de la enfermedad y el tratamiento instaurado.
- •
El seguimiento de la actividad de la enfermedad debe realizarse con escalas de clinimetría aceptadas, como DAS 28, SDAI, CDAI, RAPID3, entre otras.
- •
Para la evaluación de la funcionalidad se sugiere el uso de HAQ (mHAQ o HAQ-DI).
- •
En el contexto de la telemedicina, también debe usarse alguna de las escalas aceptadas para la evaluación de la actividad y funcionalidad.
Recomendación 19: se recomienda realizar periódicamente hemograma, transaminasas, creatinina y reactantes de fase aguda. Otros paraclínicos podrían ser necesarios a criterio del reumatólogo o médico tratante.
Recomendación fuerte a favor, calidad de la evidencia moderada
Punto de buena práctica: el médico tratante debe evaluar las comorbilidades y el riesgo cardiovascular y metabólico del paciente con AR y derivarlo oportunamente para el control de sus comorbilidades.
La evidencia con respecto a los parámetros para el seguimiento de los pacientes con AR es heterogénea y de calidad moderada, con diferencias en métodos de evaluación y comparadores. Los datos publicados indican que todos los índices de actividad que incluyan articulaciones inflamadas están relacionados con la progresión radiográfica, mientras que, de los componentes individuales, solo se asocian las articulaciones inflamadas y los reactantes de fase aguda111. El panel de expertos considera que los índices de actividad compuestos son la herramienta óptima para monitorizar la actividad de la enfermedad en pacientes con AR, y la periodicidad de su realización y el seguimiento del paciente dependerán de las características del paciente, la actividad de la enfermedad, el tratamiento instaurado, entre otros, que además deberán ser definidos por el médico tratante.
En cuanto al uso de imágenes para el seguimiento de los pacientes con AR, la evidencia es escasa y de calidad moderada112,113. Los estudios de ecografía y resonancia pueden ser un complemento útil para evaluar la respuesta del paciente en tratamiento; sin embargo, los hallazgos requieren mayor validación. El panel de expertos considera que la realización rutinaria de imágenes para el seguimiento de los pacientes con AR solamente es necesaria en aquellos casos seleccionados por el reumatólogo.
Aplicabilidad, difusión e implementaciónEsta guía, realizada por la Asociación Colombiana de Reumatología, pretende orientar la toma de decisiones de los profesionales de la salud encargados del cuidado de los pacientes con AR en Colombia. Las recomendaciones se construyeron teniendo en cuenta el contexto socioeconómico del país y la estructura del sistema de salud, a partir de la evidencia más reciente respecto al diagnóstico, el tratamiento y el seguimiento de la AR, con la experticia de un grupo de reumatólogos de diferentes regiones del país y las perspectivas de los representantes de los pacientes.
Tras el análisis de los factores determinantes para la implementación de esta guía, se identificaron como factores facilitadores la cobertura del sistema de salud colombiano, cercana al 100%, y la inclusión de la mayoría de los medicamentos y paraclínicos recomendados en esta guía en el plan de beneficios en salud. Como barreras que deben superarse se identificaron la resistencia al cambio por parte de los profesionales sanitarios, la falta de entrenamiento del personal de salud para la atención de estos pacientes, la falta de disponibilidad de pruebas de laboratorio y de imágenes en ciertas regiones del país, la falta de personal entrenado en la realización de ecografía articular, las dificultades para el acceso a la valoración especializada (medicina interna y reumatología) y la falta de programas educativos y de atención integral a los pacientes con AR.
Así, para llevar esta guía a la práctica, debe socializarse al personal de salud en todos los niveles de atención y junto con los entes gubernamentales correspondientes y las entidades administradoras de los planes de beneficios (EAPB), y garantizarse el acceso a la valoración especializada por reumatología en todas las regiones del país, lo que puede desarrollarse con programas estructurados de telemedicina. Otras acciones necesarias para la implementación de las directrices incluyen asegurar el acceso a laboratorios, imágenes y medicamentos en todo el territorio nacional y promover la creación de programas educativos y de atención integral a los pacientes con AR.
Con respecto al impacto potencial de esta guía sobre el uso de recursos, aunque no se realizaron estudios económicos para determinar la costoefectividad de cada una de las intervenciones en nuestro contexto, en general, se considera que no dan lugar a un uso de recursos adicionales, pues, como se comentó anteriormente, la gran mayoría de las tecnologías (paraclínicos y medicamentos) recomendadas en esta guía están incluidas en el plan de beneficios en salud y el uso juicioso y escalonado de las terapias aquí sugeridas lleva a un uso racional de los medicamentos de mayor costo.
La diseminación de esta guía se hará a través de la publicación en la Revista Colombiana de Reumatología, órgano oficial de Asoreuma, mediante acceso libre, y la socialización en los eventos académicos respaldados por la asociación.
Para apoyar el proceso de implementación, evaluar la adherencia a las recomendaciones y valorar el impacto de la GPC, se adoptan los indicadores para auditoría y evaluación del Ministerio de Salud y Protección Social específicos para AR, que pueden ser consultados en el material suplementario 7. El tablero de indicadores abarca aspectos de estructura (características del sistema de salud), proceso (medición de adherencia) y resultado (consecuencias o desenlaces en salud), aplicables a la implementación de la GPC.
FinanciaciónEsta GPC fue desarrollada en su totalidad por la Asociación Colombiana de Reumatología (Asoreuma), que recibió apoyo financiero por parte de AbbVie. Sin embargo, Asoreuma desarrolló esta GPC de manera independiente, y los financiadores no participaron de forma alguna en el desarrollo, el contenido de la guía o las recomendaciones finales.
Expertos temáticos: Paola Coral Alvarado, Wilson Bautista, Jairo Hernán Cajamarca, Luis Javier Cajas, Sebastián Herrera Uribe, María Constanza Latorre, Yimy Medina, Javier Ramírez Figueroa, Diana Nathalie Rincón, Wilmer Gerardo Rojas, Diego Saaibi, Lina María Saldarriaga, Adriana Vanegas, Kelly Vega y Juan Manuel Bello.
Representantes de los pacientes: María Mercedes Rueda, Luz María Sierra y la Fundación Colombiana de Apoyo al Reumático (Fundare).
Equipo metodológico: Linda Ibatá, Susan Martínez y EpiThink Health Consulting.