Se presenta el caso clínico de una mujer de 35 años con infección por VIH, desde hace 6 años, en manejo antirretroviral, sin antecedentes de enfermedad reumática previa, quien presenta cuadro de poliartralgias de predominio en manos, asociado a sinovitis, con elevación de reactantes de fase aguda, factor reumatoide y anti CCP positivos, configurándose diagnóstico de artritis reumatoide. Esta enfermedad tiene una baja incidencia en el contexto de infección por retrovirus y se considera asociada al síndrome de reconstitución inmune posterior a terapia antirretroviral. Se inicia manejo con fármacos modificadores con lo cual se obtiene control de la enfermedad autoinmune.
The case is presented of a 35 year-old woman with an HIV infection for 6 years and on antiretroviral treatment, She had no previous history of rheumatic disease. She presented with polyarthralgias, predominantly in hands associated with synovitis, elevated acute phase reactants, with both rheumatoid factor and anti-CCP positive. Thus she was diagnosed with rheumatoid arthritis. This disease has a low incidence in the context of retrovirus infection and is considered secondary to Immune Reconstitution Syndrome after antiretroviral therapy. Management starts with modifying drugs, thereby gaining control of the autoimmune disease.
La artritis reumatoide (AR) es una enfermedad relativamente común y ampliamente estudiada en la actualidad. Por varios años se consideró mutuamente excluyente con el VIH dada la inmunosupresión generada por esta infección retroviral; sin embargo, se han reportado casos de aparición de novo de AR posterior al inicio de terapia antirretroviral, fenómeno que se considera secundario al proceso de reconstitución del sistema inmune y aumento de la hipersensibilidad retardada hacia patógenos específicos que pueden desencadenar el componente autoinmune1–3.
Presentación del casoMujer de 35 años de edad, previamente asintomática, uien en marzo del 2006 se sometió a exámenes de rutina por embarazo, encontrando test de VIH positivo, con carga viral inicial de 39.100 copias/ml y recuento de linfocitos CD4 de 150 cel/mm3. Inicialmente, recibió manejo extrainstitucional antirretroviral con zidovudina-lamivudina y nelfinavir, desde mayo del 2006 hasta enero del 2007. Posteriormente, continuó manejo con zidovudina-lamivudina, atazanavir-ritonavir, desde enero hasta mayo del 2007, cuando se informó falla virológica por lo que se le rotó esquema antirretroviral a zidovudina-lamivudina, abacavir, atazanavir, ritonavir.
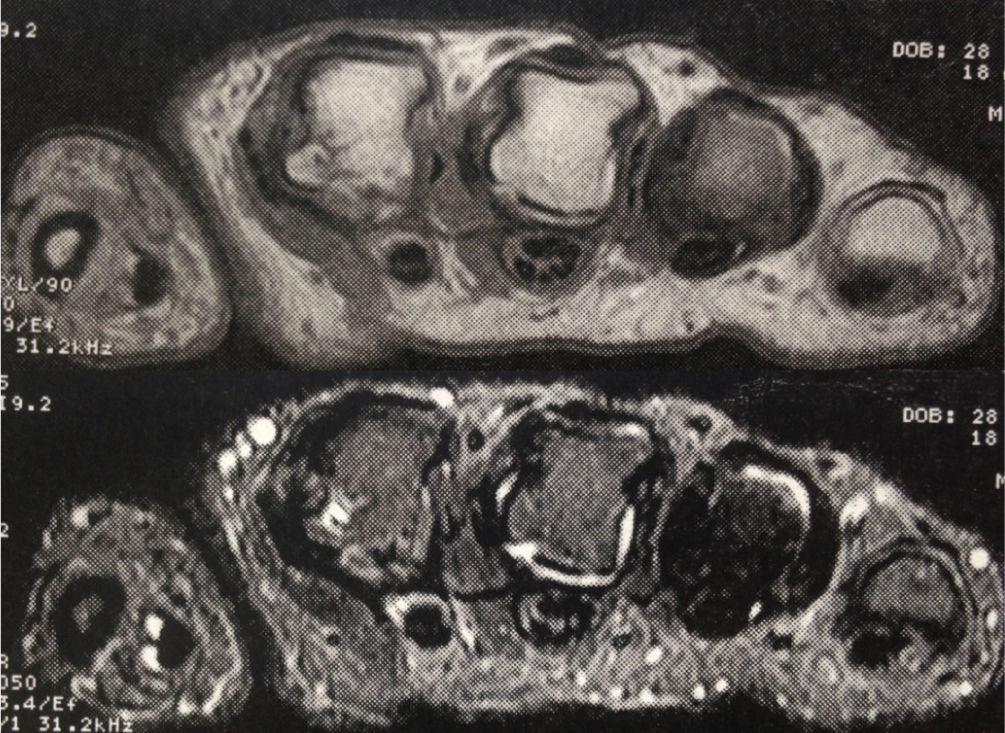
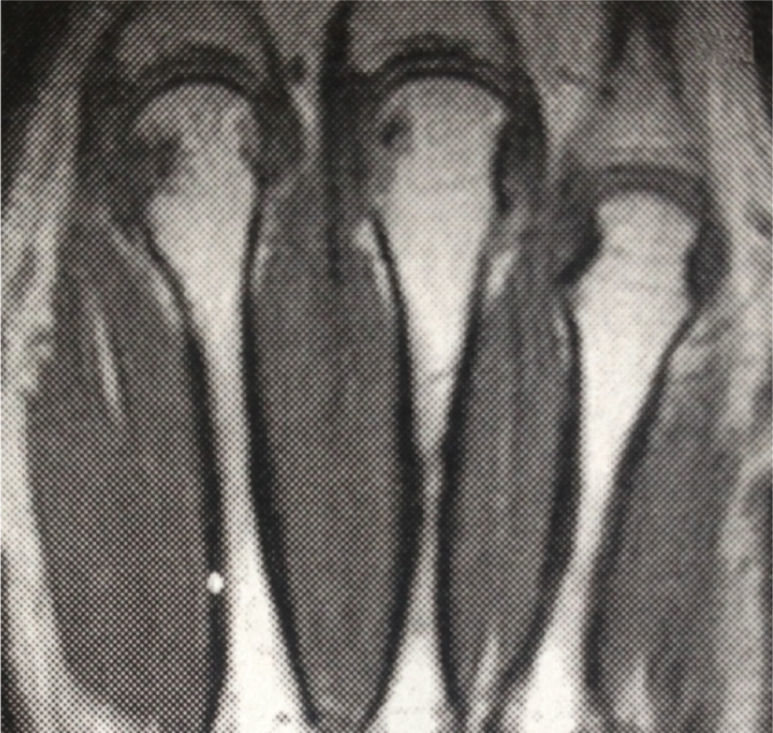
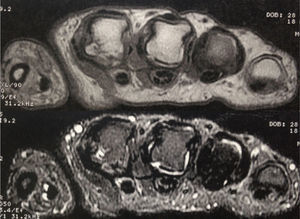
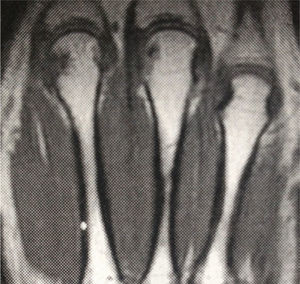
Ingresó a nuestra institución en octubre del 2007. En esta consulta no contaba con control de carga viral con el último esquema de tratamiento instaurado; sin embargo, considerando la resistencia a zidovudina/lamivudina, se decidió reiniciar manejo con abacavir 600mg vo día, didanosina 400mg vo día, atazanavir 300mg y ritonavir 100mg. Continuó estable clínicamente hasta el 2009 y para el mes de marzo, de ese mismo año, la paciente suspendió manejo antirretroviral por problemas administrativos en su aseguradora y reinició tratamiento 3 meses después. Nuevamente suspendió manejo en diciembre de 2009 y lo reinició a mediados de 2010, con evolución virológica anotada en la tabla 1. Hacia enero del 2012, la paciente refirió cuadro clínico de 3 meses de evolución de poliartralgias de predominio en manos, a nivel de articulaciones interfalángicas proximales (IFP) y distales, muñecas, rodillas y metatarsos. El dolor mejoraba con la actividad física, empeoraba con el reposo y se asociaba a rigidez matutina de una hora de duración. Al examen físico, se evidenciaba sinovitis y dolor a nivel de interfalángicas proximales 2 a 4 bilateral, metacarpofalángicas 2 y 3 bilateral. Se realizaron laboratorios, encontrando factor reumatoide de 78.5U/ml (0–14U/ml), anticuerpos antipéptido cíclico citrulinado (anti CCP) 189U/ml (0–20U/ml), VSG 58mm. La radiografía de manos comparativas mostró un aumento de tejidos blandos y osteopenia yuxta-articular. El hemograma se encontraba dentro de límites normales. Se envió para toma de resonancia nuclear magnética (RNM) de manos; la mano derecha, mostró leve aumento del líquido articular radiocarpiano y leve intercarpiano, con discreta irregularidad palmar radiocubital por sinovitis. La mano izquierda mostró erosión y quistes subcondrales contiguos escafosemilunares y en la cabeza del primero, segundo y tercer metacarpiano, sinovitis del piramidal, pisciforme y lateral radiocarpiana (figs. 1 y 2).
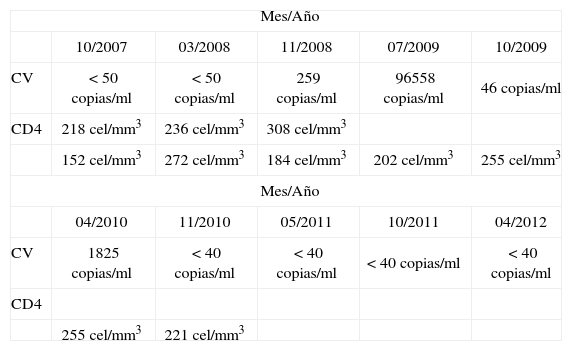
Evolución virológica e inmunológica en el tiempo
| Mes/Año | |||||
| 10/2007 | 03/2008 | 11/2008 | 07/2009 | 10/2009 | |
| CV | <50 copias/ml | <50 copias/ml | 259 copias/ml | 96558 copias/ml | 46 copias/ml |
| CD4 | 218 cel/mm3 | 236 cel/mm3 | 308 cel/mm3 | ||
| 152 cel/mm3 | 272 cel/mm3 | 184 cel/mm3 | 202 cel/mm3 | 255 cel/mm3 | |
| Mes/Año | |||||
| 04/2010 | 11/2010 | 05/2011 | 10/2011 | 04/2012 | |
| CV | 1825 copias/ml | <40 copias/ml | <40 copias/ml | <40 copias/ml | <40 copias/ml |
| CD4 | |||||
| 255 cel/mm3 | 221 cel/mm3 | ||||
CV: Carga viral.
Se consideró paciente con infección retroviral y artritis reumatoide, con factores de mal pronóstico dados por enfermedad erosiva, factor reumatoide y anti CCP positivos en títulos altos. Se inició metotrexate a 15mg/semana, ácido fólico 1mg/día, hidroxicloroquina 200mg/día, con lo cual mejoró el dolor articular, la sinovitis y la rigidez matinal. En la actualidad está en seguimiento periódico de su enfermedad, la cual se encuentra en remisión clínica.
DiscusiónLa pandemia de VIH/SIDA que inicio en los años 80 ha dejado, a la fecha, alrededor de 34 millones de personas en el mundo afectadas, según datos de la ONU para el año 2010. Durante estas dos décadas se han descrito varias manifestaciones clínicas asociadas a la enfermedad, entre ellas las reumáticas, de las cuales, las más frecuentes son las artralgias y la poliartritis que se presentan entre 25–70% en el curso de la primoinfección1,4. Característicamente estas artralgias se presentan en etapas tempranas, de forma aguda, asimétricas, no deformantes, no erosivas, de curso corto no recurrentes y de etiología probablemente reactiva4.
Estas manifestaciones reumatológicas empezaron a formar parte de síndromes clínicos que se vienen estudiando posterior a un cambio dramático en la evolución de la enfermedad, que se llevó a cabo después de 1995 con la expansión de la terapia antirretroviral. Las complicaciones autoinmunes reportadas más frecuentemente son sarcoidosis (45%), seguida por enfermedad tiroidea autoinmune (22,5%), y luego artritis inflamatorias entre las cuales se encuentra la artritis reumatoide (AR) (6,5%) y las enfermedades del tejido conectivo1.
Desde el punto de vista fisiopatológico el VIH y la AR se han considerado mutuamente excluyentes y se ha observado remisión de la AR a medida que la infección por VIH progresa, lo cual se considera secundario a que las células T reguladoras, que tienen como principal función la de mantener la autotolerancia periférica y evitar el desarrollo de autoinmunidad, son especialmente depletadas en la infección activa por VIH2. Por otro lado, se ha visto una reagudización o aparición de novo de la AR al reconstituir el sistema inmune con la terapia antirretroviral de gran actividad (HAART)2,5. Aunque la introducción de la terapia antirretroviral en los pacientes VIH(+) ha producido una considerable disminución en la incidencia de las enfermedades oportunistas6,7; se ha reportado que, al cabo de un tiempo de iniciada la terapia antirretroviral, algunos pacientes pueden debutar con reacciones inflamatorias de etiología no infecciosa y que se presentan secundarias a síndrome de reconstitución inmune (SRI). Este síndrome se define como el deterioro paroxístico del estado clínico, atribuible a la recuperación del sistema inmune durante el tratamiento antirretroviral3,8.
Las patologías autoinmunes que se presentan dentro de un SRI en 80% son de novo, es decir, el paciente hace por primera vez un episodio autoinmune sin haber tenido el antecedente en la etapa pre-VIH y solamente el 20% equivale a reactivaciones de patologías preexistentes5.
Aunque el SRI se entiende mejor cuando se produce en respuesta a un patógeno microbiano, no debería sorprender que un síndrome similar se manifieste de novo o como una exacerbación de un síndrome autoinmune latente u oculto anteriormente. Según varios reportes estas enfermedades suelen manifestarse entre los 3 y 27 meses de iniciada la terapia antirretroviral6. La probabilidad de ocurrir y la severidad del SRI se correlacionan con dos factores a su vez interrelacionados: 1) la severidad de la disminución del nivel de CD4 antes de la iniciación de la terapia HAART, y 2) el grado de supresión viral y la recuperación inmune que sigue a la iniciación de la terapia HAART.
La terapia HAART puede producir una reducción del 90% en la carga viral en el término de 2 a 3 semanas desde el comienzo del tratamiento. Esta declinación en la carga viral persiste usualmente en su curva descendente durante las siguientes 8 a 12 semanas y posteriormente se estabiliza. Un aumento en las células efectoras inmunes ocurre en proporción inversa a la caída de la carga viral del VIH en la mayoría de los pacientes tratados. La típica recuperación del nivel de linfocitos T CD4+ siguiendo a la terapia HAART es bifásica. En la primera fase se observa un rápido aumento en las células CD4 de memoria, la cual ocurre durante los primeros 3 a 6 meses de la terapia. La segunda fase, constituye la principal fase de producción de células T CD4 virgen y se acompaña de cambios en la producción de citoquinas.
En este orden de ideas, el SRI ha sido ligado a un incremento en los linfocitos T CD4, CD8 y a los niveles de citoquinas (IL6, INF), así como al imbalance en TH1 y TH2 con respuestas linfocitarias proliferativas in vitro, aumento de marcadores de activación inmune y aumento de la hipersensibilidad retardada hacia patógenos específicos que pueden desencadenar el componente autoinmune9. No existen suficientes casos publicados como para poder concluir cuál es el comportamiento de la AR en los pacientes que están manifestando esta patología dentro de un SRI.
Así mismo, los datos sobre los métodos diagnósticos de la enfermedad en pacientes afectados por VIH son controversiales. Hasta el momento los anti CCP se consideran un test altamente específico y sensible, es usado no solo para diagnóstico sino como predictor de enfermedad erosiva y es considerado más específico que el factor reumatoide, el cual puede presentar títulos positivos hasta en 1–5% de la población general, aumentando esta cifra en pacientes con VIH10. Sin embargo, los anticuerpos anticitrulínicos han sido descritos además en enfermedades infecciosas tales como tuberculosis, leischmaniasis, enfermedad de Hansen, hepatitis B y C, enfermedad de Chagas, mononucleosis infecciosa, entre otras, por lo cual Lima et al., realizan una revisión sistemática en la cual sugieren interpretar con cautela el resultado de los anti CCP, dado que se han encontrado presentes en pacientes con enfermedades infecciosas concomitantes, como es el caso de los pacientes con VIH11.
Con respecto al tratamiento de las enfermedades reumáticas, es similar en pacientes VIH positivos y en pacientes negativos para la infección antirretroviral, empleándose antirreumáticos como metotrexate, sulfasalazina, leflunomida y antimaláricos. La experiencia con agentes biológicos, especialmente anti TNF, es muy reducida dada la baja incidencia de AR en VIH12. El presente caso nos recuerda la importancia de estar alertas a los síntomas osteoarticulares en el contexto de pacientes infectados con el VIH, pues el espectro clínico es amplio y se ve influenciado por el SRI.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.