estudios recientes han reportado fenómenos trombóticos o coagulopatía en pacientes con COVID-19. Hay posiciones divergentes en cuanto a la prevención, el diagnóstico y el tratamiento de estos fenómenos, y la práctica clínica actual está basada únicamente en deducciones por extensión a partir de estudios retrospectivos, series de casos, estudios observacionales y guías internacionales desarrolladas previas a la pandemia.
Objetivoestablecer una serie de recomendaciones sobre prevención, diagnóstico y manejo de las complicaciones trombóticas asociadas a COVID-19.
Métodosse desarrolló una guía rápida en la que se aplicó el marco de la evidencia a la decisión (EtD) de GRADE y un sistema de participación iterativo, con análisis estadísticos y cualitativos de sus resultados.
Resultadosse generaron 31 recomendaciones clínicas enfocadas a: a) Pruebas de coagulación en adultos sintomáticos con sospecha de infección o infección confirmada por SARS-CoV-2; b) Tromboprofilaxis en personas adultas con diagnóstico de COVID-19 (escalas de riesgo, tromboprofilaxis de manejo ambulatorio, intrahospitalario y duración de tromboprofilaxis después del egreso de hospitalización), c) Diagnóstico y tratamiento de las complicaciones trombóticas y d) Manejo de personas con indicación previa a usar agentes anticoagulantes.
Conclusioneslas recomendaciones clínicas de este consenso orientan la toma de decisiones clínicas respecto a prevención, diagnóstico y tratamiento de fenómenos trombóticos en pacientes con COVID-19, y representan un acuerdo que ayudará a disminuir la dispersión en las prácticas clínicas acorde con el desafío que impone la pandemia.
recent studies have reported the occurrence of thrombotic phenomena or coagulopathy in patients with COVID-19. There are divergent positions regarding the prevention, diagnosis, and treatment of these phenomena, and current clinical practice is based solely on deductions by extension from retrospective studies, case series, observational studies, and international guidelines developed prior to the pandemic.
Objectiveto generate a group of recommendations on the prevention, diagnosis and management of thrombotic complications associated with COVID-19.
Methodsa rapid guidance was carried out applying the GRADE Evidence to Decision (EtD) frameworks and an iterative participation system, with statistical and qualitative analysis.
Results31 clinical recommendations were generated focused on: a) Coagulation tests in symptomatic adults with suspected infection or confirmed SARS CoV-2 infection; b) Thromboprophylaxis in adults diagnosed with COVID-19 (Risk scales, thromboprophylaxis for outpatient, in-hospital management, and duration of thromboprophylaxis after discharge from hospitalization), c) Diagnosis and treatment of thrombotic complications, and d) Management of people with previous indication of anticoagulant agents.
Conclusionsrecommendations of this consensus guide clinical decision-making regarding the prevention, diagnosis, and treatment of thrombotic phenomena in patients with COVID-19, and represent an agreement that will help decrease the dispersion in clinical practices according to the challenge imposed by the pandemic.
Alrededor del 15% de los pacientes con enfermedad por coronavirus 2019 (COVID-19) cursan con importante compromiso respiratorio dentro de las siguientes 24 a 48 horas del ingreso a hospitalización, y cerca del 6% presentan insuficiencia respiratoria, choque séptico o disfunción orgánica múltiple. Entre los factores de riesgo clínicos para mal pronóstico se encuentran edad mayor a 60 años, tabaquismo, enfermedad cardiovascular, diabetes mellitus, enfermedad pulmonar obstructiva crónica, hipertensión arterial, cáncer y obesidad1,2. Además, se han identificado como marcadores de mal pronóstico el dímero D > 1.000 ng/ml, la ferritina > 1.000 ng/ml, linfopenia < 1.000μL, proteína C reactiva > 10mg/dl, deshidrogenasa láctica > 350UI/L y puntaje de evaluación de insuficiencia secuencial de órganos (SOFA) > 2. Para pacientes con enfermedad no complicada y neumonía leve, y en ausencia de factores de riesgo para mal pronóstico o marcadores de mal pronóstico, generalmente se recomienda el manejo ambulatorio1.
Varios estudios han reportado fenómenos trombóticos o coagulopatía en pacientes con COVID-19, lo cual está relacionado con un mal pronóstico3–9. Se han identificado cuatro factores que aceleran la formación de trombos en estos casos: la tormenta de citoquinas, la supresión del sistema fibrinolítico, la activación plaquetaria y el daño endotelial10.
En pacientes críticamente enfermos con COVID-19, parece haber al menos dos procesos patológicos de la coagulación que tienen importancia en las manifestaciones clínicas: a) En la microcirculación pulmonar, y posiblemente en otros órganos, se presenta lesión vascular endotelial directa, con formación de trombos microvasculares y angiopatía; b) En la circulación sistémica, en relación con hipercoagulabilidad e hiperfibrinogenemia, existe el potencial de trombosis de vasos grandes, incluyendo la embolia pulmonar10.
La falta de ensayos clínicos adecuados, justificada por una pandemia muy reciente y las dificultades de aleatorización (entre otras causas), justifica que haya posiciones académicas diversas en cuanto a la prevención, diagnóstico y tratamiento de los fenómenos trombóticos en pacientes con COVID-19, y la práctica clínica actual está orientada por recomendaciones que se fundamentan en estudios retrospectivos, series de casos, estudios observacionales3–9, guías desarrolladas previas a la pandemia11–13 y guías más recientes basadas en recomendaciones de expertos14–18.
Ante la situación actual de pandemia y la ausencia de evidencia concluyente, el marco GRADE (Grading of Recommendations Assessment, Development and Evaluation) de la evidencia a la decisión EtD (evidence to decision), se posiciona como un enfoque metodológico que ayuda a los paneles de expertos a usar la evidencia de una manera estructurada y transparente para informar la toma de decisiones, sin limitarse a evidencia proveniente de estudios científicos rigurosos, sino, también, incorporando información de experiencias del ámbito clínico local, supuestos y consideraciones lógicas que aportan en la elaboración de las recomendaciones. El marco EtD informa a los usuarios sobre los juicios que se han hecho y la evidencia que los apoya, y dota de transparencia la base para las decisiones de los que tienen que tomarlas. El marco EtD deja claros los criterios que se usan para valorar las intervenciones y las opciones, los juicios del panel, la evidencia de los estudios y las consideraciones adicionales utilizadas para informar cada juicio19–21.
En este contexto, el objetivo del presente trabajo fue elaborar una guía rápida sobre prevención, diagnóstico y manejo de las complicaciones trombóticas asociadas a COVID-19, fundamentada en una revisión sistemática rápida de literatura, el uso del marco EtD, y un consenso Delphi para la generación de las recomendaciones.
MetodologíaGrupo desarrolladorEl grupo desarrollador (GD) contó con representación de expertos clínicos en cardiología, hematología, neumología, nefrología, medicina interna, cuidado intensivo y urgencias, así como con el apoyo de metodólogos clínicos. El grupo desarrolló cinco preguntas con la estructura PICO (población, intervención, comparación, desenlace), efectuó búsqueda y evaluación de la calidad del conjunto de la evidencia, formuló las recomendaciones y redactó una primera versión del documento final. Así mismo, orientó el desarrollo de los momentos de participación como socializaciones y consensos.
Panel de expertosSe seleccionó y se generó invitación a un panel de 120 expertos, de los cuales 95 participaron en representación de instituciones de salud, universidades y sociedades científicas de 14 subespecialidades clínicas y profesiones afines (cardiología, neumología, hematología, oncología, cuidado intensivo, nefrología, medicina interna, urgencias, infectología, anestesiología, neurología, medicina familiar, ginecoobstetricia y bacteriología). Todos los miembros del consenso declararon sus conflictos de intereses, antes de la primera ronda de votación, en un formato estándar dispuesto por el GD.
Búsqueda y síntesis de evidenciaSe realizó una revisión sistemática rápida de literatura22, con una búsqueda amplia en las bases de datos médicas Medline, Epistemonikos y Cochrane CENTRAL; se consultaron fuentes de literatura gris, como las páginas web de sociedades científicas nacionales e internacionales y se identificaron otros estudios por bola de nieve. Los términos de búsqueda utilizados fueron: COVID-19, coronavirus, anticoagulant, antithrombotic, thromboprophylaxis. Un revisor realizó la búsqueda, selección y extracción de la información. Se encontraron inicialmente 66 documentos en Medline, de los cuales se seleccionaron 8 para revisión en texto completo y una serie de artículos complementarios se fueron integrando a medida que se realizaban las consultas en las demás fuentes de información. La evidencia disponible a mayo de 2020 se derivó, principalmente, de publicaciones con baja calidad de evidencia o evidencia indirecta.
Considerando las características de la información encontrada, no fue posible construir perfiles de evidencia, por lo que, a través de síntesis narrativa, se realizó la construcción de 33 recomendaciones preliminares.
Construcción de las recomendaciones preliminaresEl marco GRADE EtD para guías de práctica clínica19–21,23,24 se usó para ayudar al panel de expertos a traducir la evidencia en recomendaciones. El proceso inició con la selección de los criterios del marco EtD, que determinarían la discusión sobre la dirección y la fuerza de las recomendaciones. El GD tuvo en cuenta la evidencia para generar recomendaciones preliminares, en un ejercicio orientado por los siguientes criterios del marco EtD:
- 1.
¿Superan los efectos deseables de la recomendación a los efectos indeseables? (balance de beneficios y riesgos)
- 2.
¿Podrían los recursos requeridos para implementar la recomendación, ser menores a los recursos utilizados para la atención de los efectos en salud por su no implementación en la prestación de servicios de salud? (uso de recursos)
- 3.
¿Puede aplicarse la inclusión de la recomendación en todas las poblaciones de riesgo con pocas restricciones en el sistema de salud? (factibilidad)
- 4.
¿Es aceptable la recomendación para incluirla en la práctica clínica por todas las partes interesadas (pacientes, profesionales de salud y tomadores de decisiones)? (aceptabilidad)
Las recomendaciones preliminares fueron redactadas en términos de la dirección de la intervención (a favor o en contra) y acompañadas de la calidad global del conjunto de la evidencia (alta, moderada, baja o muy baja). En este paso no se consideró la fuerza de la recomendación (fuerte o débil).
El GD revisó, ajustó y validó la estructura de las recomendaciones preliminares, en términos de los siguientes elementos: ¿qué?, ¿a quién? y ¿cuándo?, y luego se convocó el consenso de expertos.
Conducción del consensoEn un primer momento, se envió al panel de expertos, vía correo electrónico, el resumen de la evidencia, junto con el cuerpo de las recomendaciones. Se utilizó un método de consenso Delphi25 para la participación iterativa, basado en encuesta electrónica con opciones de respuesta tipo Likert de acuerdo (4 opciones) y preguntas abiertas para los juicios de los expertos.
Seguido a esto, el GD analizó los resultados de la primera ronda, a partir de lo cual se hizo necesario efectuar una segunda ronda para dos recomendaciones que no alcanzaron el umbral de decisión por consenso. Para la segunda ronda se tuvo la participación de 84 expertos (88.4%).
Cada recomendación tuvo una valoración global de los 4 criterios EtD en la primera ronda y una valoración global e individual en la segunda. Los juicios fueron realizados de manera independiente por cada panelista. Todos los juicios generados fueron registrados en una matriz, con lo cual se tuvo un resumen cualitativo y cuantitativo.
Para el análisis cualitativo se empleó la técnica de metasíntesis cualitativa26 para las preguntas abiertas con el uso de categorías preestablecidas y emergentes; esto permitió afinar las características de la población y las intervenciones, mejorar la redacción de las recomendaciones y generar puntos de buena práctica.
El análisis cuantitativo se utilizó para establecer el consenso o disenso, y la dirección y fuerza de las recomendaciones. Se estableció como consenso el acuerdo igual o mayor al 80% de los expertos. Se determinaron las recomendaciones como fuertes si el acuerdo era mayor al 95%, de lo contrario se consideraron como recomendaciones débiles.
En la primera ronda el 93,3% (31) de las recomendaciones fueron aprobadas. La metasíntesis se realizó por cada ronda, analizando en la primera 996 juicios de los expertos sintetizados en 8 categorías y 16 variables centrales; en la segunda ronda se analizaron 78 juicios sintetizados en 6 categorías y 6 variables centrales. En una recomendación se declaró disenso y otra, pese a ser aprobada, fue eliminada por sugerencia del panel de expertos.
El resultado final fue de 27 recomendaciones a favor y 4 en contra. De estas, 26 tuvieron fuerza de recomendación débil y 5 fuerte.
ResultadosA. Pruebas de coagulación en adultos sintomáticos con sospecha de infección o infección confirmada por SARS-CoV-2
- 1.
Pregunta 1: ¿Cuál es la utilidad diagnóstica del dímero D en pacientes que se hospitalizan con sospecha de infección por SARS-CoV-2?
- •
La evidencia se deriva de las recomendaciones de sociedades científicas y estudios de serie de casos y cohortes.
El patrón más común de coagulopatía asociada a COVID-19 es procoagulante, con elevación del fibrinógeno, el factor VIII y el dímero D27. Cerca de la mitad de los pacientes hospitalizados presentan dímero D mayor del límite superior normal (500 ng/ml)28, y los niveles marcadamente elevados (4 o más veces el límite superior normal) se han asociado con el desarrollo de SDRA, el requerimiento de cuidados intensivos o la muerte. El incremento en el dímero D y la caída del fibrinógeno pueden observarse entre 7 y 10 días después del inicio de los síntomas5,29.
Es importante precisar que la elevación del dímero D no implica necesariamente la presencia de trombosis y puede relacionarse con fibrinólisis regional en relación con la lesión pulmonar y también con la liberación exagerada de citoquinas en otra etapa inflamatoria de la infección3,5.
Se ha considerado que la coagulación intravascular diseminada (CID) puede ser un fenómeno fisiopatológico que participa en la insuficiencia circulatoria y orgánica, en particular en la lesión pulmonar. Desde antes de la actual pandemia de COVID-19, con el fin de facilitar el diagnóstico oportuno de CID en el contexto de sepsis, la Sociedad Internacional de Trombosis y Hemostasia (ISTH)30, sugirió utilizar un abordaje de dos niveles, evaluando primero el puntaje de coagulopatía inducida por sepsis (SIC, su sigla en inglés) y, si el puntaje es alto, evaluar la presencia de CID franco. Los criterios diagnósticos para SIC usan tres variables: recuento de plaquetas, tiempo de protrombina (TP) y puntaje SOFA. El diagnóstico de CID puede apoyarse en el puntaje ISTH, el cual requiere recuento de plaquetas, TP, dímero D y fibrinógeno30,31. El aspecto principal del manejo de la CID es la corrección de la condición subyacente; en el caso de COVID-19, esto puede relacionarse con el manejo de la hipoxia o la sobreinfección bacteriana32. Aunque la coagulopatía asociada a COVID-19 no es una coagulopatía de consumo típica de CID, y tiene algunas diferencias fisiopatológicas con la CID que se asocia a sepsis bacteriana, una pequeña proporción de pacientes con COVID-19 grave desarrolla coagulopatía que reúne los criterios diagnósticos ISTH para diagnóstico de CID10,33. La ISTH recomienda utilizar dosis profilácticas de heparina de bajo peso molecular en pacientes con coagulopatía asociada a sepsis, para prevenir el progreso a CID, a menos que tengan sangrado activo, y considerar ajuste a la dosis de anticoagulante en pacientes con SIC/CID30,33. El uso de agentes antiplaquetarios de acción prolongada debe suspenderse en pacientes con CID, a menos que tengan una indicación específica. Ante manifestaciones hemorrágicas se usa reposición de componentes sanguíneos. En el momento se desconoce el enfoque óptimo para pacientes con coagulopatía asociada a COVID-19.
Recomendaciones- 1.
En pacientes con sospecha de SARS-CoV-2/COVID-19 y con factores de riesgo para mal pronóstico de la enfermedad, se sugiere solicitar dímero D en su primera evaluación o al ingreso por urgencias. Recomendación débil a favor (7% de panelistas estuvieron en desacuerdo).
1.1 Punto de buena práctica clínica: se incluyen como factores de riesgo para mal pronóstico de la enfermedad, edad mayor a 60 años, tabaquismo, enfermedad cardiovascular, diabetes mellitus, enfermedad pulmonar obstructiva crónica, hipertensión arterial y cáncer1.
- 2.
En pacientes con COVID-19 e indicación de hospitalización o dímero D mayor de 1.000 ng/ml, se sugiere hacer seguimiento a esta prueba, así como al tiempo de protrombina (TP), hemograma y fibrinógeno, cada 24 a 48 horas, dependiendo de la evolución clínica, ya que tiene implicaciones potenciales para el pronóstico y el tratamiento. Recomendación débil a favor (5% de panelistas estuvieron en desacuerdo).
- 3.
Para pacientes hospitalizados con diagnóstico de COVID-19 y dímero D de 1.000 ng/ml o menor, se sugiere que el seguimiento a esta prueba sea realizado cada 72 horas o más según la evolución clínica del paciente. Recomendación débil a favor (11% de panelistas estuvieron en desacuerdo).
- 4.
Para pacientes en unidad de cuidados intensivos (UCI) por COVID-19, se sugiere hacer seguimiento al dímero D, cuadro hemático, TP, tiempo parcial de tromboplastina (TPT) y fibrinógeno cada 24 horas o en periodos más cortos según su evolución clínica. Recomendación débil a favor (11% de panelistas estuvieron en desacuerdo).
- 5.
Para pacientes en unidad de cuidados intensivos (UCI) por COVID-19, se recomienda efectuar evaluaciones de coagulación y hemostasia, y usar el puntaje de coagulopatía inducida por sepsis (SIC, que incluye recuento de plaquetas, TP y puntaje SOFA) para apoyar el juicio clínico en el diagnóstico de coagulopatía asociada a COVID-19. Recomendación fuerte a favor (2% de panelistas estuvieron en desacuerdo).
- 6.
Para el diagnóstico de coagulación intravascular diseminada (CID) en pacientes con COVID-19 se sugiere usar el puntaje ISTH CID, que incluye recuento de plaquetas, TP, dímero D y fibrinógeno. Recomendación débil a favor (3% de panelistas estuvieron en desacuerdo).
B. Tromboprofilaxis en personas adultas con diagnóstico de COVID-19
Pregunta 2: ¿Cuál es la efectividad y seguridad de la tromboprofilaxis con heparina de bajo peso molecular vs. heparina no fraccionada y fondaparinux en pacientes con diagnóstico de COVID-19?
Hallazgos- •
La evidencia se deriva de estudios de corte transversal, análisis retrospectivos de cohortes, análisis retrospectivos de series de casos multicéntricos, recomendaciones de sociedades científicas y consensos.
Las publicaciones iniciales sugieren que la incidencia de tromboembolia venosa en pacientes con COVID-19 puede ser mayor que la de pacientes sin COVID-19 hospitalizados por enfermedad de similar severidad, y particularmente en pacientes críticos, aun con el uso de profilaxis con anticoagulantes16.
Varias observaciones sugieren que los pacientes con COVID-19 en UCI presentan un estado hipercoagulable, probablemente en relación con inflamación sistémica, hipoxemia, inmovilidad, ventilación mecánica y uso de catéteres venosos centrales. En una serie de 12 pacientes fallecidos por COVID-19 a quienes se hizo necropsia, se encontró trombosis venosa profunda en 7 pacientes (la cual no se sospechó antes de morir), y la embolia pulmonar fue causa directa de la muerte en 4 pacientes9. Un estudio en 81 pacientes de UCI con neumonía grave por SARS-CoV-2 que no recibieron tromboprofilaxis en Wuhan (China), mostró una prevalencia de trombosis venosa profunda del 25% y una incidencia de CID en pacientes fallecidos del 71%3, comparado con 0.6% en los sobrevivientes5. Los niveles elevados de dímero D al ingreso y su elevación en el tiempo se asociaron con mayor mortalidad.
El estudio de Tang et al.4 busca informar sobre la efectividad de los agentes antitrombóticos para prevenir desenlaces adversos. Evaluaron de manera retrospectiva 449 pacientes hospitalizados con COVID-19 grave. De ellos, 22% recibieron tromboprofilaxis con anticoagulante durante 7 días (la mayoría enoxaparina 40-60mg/día). La mortalidad global fue 29.8%, sin diferencia entre los pacientes con y sin tromboprofilaxis. Sin embargo, en el análisis de subgrupos se encontró menor mortalidad en el grupo de tromboprofilaxis en pacientes con puntaje SIC de 4 o mayor (40.0% vs. 64.2%) y en pacientes con dímero D mayor de 3.000 ng/ml (6 veces el límite superior normal) (32.8% vs. 52.4%). Los desenlaces de sangrado fueron infrecuentes y generalmente leves. Debido al diseño retrospectivo, los resultados podrían estar sesgados por confusión por indicación de la profilaxis y otros tratamientos recibidos. El estudio sugiere que los pacientes con puntaje SIC elevado o dímero D elevado pueden beneficiarse de la tromboprofilaxis, pero estos resultados tienen menor aplicabilidad en contextos en los cuales la tromboprofilaxis es un estándar en cuidados intensivos.
El estudio de Klok et al.8,34 es un análisis retrospectivo de una serie multicéntrica de 184 pacientes con COVID-19 en UCI, de los cuales 22% murieron en un seguimiento de 14 días. Todos los pacientes recibieron dosis profilácticas de heparina de bajo peso molecular. La incidencia acumulada de un desenlace compuesto de manifestaciones trombóticas fue 49%. La mayoría (87%) de estos eventos fue embolia pulmonar confirmada. Entre los predictores independientes de complicaciones trombóticas se encontraron la edad y la coagulopatía, definida como prolongación espontánea del tiempo de protrombina y del tiempo parcial de tromboplastina (TPT). El uso de anticoagulación a largo plazo antes del ingreso, que ocurrió en 9.2% de los pacientes, se asoció con menor riesgo del desenlace compuesto [hazard ratio (HR) 0,29]. Los pacientes con complicaciones trombóticas tuvieron mayor riesgo de morir (HR 5.4), pero el uso de anticoagulación terapéutica no se asoció con menor mortalidad. El estudio sugiere que los pacientes críticamente enfermos por COVID-19 pueden desarrollar embolia de manera más frecuente que lo usual para pacientes de UCI, a pesar del empleo de anticoagulantes en dosis convencionales de tromboprofilaxis.
Middeldorp et al.35 investigaron la incidencia de tromboembolia venosa confirmada en una cohorte de 198 pacientes hospitalizados en un solo hospital en Holanda. De ellos, 38% ingresaron a UCI y 19% murieron. Con una mediana de seguimiento de 7 días, 28% de los pacientes de UCI y 3.3% de los pacientes de pisos desarrollaron tromboembolia venosa sintomática (incluyendo 6.6% con embolia pulmonar) a pesar de tener profilaxis. No se presentó tromboembolia venosa en ninguno de los pacientes que recibieron anticoagulación plena desde el ingreso. La incidencia acumulada de tromboembolia venosa sintomática a los 7, 14 y 21 días fue de 10%, 21% y 25% respectivamente. La incidencia informada en este estudio es bastante mayor a la incidencia de 0.3-1.0% reportada en los principales estudios clínicos controlados de profilaxis con anticoagulantes en pacientes hospitalizados agudamente enfermos36–38.
Ninguno de los estudios mencionados aquí permite efectuar una comparación de la efectividad de la tromboprofilaxis con anticoagulante y el placebo, ni la comparación entre diferentes dosis de agentes anticoagulantes en pacientes con COVID-19. La mayoría de los pacientes en estos estudios recibieron tromboprofilaxis en dosis convencional o dosis mayores. Con los datos actuales, no se puede efectuar una evaluación precisa del balance de riesgos de tromboembolia venosa vs. los riesgos de sangrado con dosis de anticoagulantes mayores a la dosis convencional para tromboprofilaxis; sin embargo, hay acuerdo hasta ahora en que la coagulopatía asociada a COVID-19 se relaciona más con trombosis que con sangrado.
Algunos expertos han considerado que las microtrombosis pulmonares podrían tener un papel en algunos casos de insuficiencia respiratoria hipoxémica, pero también estas trombosis pueden ser la consecuencia de inflamación e hipoxia severa. Debe tenerse en cuenta la alta prevalencia de microtrombos en SDRA, con o sin COVID-198,32,39,40.
Gran parte de las recomendaciones actuales para prevención, diagnóstico y tratamiento de la tromboembolia venosa se basan en guías de práctica ampliamente difundidas y aplicadas antes de la pandemia en otros escenarios y entidades nosológicas diferentes, en las cuales se establece el uso de la evaluación del riesgo de tromboembolia venosa y sangrado para decidir la profilaxis, así como estrategias para estratificar el riesgo de mortalidad en pacientes con embolia pulmonar y las decisiones terapéuticas asociadas12,13. Sin embargo, hay gran preocupación por la ocurrencia de fenómenos trombóticos en pacientes con COVID-19, por lo cual se ha sugerido el uso de heparina de bajo peso molecular en dosis mayores a las dosis profilácticas usuales, aunque todavía no hay estudios que avalen la efectividad de esta intervención para prevenirlos41. Uno de los aspectos a tener en cuenta es la menor efectividad de las dosis convencionales de heparina de bajo peso molecular en personas obesas, así como el aumento de proteínas procoagulantes, como fibrinógeno y factor VIII10.
Varios grupos han adoptado esquemas de intensidad intermedia de heparina de bajo peso molecular utilizando estrategias adaptadas al riesgo de trombosis. Entre los factores de riesgo para tromboembolia venosa para considerar el uso de la dosis intermedia o mayor de heparina de bajo peso molecular se han considerado los siguientes: formas de COVID-19 grave con alteraciones de laboratorio de mal pronóstico, dímero-D >3.000 ng/ml, antecedentes personales o familiares de enfermedad trombótica venosa, antecedentes personales de enfermedad trombótica arterial, trombofilia biológica conocida, cirugía reciente, gestación, terapia hormonal sustitutiva, obesidad, cáncer y puntajes de riesgo de tromboembolia venosa10,15,42.
Un consenso por método Delphi encontró que 32% de los panelistas estaban a favor de usar dosis intermedias, mientras un 5% estaban a favor de dosis terapéuticas14. Otra encuesta comprobó que 30% de los expertos favorecen la estrategia de dosis intermedia para pacientes que no se hospitalizan en cuidados intensivos y 50% la favorecen para pacientes de cuidados intensivos15.
RecomendacionesEscalas de riesgo para decidir tromboprofilaxis
- 7.
En pacientes que se evalúan por diagnóstico o sospecha de COVID-19, se sugiere valorar el riesgo de tromboembolia venosa —incluyendo puntaje de Padua para pacientes no quirúrgicos y puntaje de Caprini para pacientes quirúrgicos— y valorar el riesgo de sangrado (escala Improve). Recomendación débil a favor (7% de panelistas estuvieron en desacuerdo).
7.1 Punto de buena práctica clínica: para pacientes que se hospitalizan en UCI por COVID-19 es innecesario el uso de la escala de riesgo de tromboembolia venosa porque la misma condición que indica su ingreso a UCI se asocia con alto riesgo de tromboembolia venosa.
Tromboprofilaxis para personas adultas con diagnóstico de COVID-19 de manejo ambulatorio
- 8.
Se sugiere usar tromboprofilaxis con heparina de bajo peso molecular en pacientes con diagnóstico de COVID-19 con manifestaciones leves a moderadas (enfermedad no complicada con síntomas locales en vías respiratorias altas con o sin otros síntomas inespecíficos, o neumonía leve) y que no se hospitalizan, con muy alto riesgo de tromboembolia venosa (gran compromiso de la movilidad, antecedente de tromboembolia venosa o cáncer activo) y bajo riesgo de sangrado. Recomendación débil a favor (14% de panelistas estuvieron en desacuerdo).
8.1 Punto de buena práctica clínica: para pacientes con tasa de filtración glomerular (TFG) menor de 30ml/min y cuando no se dispone de heparina de bajo peso molecular, considere dosis profilácticas de heparina no fraccionada. Para pacientes con probabilidad clínica intermedia o alta de trombocitopenia inducida por heparina, según puntaje 4T, usar dosis profiláctica de fondaparinux43.
8.2 Punto de buena práctica clínica: en el manejo ambulatorio debe recomendarse a los pacientes: deambulación frecuente, evitar permanecer por mucho tiempo de pie o sentado, evitar cruzar las piernas, cambiar de posición cada 30 a 60min, realizar movimientos de flexoextensión y de rotación de los pies, evitar la deshidratación y consumir suficiente agua42,44.
- 9.
Se sugiere indicar la tromboprofilaxis con heparina de bajo peso molecular al menos durante 7 días, en pacientes con diagnóstico de COVID-19 con manifestaciones leves a moderadas, con muy alto riesgo de tromboembolia venosa, bajo riesgo de sangrado y que no se hospitalizan. Recomendación débil a favor (21% de panelistas estuvieron en desacuerdo).
9.1 Punto de buena práctica clínica: reevaluar al paciente después de 5 a 8 días de la formulación de la tromboprofilaxis con heparina de bajo peso molecular, para considerar su extensión.
- 10.
Se sugiere no usar tromboprofilaxis con anticoagulantes en pacientes con COVID-19 en manejo ambulatorio y de bajo riesgo para tromboembolia venosa (según puntaje de Padua o puntaje de Caprini), sin antecedente de tromboembolia venosa y sin cáncer activo. Recomendación débil en contra (8% de panelistas estuvieron en desacuerdo).
Ver punto de buena práctica clínica 8.2
Pregunta 3: ¿Cuál es la dosis óptima de heparina de bajo peso molecular (dosis profiláctica convencional vs. dosis profiláctica superior a la convencional) para garantizar la tromboprofilaxis efectiva en pacientes con diagnóstico de COVID-19?
Hallazgos- •
La evidencia se deriva de las recomendaciones de sociedades científicas e instituciones internacionales, como la Organización Mundial de la Salud, y protocolos de instituciones académicas.
En general, hay acuerdo sobre la necesidad de tromboprofilaxis, pero su esquema óptimo para pacientes con COVID-19 no se ha determinado con precisión. Entre las recomendaciones de tromboprofilaxis con anticoagulante, hay algunas sobre varias intensidades de anticoagulante, basadas en consensos de expertos.
- (a)
Dosis usual de agentes anticoagulantes para tromboprofilaxis: la Organización Mundial de la Salud y varias sociedades científicas recomiendan emplear dosis tromboprofilácticas usuales de heparina de bajo peso molecular (a menos que esté contraindicada) en todos los pacientes con COVID-19 grave14,17,40,44–47. Incluso, dada la tasa relativamente alta de tromboembolia venosa en los reportes iniciales de estos pacientes, se ha recomendado el uso de una estrategia de tromboprofilaxis “universal” para todos los pacientes hospitalizados, sin requerimiento de valorar el riesgo individual de tromboembolia venosa15,16,18,32.
- (b)
Dosis intermedia de agentes anticoagulantes: debido a la preocupación sobre la frecuencia de fenómenos trombóticos, varias instituciones han adoptado protocolos de intensidad intermedia de heparina de bajo peso molecular (mayor dosis que la dosis usual de tromboprofilaxis), basados principalmente en su plausibilidad biológica y pese a no haber evidencia de buena calidad sobre su beneficio. La anticoagulación de intensidad intermedia de tratamiento anticoagulante no es recomendada por la Asociación Americana de Hematología, el Colegio Americano del Corazón, la Sociedad Europea de Cardiología y el Panel de Expertos de Chest14,16,40,47, pero es sugerida en algunos casos por la Sociedad Internacional de Trombosis y Hemostasia, la Sociedad Española de Trombosis y Hemostasia, el Grupo de Trabajo de Trombosis Cardiovascular de la Sociedad Española de Cardiología, la Sociedad Italiana de Trombosis y Hemostasia, el Consenso de la Sociedad Torácica China y el Foro de Anticoagulación15,18,39,42,44,48.
- (c)
Dosis de intensidad terapéutica de agentes anticoagulantes: aunque para algunos autores podría parecer un enfoque razonable, actualmente no se sabe si los pacientes críticamente enfermos por COVID-19, pero sin diagnóstico (establecido o sospechado) de tromboembolia venosa, fibrilación auricular u otra indicación previamente definida de terapia antitrombótica se benefician de recibir anticoagulación de intensidad terapéutica y, por tanto, no se recomienda en la mayoría de los consensos de expertos o guías de instituciones14–18,39,40,42,46–49
Aunque aún no se conoce la frecuencia de tromboembolia venosa posegreso ni la tasa de sangrado con el uso extendido de anticoagulantes, hay acuerdo en no recomendar tromboprofilaxis después del egreso en todos los pacientes que se hospitalizaron por COVID-19. Algunos grupos consideran razonable utilizar estratificación individualizada de riesgo de trombosis y hemorragia, seguido de la consideración de tromboprofilaxis ambulatoria y extendida después del egreso con duración de al menos 14 días, y hasta de 30 días, para pacientes con bajo riesgo de sangrado y riesgo muy elevado de tromboembolia venosa dado por factores de riesgo, como requerimiento de tratamiento en cuidados intensivos, antecedente de tromboembolia venosa, trombofilia y gran inmovilidad14,15,39,44.
Además del uso de anticoagulantes, se ha dado consideración a la compresión neumática intermitente en miembros inferiores cuando hay contraindicación para la anticoagulación, y en algunos casos en esquemas multimodales15,18,44.
RecomendacionesTromboprofilaxis para adultos con diagnóstico de COVID-19 de manejo intrahospitalario que no ingresan a UCI
- 11.
Se recomienda usar tromboprofilaxis con heparina de bajo peso molecular para pacientes hospitalizados por COVID-19 que no ingresan a UCI, siempre que no esté contraindicada (sangrado activo, recuento de plaquetas menor de 25 K/μL, o fibrinógeno menor de 100mg/dl; la prolongación del TP o el TPT no contraindica la profilaxis con anticoagulante). Recomendación fuerte a favor (0% de panelistas estuvieron en desacuerdo).
11.1 Punto de buena práctica clínica: para pacientes con contraindicación para anticoagulantes, usar compresión neumática intermitente.
Ver punto de buena práctica clínica 8.1
- 12.
Se sugiere usar tromboprofilaxis con dosis convencionales de heparina de bajo peso molecular (enoxaparina 40mg subcutánea al día o dalteparina 5.000 unidades internacionales subcutánea al día) en pacientes con COVID-19 hospitalizados sin ingreso a UCI, siempre que tengan bajo riesgo de sangrado y no tengan factores de riesgo adicionales para tromboembolia venosa (tabla 1). Recomendación débil a favor (5% de panelistas estuvieron en desacuerdo).
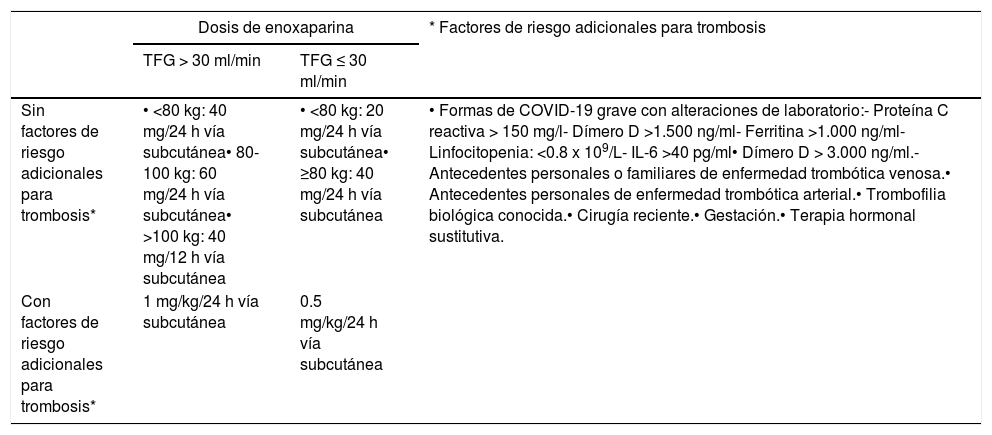
Tabla 1.Recomendaciones de dosis de enoxaparina para tromboprofilaxis en pacientes con COVID-19, según presencia de factores de riesgo adicionales para trombosis y peso, con ajuste por TFG, derivadas de la Sociedad Española de Trombosis y Hemostasia42
Dosis de enoxaparina * Factores de riesgo adicionales para trombosis TFG > 30 ml/min TFG ≤ 30 ml/min Sin factores de riesgo adicionales para trombosis* • <80 kg: 40 mg/24 h vía subcutánea• 80-100 kg: 60 mg/24 h vía subcutánea• >100 kg: 40 mg/12 h vía subcutánea • <80 kg: 20 mg/24 h vía subcutánea• ≥80 kg: 40 mg/24 h vía subcutánea • Formas de COVID-19 grave con alteraciones de laboratorio:- Proteína C reactiva > 150 mg/l- Dímero D >1.500 ng/ml- Ferritina >1.000 ng/ml- Linfocitopenia: <0.8 x 109/L- IL-6 >40 pg/ml• Dímero D > 3.000 ng/ml.- Antecedentes personales o familiares de enfermedad trombótica venosa.• Antecedentes personales de enfermedad trombótica arterial.• Trombofilia biológica conocida.• Cirugía reciente.• Gestación.• Terapia hormonal sustitutiva. Con factores de riesgo adicionales para trombosis* 1 mg/kg/24 h vía subcutánea 0.5 mg/kg/24 h vía subcutánea - 13.
Se sugiere usar tromboprofilaxis con dosis ajustadas de heparina de bajo peso molecular teniendo en cuenta el peso y la tasa de filtración glomerular (TFG) en pacientes hospitalizados por COVID-19 sin ingreso a UCI, sin factores de riesgo adicionales para tromboembolia venosa (tabla 1) y con bajo riesgo de sangrado. Recomendación débil a favor (4% de panelistas estuvieron en desacuerdo).
- 14.
Se sugiere usar dosis intermedias de heparina de bajo peso molecular (enoxaparina 1mg/kg/día) en pacientes hospitalizados por COVID-19 que no ingresan a UCI, tienen bajo riesgo de sangrado y presencia de factores de riesgo adicionales para tromboembolia venosa (tabla 1). Recomendación débil a favor (13% de panelistas estuvieron en desacuerdo).
14.1 Punto de buena práctica clínica: al usar enoxaparina en dosis mayores a las convencionales de tromboprofilaxis, considere disminución de la dosis con TFG menor 30ml/min, así como monitorización de actividad anti-Xa, si está disponible, siguiendo el protocolo institucional.
Uso de agentes anticoagulantes en personas adultas con diagnóstico de COVID-19 de manejo en UCI
- 15.
En pacientes hospitalizados en UCI por COVID-19, con bajo riesgo de sangrado, puntaje SIC < 4 y puntaje ISTH/CID < 5, se sugiere usar dosis ajustada (con peso mayor a 80kg) de enoxaparina en ausencia de factores de riesgo adicionales para tromboembolia venosa, o dosis intermedias (1mg/kg/día) de enoxaparina en presencia de factores de riesgo adicionales para tromboembolia venosa, con consideraciones similares a las de pacientes hospitalizados sin ingreso a UCI (tabla 1). Recomendación débil a favor (14% de panelistas estuvieron en desacuerdo).
Ver punto de buena práctica clínica 14.1
- 16.
En pacientes hospitalizados en UCI por COVID-19, con bajo riesgo de sangrado, y puntaje SIC 4 o mayor, o ISTH/CID 5 o mayor, se sugiere usar dosis intermedias altas tales como enoxaparina 1.5mg/kg cada día (mayor dosis que en pacientes hospitalizados que no ingresan a UCI). Recomendación débil a favor (19% de panelistas estuvieron en desacuerdo).
16.1 Punto de buena práctica clínica: en caso de falta de disponibilidad de enoxaparina, considere el uso de dosis intermedias correspondientes de otra heparina de bajo peso molecular.
Ver punto de buena práctica clínica 14.1
- 17.
Se sugiere considerar la estrategia de anticoagulación con la que se encuentre familiarizado el centro, en pacientes con COVID-19 y bajo riesgo de sangrado que presentan trombosis recurrente en sus dispositivos de acceso venoso o arterial a pesar del uso de dosis profilácticas de anticoagulación. Recomendación débil a favor (10% de panelistas estuvieron en desacuerdo).
- 18.
En pacientes hospitalizados por COVID-19 con circuitos extracorpóreos, se sugiere usar protocolo de anticoagulación con citratos o con heparinización sistémica como estrategia de prevención de coagulación del circuito. Recomendación débil a favor (7% de panelistas estuvieron en desacuerdo).
18.1 Punto de buena práctica clínica: en el caso de implementar protocolo de citratos, realice seguimiento de calcio iónico, calcio total, pH arterial y calcio del circuito; en el caso de implementar protocolo de heparina no fraccionada, monitorizar con TPT activado para metas entre 60 y 90 segundos, o con antitrombina III según disponibilidad del centro.
- 19.
Se sugiere no usar dosis plenas de agentes anticoagulantes, en ausencia de sospecha o confirmación del diagnóstico de complicaciones trombóticas de COVID-19 o indicaciones previas o diferentes para anticoagulación. Recomendación débil en contra (8% de panelistas estuvieron en desacuerdo).
Duración de tromboprofilaxis después del egreso de hospitalización
- 20.
Se sugiere usar el esquema de tromboprofilaxis con agente anticoagulante hasta el egreso o al menos durante 10 días, si el egreso ocurre antes, en pacientes hospitalizados por COVID-19 que no requirieron UCI y sin factores de riesgo adicionales para tromboembolia venosa. Recomendación débil a favor (14% de panelistas estuvieron en desacuerdo).
20.1 Punto de buena práctica clínica: cuando se decide tromboprofilaxis después del egreso, considere el mismo esquema de anticoagulante que se usó hasta el final de la hospitalización.
20.2 Punto de buena práctica clínica: evalúe al paciente a los 10 días del inicio de la tromboprofilaxis y considere si se indica su extensión.
- 21.
Se sugiere continuar la tromboprofilaxis con agente anticoagulante por 14 días después del egreso para pacientes hospitalizados por COVID-19 que no requirieron UCI, pero con riesgo muy elevado adicional de trombosis (antecedente de tromboembolia venosa, cáncer activo, índice de masa corporal mayor de 35, embarazo, puerperio o movilidad muy reducida) y bajo riesgo de sangrado. Recomendación débil a favor (6% de panelistas estuvieron en desacuerdo).
21.1 Punto de buena práctica clínica: evalúe al paciente a los 12-14 días del egreso y considere si se indica extensión del tiempo de tromboprofilaxis.
- 22.
Para pacientes que estuvieron en UCI por COVID-19, se sugiere continuar la tromboprofilaxis con agente anticoagulante por 30 días después del egreso de UCI. Recomendación débil a favor (19% de panelistas estuvieron en desacuerdo).
C. Diagnóstico y tratamiento de las complicaciones trombóticas en pacientes con COVID-19
Pregunta 4: ¿Cuál es la mejor estrategia diagnóstica y de tratamiento de la embolia pulmonar en pacientes con diagnóstico de COVID-19 vs. pacientes con condiciones diferentes a COVID-19?
Hallazgos- •
La evidencia se deriva de una serie de casos, una revisión sistemática y recomendaciones realizadas por diferentes sociedades científicas.
Gran parte de las recomendaciones actuales para prevención, diagnóstico y tratamiento de la tromboembolia venosa se basan en guías de práctica de otros escenarios o enfermedades, y son ampliamente difundidas y aplicadas. En estas se establece el uso de la evaluación del riesgo de tromboembolia venosa y de sangrado para decidir la profilaxis, así como estrategias para estratificar el riesgo de mortalidad en pacientes con embolia pulmonar y las decisiones terapéuticas asociadas12,13. En casos de deterioro súbito con aumento en el trastorno de oxigenación, falla o sobrecarga ventricular derecha, o choque, debe mantenerse un alto índice de sospecha de embolia pulmonar. Hay que tener en cuenta que el diagnóstico de embolia pulmonar y trombosis venosa profunda puede ser problemático en estos pacientes graves con COVID-19, debido al riesgo de infectar a otros pacientes y al personal hospitalario, aunado a las dificultades asociadas a efectuar pruebas diagnósticas en pacientes críticamente enfermos14. La elevación del dímero D se asocia a mortalidad, pero no permite hacer el diagnóstico de tromboembolia venosa, y el régimen anticoagulante (por ejemplo, de dosis profiláctica a dosis terapéutica) no se debe cambiar con base exclusivamente en el nivel del dímero D15. No se dispone de criterios clínicos fiables que permitan definir la indicación de tomografía para el diagnóstico de embolia pulmonar en pacientes con COVID-1914,47,50. La evidencia no es concluyente en definir si la tromboembolia venosa puede quedar subdiagnosticada en pacientes con COVID-19 grave. Esto es importante ya que el SDRA mismo puede ser una causa de vasoconstricción pulmonar hipóxica, hipertensión pulmonar y falla ventricular derecha14,15. Por estas razones, en ocasiones, puede ser necesario dar tratamiento con anticoagulación plena a pacientes con sospecha de embolia pulmonar, fundamentado solamente en deterioro pulmonar en un paciente con SDRA, a la espera de poder confirmar el diagnóstico por medio de imágenes diagnósticas10,15. El tratamiento anticoagulante preferido es la heparina de bajo peso molecular. El uso de heparina no fraccionada presenta inconvenientes por el requerimiento de monitoría frecuente de laboratorio y por la dificultad para interpretar el TPT debido a las alteraciones de coagulación de pacientes críticos con COVID-19, que puede implicar la necesidad de monitorizar con actividad anti-Xa. Una vez que se confirma el diagnóstico de tromboembolia venosa, se sugiere usar tratamiento anticoagulante al menos durante tres meses16,18.
Recomendaciones- 23.
Se recomienda mantener un alto índice de sospecha para complicaciones trombóticas (embolia pulmonar y otras presentaciones de tromboembolia venosa, trombosis arteriales sistémicas y microtrombosis) en pacientes hospitalizados por COVID-19. Recomendación fuerte a favor (0% de panelistas estuvieron en desacuerdo).
- 24.
Se recomienda considerar el inicio de anticoagulación plena con enoxaparina 1mg/kg/dosis cada 12 horas, con ajuste de dosis al 50% en caso de TFG menor de 30ml/min, en pacientes con COVID-19 con alta sospecha o confirmación de una complicación trombótica (excluyendo evento isquémico cerebral). Recomendación fuerte a favor (4% de panelistas estuvieron en desacuerdo).
24.1 Punto de buena práctica clínica: en pacientes con COVID-19 y diagnóstico de embolia pulmonar aguda, aplique estrategias establecidas en guías de manejo para la estratificación de riesgo y severidad, así como de tratamiento, dando consideración a trombólisis y otras terapias de reperfusión en casos seleccionados13.
24.2 Punto de buena práctica clínica: en caso de no disponer de enoxaparina, se puede considerar el uso de dosis anticoagulantes de otras heparina de bajo peso molecular.
24.3 Punto de buena práctica clínica: en pacientes con COVID-19 con probabilidad clínica intermedia o alta de trombocitopenia inducida por heparina (según puntaje 4T), use dosis anticoagulante de fondaparinux43.
- 25.
En pacientes con COVID-19 y complicación trombótica, se sugiere evitar el uso de heparina no fraccionada en infusión intravenosa, teniendo en cuenta el requerimiento de monitorización más frecuente y la dificultad para interpretar el TPT en pacientes críticamente enfermos con COVID-19, pero su uso puede ser útil en pacientes con TFG menor de 30ml/min, o cuando se requiere reversibilidad para intervenciones urgentes. Recomendación débil en contra (10% de panelistas estuvieron en desacuerdo).
- 26.
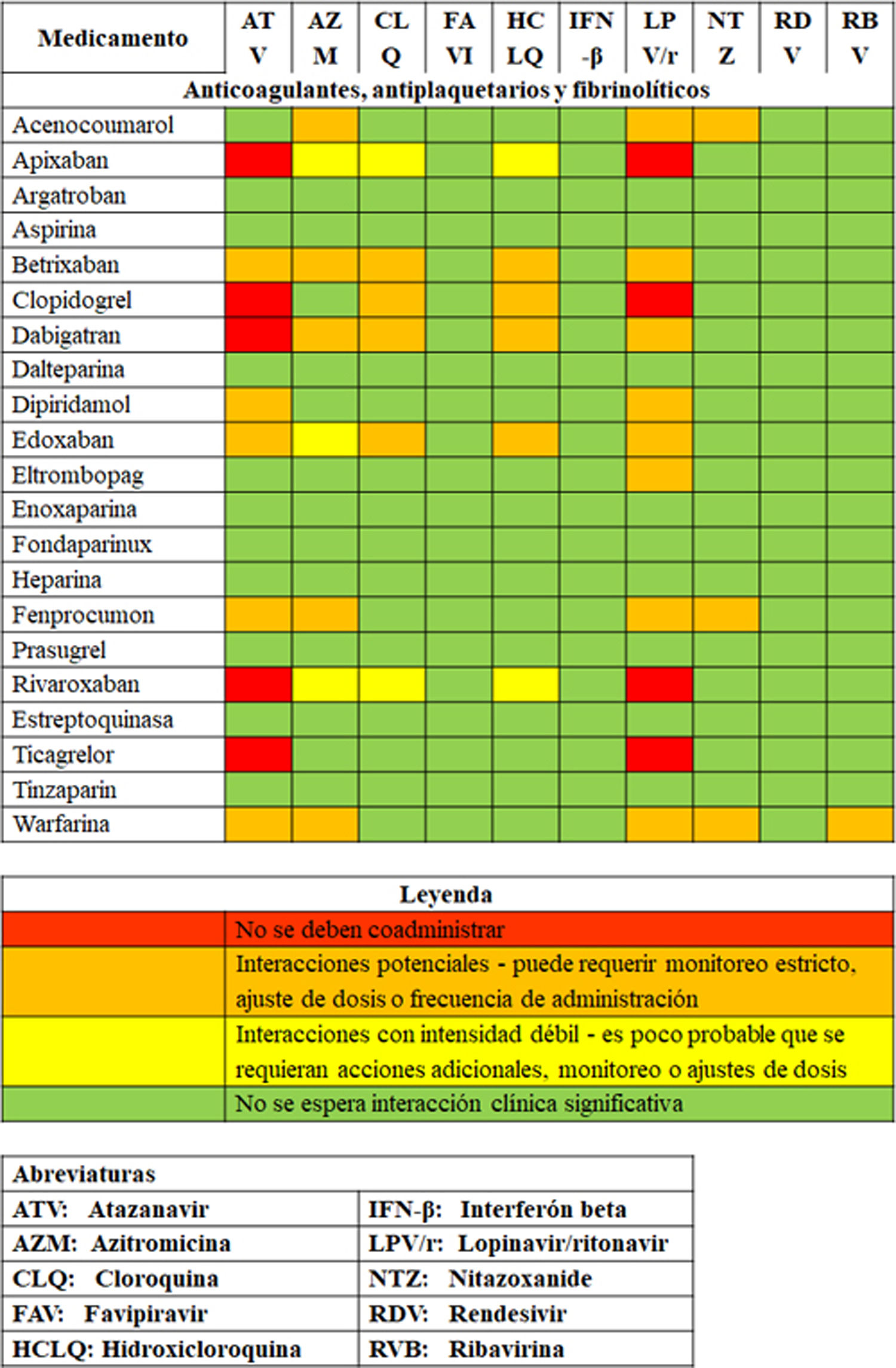
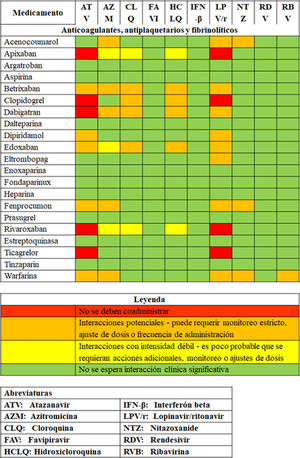
En pacientes con COVID-19 que desarrollan complicación trombótica durante la hospitalización, se sugiere evitar el uso de anticoagulantes orales directos (dabigatrán, rivaroxabán, apixabán) y de warfarina en la fase de inestabilidad clínica, teniendo en cuenta su potencial de interacciones (fig. 1), pero se sugiere considerar su inicio según indicación, una vez el paciente se ha estabilizado. Recomendación débil en contra (3% de panelistas estuvieron en desacuerdo).
Figura 1.Interacciones con terapias antivirales en experimentación para COVID-19.
Adaptada de: Prescribing Resource, updated 04 jun 2020, University of Liverpool51. Disponible en: https://www.covid19-druginteractions.org/prescribing-resources.
(0,44MB).
D. Adultos con indicación previa de usar agentes anticoagulantes
Pregunta 5: ¿Cuáles son los ajustes de tratamiento anticoagulante que se deben considerar en pacientes con indicación de uso de anticoagulantes previo a la pandemia COVID-19?
Hallazgos- •
La evidencia se deriva de las recomendaciones de las sociedades científicas basadas en panel de expertos.
Los tratamientos para pacientes con COVID-19 grave pueden tener interacciones con agentes antitrombóticos establecidos, tales como los anticoagulantes orales directos (DOAC, su sigla en inglés) y los antagonistas de la vitamina K15,51. Para los pacientes que ya estaban anticoagulados, se recomienda, como norma general, seguir el régimen anticoagulante establecido, pero, según sea el manejo ambulatorio u hospitalario, la elección farmacológica puede cambiar14. Cabe anotar que el uso de anticoagulantes orales (warfarina y anticoagulantes orales directos) tiene menos interés dando consideración al potencial de interacciones de medicamentos, comparado con la falta de interacciones importantes, y la conveniencia de la vía parenteral de las heparinas para pacientes en estado crítico o con alto riesgo de deterioro clínico rápido. También, a menos que se anticipen procedimientos urgentes, se prefiere la heparina de bajo peso molecular sobre la heparina no fraccionada para disminuir las ocasiones de contacto de los profesionales con los pacientes16. Los agentes antiplaquetarios no se consideran una alternativa razonable de tromboprofilaxis para estos pacientes.
Recomendaciones- 27.
Durante la pandemia, en pacientes ambulatorios sin diagnóstico de COVID-19, que tenían indicación previa de tratamiento con agentes anticoagulantes orales directos (DOAC), se recomienda que continúen recibiéndolos en sus dosis habituales. Recomendación fuerte a favor (1% de panelistas estuvieron en desacuerdo).
- 28.
En pacientes con COVID-19 leve de manejo ambulatorio que tenían indicación previa de tratamiento con DOAC, se recomienda que continúen recibiéndolos en sus dosis habituales. Recomendación fuerte a favor (3% de panelistas estuvieron en desacuerdo).
28.1 Punto de buena práctica clínica: al utilizar anticoagulantes orales directos en pacientes con COVID-19, se debe tener en cuenta el potencial de interacciones farmacológicas (fig. 1).
- 29.
Para los pacientes ambulatorios sin diagnóstico de COVID-19 durante la pandemia, que venían recibiendo warfarina con una tasa normalizada internacional (INR) que mantiene el tiempo en el rango terapéutico 70% o mayor en los 3 meses previos, se sugiere espaciar los controles de INR a cada 2-3 meses, a menos que existan factores que afecten la confiabilidad del efecto terapéutico. Recomendación débil a favor (15% de panelistas estuvieron en desacuerdo).
- 30.
Para los pacientes ambulatorios sin diagnóstico de COVID-19 durante la pandemia, y también en pacientes con COVID-19 leve de manejo ambulatorio que venían recibiendo warfarina y tienen INR con tiempo en el rango terapéutico < 70% en los 3 meses previos, se sugiere plantear formas de monitorización de INR que no impliquen asistir a la consulta o al laboratorio, o cambiar el tratamiento a DOAC o a heparina de bajo peso molecular. Recomendación débil a favor (4% de panelistas estuvieron en desacuerdo).
- 31.
En pacientes hospitalizados por COVID-19 en tratamiento previo con anticoagulantes orales, se sugiere cambiar el agente anticoagulante a heparina de bajo peso molecular, teniendo en cuenta el potencial de interacciones farmacológicas (fig. 1). Recomendación débil a favor (8% de panelistas estuvieron en desacuerdo).
Las recomendaciones clínicas de esta guía rápida orientan la toma de decisiones clínicas que, deducidas por extensión desde otros escenarios similares, pueden contribuir a una atención y a un cuidado centrados en la persona, con altos estándares de calidad y seguridad. Esto puede disminuir la dispersión en las prácticas clínicas actuales, mejorar las indicaciones y reducir los riesgos, acorde con el desafío que nos impone la pandemia por COVID-19. La mayor parte de las recomendaciones se relacionan con tromboprofilaxis, ya que es uno de los temas que dan lugar a mayor desacuerdo sobre su enfoque. En particular, esta guía delimita escenarios para el uso de dosis intermedias.
La metodología utilizada se presenta como una muestra práctica del método en escenarios de enfermedades emergentes, en el que la evidencia es escasa y hay alta incertidumbre en la toma de decisiones, al tiempo que se mantiene una postura sistemática, rigurosa, multidisciplinar e interinstitucional (sociedades científicas, universidades y prestadores de servicios de salud).
Entre las limitaciones identificadas, se encontró que la robustez del marco metodológico complica la actividad del consenso al ser llevado a escenarios de la vida real, debido a: a) un volumen elevado de recomendaciones, b) la valoración de cada criterio contemplando varios aspectos dentro de cada criterio, c) un número elevado de panelistas, y d) un tiempo limitado para la aplicación del método.
Hay una necesidad urgente de datos de alta calidad para responder algunas de las preguntas consideradas en este consenso. Entre los estudios en curso hay varios registros, tales como RIETE, CORONA-VTE y CORE-19, que capturan información de pacientes con COVID-19. Además, en la actualidad se planean y se llevan a cabo estudios aleatorizados con el objetivo de evaluar la eficacia y seguridad de dosis intermedias o terapéuticas de heparina de bajo peso molecular vs. dosis convencionales de tromboprofilaxis en pacientes hospitalizados, incluyendo COVID Hep, Hep-COVID y PROTECT COVID-19. Dada la rapidez con la cual se desarrolla la evidencia, los autores consideran éste como un documento vivo, con planes de actualización de sus recomendaciones de acuerdo con la generación de nueva evidencia y de mejor calidad. Debido a que en algunas de las recomendaciones la evidencia no es concluyente, no está disponible o está en desarrollo, este consenso representa la opinión de los autores y no puede sustituir el juicio clínico cuidadoso de profesionales calificados.
Finalmente, la implementación de estas recomendaciones será el siguiente reto, para el cual es clave mantener la articulación intersectorial e interdisciplinar alcanzada y el establecimiento de la voluntad y de los planes concretos de divulgación, comprensión y adherencia, para beneficio final de la población colombiana.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.
Avalan: Sociedad Colombiana de Cardiología y Cirugía Cardiovascular, Asociación Colombiana de Neumología y Cirugía de Tórax, Asociación Colombiana de Nefrología e Hipertensión Arterial, Asociación Colombiana de Medicina Interna, Sociedad Colombiana de Medicina Familiar, Asociación Colombiana de Especialistas en Medicina de Urgencias y Emergencias, Asociación Colombiana de Hematología y Oncología, Asociación Colombiana de Medicina Crítica y Cuidado Intensivo, Grupo Cooperativo Latinoamericano de Hemostasia y Trombosis, Fundación internacional de Medicina Materno-Fetal, Sociedad Ecuatoriana de Cardiología, Universidad Nacional de Colombia, Universidad de los Andes, Fundación Universitaria Juan N. Corpas, Fundación Universitaria Sanitas, Hospital Universitario Nacional de Colombia, Clínica de Marly, Clínica Universitaria Colombia, Clínica Reina Sofía, Clínica Iberoamérica, Clínica Sebastián de Belalcázar.