La microangiopatía trombótica asociada a cáncer (MTAC) comprende la presencia de anemia hemolítica microangiopática, trombocitopenia y lesión isquémica de órganos en pacientes con neoplasia de origen conocido o desconocido. Su diagnóstico es desafiante pues suele ser confundido con la púrpura trombocitopénica trombótica, que es la causa más frecuente de microangiopatía trombótica en pacientes sanos. La MTAC puede ser manifestación de la neoplasia en sí misma o manifestación de complicación de la quimioterapia, por lo que tiene un pronóstico pobre. A continuación se presenta el caso de una paciente que desarrolló MTAC en el contexto de cáncer metastásico de origen primario desconocido.
Cancer-associated thrombotic microangiopathy (CATM) consists of microangiopathic haemolytic anaemia, thrombocytopenia, and ischaemic end organ-damage in patients with a known or unknown primary malignancy. Its diagnosis is challenging, as it is sometimes confused with thrombotic thrombocytopenic purpura, which is the most common cause of thrombotic microangiopathy in healthy patients. CATM can be a manifestation of the malignancy itself or a chemotherapy-related complication, with these patients having a poor prognosis. A case is presented of a patient who developed CATM in the context of metastatic cancer with an unknown primary site.
Las microangiopatías trombóticas (MAT) son un conjunto de entidades que tienen en común la presencia de anemia hemolítica microangiopática, trombocitopenia y compromiso de órganos1. En los pacientes adultos sin cáncer, la púrpura trombocitopénica trombótica es la forma más frecuente de MAT y la piedra angular de su manejo es la plasmaféresis. Sin embargo, en pacientes con microangiopatía trombótica asociada a cáncer (MTAC) este manejo no ha demostrado tener beneficios2. La prevalencia de detección MTAC está subestimada hoy en día debido a la baja sospecha clínica de esta, lo que promueve una reducción en las opciones terapéuticas que de por si son limitadas2.
Caso clínicoMujer de 72 años de edad que consultó al servicio de urgencias por dolor progresivo de dos meses de evolución en la región lumbar, con irradiación a cara dorsal de ambos muslos de características lacerantes; el dolor se exacerbaba con los movimientos y mejoraba parcialmente con el uso de opioides y antiinflamatorios no esteroideos. Adicionalmente, previo al inicio de los síntomas también refierió: tos seca; disnea con medianos esfuerzos; astenia; adinamia; hiporexia, y pérdida de 9kg de peso de 2 meses de evolución. Como antecedentes médicos de importancia se encontraban: hipertensión arterial y diabetes mellitus 2 controladas. Al examen físico la paciente se encontraba alerta, orientada, sin signos de dificultad respiratoria con signos vitales estables y facies álgica; llama la atención taquicardia, diaforesis profusa y en la exploración del abdomen se detectó la presencia de distensión abdominal con movimientos intestinales, abdomen no doloroso a la palpación, sin adenopatías o megalias, resto de exploración normal.
Pruebas complementariasAl ingreso presentaba un hemograma normal, a excepción de una trombocitopenia y neutrofilia leve, proteinograma, trasaminasas y función renal normal. Por otra parte, gamma glutamiltransferasa (GGT) 149 UI/L (7- 43Ul/L), lactato deshidrogenasa (LDH) 610 UI/L (< 395 Ul/L) y fosfatasa alcalina (FA) 449 UI/L (< 100 Ul/L). La paciente asiste con estudio de gammagrafía ósea y tomografía de columna dorsal sin contraste realizados ambulatoriamente un mes previo al ingreso que muestran múltiples lesiones óseas localizadas en región parietal bilateral y frontal izquierda de calota craneal, columna vertebral, pelvis, hombro derecho, clavícula derecha, esternón y tercio proximal de fémur. Ante el posible diagnóstico de cáncer metastásico de origen desconocido, se solicitaron mamografía, radiografía de tórax, proteinuria en 24 horas e inmunofijación, ecografía de tiroides y tomografía de cráneo, sin reportar hallazgos sugestivos de lesión neoplásica primaria. En tomografía axial computarizada toraco-abdominal se describieron nuevamente múltiples lesiones óseas dorsales y lumbares, sobre todo en D11 y D12 compatibles con metástasis, sin especificar presencia de alguna lesión tumoral torácica o intraabdominal; no obstante, se evidencia patrón en vidrio esmerilado en la ventana pulmonar en ambos campos pulmonares y una ocupación nodular de morfología oval en aurícula izquierda. En ecocardiograma se confirmó la presencia de una imagen circular exógena de 1,6 cm x 2,1cm localizada en aurícula izquierda, de bordes bien definidos y poco móvil, que no fue ocupada por contraste, y no fue posible diferenciar entre un trombo intracavitario o mixóma auricular. Cardiología sugirió cardioresonancia que no se realizó por tórpida evolución clínica de la paciente.
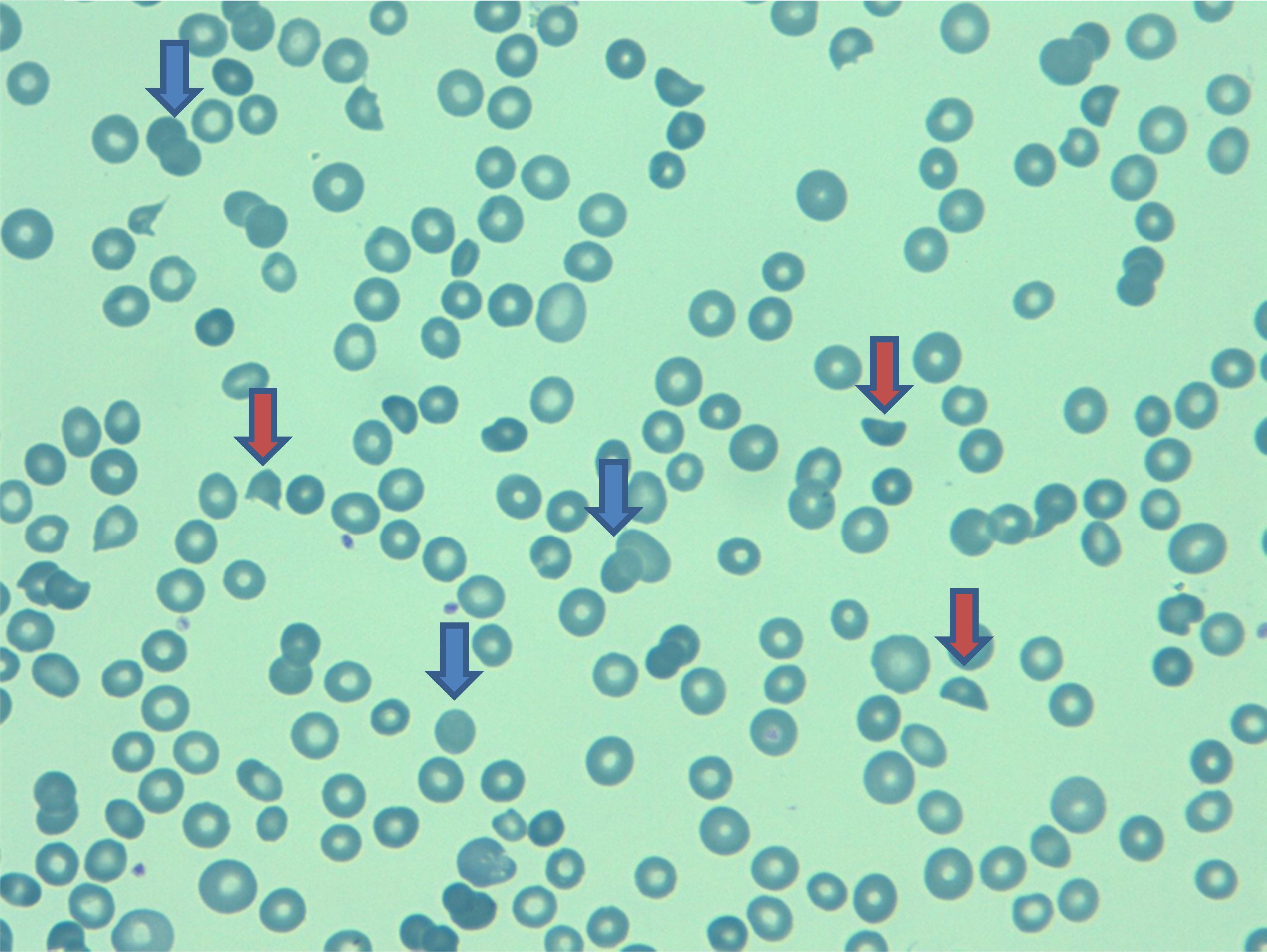
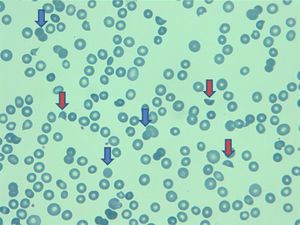
EvoluciónPor los hallazgos ecocardiográficos, sin descartarse un trombo intraauricular, se decide iniciar anticoagulación plena con heparina de bajo peso molecular (1mg/kg/12 horas). La paciente desde el inicio presentó un curso clínico tórpido por pobre control del dolor y al cabo de 5 días después del ingreso presentó signos de dificultad respiratoria y se descartó tromboembolismo pulmonar por angioTAC. Posteriormente, desarrolló anasarca, descenso de la hemoglobina a 8,2g/dL (previa 12,9g/Dl) con adecuada respuesta medular (reticulocitos 9,3%) y disminución del conteo plaquetario (plaquetas 66.000 cel/m3, previa 121 cel/m3). Se extendió estudio de anemia hemolítica que mostró: hiperbilirrubinemia (bilirrubina total 24,8 umol/L, previa 12,2 umol/L); test de Coombs directo negativo, LDH 5.300 UI/L; presencia de esquistocitos y anisocitosis en frotis de sangre periférica (fig. 1), y alteración en las pruebas de función hepatobiliar (alanina-aminotransferasa 1.116 UL/L, aspartat-aminotrasfersa 1.256 UL/L, GTT 453 UL/L, FA 540 UL/L) y renal (creatinina 152,4 umol/L, previa 75,9 umol/L). Por el deterioro multiorgánico y el pronóstico pobre de la paciente, se determinó junto a la familia iniciar pauta de sedación farmacológica y la paciente falleció al séptimo día de hospitalización.
DiagnósticoMicroangiopatía trombótica (MAT) inducida por cáncer metastásico de origen primario desconocido.
DiscusiónEl síndrome de MAT está compuesto por la presencia de anemia hemolítica microangiopática, trombocitopenia y lesión isquémica de órgano. La MTAC está presente en el 6% de los pacientes con carcinomas metastásicos y el adenocarcinoma es el subtipo histológico más comúnmente asociado1. También puede ocurrir en pacientes sin metástasis conocida o incluso puede ser la presentación clínica de cáncer no diagnosticado3. Los principales mecanismos en pacientes con cáncer están dados por metástasis microvasculares inducidas por el propio cáncer, coagulación intravascular diseminada o inducida por quimioterapia y que pueden estar asociadas a toxicidad dosis dependiente (gemcitabina, mitomicina, interferón alfa y cisplatino) o reacción mediada por anticuerpos (oxiplatino)4–6.
Existen otras causas de MAT, entre estas la púrpura trombocitopénica trombótica (PTT) que es la causa más frecuente en pacientes sanos (46%) y ocurre como resultado de la deficiencia severa de ADAMTS13 (<5%). La terapia de elección por su efectividad es la plasmaféresis, con una sobrevida postratamiento del 80%, lo que demanda un rápido diagnóstico y tratamiento y, aunque no es frecuente en pacientes con cáncer, es importante descartarlo en busca de una posible opción terapéutica7,8.
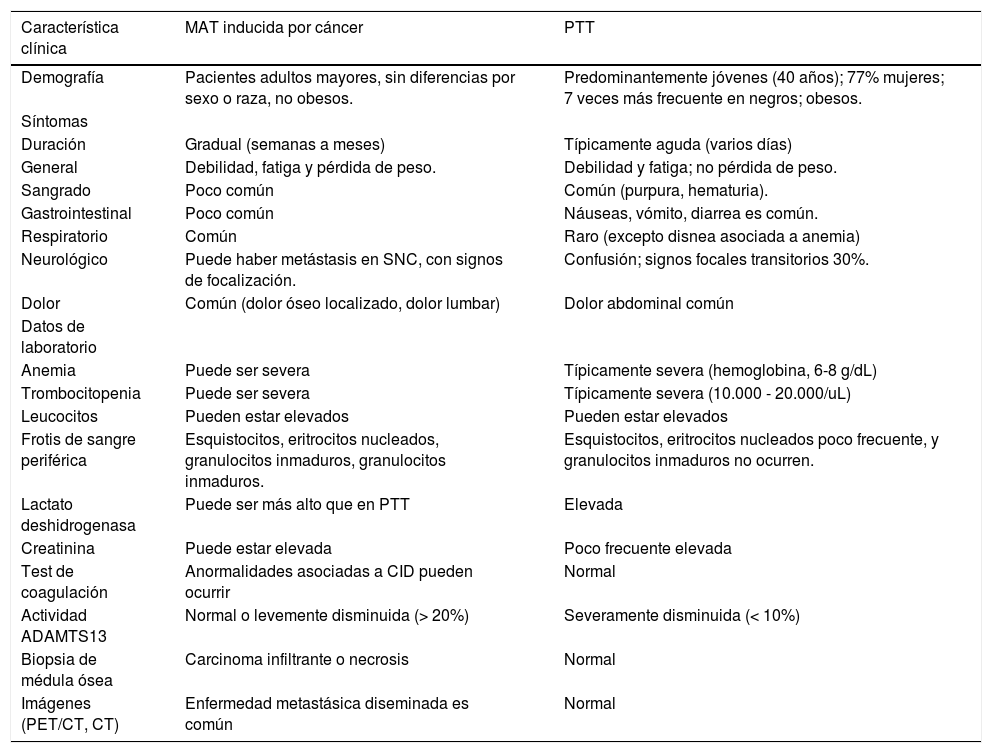
Para realizar un correcto diagnóstico de MTAC en pacientes con cáncer es necesario documentar si está recibiendo algún medicamento de los mencionados previamente y determinar si los síntomas son súbitos o insidiosos en sospecha de respuesta mediada por anticuerpos o toxicidad dosis dependiente, respectivamente. Por último, si se no demuestra exposición a medicamentos inductores de MTAC es imprescindible descartar PTT por lo que se han descrito características clínicas diferenciales entre MTAC y PTT presentadas en la tabla 1.
Características clínicas de los pacientes con MAT inducida por cáncer y PTT
| Característica clínica | MAT inducida por cáncer | PTT |
|---|---|---|
| Demografía | Pacientes adultos mayores, sin diferencias por sexo o raza, no obesos. | Predominantemente jóvenes (40 años); 77% mujeres; 7 veces más frecuente en negros; obesos. |
| Síntomas | ||
| Duración | Gradual (semanas a meses) | Típicamente aguda (varios días) |
| General | Debilidad, fatiga y pérdida de peso. | Debilidad y fatiga; no pérdida de peso. |
| Sangrado | Poco común | Común (purpura, hematuria). |
| Gastrointestinal | Poco común | Náuseas, vómito, diarrea es común. |
| Respiratorio | Común | Raro (excepto disnea asociada a anemia) |
| Neurológico | Puede haber metástasis en SNC, con signos de focalización. | Confusión; signos focales transitorios 30%. |
| Dolor | Común (dolor óseo localizado, dolor lumbar) | Dolor abdominal común |
| Datos de laboratorio | ||
| Anemia | Puede ser severa | Típicamente severa (hemoglobina, 6-8 g/dL) |
| Trombocitopenia | Puede ser severa | Típicamente severa (10.000 - 20.000/uL) |
| Leucocitos | Pueden estar elevados | Pueden estar elevados |
| Frotis de sangre periférica | Esquistocitos, eritrocitos nucleados, granulocitos inmaduros, granulocitos inmaduros. | Esquistocitos, eritrocitos nucleados poco frecuente, y granulocitos inmaduros no ocurren. |
| Lactato deshidrogenasa | Puede ser más alto que en PTT | Elevada |
| Creatinina | Puede estar elevada | Poco frecuente elevada |
| Test de coagulación | Anormalidades asociadas a CID pueden ocurrir | Normal |
| Actividad ADAMTS13 | Normal o levemente disminuida (> 20%) | Severamente disminuida (< 10%) |
| Biopsia de médula ósea | Carcinoma infiltrante o necrosis | Normal |
| Imágenes (PET/CT, CT) | Enfermedad metastásica diseminada es común | Normal |
Abreviaciones: MAT, microangiopatía trombótica; PTT, purpura trombocitopénica trombótica: CID, coagulación intravascular diseminada; PET, tomografía por emisión de positrones; LDH, lactato deshidrogenasa; TMA, microangiopatía.
Respecto al pronóstico, este es ominoso. Se estima una sobrevivencia de 3 días, por lo que las opciones terapéuticas son limitadas y es necesario decidir entre quimioterapia o plan de cuidados paliativos, esto si se conoce la neoplasia de base y su pronóstico9.
En conclusión, se presenta este caso para dar a conocer su difícil manejo, dado el rápido deterioro clínico, además del desconocimiento de la patología de base, lo que limitó el inicio de una terapia dirigida. Sin embargo, la evidencia tanto de metástasis óseas con un tumor primario desconocido, síndrome constitucional progresivo, trombocitopenia, como hallazgos de anemia hemolítica microangiopática y disfunción orgánica múltiple, nos hizo pensar que estábamos ante un caso de MTAC cuyo pronóstico desde el inicio era desalentador.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.