El ultrasonido realizado al lado de la cama del paciente se utiliza cada vez con más frecuencia en anestesiología y cuidado crítico. Son muchas sus aplicaciones aparte de la anestesia regional y el acceso vascular.
ObjetivoDescribir la forma de integrar el ultrasonido al lado de la cama del paciente en el actual manejo clínico del paciente hemodinámicamente inestable, hipoxémico y oligoanúrico, y del paciente con estado neurológico alterado.
Materiales y métodosEnsayo que describe una síntesis de la literatura actual, las opiniones de expertos, la práctica corriente y los experimentos clínicos recientes para el desarrollo de la propuesta de un algoritmo relativo al uso del ultrasonido al lado de la cama del paciente en el manejo de la inestabilidad hemodinámica y la hipoxemia.
ResultadosSe describen 3 algoritmos utilizados actualmente en el paciente hemodinámicamente inestable e hipoxémico. Adicionalmente se propone un enfoque simple de ultrasonido a la cabecera del paciente para la oligoanuria y el estado neurológico alterado.
ConclusiónSerá necesario validar estudios ulteriores que incorporen la realización de ultrasonido de la cabeza a los pies por parte de clínicos entrenados, pero es probable que demuestren las ventajas importantes de incorporar el ultrasonido a la cabecera del paciente en la práctica de la anestesiología y el cuidado crítico.
Bedside ultrasound is now more commonly used in anesthesiology and critical care. There are numerous applications beyond its role in regional anesthesia and vascular access.
ObjectiveTo describe how bedside ultrasound can be integrated to current clinical management is dealing with hemodynamically unstable, hypoxemic, oligoanuric patient and in the patient with altered neurological status.
Materials and methodsEssay article describing a synthesis of the current literature, expert opinion, current practice and recent clinical trials in the development of proposed algorithm dealing with the use of bedside ultrasound in the management hemodynamic instability and hypoxemia.
ResultsThree algorithms currently used in the hemodynamically unstable and the hypoxemic patient and the patient are described. In addition, a simple bedside ultrasound approach to oligoanuria and altered neurological status is proposed.
ConclusionFurther studies incorporating head-to-toe bedside ultrasound by trained clinicians will need to be validated but are likely to demonstrate the significant advantages of incorporating bedside ultrasound in the practice of anesthesiology and critical care.
El ultrasonido se ha afianzado ya en el quirófano en anestesia cardíaca, para bloqueos nerviosos regionales y para los accesos vasculares. Se han publicado artículos y guías que demuestran las ventajas de utilizar el ultrasonido para guiar las decisiones, intervenciones y procedimientos1-4. Las guías de reanimación incorporaron el ultrasonido como recurso fundamental para el diagnóstico diferencial durante el paro cardiorrespiratorio y también como herramienta alternativa para confirmar la colocación del tubo endotraqueal o, en otras palabras, para excluir la intubación esofágica5,6. En un análisis reciente sobre los avances en el monitoreo anestésico se determinó que la ecocardiografía transesofágica era el segundo tema reportado con mayor frecuencia, con 141 artículos en revistas de alto impacto para los años 2009-2013. Se ha demostrado que su uso por parte de anestesiólogos para ecografía transtorácica con el propósito de evaluar el corazón y los pulmones en el escenario preoperatorio es confiable y tiene también un impacto clínico. Es solo cuestión de tiempo hasta que los anestesiólogos acojan el uso del ultrasonido para situaciones relativamente comunes en el quirófano, como lo han hecho los médicos emergenciólogos desde hace ya decenios. Es de la mayor importancia que el uso generalizado de la ecocardiografía por parte de los anestesiólogos en el preoperatorio se ciña a un proceso riguroso de entrenamiento y obedezca a unas reglas bien fundamentadas para lograr el impacto más positivo sobre la atención del paciente. En las páginas siguientes se describe el papel crucial del ultrasonido a la cabecera del paciente para el manejo del paciente con hipoxemia aguda o inestabilidad hemodinámica. Se hará breve referencia a otras posibles aplicaciones, como el paciente oligoanúrico o el paciente con estado neurológico alterado y compromiso de la perfusión cerebral.
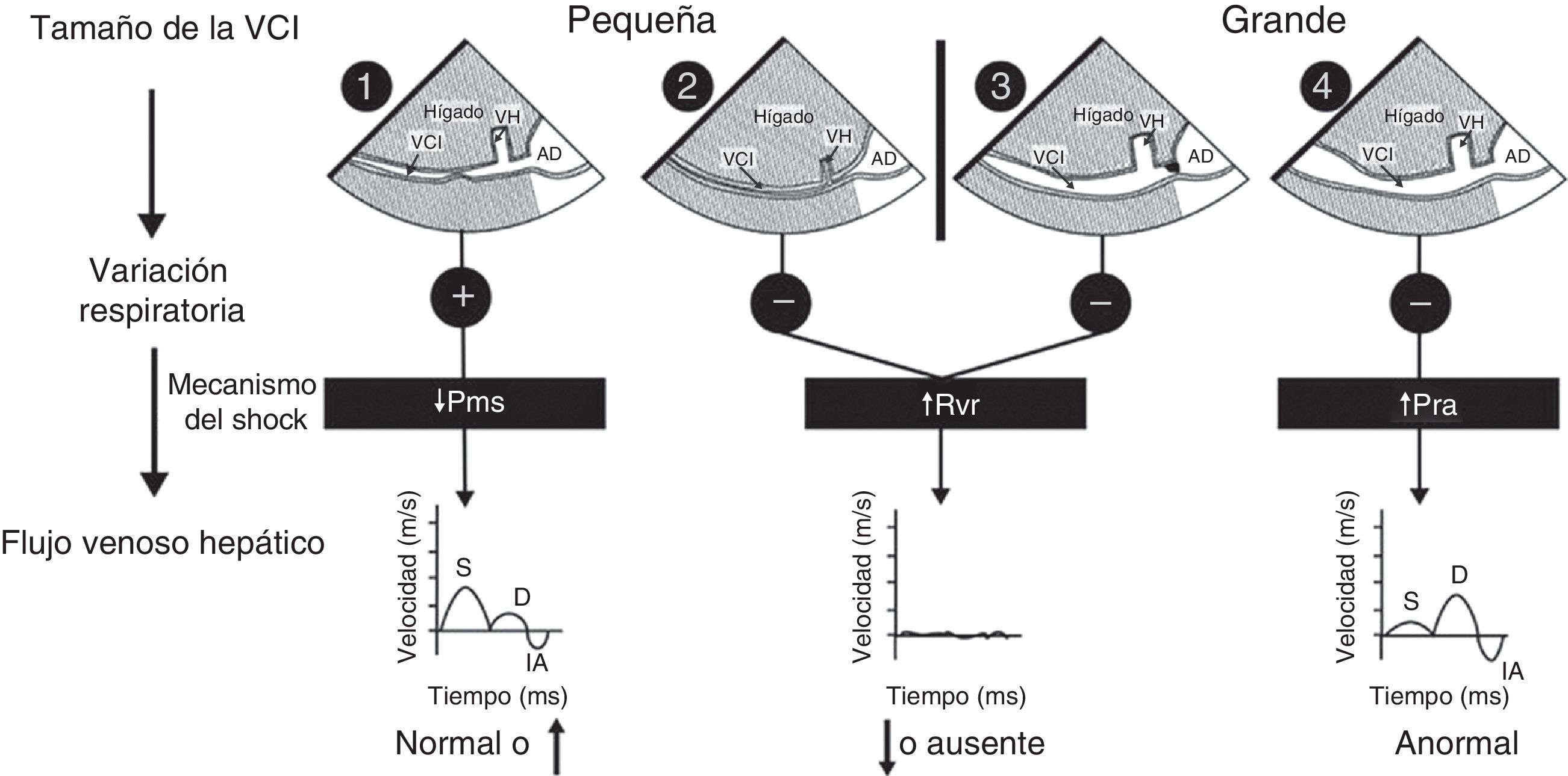
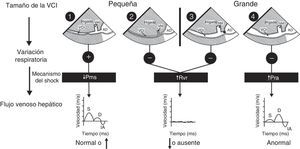
Mecanismos de la inestabilidad hemodinámica y la hipoxemiaLa inestabilidad hemodinámica y la hipoxemia son situaciones críticas en las cuales el tiempo es también crítico, lo cual significa que mientras más tiempo pase antes de restablecer la perfusión y la oxigenación, peor será el desenlace. Esto se ha demostrado claramente en medicina de urgencias7, en shock séptico8 y probablemente en cualquier situación en la cual se vea comprometido el transporte de oxígeno. La hipoxemia prolongada producirá daño neurológico. Si además la hipotensión se asocia con una menor perfusión cerebral, el desenlace podría ser peor. En 2014 se reportó el papel crucial del ultrasonido en los pacientes hemodinámicamente inestables mediante la utilización del enfoque fisiológico basado en el concepto del retorno venoso de Guyton9,10. Dicho simplemente, el retorno venoso normalmente es igual al gasto cardíaco y se determina con base en 3 variables: la presión de la aurícula derecha, la presión sistémica venosa media y la resistencia al retorno venoso. El ultrasonido también permite identificar rápidamente el mecanismo del shock al interrogar la vena cava inferior (VCI) y el flujo venoso hepático (FVH) mediante Doppler de onda pulsada (fig. 1). Una vez identificado el mecanismo, el siguiente paso es determinar la etiología del shock.
Mecanismo del shock. Algoritmo para determinar el mecanismo del shock con base en el tamaño de la vena cava inferior (VCI), la variación respiratoria durante la ventilación espontánea y el flujo venoso hepático (FVH). (Véanse los detalles en el texto).AD: aurícula derecha; D: velocidad diastólica del FVH; IA: inversión auricular de la velocidad del FVH; S: velocidad sistólica del FVH; Pms: presión arterial sistémica media; Pra: presión auricular derecha; Rvr: resistencia al retorno venoso; VH: vena hepática.
Fuente: con autorización de Denault et al.11.
El shock cardiogénico se asocia con un incremento de la presión de la aurícula derecha, el cual puede deberse a disfunción sistólica izquierda o derecha, pero también a disfunción diastólica, obstrucción del tracto de salida del ventrículo izquierdo o derecho, enfermedad valvular o embolismo pulmonar. Además, de no corregirse, la hipoxemia o la hipercapnia se traducen en un aumento de la hipertensión pulmonar y, por consiguiente, en un aumento de la presión de la aurícula derecha. En el shock cardiogénico se observa dilatación de la VCI y un FVH anormal. Cada vez se reconoce más la relación entre el FVH anormal y el aumento progresivo de la presión de la aurícula derecha y su relevancia clínica12,13. Es importante un examen del corazón para determinar la etiología y el tratamiento más apropiado. Por ejemplo, el uso de inotrópicos está indicado en disfunción sistólica, no es útil en disfunción diastólica, y está contraindicado en caso de obstrucción del tracto de salida izquierdo o derecho14,15.
La reducción de la presión sistémica venosa media puede ser el resultado de pérdida de volumen o shock hipovolémico o de un aumento de la distensibilidad venosa o de un shock distributivo. El shock hipovolémico puede ser el resultado de una hemorragia externa o de pérdidas sanguíneas en el tórax, el abdomen, la vía gastrointestinal o el retroperitoneo. También puede ser producto de pérdida de líquido a causa de una diarrea severa. La vasodilatación venosa puede ser producida por varios procesos, siendo los más comunes los relacionados con fármacos como los utilizados durante la inducción de la anestesia. Otras condiciones como el shock séptico, la anafilaxis, el shock neurogénico y la enfermedad de Addison por lo general se asocian con vasodilatación. En los casos tanto de pérdida de volumen como de vasodilatación, la VCI se verá pequeña y el FVH presentará una velocidad normal o elevada10. El ultrasonido se utilizará entonces para identificar una fuente de hemorragia o de sepsis, y el tratamiento será completamente diferente en cada caso.
La resistencia al retorno venoso es poco común. Dicho simplemente, se debe a la imposibilidad de la sangre de llegar al corazón. Esto puede suceder si hay una obstrucción intratorácica o intraabdominal que impida el retorno venoso. Por ejemplo, un neumotórax a tensión, la hiperinsuflación dinámica, y el taponamiento pericárdico o mediastínico típicamente elevan la presión de la aurícula derecha por compresión externa. El síndrome de compartimento abdominal produce el mismo efecto a través del diafragma. La presencia de una estenosis de la VCI, la cual puede ocurrir después de ciertos tipos de intervenciones como un trasplante hepático o un procedimiento de Fontan, o un trombo grande, también aumentan la resistencia al retorno venoso16. El aspecto de la VCI variará en estas condiciones. Si la resistencia ocurre encima del diafragma, la VCI se verá dilatada. Si la obstrucción está debajo del diafragma, la VCI se verá pequeña y muchas veces será difícil de visualizar. Cuando la VCI está dilatada, un examen cuidadoso de la misma cerca de la unión con la aurícula derecha puede revelar la estenosis. La clave para diagnosticar la resistencia al retorno venoso es la disminución, ausencia o anormalidad significativa del FVH16. Además, el corazón se verá normal cuando el flujo venoso pulmonar está preservado o elevado, en comparación con el FVH, el cual presentará una reducción significativa. En estos pacientes, cuando se alivia la obstrucción por lo general se produce un aumento súbito del retorno venoso, el cual puede producir falla ventricular derecha con disfunción diastólica transitoria del ventrículo izquierdo17,18.
Infortunadamente, es posible que varios mecanismos de shock estén presentes al mismo tiempo. Por ejemplo, en el shock séptico causado por una fuente abdominal que requiera cirugía, habrá inicialmente una reducción de la presión sistémica venosa media. Una reanimación con volumen excesivo de líquidos puede producir hipertensión abdominal y síndrome de compartimento abdominal, incrementando la resistencia al retorno venoso. Por último, en shock séptico, los mediadores inflamatorios con frecuencia producen depresión miocárdica19.
Son 5 los mecanismos específicos que pueden dar lugar a hipoxemia: discordancia de ventilación-perfusión, cortocircuito, difusión anómala, hipoventilación y oxigenación venosa mixta reducida. Las anomalías de ventilación-perfusión son la causa más común de desaturación. La característica distintiva de esta condición es que responde a la terapia con oxígeno. Las condiciones típicas son la enfermedad pulmonar obstructiva crónica descompensada, el edema pulmonar cardiogénico y la atelectasia. La característica de un cortocircuito es que no responde al oxígeno. El cortocircuito puede ser pulmonar, como una neumonía, o cardíaco, como un foramen oval persistente20. El embolismo pulmonar se puede asociar inicialmente con una anomalía de ventilación-perfusión pero, en caso de haber una oclusión vascular significativa, es más apropiado el término de espacio muerto para describir el mecanismo. La reducción de la saturación venosa mixta de oxígeno se asocia con shock severo, y el mecanismo ya se describió anteriormente. La hipoventilación como causa de hipoxemia es típica de una sobredosis de medicamentos y se asocia con un gradiente alveolar/arterial normal. Las anomalías de difusión son raras y principalmente crónicas. Otro mecanismo de la hipoxemia a considerar en particular en medicina ambiental sería la hipoxemia celular debida a intoxicación por monóxido de carbono y cianuro, en particular en las víctimas quemadas.
El ultrasonido a la cabecera del paciente es muy útil en presencia de hipoxemia. Se han desarrollado y validado algoritmos como el «protocolo azul» para abordar a los pacientes con hipoxemia21. Los principios de la física determinan que el aire es enemigo de todo examen ecográfico. En efecto, el aire actúa como espejo y refleja la totalidad de los haces ecográficos. Parecería lógico pensar que el pulmón no sería buen candidato para el ultrasonido a la cabecera del paciente, pero los pulmones no están hechos solo de aire sino de diversas combinaciones de parénquima y fluidos fisiológicos y patológicos. El paso de los haces de ultrasonido a través del pulmón normal o del patológico crea artificios. El ultrasonido pulmonar depende de la interpretación de esos artificios dentro del contexto de la clínica para llegar al diagnóstico. Siguiendo un algoritmo sencillo es fácil diagnosticar las patologías torácicas y pulmonares más comunes, como el derrame pleural, el edema pulmonar, el síndrome de dificultad respiratoria aguda, la neumonía y el neumotórax. El ultrasonido pulmonar también es útil para descartar la intubación del bronquio fuente y diagnosticar la parálisis diafragmática. Varios de los protocolos para el ultrasonido pulmonar se centran en los artificios pulmonares, pero hay ciertas situaciones en las cuales es esencial examinar el corazón, como sucede en los casos de cortocircuito intracardíaco y embolismo pulmonar. En el caso de la desaturación debida al edema pulmonar o la atelectasia, el uso de presión positiva al final de la espiración (PEEP) mejora la condición del paciente. Sin embargo, la PEEP empeora un cortocircuito intracardíaco como puede ser un foramen oval persistente, el cual suele estar presente hasta en un 20% de los pacientes adultos22.
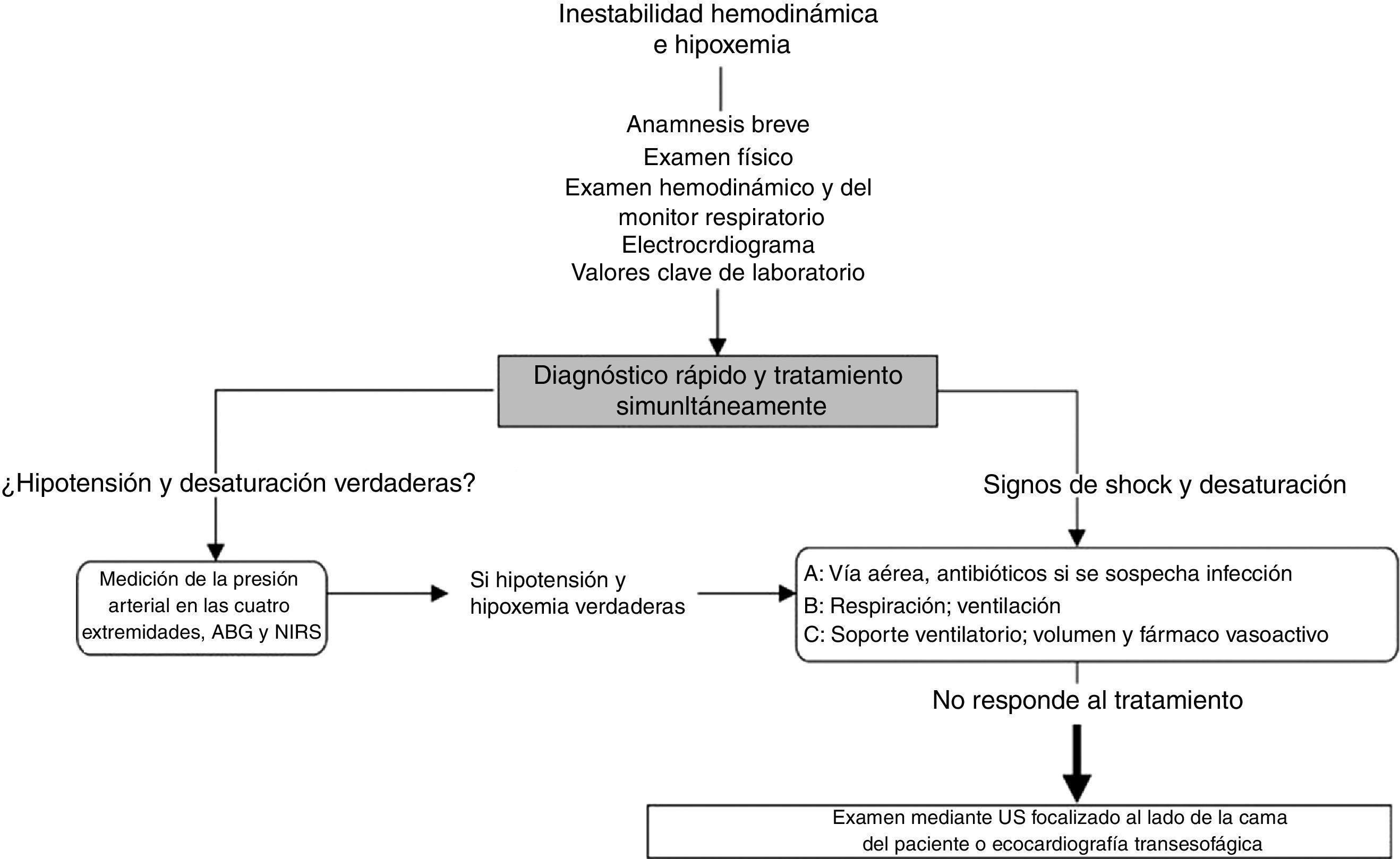
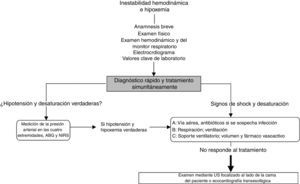
Enfoque frente al paciente hemodinámicamente inestable o hipoxémicoEn la figura 2 se resume la forma de abordar la hipotensión y la desaturación mediante ultrasonido a la cabecera del paciente. Este enfoque se basa en nuestra experiencia clínica, dentro de la cual vemos el ultrasonido como elemento complementario o confirmatorio del diagnóstico diferencial. El ultrasonido no reemplaza el criterio clínico, y su utilidad es proporcional a la idoneidad del clínico para reconocer signos y patrones ecográficos específicos.
Enfoque general frente a la inestabilidad hemodinámica y la hipoxemia. En presencia de shock se realizan una anamnesis breve y específica, se examina al paciente y se examinan los monitores. Adicionalmente se solicitan los valores de laboratorio considerados clave y también un electrocardiograma. Una vez confirmadas la hipotensión y la hipoxemia se sugiere aplicar el método del ABC, tal como se describe en el texto. Si estas medidas iniciales no funcionan, se debe considerar una ecocardiografía superficial o transesofágica al lado de la cama del paciente y un examen ecográfico focalizado en el paciente inestable e hipoxémico.
GA: gases arteriales; NIRS, espectroscopía de infrarrojo cercano; PA: presión arterial. Fuente: adaptado con autorización de Denault et al.9,11.
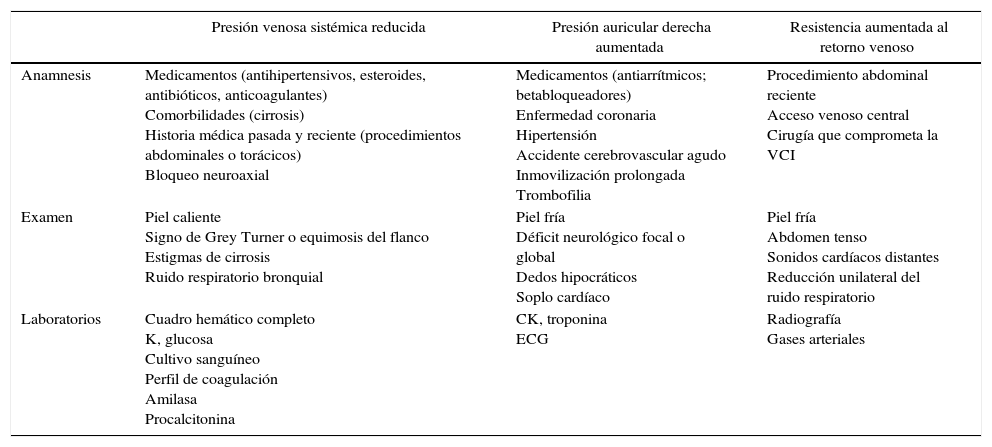
En el paciente hipotenso o hipoxémico, el diagnóstico y el tratamiento se inician simultáneamente. Los indicios importantes derivados de la anamnesis, el examen físico y los datos clave de laboratorio, resumidos en la tabla 1, ayudan a orientar el diagnóstico.
Elementos clave para la valoración de un paciente con inestabilidad hemodinámica
| Presión venosa sistémica reducida | Presión auricular derecha aumentada | Resistencia aumentada al retorno venoso | |
|---|---|---|---|
| Anamnesis | Medicamentos (antihipertensivos, esteroides, antibióticos, anticoagulantes) Comorbilidades (cirrosis) Historia médica pasada y reciente (procedimientos abdominales o torácicos) Bloqueo neuroaxial | Medicamentos (antiarrítmicos; betabloqueadores) Enfermedad coronaria Hipertensión Accidente cerebrovascular agudo Inmovilización prolongada Trombofilia | Procedimiento abdominal reciente Acceso venoso central Cirugía que comprometa la VCI |
| Examen | Piel caliente Signo de Grey Turner o equimosis del flanco Estigmas de cirrosis Ruido respiratorio bronquial | Piel fría Déficit neurológico focal o global Dedos hipocráticos Soplo cardíaco | Piel fría Abdomen tenso Sonidos cardíacos distantes Reducción unilateral del ruido respiratorio |
| Laboratorios | Cuadro hemático completo K, glucosa Cultivo sanguíneo Perfil de coagulación Amilasa Procalcitonina | CK, troponina ECG | Radiografía Gases arteriales |
Otros indicadores globales útiles para determinar la severidad del shock: signos vitales, creatinina, enzimas hepáticas, lactato, saturación venosa mixta, presión parcial de dióxido de carbono en sangre venosa y arterial (PCO2).
CK: creatinina quinasa; ECG: electrocardiograma; VCI: vena cava inferior.
Fuente: con autorización de Denault et al.9.
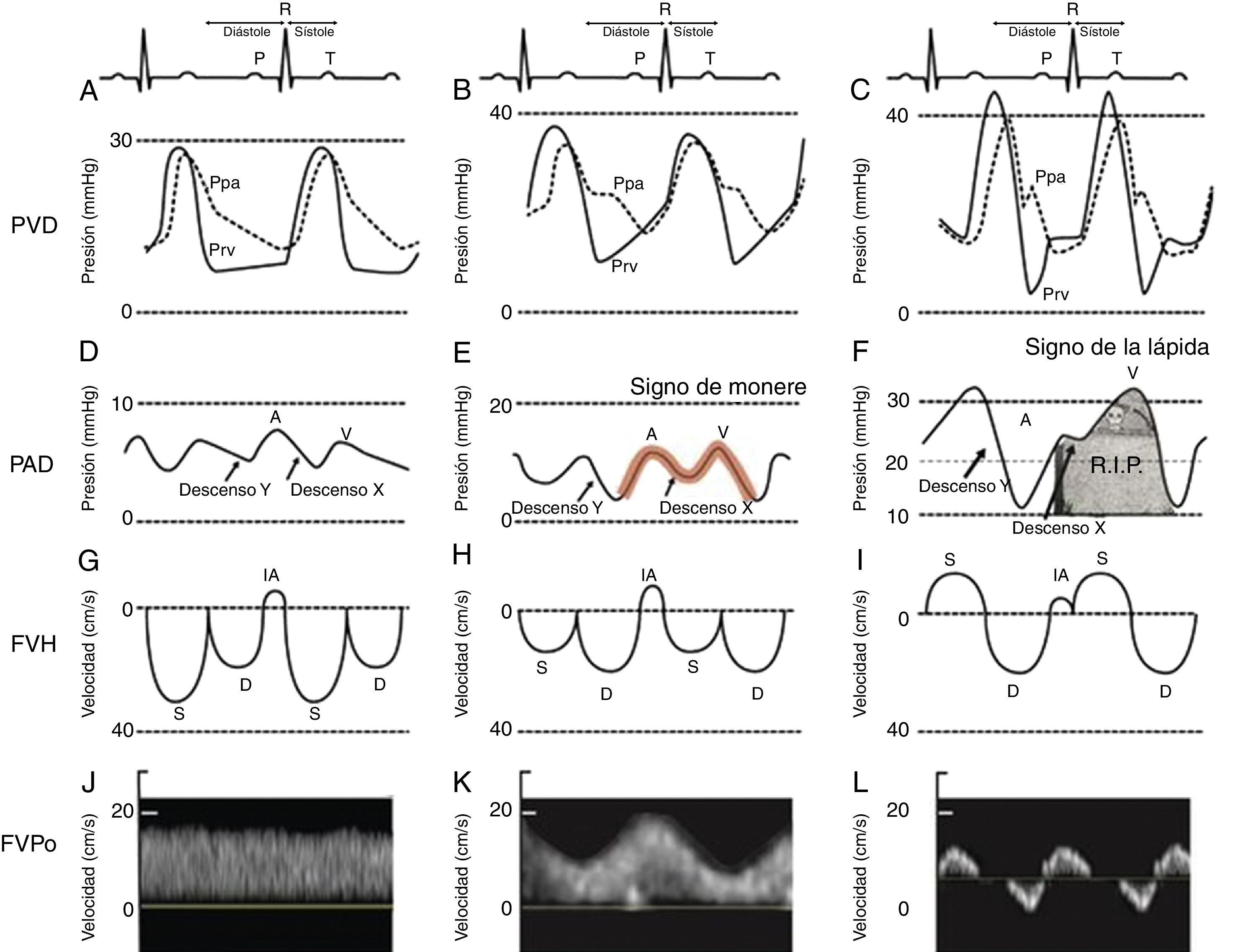
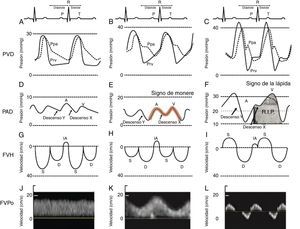
Es muy importante examinar atentamente el monitor para buscar indicios acerca del mecanismo del shock o de la desaturación. Son indicios importantes hallazgos tales como cambios electrocardiográficos del segmento ST con shock cardiogénico, prolongación del intervalo QT a causa de transfusión masiva, y microvoltaje por taponamiento cardíaco. También es importante analizar las formas de onda hemodinámicas. Por ejemplo, el shock cardiogénico se puede asociar con pulso alternante o pulso tardío. El pulso paradójico se utiliza comúnmente como marcador de una presión venosa sistémica reducida; sin embargo, también puede estar presente en hiperinsuflación dinámica, taponamiento y disfunción severa del ventrículo derecho (VD). La presión venosa central o la presión de la aurícula derecha pueden proporcionar información sobre la presencia o ausencia de disfunción ventricular derecha. En nuestro Instituto hemos utilizado ya desde hace varios años el monitoreo de la forma de onda de la presión ventricular derecha15. Esto nos ha permitido establecer el vínculo entre la forma de onda de la presión ventricular derecha, el FVH y, más recientemente, la velocidad del flujo de la vena porta23. A medida que se deteriora la función del VD, el descensoY predomina sobre el descensoX, creando un signo en forma de M o W. A este signo le damos el nombre de monere o «alarma». Monere es el origen de las palabras monitoreo y monumento y significa alarma. A medida que se deteriora la función del VD, el descensoX desaparece y solamente quedan el descensoY y una onda CV. Lo denominamos el signo de la «lápida» porque si es persistente se asocia con un aumento de la mortalidad por falla del VD. Tal como se aprecia en la figura 3, el FVH es equivalente a una PVC pero se expresa en términos de velocidad en cm/s en lugar de presión en mmHg. Además, en la literatura actual hay gran interés por el uso de flujo de la vena porta como un método indirecto y más sencillo para evaluar el impacto extracardíaco de la disfunción ventricular derecha. Por último, el cuarto trazado en la figura 3 es el flujo de la vena porta, el cual se correlaciona con la severidad de la insuficiencia cardíaca derecha23-25. Una vena porta normal es monofásica y se torna pulsátil y hasta se invierte al reducirse la distensibilidad de la aurícula derecha por lo general debido a insuficiencia cardíaca derecha. Los radiólogos y los cardiólogos han reconocido desde hace años la asociación entre hipertensión portal e insuficiencia cardíaca26-28. La señal es relativamente fácil de adquirir y se describió recientemente en Anesthesia & Analgesia29. Tremblay et al. reportaron recientemente que el uso del ultrasonido a la cabecera del paciente para detectar hipertensión portal tuvo un papel crucial en el manejo de 2 pacientes con insuficiencia cardíaca derecha30.
Clasificación de la disfunción ventricular. Presión del ventrículo derecho (PVD), presión de la aurícula derecha (PAD), flujo venoso hepático (FVH) y flujo de la vena porta (FVPo) en pacientes normales (A,D,G,J) y los observados comúnmente en pacientes con disfunción ventricular derecha leve (B,E,H,K) y severa (C,F,I,L). El signo de monere («advertencia» en latín) es signo de disfunción ventricular precoz. Ocurre cuando la onda «V» es más alta que la onda «A» y el descenso «Y» es igual o más profundo que el descenso «X». El signo de la «lápida» indica insuficiencia cardíaca derecha. Ocurre cuando no hay presencia del descenso «X» y solamente se observa una «V».
D: velocidad diastólica del FVH en el Doppler; IA: inversión auricular de la velocidad del FVH; Pap: presión de la arteria pulmonar; Pvd: presión del ventrículo derecho; S: velocidad sistólica del FVH.
Fuente: adaptada de Haddad et al.23.
Por tanto, en ausencia de enfermedad pericárdica y valvular, la evaluación no invasiva del VFH al lado de la cama del paciente permite diagnosticar rápidamente la disfunción del VD. Es importante analizar las formas de ondas respiratorias en caso de asociarse la hipoxemia con un aumento del pico de presión de la vía aérea en el paciente intubado9.
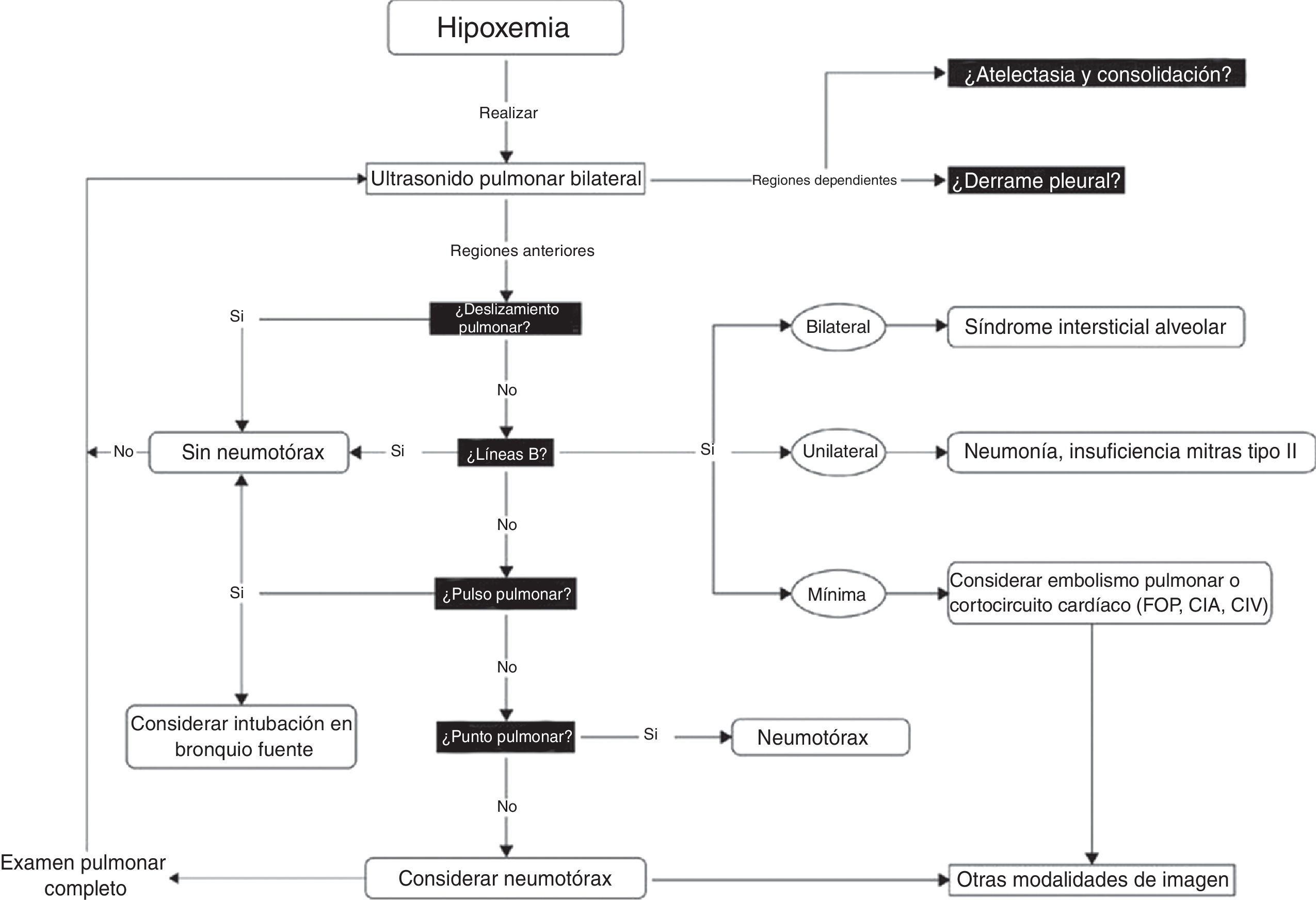
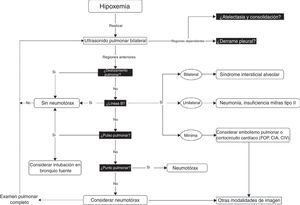
Una vez se han tomado estas medidas iniciales, es preciso cerciorarse de que se trata de una hipotensión y/o desaturación verdaderas. No es poco común observar una discrepancia entre la severidad de la hipotensión y los signos y síntomas correspondientes. Es probable que se subestimen la pseudohipotensión y la pseudosaturación, especialmente en pacientes que reciben cantidades significativas de agentes vasoactivos y tienen un catéter radial31. En el quirófano pueden presentarse gradientes significativos entre el catéter radial y el central o femoral hasta en un 45% de los pacientes32. Es por esto que recomendamos tomar la presión arterial en las 4 extremidades antes de avanzar en el tratamiento de la hipotensión cuando los signos clínicos no encajan en el cuadro clínico. Lo mismo puede ocurrir con la desaturación, en particular en pacientes con vasoconstricción periférica. En el quirófano y en la unidad de cuidados intensivos es útil la espectroscopia de infrarrojo cercano (NIRS) para ese propósito. En los casos de shock verdadero y desaturación, la NIRS está siempre reducida. En los casos de pseudohipotensión y desaturación, la NIRS aparece normal33. Una vez confirmadas la hipotensión y la desaturación verdaderas se inicia el ABC. La «A» se refiere a vía aérea pero también a antibióticos porque si se sospecha un shock séptico es necesario administrar antibióticos lo antes posible8. La «B» se refiere a respiración, ventilación y volumen hasta 15ml/kg, el cual podría ser suficiente para determinar si hay respuesta a los líquidos. También se puede utilizar la maniobra de elevar las piernas para ese propósito, evitando una provocación innecesaria con líquidos34. Por último, la «C» se refiere a circulación y recomendamos usar noradrenalina como agente inicial35. Una vez tomadas estas medidas iniciales se debe considerar un ultrasonido minucioso. El objetivo del examen ecográfico es determinar primero el mecanismo del shock (fig. 1) para después investigar la etiología. Puesto que en más del 90% de los casos la hipoxemia se asocia con un problema pulmonar, se debe entonces realizar una ecografía pulmonar para descartar primero un neumotórax y después para determinar las otras causas de la hipoxemia (fig. 4)36.
Algoritmo para el ultrasonido pulmonar. Algoritmo para el ultrasonido a la cabecera del paciente en presencia de hipoxemia. Se buscan en total 6 anomalías: derrame pleural, atelectasia en las regiones dependientes y no dependientes, deslizamiento pulmonar, líneas B en el punto pulmonar y pulso pulmonar. Una vez identificados o descartados esos artificios, se pueden descartar o incluir diagnósticos específicos.
CIA: comunicación interauricular; CIV: comunicación interventricular; FOP: foramen oval persistente. Para más detalles, consultar Piette et al.36 y Denault et al.11.
El primer paso en el manejo de un paciente con diuresis disminuida o creatinina elevada es descartar una causa posrenal. Es indispensable examinar la vejiga y el riñón con ultrasonido antes de cualquier intervención. Es muy común una obstrucción de la sonda urinaria, en particular en pacientes con hematuria traumática o postoperatoria. También es importante descartar la hidronefrosis. Una vez realizado este primer paso se debe evaluar la volemia tal como se describió en la figura 1. Recientemente ha habido gran interés en la identificación ecográfica de congestión renal como causa de insuficiencia cardíaca. Un estudio reciente realizado en pacientes con insuficiencia cardíaca identificó 3 patrones de congestión venosa semejantes a los descritos previamente con FVH13. En nuestra práctica incluimos el examen con ultrasonido 2D y Doppler de la vejiga y los riñones como parte de la valoración de rutina de los pacientes con insuficiencia cardíaca.
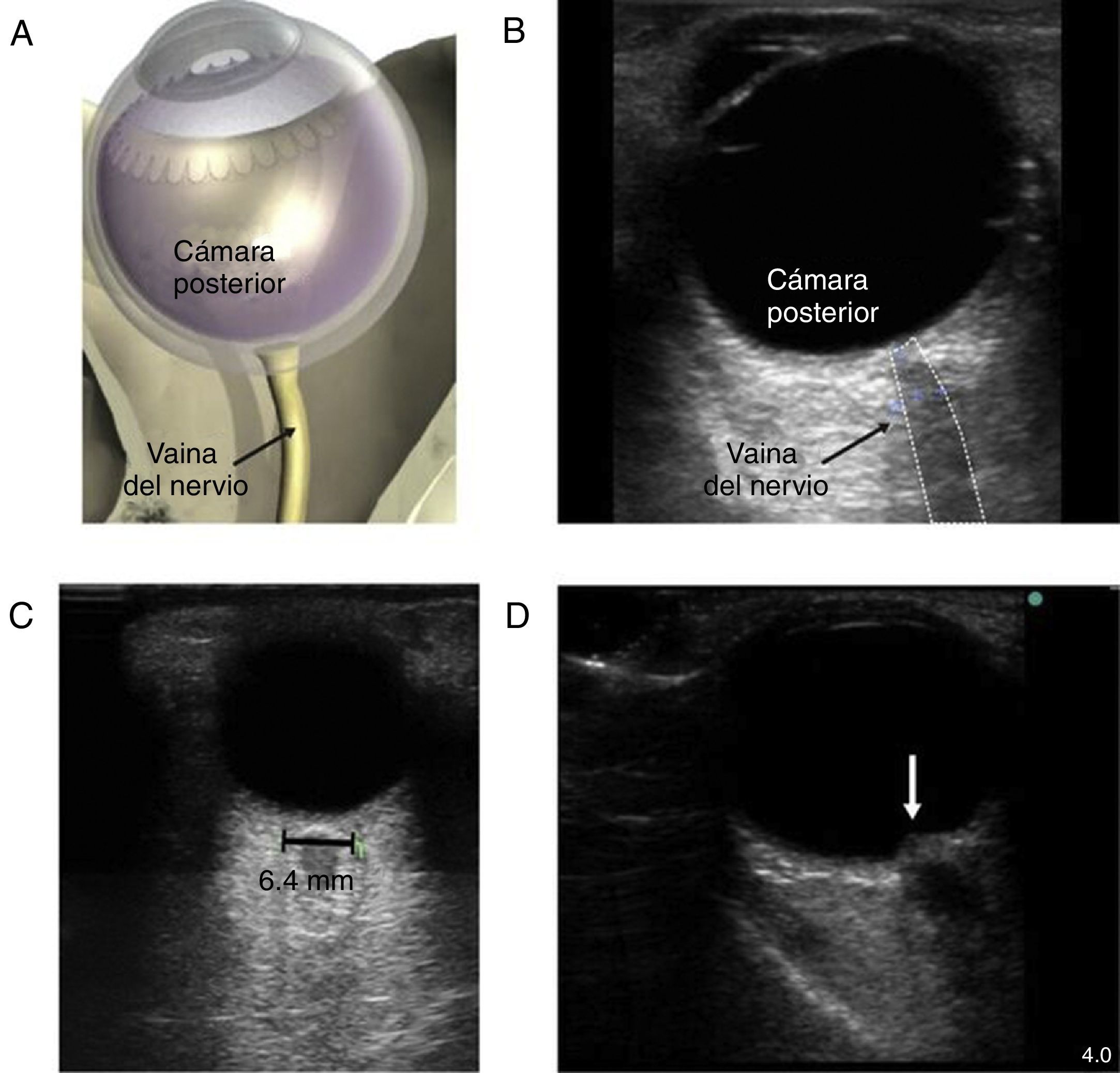
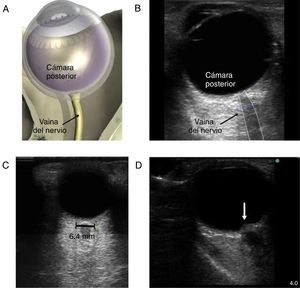
El paciente con estado neurológico alteradoEl ultrasonido a la cabecera del paciente puede ser útil para determinar la presencia de hipertensión intracraneal. Esto se puede hacer mediante Doppler transcraneal. Cuando la presión intracraneal se eleva, la velocidad diastólica se reduce y puede estar ausente cuando dicha elevación de la presión intracraneal llega al nivel de la presión arterial diastólica. Sin embargo, el Doppler transcraneal depende hasta cierto punto del operador y requiere entrenamiento. Un método mucho más simple es medir la vaina del nervio óptico37. Se trata de una técnica muy simple para la cual la curva de aprendizaje es muy rápida. La técnica se presenta en la figura 5. Se ha utilizado el umbral para el diámetro de la vaina del nervio óptico de 5,2 a 5,9mm para detectar el aumento de la presión intracraneal. La precisión diagnóstica para la detección de la hipertensión intracraneal se ha evaluado en múltiples estudios observacionales y ha demostrado una buena precisión diagnóstica en comparación con el monitoreo invasivo38.
Medición de la vaina del nervio óptico. A) Se indica el punto para medir el diámetro de la vaina del nervio óptico. Se muestra una línea de 3mm perpendicular desde el centro del nervio óptico, en el punto en el cual se hace la medición transversal de la vaina del nervio óptico. Nótese que la medición incluye la vaina y llega hasta el contraste de transición entre el nervio óptico y el tejido circundante. B) Imagen en 2D donde aparecen las estructuras oculares y la vaina del nervio óptico. C) Ultrasonido de la órbita ocular de un paciente de 85años después del reemplazo de la válvula aórtica con un balance hídrico postoperatorio significativo. El diámetro del nervio óptico era de 6,4mm (normal 3,5-4,5mm). D) Imágenes en 2D del nervio óptico con papiledema (flecha) en un paciente con muerte cerebral para donación de órganos.
Fuente: adaptado con autorización de Denault et al.11.
Es importante señalar que el ultrasonido no reemplaza el criterio clínico y se debe utilizar como herramienta complementaria dentro de lo que se considera el estándar de atención. En medicina crítica, el ultrasonido se debe realizar después de la anamnesis y el examen físico. Además, el ultrasonido es mal monitor puesto que, como se explicó anteriormente, el término monitor viene del latín monere, que significa advertencia. Ninguna máquina de ultrasonido viene equipada con alarmas. Sin embargo, el ultrasonido es el complemento ideal para nuestros dispositivos de monitoreo. Por ejemplo, cuando la presión arterial desciende, la oximetría de pulso o la NIRS se reducen, y el diagnóstico diferencial es muy amplio. Con el ultrasonido se puede limitar rápidamente esa amplitud, descartando en segundos las condiciones potencialmente fatales. El enfoque que proponemos se ha publicado en revistas revisadas por pares9,10,16,36, tesis de doctorado39 y en un libro de texto11. La importancia y la pertinencia de interrogar el flujo venoso ha sido el tema reciente de un editorial12 y de varios artículos13,23,25,28-30. Sin embargo, es esencial y necesario un entrenamiento adecuado para poder utilizar con éxito el ultrasonido a la cabecera del paciente.
El ultrasonido se ha incorporado ya en el currículo de varias facultades de medicina. En la Universidad de Montreal y en la Universidad del Occidente de Ontario ya es parte del programa de formación en cuidado crítico y anestesiología. Los objetivos se basan en las guías canadienses y norteamericanas actuales40,41. Por último, hay que preguntar si el ultrasonido al lado de la cama del paciente modifica el desenlace. Los autores de estos artículos no consideran que lo haga. Hasta ahora no se ha demostrado que una técnica o un monitor modifiquen el desenlace, pero lo que sí ha demostrado modificar el manejo es la idoneidad de la persona para realizar el ultrasonido al lado de la cama del paciente y su capacidad para reconocer el «signo de alarma» en el monitor. Este impacto del ultrasonido a la cabecera del paciente se resume muy bien en el artículo de Royse et al.42.
El enfoque que nosotros proponemos no se ha validado formalmente en ensayos clínicos. Sin embargo, hay ya 4 ensayos clínicos que han demostrado la superioridad del ultrasonido al lado de la cama del paciente frente a la valoración convencional en estado de shock43,44 y dificultad respiratoria45. Un estudio canadiense realizado en 220pacientes críticos ha demostrado que el ultrasonido realizado al lado de la cama del paciente por clínicos competentes y limitado únicamente a la valoración cardíaca y de volumen se asoció con un mejor desenlace y una reducción de la mortalidad a los 28días44. Un estudio realizado en los Estados Unidos en 240pacientes traumatizados también demostró una reducción de la mortalidad, en particular en pacientes con neurotrauma manejados con el uso de ultrasonido al lado de la cama43. Un estudio llevado a cabo en Finlandia en 320pacientes con síntomas respiratorios hospitalizados por urgencias demostró que el ultrasonido al lado de la cama del paciente fue superior, para establecer un diagnóstico correcto, a la prueba estándar de diagnóstico realizada por sí sola. Esos hallazgos se reconfirmaron en un estudio italiano con 2.683pacientes46. Es probable que estudios ulteriores en los cuales se incorpore el ultrasonido realizado de la cabeza a los pies al lado de la cama del paciente demuestren las ventajas significativas de incorporar este examen en la práctica de la medicina. Por último, pese a todos los esfuerzos, en algunos pacientes no podrá obtenerse una ventana acústica adecuada. En esos pacientes tendrá que realizarse una ecocardiografía transesofágica para descartar condiciones que no se puedan abordar mediante el ultrasonido de superficie. En la actualidad, el ultrasonido básico forma ya parte de la formación en varios programas de anestesia. Se han publicado guías para el entrenamiento47 y se ha instituido un examen de certificación de la Junta Nacional de Ecocardiografía para anestesiólogos no cardíacos y médicos de cuidado crítico.
ConclusiónSe observa un creciente interés y evidencia acerca del papel importante del ultrasonido realizado al lado de la cama del paciente en el manejo de pacientes con inestabilidad hemodinámica, hipoxemia y oligoanuria, y en el paciente con estado neurológico alterado. Se han desarrollado métodos basados en el ultrasonido a la cabecera del paciente a fin de integrar esta importante modalidad diagnóstica como complemento para nuestra actual aproximación a estos pacientes.
FinanciamientoCon apoyo del Fondo Richard I. Kaufman en Anestesia y Cuidado Crítico y la Fundación del Montreal Heart Institute.
Conflicto de interesesEl Dr. Denault es consultor de CAE Healthcare y de la oficina de Medtronic, Masimo y Edwards.