La broncoscopia flexible es un procedimiento diagnóstico o terapéutico con baja incidencia de complicaciones (0,08-6,8%). El sangrado por biopsia transbronquial es una complicación rara (0-2,8% de los casos), suele ser leve y resuelve con medidas locales. No existe una definición clara de hemoptisis masiva y, por su baja incidencia, no hay guías de práctica clínica para el tratamiento de esta complicación, que puede ser catastrófica. Presentamos un caso de hemoptisis masiva durante la realización de una broncoscopia flexible más biopsia transbronquial y revisamos la literatura acerca del manejo intraoperatorio.
Flexible bronchoscopy is a diagnostic or therapeutic procedure with a low incidence of complications (0.08–6.8%). Bleeding after transbronchial biopsy is a rare complication (0-2.8% of the cases), usually resulting in minor bleeding that resolves with local measures. There is no clear definition of massive hemoptysis and due to the low incidence of this condition, there are no practical guidelines for the treatment of this complication that may be catastrophic. This case discusses the occurrence of massive hemoptysis during a transbronchial biopsy under flexible bronchoscopy, including a literature review on perioperative management.
La broncoscopia flexible es uno de los procedimientos más utilizados para el diagnóstico o tratamiento de enfermedades de vía aérea y parénquima pulmonar. La incidencia de complicaciones es 0,08-6,8%1-7.
El sangrado leve es una complicación que ocurre uno o 2días después del procedimiento y resuelve de forma espontánea, y es más frecuente en pacientes con tratamiento antiagregante, anticoagulante o con coagulopatía. El sangrado por biopsia transbronquial se presenta hasta en el 2,8% de los casos y suele resolver con medidas locales (solución salina helada)1.
Los anestésicos intravenosos o locales inhiben el reflejo tusígeno y aumentan el riesgo de depresión respiratoria; volúmenes bajos de sangrado en la vía aérea alteran la relación ventilación/perfusión y aumentan el riesgo de falla respiratoria hipoxémica8.
No existe una definición exacta de hemoptisis masiva con volúmenes entre 100 y 1.000ml en 24 h9-12; se ha propuesto que se base en el grado de funcionalidad comprometido por el sangrado11. Algunos autores incluyen en la definición el requerimiento de hemoderivados, falla respiratoria hipoxémica o inestabilidad hemodinámica, entre otros12-16.
Por su baja incidencia, no hay guías de práctica clínica sobre el manejo de hemoptisis masiva durante la realización de broncoscopia17. Se presenta un caso de hemoptisis masiva posterior a biopsia transbronquial con broncoscopia flexible.
Reporte de casoPaciente de 34 años, con antecedente de VIH, no adherente a tratamiento, en manejo por criptococosis meníngea. Sintomático respiratorio con signos de ocupación alveolar en imágenes de tórax y sospecha de infección por microorganismos oportunistas. Es programado para broncoscopia flexible, lavado broncoalveolar y biopsia transbronquial. Clase funcional II/IV (escala NYHA). Examen físico sin hallazgos positivos; tiempos de coagulación y hemograma normales.
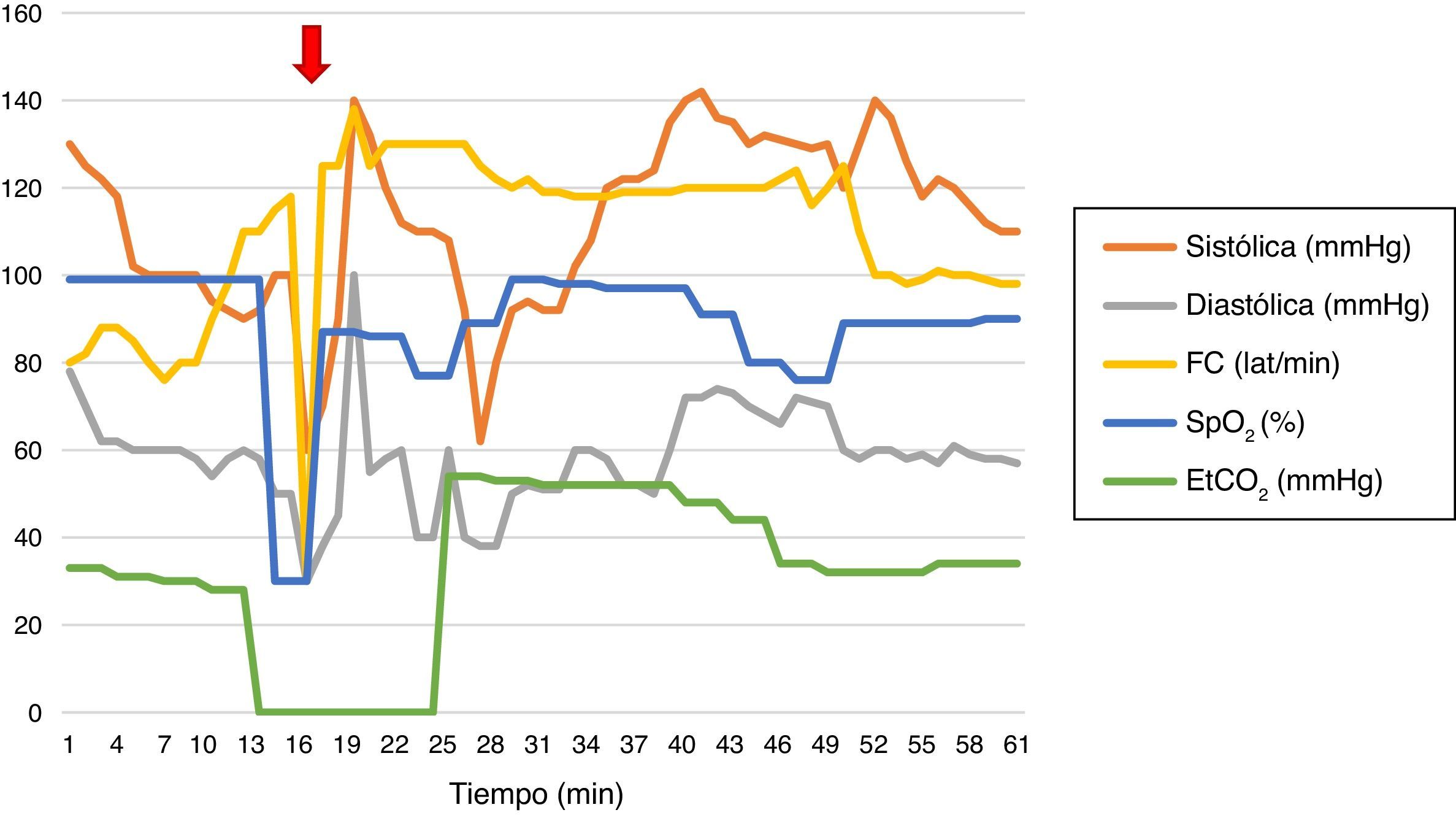
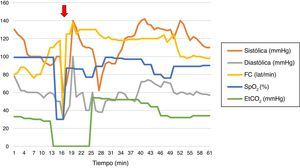
Monitorización básica y comportamiento hemodinámico (fig. 1). Inducción anestésica con fentanilo (150μg intravenosos [iv]), propofol (150mg iv) y succinilcolina (50mg iv); colocación de máscara laríngea # 5. Mantenimiento con fentanilo y propofol en infusión continua.
Comportamiento hemodinámico durante el procedimiento.
Flecha roja: inicio de sangrado posterior a biopsia transbronquial y paso de tubo de doble luz izquierdo.
EtCO2: CO2 al final de espiración; FC: frecuencia cardiaca; SpO2: saturación de pulso de oxígeno.
Fuente: Historia clínica (consentimiento informado).
Al realizar biopsia transbronquial (fig. 1), presenta sangrado con posterior desaturación, bradicardia e hipotensión. Se administra atropina (1mg iv) y etilefrina (3mg iv). Se canaliza línea arterial radial. Se pasa tubo de doble luz izquierdo a ciegas, con verificación con fluoroscopio; se aplican 2 cc al neumotaponador (la hemoptisis no permite visualización con fibrobroncoscopio); se inicia ventilación unipulmonar protectora (de acuerdo al peso del paciente) con posterior SpO2 77% y con FiO2 100%. Se realizan maniobras de reclutamiento alveolar, presión de vía aérea 57cm de H2O, se cambia a ventilación bipulmonar con volumen corriente 475ml, frecuencia respiratoria 20, relación inspiración:espiración 1:2, presión positiva al final de espiración 10cm de H2O, FiO2 100%, presión inspiratoria máxima y meseta 66 y 23cm de H2O, respectivamente, a pesar de relajación neuromuscular.
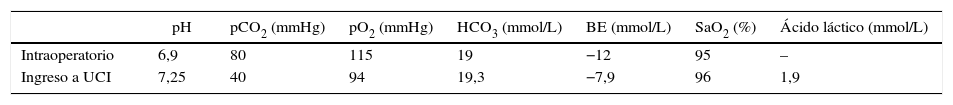
Se realiza fibrobroncoscopia sin encontrar sitio de sangrado. Hipotensión persistente; se inicia soporte vasopresor con noradrenalina con el que se logra estabilidad hemodinámica. Los gases arteriales (tabla 1) evidencian acidemia respiratoria, hemoglobina de 4,4g/dl y hematocrito de 13%. El cálculo aproximado de sangrado intraoperatorio es de 1.300 cc; se decide transfundir 2 unidades de glóbulos rojos. El tromboelastograma postransfusión reporta R: 6,1min,K: 3,6min, ángulo 46,5°, MA: 57,1mm, IC: −2,6, interpretado como normal. Por comorbilidades, se decide no transfundir otros hemoderivados.
Gases arteriales
| pH | pCO2 (mmHg) | pO2 (mmHg) | HCO3 (mmol/L) | BE (mmol/L) | SaO2 (%) | Ácido láctico (mmol/L) | |
|---|---|---|---|---|---|---|---|
| Intraoperatorio | 6,9 | 80 | 115 | 19 | −12 | 95 | – |
| Ingreso a UCI | 7,25 | 40 | 94 | 19,3 | −7,9 | 96 | 1,9 |
BE: base exceso; SaO2: saturación arterial de oxígeno; UCI: Unidad de Cuidados Intensivos.
Fuente: Historia clínica (consentimiento informado).
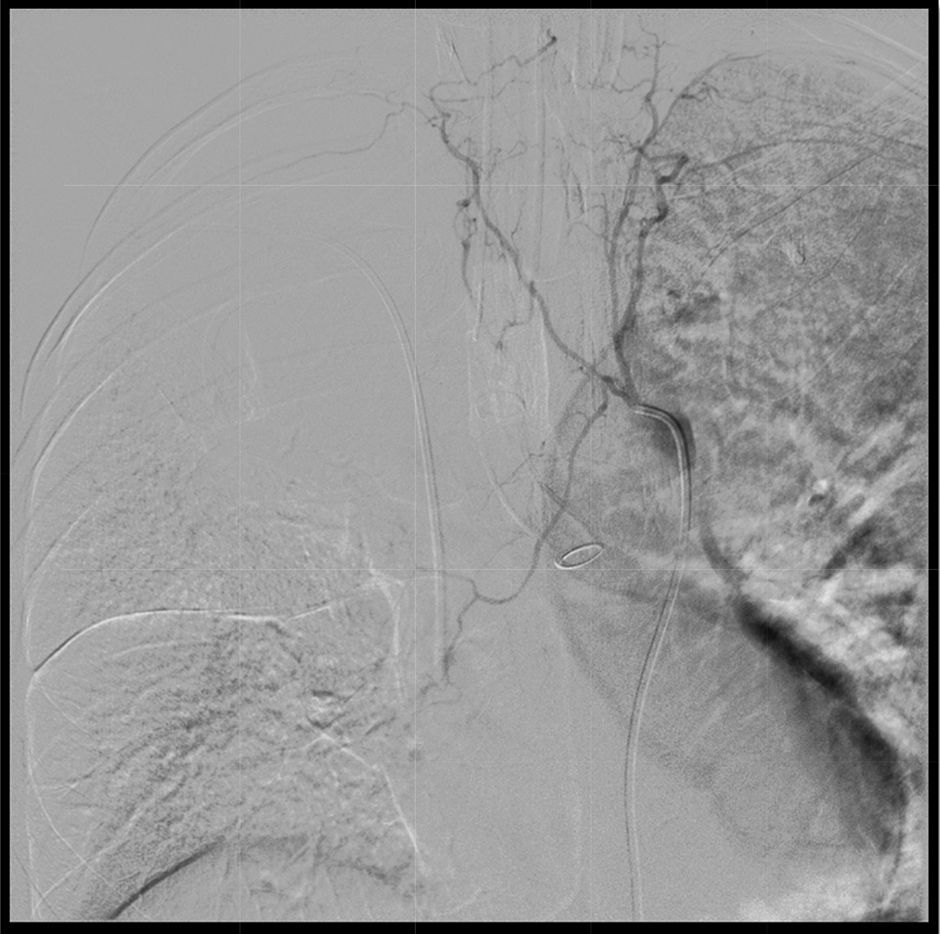
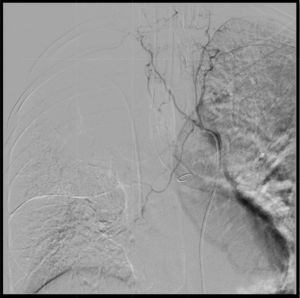
En Radiología Intervencionista se le realiza arteriografía en la que se evidencia vasoespasmo severo del sitio del sangrado, por lo que se difiere embolización (fig. 2).
Aortografía y arteriografía bronquial.
El estudio arteriográfico permite la cateterización selectiva de todos los troncos intercostales bilaterales por encima y por debajo del ángulo traqueobronquial izquierdo, sin obtener cateterización arterial bronquial, lo que indica vasoespasmo y coincide con el detenimiento del sangrado activo. Sangrado no visible en estudio aortográfico. Tubo de doble luz en bronquio fuente izquierdo.
Fuente: Historia clínica (consentimiento informado).
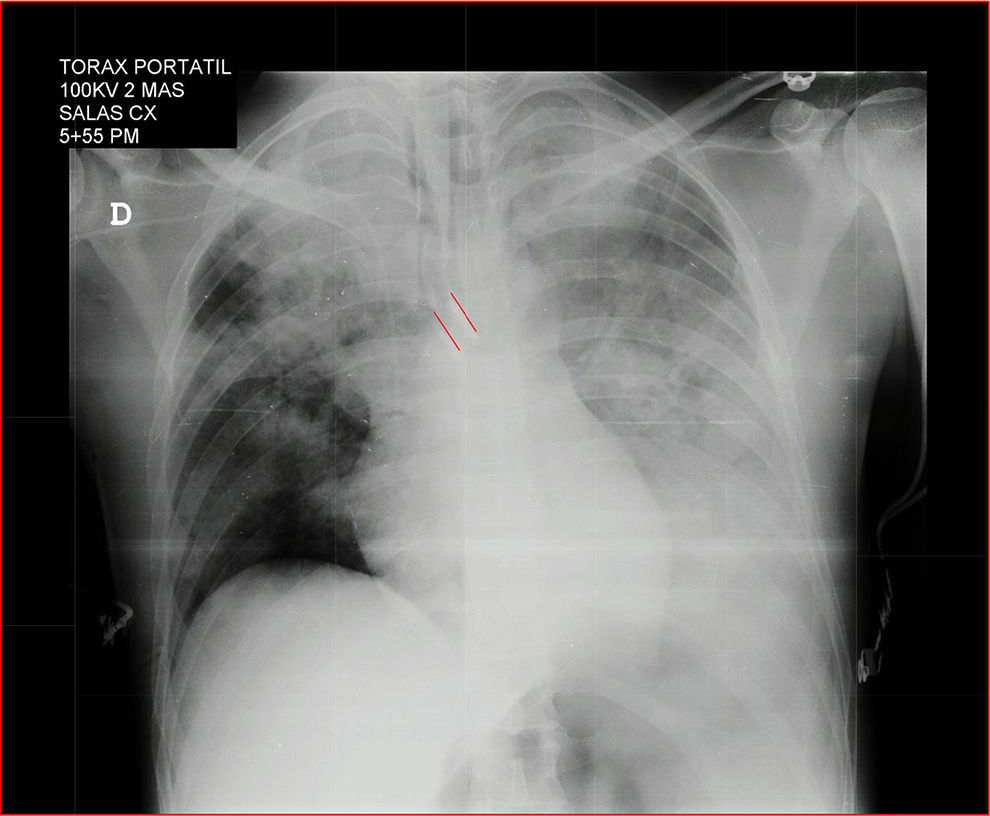
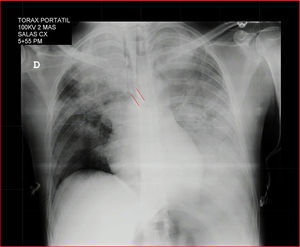
Una radiografía de tórax portátil confirma la posición del tubo de doble luz y el sangrado en el pulmón izquierdo (fig. 3). Se traslada a Unidad de Cuidados Intensivos con signos vitales estables, gases arteriales de control con mejoría de acidemia respiratoria, ácido láctico normal, tiempos de coagulación normales, hemoglobina de 10,8g/dl, hematocrito de 34%, recuento manual de plaquetas de 69.000, lo que indica posible hemodilución en el transoperatorio con MA normal y se decide diferir la transfusión de plaquetas.
Radiografía de tórax posterior al procedimiento.Se observan opacidades parenquimatosas de ocupación alveolar que comprometen casi la totalidad del pulmón izquierdo y, en el pulmón derecho, principalmente el lóbulo superior. Tubo endotraqueal selectivo en el bronquio fuente izquierdo (líneas rojas).
Fuente: Historia clínica (consentimiento informado).
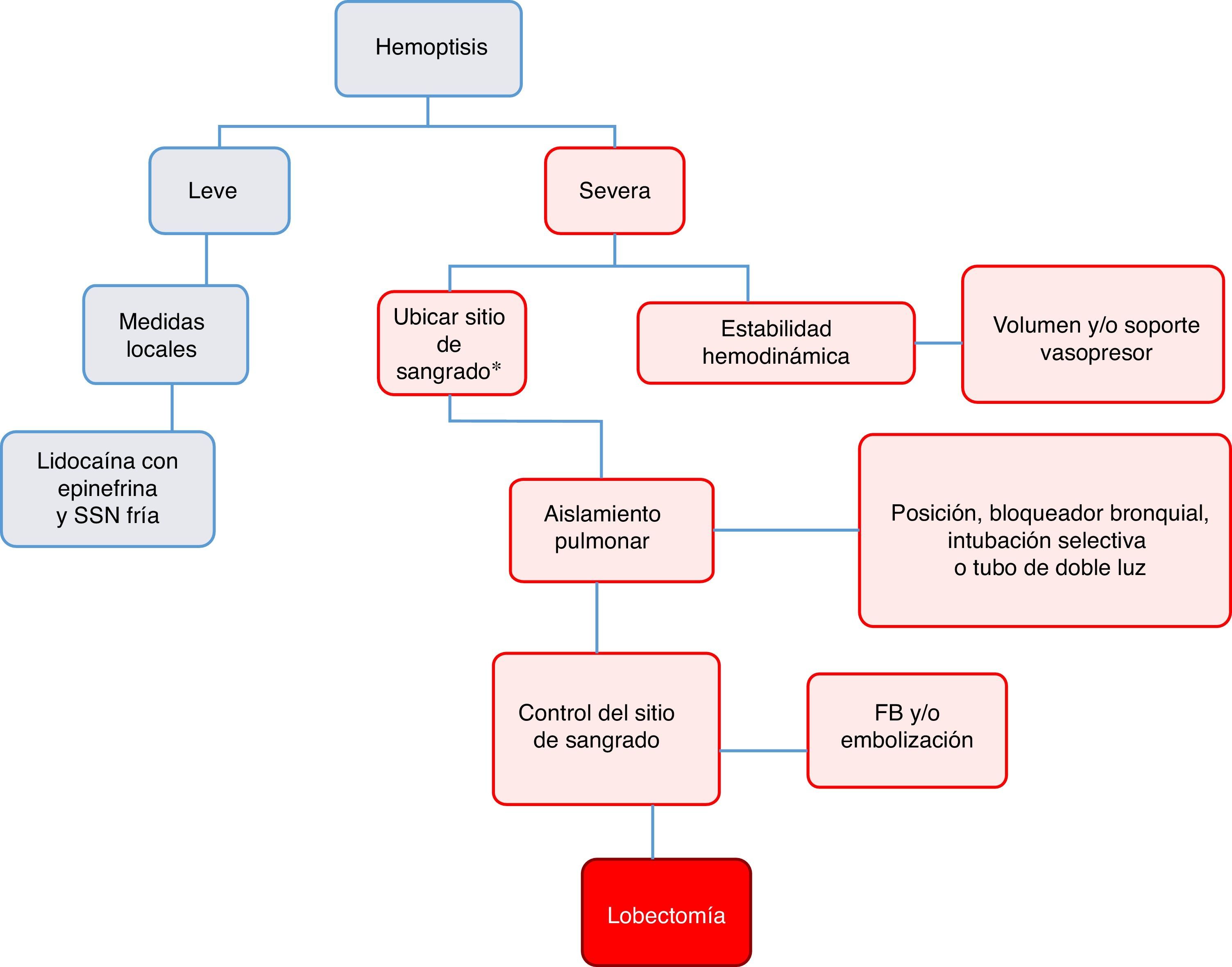
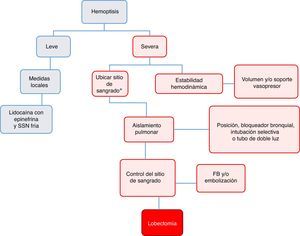
El manejo de la hemoptisis masiva durante la realización de fibrobroncoscopia tiene 3 objetivos: estabilidad hemodinámica, aislamiento pulmonar y control del sangrado17. La figura 4 muestra el algoritmo propuesto para este manejo.
Algoritmo propuesto para el manejo de hemoptisis masiva durante la realización de fibrobroncoscopia.
Hemoptisis leve: sin compromiso hemodinámico y sangrado autolimitado. Hemoptisis severa: produce inestabilidad hemodinámica, requerimiento de transfusión o falla respiratoria hipoxémica.
*Con fibrobroncoscopio (FB) rígido si se sospecha sangrado proximal o flexible si es distal.
SSN: solución salina normal.
Fuente: Autores.
Grandes volúmenes de sangre perdidos deben repletarse rápidamente con el fin de evitar isquemia tisular, choque irreversible y falla multiorgánica. El uso de cristaloides es la primera línea de tratamiento: los coloides no han demostrado mejores desenlaces en mortalidad, falla multiorgánica, número de días en Unidad de Cuidados Intensivos o en estancia hospitalaria, días de requerimiento de ventilación mecánica o de terapia de reemplazo renal18. En nuestro caso se utilizó lactato de Ringer porque la SSN isotónica se relaciona con hipercloremia y acidosis metabólica19,20.
La transfusión masiva inmediata debe considerarse en hemorragia no controlada e inestabilidad hemodinámica. Se define como el empleo de más de 10 unidades en las primeras 24 h, más de 4 unidades en una hora o reemplazo de más de 50% de volemia en 3 h21-23.
Los protocolos de transfusión masiva con estrategias transfusionales con proporciones fijas de GR/plasma fresco/plaquetas (1:1:1 o 2:1:1) no han demostrado un beneficio entre unos y otros23. En nuestro caso, solo fueron necesarias 2 unidades de GR: por el resultado del tromboelastograma no se administraron otros hemoderivados ni se activó el protocolo de transfusión masiva.
El uso de vasopresores como norepinefrina no tratan la causa del choque hipovolémico y disminuyen la perfusión tisular periférica. La decisión de su uso debe ser basada en la clínica de cada paciente.
Para ubicar el sitio de sangrado, los signos clínicos (sibilancias, agregados pulmonares, matidez a la percusión) pueden ser inespecíficos. El broncoscopio rígido tiene mayor diámetro, lo cual tiene como ventaja mayor poder de succión y mantenimiento de la vía aérea permeable: es de elección en caso de sangrado proximal de la vía aérea, pero no en sangrado periférico, razón por la cual el fibrobroncoscopio flexible es el ideal en estos casos; sin embargo, su menor calibre limita las posibles intervenciones terapéuticas e impide una adecuada succión en hemoptisis masiva16.
La posición del paciente del lado del pulmón sangrante tiene el objetivo de evitar que el sangrado llegue al pulmón sano y aumente el cortocircuito pulmonar, empeorando la relación ventilación/perfusión. En la literatura revisada no hay estudios que midan la utilidad de dicha maniobra y la prioridad debe ser asegurar la vía aérea16.
La intubación con tubo de doble luz es lo ideal para asegurar la vía aérea, ya que permite aislar el pulmón sangrante y ventilar el otro pulmón. El adecuado posicionamiento debe hacerse o verificarse bajo visión directa, lo cual requiere experiencia y es difícil de realizar con sangrado abundante de la vía aérea; además, varios intentos fallidos pueden aumentar la morbimortalidad del paciente16,24,25. En nuestro caso, fue posible la intubación con un tubo de doble luz en el primer intento. Otras posibilidades son intubación selectiva con tubo orotraqueal normal o el uso de bloqueador bronquial.
El control del sitio de sangrado debe ser oportuno para mejorar los desenlaces perioperatorios. El fibrobroncoscopio permite la visualización del sangrado: si es leve, permite controlarlo con aplicación continua de 50ml de agua fría (4°C)26. Otra posibilidad es la colocación de un bloqueador bronquial, aunque la literatura sobre la eficiencia es escasa y en un sangrado masivo es muy difícil su adecuado posicionamiento16,26-29. Las técnicas endobronquiales que usan dispositivos eléctricos (láser, crioterapia y argón plasma) podrían ser una opción para el tratamiento definitivo, aunque es difícil su implementación en hemoptisis masiva30.
En nuestro caso, no fue posible realizar una embolización guiada por arteriografía por presentar un severo vasoespasmo del sitio de sangrado (fig. 2), lo cual contraindica su realización. Esta técnica es una opción diagnóstica y terapéutica del sitio de sangrado31,32. Alrededor del 90% de las hemoptisis masivas provienen de las arterias bronquiales33; la embolización selectiva de estas arterias controla el sangrado hasta en un 90% de los casos34,35.
La cirugía de urgencia (lobectomía o segmentectomía) es la última opción para el control de la hemoptisis severa. La mortalidad puede llegar hasta el 25%, aunque suele ser menor con resecciones más pequeñas36.
Por último, nosotros no utilizamos terapia antifibrinolítica (ácido tranexámico) para el control de hemoptisis. La literatura es escasa, no es comparable y tiene un bajo nivel de evidencia37. Hay evidencia insuficiente para saber si la terapia antifibrinolítica debe ser usada en el tratamiento de hemoptisis de cualquier causa, aunque algunos estudios indican una reducción de la duración del sangrado38.
En conclusión, el manejo de la hemoptisis masiva debe ser multidisciplinario (anestesiólogo, neumólogo intervencionista, cirujano de tórax y radiólogo intervencionista). Los 3pilares del tratamiento se basan en lograr una estabilidad hemodinámica, asegurar una adecuada ventilación del pulmón sano y controlar el sitio del sangrado (fig. 4). Si bien la incidencia de esta complicación es baja, puede tener consecuencias fatales y se requieren más estudios para su adecuado tratamiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoNinguno.
Conflicto de interesesPara este trabajo no se tienen conflictos de intereses.