El síndrome X frágil es una forma hereditaria de retraso mental con una afectación de tejido conectivo que produce prolapso de la válvula mitral. Las manifestaciones más frecuentes del síndrome X frágil son la dificultad en el aprendizaje, alteraciones morfológicas orofaciales y macroorquidismo.
La utilidad de la monitorización hemodinámica avanzada para terapia dirigida por objetivos es cada vez mayor durante los procedimientos neuroquirúrgicos. La monitorización no invasiva de gasto cardiaco puede considerarse una nueva alternativa en los procedimientos neuroquirúrgicos emergentes.
Nuestro objetivo fue detectar los cambios hemodinámicos en un paciente sindrómico X frágil —que suelen presentar patología cardiovascular, como prolapso mitral y dilatación de la raíz aórtica— intentando obtener los mejores resultados neurológicos intraoperatorios y postoperatorios sin deteriorar la función cardiovascular individualizada por una terapia guiada por objetivos. Este tipo de monitorización no invasiva permite desarrollar la intervención quirúrgica sin demora, aportando gran información del estado hemodinámico. Este síndrome es relevante debido a sus implicaciones anestésicas y a los pocos casos publicados hasta la fecha.
Fragile-X syndrome is an inherited form of mental retardation with a connective tissue component involving mitral valve prolapse. The most frequent manifestations of fragile-X syndrome are learning disability, orofacial morphological alterations and macroorchidism.
The usefulness of advanced haemodynamic monitoring for goal-directed therapy is increasingly high during neurosurgical procedures. Non-invasive cardiac output monitoring may be considered as a new alternative for emergency neurosurgical procedures.
Our aim was to detect hemodynamic changes in a syndromic fragile-X patient, given the usual concomitant presentation of cardiovascular disease, such as mitral valve prolapse and dilated aortic root, in an attempt at obtaining the best intraoperative and postoperative neurological outcomes without worsening cardiovascular function, by means of individualised intra-operative goal directed therapy. This type of non-invasive monitoring allows surgery to proceed without delay and provides excellent information of the hemodynamic status.
This syndrome is relevant due to its anaesthetic implications and the paucity of cases published to date.
El síndrome X frágil (SXF) es la causa de retraso mental hereditaria más frecuente1,2, constituyendo el 30% de los mismos3 y asociando una afectación del tejido conectivo que determina un prolapso de la válvula mitral (PVM) en la mayoría de los sujetos4. El objetivo de nuestro caso clínico es individualizar el manejo anestésico en este peculiar síndrome, determinado por el difícil control de la vía aérea y la asociación de patología cardiovascular. Se realizó una monitorización no invasiva de gasto cardiaco durante la craneotomía emergente, con la intención de reducir la morbilidad mediante una terapia guiada por objetivos no demorando el inicio de la cirugía, ya que solo se necesita un dispositivo colocado en el dedo para obtener toda la información relevante acerca del estado hemodinámico.
Caso clínicoPaciente de 38años de edad con SXF, retraso mental severo y encefalopatía epiléptica refractaria. Tras una crisis tónico-clónica presentó un traumatismo craneoencefálico con hematoma subdural agudo frontoparietal izquierdo realizándose una craneotomía emergente.
Tras monitorización mediante presión arterial (PA), electrocardiograma, pulsioximetría, índice biespectral (BIS) y monitor no invasivo de gasto cardiaco (GC) Nexfin® (BMEYE, Amsterdam, Países Bajos), se administraron por acceso venoso periférico 2g de cefazolina y 5mg de midazolam i.v. por escasa colaboración del paciente. Se realizó una inducción anestésica con propofol 120mg, remifentanilo 0,1μg/kg/min y 50mg de rocuronio, permitiendo una intubación endotraqueal exitosa mediante el videolaringoscopio Glidescope®. Se instauró la ventilación mecánica y se canalizó acceso venoso yugular interno derecho bajo control ecográfico.
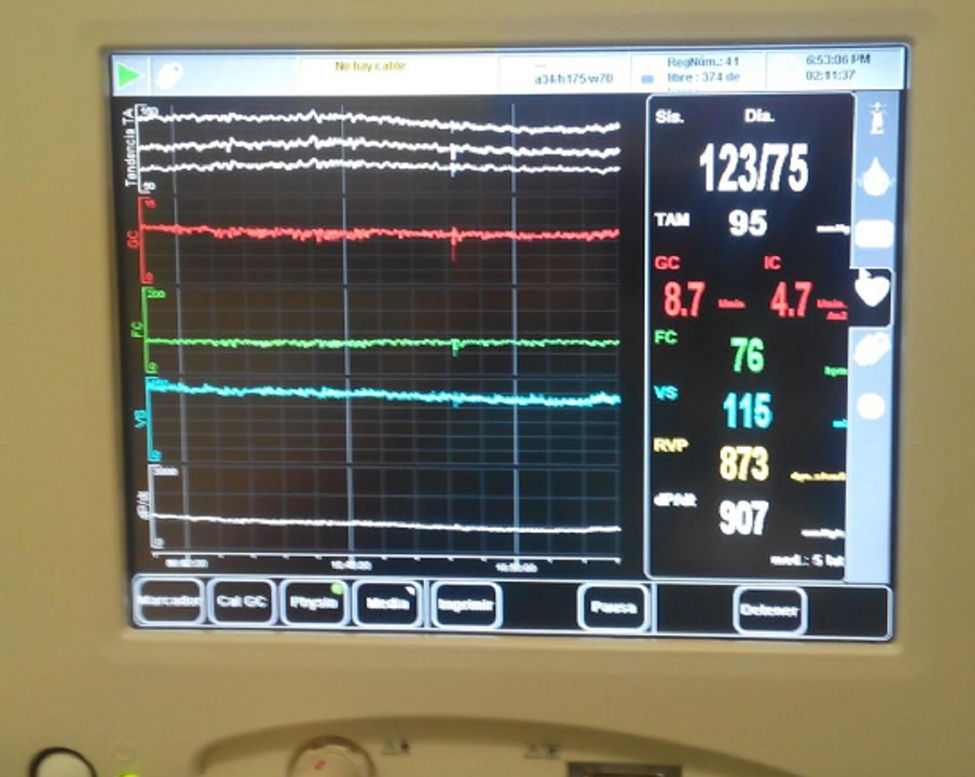
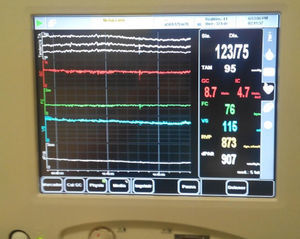
Para el mantenimiento anestésico se emplearon propofol y remifentanilo. Se precisaron 25g de manitol y 20mg de furosemida para disminuir la presión intracraneal (PIC), que fue monitorizada mediante colocación de un sensor de PIC subdural (valores iniciales 22mmHg y tras evacuación del hematoma de 4mmHg). Durante el periodo intraoperatorio realizamos una terapia guiada por objetivos (TGO) en función de los valores de GC obtenidos, realizándose un aporte inicial de 1.000ml de cristaloides y total de 4.000ml por presentar signos de hipovolemia subsidiaria de responder a fluidoterapia. Se precisó una perfusión de noradrenalina hasta 0,1μg/kg/min para normalizar las cifras iniciales de resistencia vascular sistémica notablemente bajas y mantener valores de PA media en torno a 90mmHg, favoreciendo una adecuada perfusión cerebral (fig. 1). Se mantuvo estable hemodinámicamente, retirándose la perfusión de aminas vasoactivas y trasladándose a la unidad de cuidados intensivos correctamente sedoanalgesiado y conectado a ventilación mecánica.
DiscusiónEl SXF, descrito por Martin y Bell en 19433, presenta unas características físicas y conductuales típicas1. La prevalencia en varones (1:3.600) es mayor que en mujeres (1:8.000) al estar vinculado al cromosomaX1. Se produce por una expansión anormal del triplete citosina-guanina-guanina (CGG) en el gen Fragile X Mental Retardation 1 gene (FMR1) del cromosomaX (Xq27.3) bloqueando la producción de la proteína del gen FMR1 (FMRP)5.
El fenotipo característico de este síndrome puede presentar importantes implicaciones anestésicas, entre otros hallazgos, por las alteraciones craneofaciales. Entre las características físicas encontramos macrocefalia3,6, hipertelorismo, estrabismo, prognatismo3, pabellones auriculares grandes y despegados, macroorquidia pospuberal, etc.7.
Presentan una mala implantación dental, abrasiones de las superficies dentales, así como un aumento en las dimensiones de las coronas dentales que producen discrepancias hueso-dentales graves8, limitando la apertura oral y dificultando la colocación del tubo endotraqueal.
Nuestro paciente presentaba una mala implantación dental, limitando a 3cm la apertura oral, así como prognatismo, por lo que ante la sospecha de vía aérea difícil decidimos utilizar el videolaringoscopio Glidescope®9. De esta forma se realizó una intubación endotraqueal exitosa con el mínimo estímulo, evitando un aumento de la presión intracraneal.
Los pacientes con SXF presentan una excesiva laxitud articular7, pie plano, hernias, pectus excavatum y escoliosis. La colocación del paciente en quirófano protegiendo los puntos de apoyo debe ser apropiada, con el objetivo fundamental de evitar dislocaciones articulares y compresión gonadal4.
Un 80-90% de los pacientes con SXF presentan un retraso mental moderado-severo3. El autismo, la hiperactividad, la agitación y la ansiedad también son frecuentes3, por lo que normalmente precisan una adecuada sedación previa a la inducción anestésica por escasa cooperación.
Del 15 al 20%3 de los casos presentan crisis epilépticas parciales complejas y generalizadas, tónico-clónicas, frecuentemente de curso benigno3, desapareciendo antes de los 20años, no ocurriendo así en el caso expuesto. Una correcta premedicación puede disminuir el estrés quirúrgico elevando el umbral convulsivo en el periodo perioperatorio.
Desde el punto de vista cardiovascular, el 80% de los casos puede asociarse un PVM sin haber presentado episodios de dolor torácico ni palpitaciones4, pudiendo ocasionar cuadros de arritmias intraoperatorias4. Ocasionalmente presentan una dilatación de la raíz aórtica4, por lo que sería recomendable una adecuada monitorización para permitir una TGO, pues condiciona unos mejores resultados en cirugía mayor10. Al tratarse de una emergencia vital trasladada de otro hospital, no pudimos confirmar la existencia de un PVM, pero dada su elevada incidencia y el hecho de que la sintomatología se exacerba por la inducción anestésica, conllevando al colapso cardiovascular11, decidimos realizar una monitorización no invasiva del gasto cardiaco.
El principal objetivo en el manejo anestésico fue evitar cualquier reducción en el volumen del ventrículo izquierdo durante la sístole para reducir el prolapso mitral11.
La reducción en el retorno venoso, en las resistencias vasculares, la taquicardia y el aumento en la contractilidad son pobremente toleradas11. Durante la anestesia general se recomienda el uso de vasoconstrictores para mantener la PA y betabloqueantes de corta acción para el control de la frecuencia cardíaca, conservando los volúmenes telediastólico y sistólico para controlar el prolapso mitral11.
En los casos asociados a insuficiencia mitral el manejo difiere, ya que el mantenimiento de frecuencias cardiacas más elevadas reduce el tiempo diastólico disminuyendo el volumen de regurgitación12.
La variación de la presión de pulso (VPP) y la variación del volumen sistólico (VVS) son valores dinámicos predictores de la respuesta a fluidos en pacientes bajo ventilación mecánica. Habitualmente se miden de forma invasiva a través de la señal obtenida de la curva de PA. El monitor no invasivo de GC empleado proporciona una medida continua de la PA mediante un sensor colocado en el dedo13 basado en el desarrollo de una descarga pulsátil de las paredes arteriales del dedo utilizando un manguito inflable con un pletismógrafo fotoeléctrico incorporado13.
La medición de la VVS y la VPP sin catéter intraarterial es una ventaja para la cirugía emergente como la neuroquirúrgica, donde la demora del inicio de la intervención condiciona peores resultados clínicos. La TGO proporciona una detección precoz de los cambios fisiopatológicos ajustando el manejo hemodinámico intraoperatorio de forma individualizada a cada paciente10. La medición de la PA invasiva con catéter intraarterial13 se considera el gold standard14. La medición no invasiva de los índices dinámicos predictores de la respuesta a fluidos ha mostrado una alta especificidad y sensibilidad13, confiriendo una gran seguridad y comodidad15. Este sistema se ha mostrado superponible a la medición no invasiva de la PA en pacientes bajo anestesia general con estabilidad hemodinámica con la ventaja de ofrecer la medición de la PA latido a latido14. Sin embargo, existe controversia en cuanto a su superponibilidad con el monitor de termodilución transpulmonar PICCO® para medición del gasto cardiaco15,16.
En resumen, pretendemos exponer el manejo anestésico de los pacientes con SXF dada su baja incidencia y escasos reportes recogidos en la literatura anestésica. Consideramos el monitor no invasivo de GC una alternativa novedosa para los procedimientos neuroquirúrgicos emergentes y en pacientes con cardiopatía, proporcionando un acortamiento de tiempo anestésico y unos parámetros fiables para realizar una TGO. Por otro lado, consideramos el empleo de un videolaringoscopio como la primera opción en el manejo de una vía aérea previsiblemente difícil donde la intubación endotraqueal podría conllevar a aumentos importantes de PIC.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNuestro trabajo no ha sido financiado.
Conflicto de interesesNo existen conflictos de intereses.