La N-acetilcisteína se ha propuesto para el tratamiento de COVID-19 gracias a sus efectos mucolítico, antioxidante y antiinflamatorio. El presente estudio tiene como objetivo evaluar su efecto en pacientes ingresados con COVID-19, en términos de mortalidad.
Material y métodosEstudio de cohorte retrospectivo unicéntrico. Se incluyeron todos los pacientes ingresados por COVD-19 entre marzo y abril de 2020 en nuestro hospital.
ResultadosUn total de 378 pacientes fueron incluidos; de ellos, 196 (51,9%) fueron hombres, la edad media fue de 73,3±14,5 años. Un total de 199 (52,6%) pacientes recibieron tratamiento con N-acetilcisteína. Más del 70% tuvieron tos, fiebre y/o disnea. La mortalidad hospitalaria global fue del 26,7%. Un análisis multivariante mediante regresión logística identificó la edad de los pacientes [mayores de 80 años; OR: 8,4 (IC95%: 3-23,4)], una afectación radiológica moderada o grave medida por la escala RALE [OR: 7,3 (IC95%: 3,2-16,9)], el consumo de tabaco [OR: 2,8 (IC95%: 1,3-6,1)] y arritmia previa [OR: 2,8 (IC95%: 1,3-6,2)] como factores de riesgo que se asociaron independientemente con la mortalidad durante el ingreso. El tratamiento con N-acetilcisteína fue identificado como factor protector [OR: 0,57 (IC95%: 0,31-0,99)]. El asma podría representar asimismo un factor protector de mortalidad, aunque en el presente estudio no alcanza significación estadística [OR: 0,19 (IC95%: 0,03-1,06)].
ConclusionesLos pacientes con COVID-19 tratados con N-acetilcisteína presentaron una menor mortalidad y mejor evolución en nuestro estudio. Futuros estudios prospectivos o ensayos clínicos aleatorizados deben confirmar el papel de la N-acetilcisteína en pacientes con COVID-19.
N-acetylcysteine has been proposed for the treatment of COVID-19 thanks to its mucolytic, antioxidant and anti-inflammatory effects. Our aim is to evaluate its effect on patients admitted with COVID-19 in mortality terms.
Material and methodsRetrospective single-center cohort study. All patients admitted to our hospital for COVID-19 from March to April 2020 have been considered.
ResultsA total of 378 patients were included, being 196 (51.9%) men, with an average age of 73.3±14.5 years. The 52.6% (199) received treatment with N-acetylcysteine. More than 70% presented coughs, fever, and/or dyspnea. The global hospital mortality was 26.7%. A multivariate analysis through logistic regression identified the age of patients [older than 80; OR: 8.4 (95% CI: 3–23.4)], a moderate or severe radiologic affectation measured by the RALE score [OR: 7.3 (95% CI: 3.2–16.9)], the tobacco consumption [OR: 2.8 (95% CI: 1.3–6.1)] and previous arrhythmia [OR 2.8 (95% CI: 1.3–6.2)] as risk factor that were independently associated with mortality during the admission. The treatment with N-acetylcysteine was identified as a protective factor [OR: 0.57 (95% CI: 0.31–0.99)]. Asthma also seems to have a certain protective factor although it was not statistically significant in our study [OR: 0.19 (95% CI: 0.03–1.06)].
ConclusionsPatients with COVID-19 treated with N-acetylcysteine have presented a lower mortality and a better evolution in this study. Future prospective studies or randomized clinical trials must confirm the impact of N-acetylcysteine on COVID-19 patients.
Desde noviembre de 2019 el mundo se enfrenta a una pandemia causada por el coronavirus denominado SARS-CoV-2. Se trata de un betacoronavirus que utiliza la enzima convertidora de angiotensina 2 (ECA2) para entrar en las células mediante su interacción con la proteína S1. Los puentes disulfuro que se forman en dicha interacción son fundamentales, así como el equilibrio entre los grupos disulfuros (SS) y los tioles (-SH)2.
En las formas más graves de COVID-19 se produce una liberación excesiva de mediadores inflamatorios como interleucina (IL)-1β, IL-2, IL-6, factor de necrosis tumoral (TNF)-α y otros, lo que se conoce como «tormenta de citoquinas»3,4. Esto conduce a una liberación masiva de radicales libres, con el desarrollo de estrés oxidativo y disminución de los niveles de glutatión, jugando un papel importante en el daño tisular5,6. Así, se han propuesto como opciones terapéuticas sustancias con efecto antioxidante: ácido ascórbico, zinc, vitamina D o N-acetilcisteína (NAC)7-9.
La NAC es un precursor del glutatión derivado de la L-cisteína con acción antioxidante, y con amplia experiencia en otras patologías como la enfermedad pulmonar obstructiva crónica. Se ha propuesto su uso en COVID-19 gracias a sus múltiples efectos. Su acción mucolítica se debe a su capacidad para romper los puentes disulfuro de la matriz glicoproteica. El efecto antioxidante es gracias a su capacidad para replecionar los niveles de tioles y glutatión, así como para neutralizar radicales libres10. Por último, posee acción antiinflamatoria al ser capaz de inhibir citoquinas como la IL-6 y de promover la proliferación linfocitaria (que es inversamente afectada por el estrés oxidativo y los bajos niveles de glutatión)11,12.
España ha sido uno de los países más afectados por la pandemia durante la primera ola (del 31 enero al 21 de junio de 2020). Los peores meses fueron marzo y abril, también en nuestro centro13. Ante la ausencia de un tratamiento específico para la COVID-19, uno de los tratamientos adyuvantes propuestos fue la NAC a dosis de 1.200mg/día vía oral. El objetivo del presente estudio es comprobar si el uso de la NAC tuvo un impacto positivo en la evolución de los pacientes ingresados, así como en reducir la mortalidad por COVID-19.
Pacientes y métodosDiseñoSe trata de un estudio observacional de cohorte retrospectivo.
PacientesSe incluyeron los pacientes adultos ingresados por enfermedad COVID-19 confirmada mediante PCR de exudado nasofaríngeo, entre el 9 de marzo y el 30 de abril de 2020 en el Hospital General La Mancha Centro. Se excluyeron aquellos pacientes que recibieron esquemas de tratamiento con bajo número de pacientes (<10); esto incluyó fármacos de uso restringido como los inhibidores de IL-1 (anakinra) o IL-6 (tocilizumab), lopinavir/ritonavir, emtricitabina/tenofovir, aféresis. También se excluyeron los pacientes tratados con dexametasona (su uso comenzó a finales de abril) y/o calcifediol por su escaso número.
Procedimiento/recogida de datosLos pacientes se trataron según el protocolo vigente del centro, existiendo varios esquemas terapéuticos: hidroxicloroquina±azitromicina±heparina de bajo peso molecular±glucocorticoides±NAC. La elección de tratamiento para NAC fue a criterio del médico responsable de acuerdo con su juicio clínico. La dosis utilizada para NAC fue 1.200mg/día vía oral repartidos en dos dosis de 600mg. Se recogieron las principales variables (incluyendo tratamientos recibidos y mortalidad) de la historia clínica electrónica y los registros electrónicos de Radiología, Farmacia y Laboratorio.
Se utilizó la escala Radiographic Assessment of Lung Edema (RALE) score para medir el grado de afectación pulmonar en la radiografía de tórax: 0 puntos (normal), 1-2 (afectación leve), 3-6 (moderada) y 7-8 (grave).
Análisis estadísticoSe ha realizado un análisis descriptivo de todas las variables incluidas en el estudio; las variables cualitativas se han descrito mediante frecuencias absolutas y relativas, mientras que las variables cuantitativas se han descrito mediante media±desviación estándar (DE) o mediana±rango intercuartílico (RIC) según la distribución de la variable. Para comprobar la normalidad de las variables se han utilizado métodos estadísticos (test de Kolmogorov-Smirnov o Shapiro-Wilks) y métodos gráficos (histogramas).
Para la comparación entre los grupos (NAC vs. no NAC y muerte vs. alta) se ha realizado un análisis bivariante, se han utilizado los test χ2 (o el exacto de Fisher) para las variables cualitativas y los test de t de Student o U de Mann-Whitney para las variables cuantitativas según la normalidad de la variable.
Finalmente se ha realizado un análisis multivariante mediante regresión logística para identificar los posibles factores de riesgo y factores protectores de forma independiente. Se han calculado los odd ratio (OR) y sus intervalos de confianza al 95% (IC95%) para las variables significativas. Para la construcción del modelo final se han utilizado las variables significativas en el análisis multivariante, variables cercanas a la significación estadística (p<0,200) y variables de ajuste o clínicamente relevantes. Una vez construido este modelo mayor, se fueron eliminando variables de dicho modelo que no alcanzaban la significación estadística y no eran variables de ajuste, modificadoras de efecto o confusoras. De la misma manera se realizó un modelo de regresión de Cox, calculándose hazard ratios (HR) y sus IC95%.
Todos los cálculos se han realizado mediante el programa SPSS versión 18. Se ha tomado el valor p<0,05 como estadísticamente significativo.
Aspectos éticosEl estudio se ha realizado atendiendo a los principios éticos de la Declaración de Helsinki, y con la aprobación del Comité de Ética e Investigación Clínica del Hospital General La Mancha Centro (ref. 147-C).
ResultadosCaracterísticas generales de los pacientes y comparación entre pacientes con o sin N-acetilcisteínaUn total de 378 pacientes fueron incluidos. El porcentaje de hombres fue ligeramente superior con 199 (52,6%), la edad media fue de 73,3±14,5 años. Los síntomas más habituales fueron los respiratorios con >70% de tos, fiebre y/o disnea, seguidos de la astenia (34,4%).
La mitad de los pacientes (52,6%) recibieron tratamiento con NAC (n=199). Cuando se compararon sus características con el grupo que no recibió NAC, se apreció que eran similares y sin diferencias estadísticamente significativas (tabla 1).
Principales características de los pacientes incluidos en el estudio y comparación entre pacientes que recibieron NAC y pacientes que no recibieron NAC
| Global(n=378) | Sin NAC(n=179) | Con NAC(n=199) | p | |
|---|---|---|---|---|
| Edad media±DE (rango) | 73,3±14,5 (22-100) | 73,9±15,4 | 72,8±13,7 | 0,482 |
| Sexo | ||||
| Hombre | 196 (51,9%) | 89 (49,7%) | 107 (53,8%) | 0,432 |
| Mujer | 182 (48,1%) | 90 (50,3%) | 92 (46,2%) | |
| Institucionalizado | 51 (13,5%) | 21 (11,7%) | 30 (15,1%) | 0,342 |
| Comorbilidades | ||||
| Hipertensión arterial | 246 (65,3%) | 122 (68,5%) | 124 (62,3%) | 0,205 |
| Dislipemia | 144 (38,1%) | 66 (36,9%) | 78 (39,2%) | 0,642 |
| Diabetes | 124 (32,8%) | 52 (29,1%) | 72 (36,2%) | 0,140 |
| OCFA | 40 (10,6%) | 21 (11,7%) | 19 (9,5%) | 0,491 |
| Asma | 24 (6,3%) | 12 (6,7%) | 12 (6%) | 0,789 |
| Cardiopatía isquémica | 49 (13%) | 22 (12,3%) | 27 (13,6%) | 0,712 |
| Arritmia previa | 51 (13,5%) | 24 (13,4%) | 27 (13,6%) | 0,635 |
| Deterioro cognitivo | 65 (17,2%) | 34 (19%) | 31 (15,6%) | 0,379 |
| ETEV previa | 39 (10,3%) | 23 (12,8%) | 16 (8%) | 0,125 |
| Insuficiencia renal | 54 (14,3%) | 31 (17,3%) | 23 (11,6%) | 0,110 |
| Tumor sólido | 45 (11,9%) | 26 (14,5%) | 19 (9,5%) | 0,136 |
| Tumor hematológico | 9 (2,4%) | 6 (3,3%) | 3 (1,5%) | 0,605 |
| Hábito tabaco | ||||
| No fumador | 288 (76,2%) | 138 (77,1%) | 150 (75,4%) | 0,864 |
| Fumador activo | 80 (21,2%) | 37 (20,7%) | 43 (21,6%) | |
| Exfumador | 10 (2,6%) | 4 (2,2%) | 6 (3%) |
DE: desviación estándar; ETEV: enfermedad tromboembólica; NAC: N-acetilcisteína; OCFA: obstrucción crónica al flujo aéreo.
En cuanto a la gravedad radiológica al ingreso y el oxígeno máximo requerido, se observa que los pacientes con o sin tratamiento con NAC fueron similares. La mortalidad global se situó en un 26,7%, observándose una tendencia a una mayor mortalidad en el grupo que no recibió NAC (31,3% vs. 22,6%; p=0,057). Sí se aprecian diferencias estadísticamente significativas entre los 8 esquemas terapéuticos utilizados entre ambos grupos (tabla 2). No hubo diferencias en los análisis de sangre realizados.
Características clínicas, hallazgos radiológicos y esquemas terapéuticos y comparativa entre los pacientes que recibieron NAC y los que no
| Global(n=378) | Sin NAC(n=179) | Con NAC(n=199) | p | |
|---|---|---|---|---|
| Días ingreso (mediana±RIC) | 7±4 | 6±5 | 7±5 | 0,002 |
| Rx tórax | ||||
| Normal | 79 (21,5%) | 43 (24,7%) | 36 (18,6%) | 0,274 |
| Leve (RALE score 1-2) | 163 (44,3%) | 78 (44,8%) | 85 (43,8%) | |
| Moderada (RALE score 3-6) | 111 (30,2%) | 45 (25,9%) | 66 (34%) | |
| Grave (RALE score 7-8) | 15 (4,1%) | 8 (4,6%) | 7 (3,6%) | |
| No realizada | 10 | 5 | 5 | - |
| Oxígeno máximo requerido | ||||
| No precisó | 38 (10,1%) | 21 (11,7%) | 17 (8,6%) | 0,100 |
| Gafas nasales | 258 (68,3%) | 112 (62,7%) | 146 (73,3%) | |
| Mascarilla facial tipo Venturi | 26 (6,8%) | 14 (7,8%) | 12 (6%) | |
| Mascarilla facial con reservorio | 51 (13,5%) | 30 (16,7%) | 21 (10,6%) | |
| VMNI | 5 (1,3%) | 2 (1,1%) | 3 (1,5%) | |
| Esquemas tratamiento | ||||
| Hidroxicloroquina | 15 (4%) | 15 (8,4%) | 0 | <0,001 |
| HBPM | 42 (11,1%) | 25 (14%) | 17 (8,5%) | |
| Hidroxicloroquina+azitromicina | 10 (2,6%) | 10 (5,6%) | 0 | |
| Hidroxicloroquina+HBPM | 45 (11,9%) | 23 (12,8%) | 22 (11,1%) | |
| Glucocorticoides+HBPM | 45 (11,9%) | 13 (7,3%) | 32 (16,1%) | |
| Hidroxicloroquina+azitromicina+HBPM | 48 (12,7%) | 18 (10,1%) | 30 (15,1%) | |
| Hidroxicloroquina+glucocorticoides+HBPM | 12 (3,2%) | 12 (6,7%) | 0 | |
| Todos | 161 (42,6%) | 63 (35,2%) | 98 (49,2%) | |
| Ingreso en Unidad de Cuidados Intensivos | 4 (1,1%) | 1 (0,6%) | 3 (1,5%) | 0,625 |
| Fallecimiento en el hospital | 101 (26,7%) | 56 (31,3%) | 45 (22,6%) | 0,057 |
HBPM: heparina de bajo peso molecular; NAC: N-acetilcisteína; RALE: Radiographic Assessment of Lung Edema; RIC: rango intercuartílico; Rx: radiografía; VMNI: ventilación mecánica no invasiva.
La mortalidad intrahospitalaria fue un 26,7%, con mayor edad media de los pacientes fallecidos respecto a los dados de alta (81,3±11,5 vs. 70,4±14,5 años, p<0,001).
En cuanto a la radiografía al ingreso se observa mayor mortalidad a mayor afectación radiológica, siendo la mortalidad <20% en los pacientes con radiografía normal o afectación leve, y aumentando al 41,4% en los pacientes con RALE moderada y al 80% en los pacientes con afectación grave. También se apreció mayor mortalidad a mayor requerimiento máximo de oxígeno, con un 2,6% de mortalidad en los pacientes que no precisaron oxígeno, 17,1% en pacientes con gafas nasales, 50% en pacientes con mascarilla tipo Venturi y un 80% en los pacientes con mascarilla con reservorio o ventilación mecánica no invasiva.
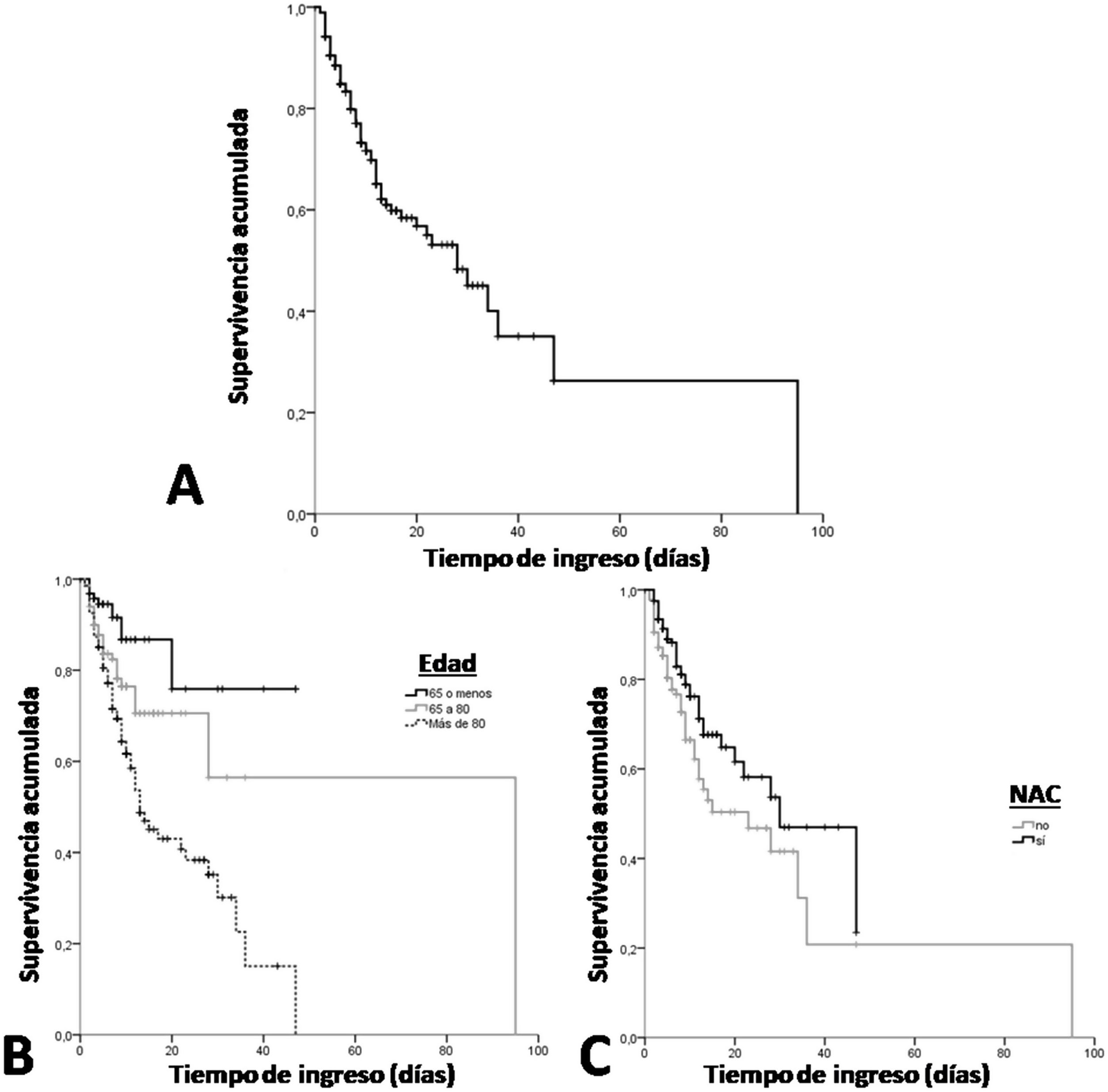
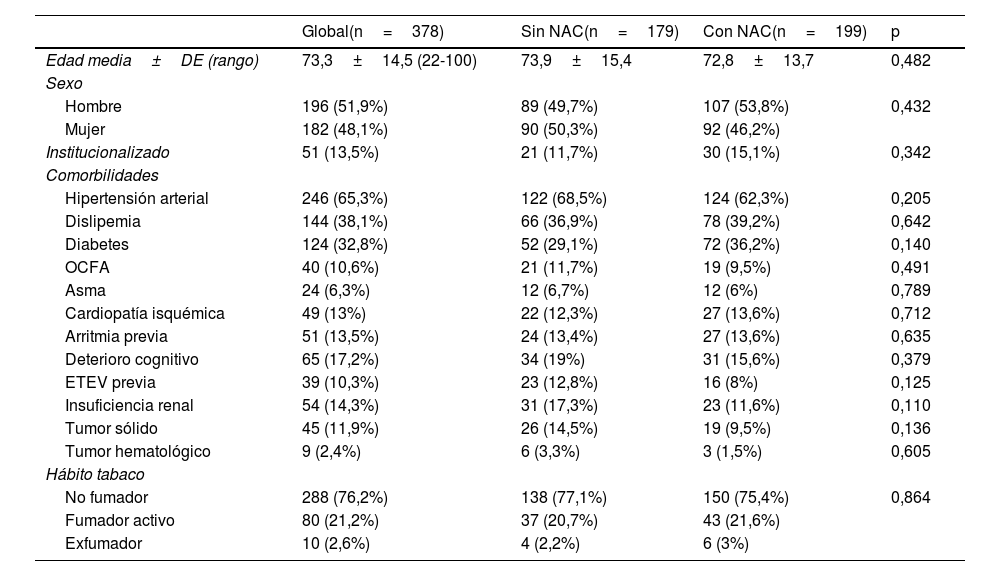
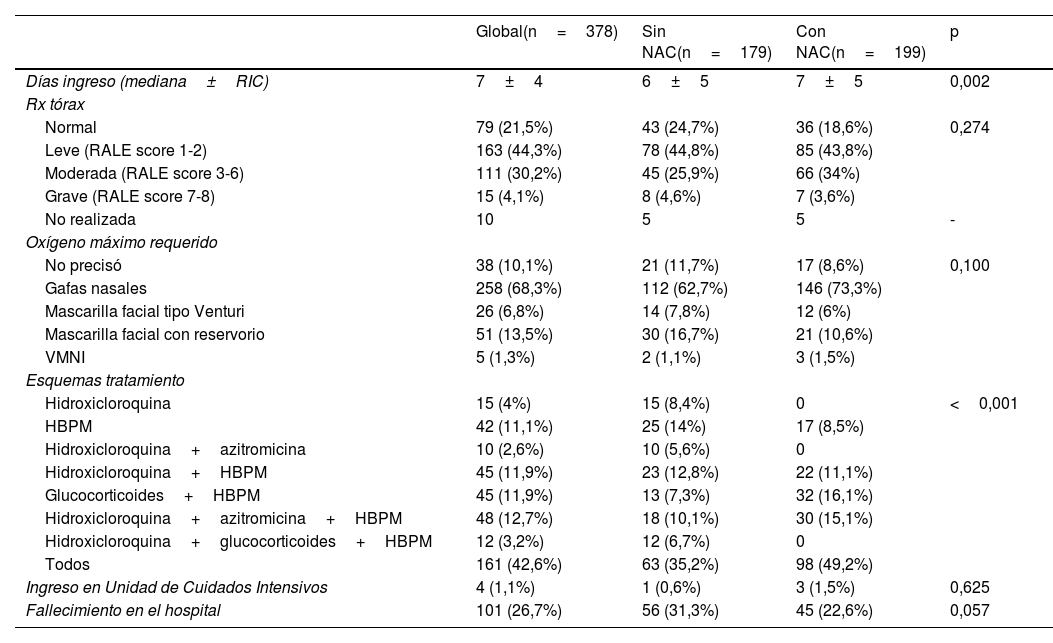
El tiempo de supervivencia mediano fue de 28 (19,5-36,5) días (fig. 1A). Si comparamos según los distintos grupos de edad, observamos que la supervivencia mediana disminuyó significativamente a mayor edad (p<0,001), siendo de 13 (8,8-17,2) días en los pacientes mayores de 80 años (fig. 1B). Adicionalmente, se observa que el tiempo mediano de supervivencia fue significativamente mayor en los pacientes tratados con NAC (p=0,013), con 30 (17,2-42,8) días de supervivencia frente a aquellos pacientes que no la recibieron: 23 (8,4-37,6) días (fig. 1C).
Factores de riesgo y factores protectores de mortalidad identificadosFinalmente, el análisis multivariante mediante regresión logística ajustado por los diferentes esquemas terapéuticos identificó los siguientes factores de riesgo de mortalidad: edad de los pacientes [mayores de 80 años; OR: 8,4 (IC95%: 3-23,4)], una afectación radiológica moderada o grave medida por la escala RALE [OR: 7,3 (IC95%: 3,2-16,9)], el consumo de tabaco [OR: 2,8 (IC95%: 1,3-6,1)] y arritmia previa [OR: 2,8 (IC95%: 1,3-6,2)].
Por el contrario, el tratamiento con NAC fue identificado como factor protector [OR: 0,57 (IC95%: 0,31-0,99)]. El asma también parece tener cierto factor protector, aunque sin llegar a la significación estadística [OR: 0,19 (IC95%: 0,03-1,06)] (tabla 3). Resultados similares fueron encontrados en el análisis de regresión de Cox.
Análisis multivariante de factores de riesgo de mortalidad, ajustado por las principales comorbilidades
| OR (IC95%) | p | |
|---|---|---|
| Edad | ||
| 65 años o menos | Referencia | - |
| 65 a 80 años | 2,442 (0,894-6,667) | 0,082 |
| Más de 80 años | 8,429 (3,029-23,453) | <0,001 |
| Hábito tabaco (fumador+exfumador vs. no fumador) | 2,816 (1,1310-6,056) | 0,008 |
| Arritmia previa | 2,791 (1,255-6,207) | 0,012 |
| Asma | 0,190 (0,034-1,061) | 0,058 |
| Rx tórax | ||
| Normal | Referencia | - |
| Leve | 0,846 (0,370-1,931) | 0,691 |
| Moderada+grave | 7,322 (3,179-16,863) | <0,001 |
| N-acetilcisteína | 0,566 (0,310 – 0,997) | 0,049 |
IC: intervalo de confianza; OD: odds ratio; Rx: radiografía.
Nuestro estudio mostró que la administración oral de NAC a dosis de 1.200mg al día se asoció con una menor mortalidad en pacientes ingresados por COVID-19. Los factores de riesgo identificados mediante regresión logística fueron la edad, una mayor afectación radiológica, el consumo de tabaco y la presencia de arritmia previa, mientras que el tratamiento con NAC fue un factor protector. Sobre el asma, el uso de corticoides inhalados parece conferir cierta protección contra el SARS-CoV-2 ya que reduce la expresión del receptor ECA2 en el pulmón14,15.
Como se muestra en otros estudios, el uso de NAC a dosis elevadas (≥1.200mg/día) puede tener efectos beneficiosos por su acción antioxidante y antiinflamatoria, lo que ayudaría a prevenir la producción de radicales libres de oxígeno y la tormenta de citoquinas en la COVID-1916,17. Por otro lado, la NAC puede ejercer un papel modulador en los receptores ECA2, dificultando la unión del SARS-CoV-2 a la proteína S y su entrada en la célula18. Este efecto se mantiene incluso con las nuevas variantes, incluyendo delta y ómicron19. Recientemente se ha publicado su papel para reducir los inflamasomas en muestras obtenidas mediante biopsia traqueal de pacientes graves con COVID-19 tratados con NAC20.
El bajo coste de la NAC y su buen perfil de seguridad con muy escasos efectos secundarios incluso a dosis elevadas hacen que pueda ser considerada como una opción terapéutica. No obstante, hay resultados contradictorios sobre su efecto terapéutico. La mayoría de estudios incluyen un porcentaje pequeño de pacientes, y las dosis utilizadas, así como la duración y la vía de administración, difieren entre ellos. Así, un estudio realizado en Brasil con 135 pacientes graves y que recibieron NAC intravenosa en dos dosis iniciales no mostró diferencias en cuanto a la evolución y la mortalidad21. Otros estudios han comunicado mejoría en la mortalidad y en los parámetros inflamatorios, aunque sin llegar a la significación estadística22,23. Un estudio griego de 82 pacientes que recibieron la misma dosis de NAC que nuestro estudio (1.200mg/día oral) mostró reducción en la mortalidad y en la necesidad de ventilación mecánica invasiva16. Uno de los estudios con mayor número de casos incluyó 2.071 pacientes tratados con NAC a dosis de 1.800mg/día, y también mostró menor mortalidad a favor de NAC, si bien no hubo diferencias estadísticamente significativas en cuanto a la necesidad de ventilación mecánica invasiva17. Una de las dificultades es establecer la dosis más adecuada (en términos de seguridad y eficacia), teniendo en cuenta que los efectos de la NAC son altamente dependientes de la dosis administrada. En general se recomienda una dosis mínima de NAC oral de 1.200mg/día; en pacientes con enfermedad grave y compromiso respiratorio, podría utilizarse NAC intravenosa a dosis de 100mg/kg durante al menos 3 días24.
Recientemente se han publicado dos metaanálisis. El de Paraskevas et al.25 incluyó 8 estudios y no mostró diferencias significativas a favor de NAC, si bien los autores reconocen la baja evidencia (fundamentalmente por el escaso número de pacientes) y la necesidad de futuras investigaciones. El realizado por Chen et al.26 tampoco mostró diferencias en mortalidad, necesidad de intubación o estancia hospitalaria. En cambio, el ensayo clínico de Panahi et al., que incluyó 250 pacientes y en el que el grupo de tratamiento recibió NAC nebulizada, sí mostró beneficios en disminución de mortalidad y de parámetros inflamatorios27. En el momento actual hay varios ensayos clínicos sobre el uso de NAC en COVID-19, que ayudarán a esclarecer estas cuestiones28.
Nuestro estudio presenta varias limitaciones. En primer lugar, se trata de un estudio observacional, por lo que los resultados obtenidos deben ser confirmados por futuros ensayos clínicos aleatorizados y controlados. Segundo, los pacientes fueron tratados según los protocolos vigentes en el hospital, incluyendo otros fármacos con posible efecto beneficioso sobre COVID-19. Para minimizar esta limitación se dividieron los pacientes en subgrupos de tratamiento cuya diferencia era haber recibido o no NAC y se utilizó esta variable para ajustar el análisis multivariante. Tercero, no incluye pacientes con las nuevas variantes delta y ómicron, si bien la evidencia disponible muestra que la NAC puede tener el mismo efecto sobre dichas variantes19,24. Nuestro estudio también tiene fortalezas, se trata de una muestra con un número elevado de pacientes, homogénea y representativa de los pacientes de la primera ola donde se pudo estudiar el efecto de la NAC aun no existiendo tratamientos específicos para estos pacientes. La recogida de información fue exhaustiva y todos los datos fueron revisados y comprobados, en especial lo referente a los tratamientos recibidos. Al agrupar los pacientes con tratamientos similares, se facilita poder apreciar el efecto de la NAC. Actualmente, gracias a la evolución de la enfermedad COVID-19, es difícil reclutar un grupo de pacientes de estas características.
En conclusión, el uso de NAC a dosis elevadas en pacientes con COVID-19 disminuyó la mortalidad y presentaron una evolución más favorable. Futuros ensayos clínicos aleatorizados o estudios prospectivos ayudarán a confirmar el papel de la NAC en estos pacientes. Hasta entonces, el bajo coste y el buen perfil de seguridad de la NAC hacen razonable su uso como tratamiento asociado.
Consideraciones éticasEl trabajo se ha llevado a cabo de conformidad con el Código de Ética de la Asociación Médica Mundial (Declaración de Helsinki). El protocolo del estudio fue aprobado por el Comité Ético de Investigación con medicamentos (CEIm) de la Gerencia de Atención Integrada de Alcázar de San Juan.
FinanciaciónLa presente investigación no ha recibido financiación para su elaboración de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.