Se presentan recomendaciones basadas en la literatura actual para la nutrición posnatal del prematuro, según grupos de peso al nacer: menores de 1.000g, de 1.000 a 1.500g y mayores de 1.500g, y períodos de evolución: adaptación, estabilización y crecimiento. Se revisa el manejo nutricional de las morbilidades que afectan o pueden afectar la nutrición: osteopenia, displasia broncopulmonar, ductus persistente, trasfusión de glóbulos rojos e intestino corto.
Recommendations based on current publications are presented for postnatal preterm nutrition, depending on birth weight: less 1000g, between 1000 and 1500g, and above 1500g, as well for the development periods: adaptation, stabilisation, and growth. A review is also presented on the nutritional management of morbidities that affect or may affect nutrition, such as: osteopenia, bronchopulmonary dysplasia, patent ductus arteriosus, red cell transfusion, and short bowel syndrome.
En la última década se han producido cambios importantes en la nutrición del prematuro, especialmente el extremo bajo peso de nacimiento, menor de 1.000g al nacer (EBPN), en quien la restricción de crecimiento posnatal (RCPN) es muy frecuente y las consecuencias de la falta de energía, proteínas y nutrientes en las primeras semanas afectan el potencial de desarrollo posterior.
Las intervenciones con nutrición precoz y mayor aporte de proteínas han documentado: reducción de la RCPN, mejor crecimiento craneano, mejor talla y mejor desarrollo evaluado a los 2 y a los 5años1,2. Si bien el crecimiento posnatal también está afectado por la morbilidad, especialmente la displasia broncopulmonar (DBP), enterocolitis y sepsis, el crecimiento puede mejorar con protocolos de manejo y vigilancia nutricional3,4. El neurodesarrollo se asocia al mejor cuidado nutricional y a los mejores logros de crecimiento. El riesgo de desnutrición posnatal es mayor a menor edad gestacional y evitar el riesgo es fundamental, por lo que la intervención debe iniciarse desde el nacimiento.
Aspectos generales de la nutrición parenteralAminoácidosLos cambios de composición de las proteínas de uso parenteral han permitido su inicio precoz, en mayores cantidades y en rápido aumento, sin observarse mayores riesgos metabólicos pero sí ventajas, como: mejor tolerancia a la glucosa, mayor aporte de energía, evita la pérdida de agua intracelular, o sea el catabolismo, mejora la síntesis de proteínas, también aumenta el ingreso de fósforo y potasio al tejido magro, que puede provocar niveles plasmáticos menores de estos5. Las mezclas de aminoácidos para recién nacidos prematuros no están disponibles en el país, por lo que se utilizan mezclas pediátricas que tienen algunas diferencias, como es la menor solubilidad de calcio y fósforo (mayor a menor pH de la mezcla) y mayor riesgo de niveles inadecuadamente altos de algunos aminoácidos; por lo tanto, menor tolerancia a niveles altos de aporte. Los aminoácidos pediátricos disponibles son relativamente adecuados para obtener anabolismo y crecimiento mientras se logra el adecuado aporte enteral, pero es posible que no sean óptimos en términos de los roles de mantener funciones no nutricionales, prevenir eventos fisiopatológicos o como agentes farmacológicos.
Hidratos de carbonoLa glucosa es una de las principales fuentes de energía y debe ser provista al prematuro menor de 32 semanas desde el nacimiento, ya que no logrará movilizar energía de depósito, ya sea por falta de este o por inmadurez enzimática de las vías de movilización. Es fundamental prevenir la hipoglucemia y asegurar un aporte adecuado, especialmente al sistema nervioso central.
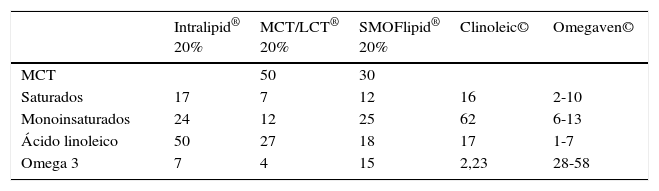
LípidosEs una de las fuentes importantes de energía, un mecanismo para entregar vitaminas liposolubles y proveer ácidos grasos esenciales (AGE). La importancia de un buen balance entre los AGE de la serie omega3 y omega6, como la necesidad de aporte de ácidos grasos poliinsaturados de cadena larga como DHA (22:5 n-3) y ácido araquidónico (20:4 n-6), ha sido establecida a nivel enteral y parenteral. Tanto el balance como la presencia de derivados largos son importantes para las respuestas fisiopatológicas y la modulación de la morbilidad del prematuro6.
La existencia de nuevas mezclas con un mejor balance de omega 6 y omega 3, con triglicéridos de cadena larga y mediana, con menos fitoesteroles y mayores niveles de vitamina E han disminuido los riesgos antiguamente descritos como efectos colaterales, en especial colestasia intrahepática, asociada a nutrición parenteral. Hay elementos fisiopatológicos y algunos estudios que muestran menor riesgo de DBP y retinopatía del prematuro, si bien las evidencias son insuficientes, dado el número limitado de casos estudiados7. Son bien tolerados para inicio precoz y un avance rápido. Los lípidos combinados con relación 2,5:1 de omega 6:omega 3, se pueden iniciar el primer día con 1-2g/kg/día y avanzar la misma cantidad diariamente hasta 3,5g/kg/día, para el menor de 1.500g, permitiendo un aporte de energía de 25kcal no proteicas por gramo de proteína cerca de los 7días.
Niveles de triglicéridos. No existe consenso sobre los niveles de triglicéridos aceptables en un recién nacido con lípidos parenterales. No se han documentado efectos adversos asociados a niveles moderadamente altos (bajo 400mg/dl). Los eventos adversos graves con hipertrigliceridemia están asociados a accidentes de infusión con niveles sobre 1.000mg/dl. La práctica de suspender la infusión de lípidos con niveles mayores de 250mg/dl ha determinado restricción significativa del aporte energético. Aspen recomienda niveles de triglicéridos menores de 250mg/dl para recién nacidos y menores de 400mg/dl para niños, pero basados en lípidos predominantes en omega 6 como son los de soya8. Los niveles altos de triglicéridos están menos asociados a los aportes de lípidos que a características clínicas del paciente: sepsis, premadurez extrema, restriccion de crecimiento intrauterino (RCIU), hipotermia, hipoxia se asocian significativamente a mayores niveles de triglicéridos9. En caso de sepsis, la disminución de los niveles de lípidos a 1g/kg/día produce menor duración de hemocultivos positivos, pero concomitantemente menor ganancia de peso10.
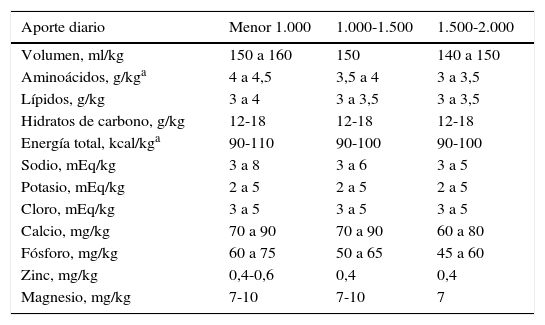
En las tablas 1 y 2 recomendamos un esquema de manejo para evitar aporte insuficiente (recomendación de expertos).
Los altos requerimientos de calcio y fósforo del prematuro para una óptima osificación son difíciles de administrar por vía parenteral por el riesgo de precipitación de las mezclas. La precipitación depende fundamentalmente de las cantidades de calcio, fósforo, aminoácidos y el pH de la mezcla. A pH más ácido y mayor concentración de aminoácidos, aumenta la solubilidad. A mayor concentración de calcio se puede agregar menor fosfato, y viceversa. Las centrales de preparación detectan el riesgo con modelos computacionales que son poco predecibles clínicamente, aportes mayores de 1,5mmol/dl de calcio y fósforo son difíciles de administrar11 Al utilizar trophAmine® la solubilidad aumenta muy significativamente, y más aún al utilizar glicerofosfato de sodio en vez de fosfato inorgánico12. La equivalencia de Ca es: 1mMol=40mg, y la de P: 1mMol=31mg. El aporte endovenoso en mMol de Ca:P varía de 1:1 a 1,3:1, pero en la primera semana de vida en prematuro extremo o después de morbilidad que haya comprometido severamente la nutrición se requiere mayor aporte de fósforo, con Ca:P de 0,8:1 a 0,6:1. El uso de glicerofosfato de sodio pentahidratado permite mayor aporte de calcio y fósforo pero aporta 2mMol de sodio por cada mMol de fósforo, por lo que hay que considerar este aporte.
ElectrólitosConsiderar la interacción de aniones y cationes y el estado ácido-base. El cloro total debe ser menor a 6mEq/kg/día para no producir acidosis metabólica por pérdida de bicarbonato. El aporte de más de 4mEq/kg/día de sodio debe considerar el uso de acetato, observando el pH. Contabilizar el aporte de sodio o de potasio según el compuesto de fosfato utilizado (tabla 3).
Recomendaciones de aporte parenteral total según peso corporal (g)
| Aporte diario | Menor 1.000 | 1.000-1.500 | 1.500-2.000 |
|---|---|---|---|
| Volumen, ml/kg | 150 a 160 | 150 | 140 a 150 |
| Aminoácidos, g/kga | 4 a 4,5 | 3,5 a 4 | 3 a 3,5 |
| Lípidos, g/kg | 3 a 4 | 3 a 3,5 | 3 a 3,5 |
| Hidratos de carbono, g/kg | 12-18 | 12-18 | 12-18 |
| Energía total, kcal/kga | 90-110 | 90-100 | 90-100 |
| Sodio, mEq/kg | 3 a 8 | 3 a 6 | 3 a 5 |
| Potasio, mEq/kg | 2 a 5 | 2 a 5 | 2 a 5 |
| Cloro, mEq/kg | 3 a 5 | 3 a 5 | 3 a 5 |
| Calcio, mg/kg | 70 a 90 | 70 a 90 | 60 a 80 |
| Fósforo, mg/kg | 60 a 75 | 50 a 65 | 45 a 60 |
| Zinc, mg/kg | 0,4-0,6 | 0,4 | 0,4 |
| Magnesio, mg/kg | 7-10 | 7-10 | 7 |
Las mezclas parenterales pueden usarse como 2 y 1: con los lípidos infundidos por separado de los aminoácidos, glucosa, minerales y vitaminas, o todos juntos: 3 en 1. No hay consenso en la literatura, y el uso es habitual de 2 y 1 en Estados Unidos y de 3 en 1 en Europa.
Mezcla 2 y 1Esta mezcla tiene la ventaja de permitir el uso de la mezcla de aminoácidos por 72h, es más estable una vez preparada en el tiempo, permite mayor aporte de glucosa, calcio y fósforo, pero presenta la desventaja de mayor peroxidación de vitaminas con necesidad de mayor fotoprotección de la mezcla. El uso de lípidos en la misma vía del resto de la mezcla, en conexión «en y», protege el endotelio capilar. Permite mantener aporte parenteral general cuando es necesario disminuir o suspender los lípidos por hipertrigliceridemia.
Mezcla 3 en 1Reúne en la misma bolsa todos los nutrientes parenterales; tiene la ventaja de reducir por sí misma la fotooxidación y de reducir el daño endotelial en la vía de infusión. Su uso solo se realiza por 24h, y podría limitar el aporte de calcio y fósforo. Un reciente estudio multicéntrico sobre fotooxidación muestra menor riesgo de DBP o muerte con el uso de esta mezcla, lo que requiere nuevos estudios prospectivos13,14.
Vías de administraciónLa administración parenteral en el período neonatal se puede realizar por catéter venoso umbilical si está en óptima posición (vena cava inferior) y se puede mantener hasta 15 a 18 días15. Se realiza fundamentalmente por catéter percutáneo, cuidando la ubicación del catéter en cava superior y excepcionalmente en cava inferior. Las extremidades superiores y el cuello son las vías preferenciales. La vía femoral derecha es la alternativa siguiente, y debe evitarse, en lo posible, la femoral izquierda, por la mayor frecuencia de desplazamiento e ingreso a la circulación vertebral16. La ubicación del catéter intracardíaco es de riesgo, por lo que debe vigilarse y modificarse. La vigilancia de posición de catéteres percutáneos debe continuar, con imágenes ecográficas y aprovechando los controles radiológicos, que debieran ser semanales. La tolerancia de una vía menos central varía según las características de la solución y de la anatomía individual16.
Uso de heparinaEl uso de heparina en los catéteres venosos centrales y los catéteres venosos de inserción periférica es un tema controvertido, por cuanto es una droga considerada de alto riesgo en su uso, por el potencial daño que puede significar su indicación errónea, sumado a complicaciones como trombocitopenia, reacciones adversas, hemorragias intracraneanas, entre otras. La revisión Cochrane (2002) aconseja su uso, pero algunas evidencias actuales no ofrecen diferencias en los riesgos de oclusión, trombosis o sepsis relacionados al catéter17,18. El uso de heparina con lípidos aumenta los ácidos grasos libres, por lo que no se recomienda, aunque disminuya los triglicéridos totales. No aconsejamos su uso en forma rutinaria, pero sí la vigilancia periódica de la posición correcta del catéter para minimizar sus riesgos.
OsmolaridadEn neonatología ha existido tradicionalmente una recomendación de no utilizar vía periférica con soluciones de más de 750mOsm/l (solución glucosada al 12,5%). Similar nivel se ha aplicado a la nutrición parenteral, sin evidencias claras. El uso de niveles de 900 a 1.350mOsm/l a través de catéter percutáneo se ha aceptado. No hay suficiente evidencia de un tamaño venoso seguro según osmolaridad19.
Riesgos de la nutrición parenteralLa nutrición parenteral ha permitido sobrevivir mejor a los prematuros de extremo bajo peso, pero debe considerarse como un fármaco, con efectos colaterales importantes. El riesgo de infección adquirido por una vía parenteral puede causar grave daño y muerte20.
Están documentados efectos en el desarrollo neurocognitivo en prematuros con más de 10 días de parenteral con contaminación habitual con aluminio. Efectos de esta contaminación sobre el hueso se detectan todavía en la adolescencia de estos prematuros. El mayor contaminante es el gluconato de calcio envasado en ampollas de vidrio.
El desbalance de nutrientes respecto a los requerimientos, ya sea por características fisiopatológicas del recién nacido o por errores de preparación o disponibilidad, es un riesgo a considerar; por ejemplo, la hipofosfemia precoz, asociada a un aporte alto de aminoácidos en prematuros extremos con severo RCIU, o la acidosis metabólica hiperclorémica cuando el aporte de cloro es mayor de 6mEq/kg/día.
Dado que no hay información sobre riesgos a largo plazo, es prudente utilizar la nutrición parenteral necesaria para un buen crecimiento, sin prolongarla cuando está disponible la vía enteral en forma suficiente21.
Todo el proceso de parenteral requiere adecuados controles para evitar errores en la indicación, preparación y administración22.
Aspectos generales de la alimentación enteralLeche maternaLa leche materna de la propia madre es la primera alternativa de aporte enteral para el prematuro.
Para obtener adecuados volúmenes debe iniciarse la extracción de leche antes de las 6h de vida. La extracción debe realizarse 8 veces al día, hasta la bajada de leche, y posteriormente 6 veces al día. La extracción puede ser manual o por bomba, idealmente por bomba, ambos pechos simultáneos y con masaje. Es importante vigilar la producción de leche, ya que tiende a disminuir a la tercera semana; en ese caso, el uso de galactogogo y el aumento de la frecuencia de extracción aumenta significativamente la producción de leche23.
La leche de la madre del prematuro contiene más proteínas, sodio e IgA. Pese a este mayor contenido, que disminuye progresivamente en el primer mes, se requiere aumentar el aporte de proteínas, calcio y fósforo. El contenido de proteínas y de energía es variable entre una y otra madre, y esta variabilidad es mayor que en la leche de madre de término, de manera que un niño puede recibir muy buen aporte nutricional, pero otro no. Idealmente, caracterizar la leche midiendo los macronutrientes con neflectometría permite fortificar individualmente y anticiparse a un crecimiento insuficiente. Esta no es una posibilidad fácil. El aporte energético se puede evaluar con el crematócrito. No hay relación entre el aporte energético y las proteínas de la leche materna. La cantidad de proteínas es el mayor limitante en el crecimiento. Vigilar el crecimiento y controlar el nitrógeno ureico (NU) es fundamental, ya que si el crecimiento disminuye y el NU es menor de 8, requiere aporte de proteínas adicionales, incluso sobre el fortificante24.
La leche materna donada tiene un contenido de proteínas significativamente menor; además, al pasteurizarse disminuyen sus propiedades bioactivas y la protección de infección, pero mantiene ventajas en el riesgo de enterocolitis necrosante (ECN) en relación a las fórmulas. Para un buen crecimiento requiere fortificación óptima, y eventualmente realizar alimentación mixta con fórmula25.
FortificantesLos nutrientes indispensables para suplementar la leche materna o donada son proteínas, calcio, fósforo, zinc y hierro para una buena evolución. Los fortificantes comerciales contienen otros nutrientes teóricamente necesarios. Es importante individualizar el suplemento de fortificante según se describe posteriormente, eventualmente agregando proteínas del tipo lactoalbúmina.
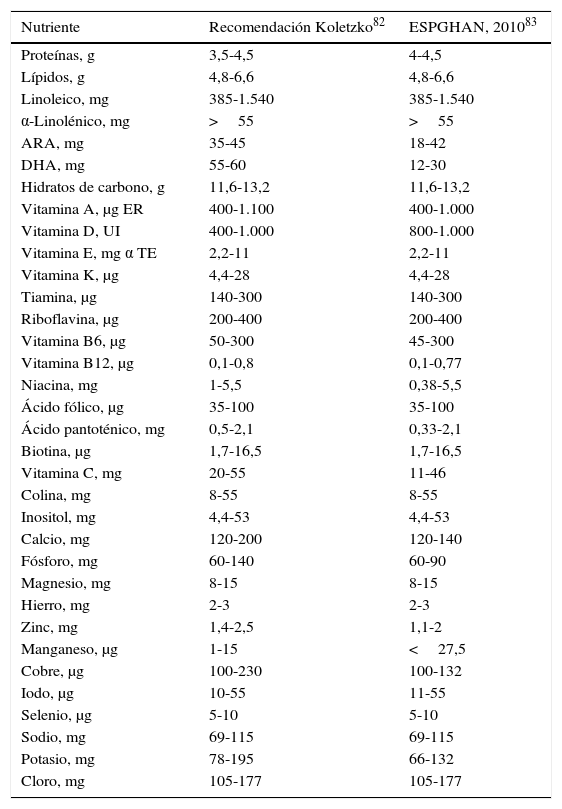
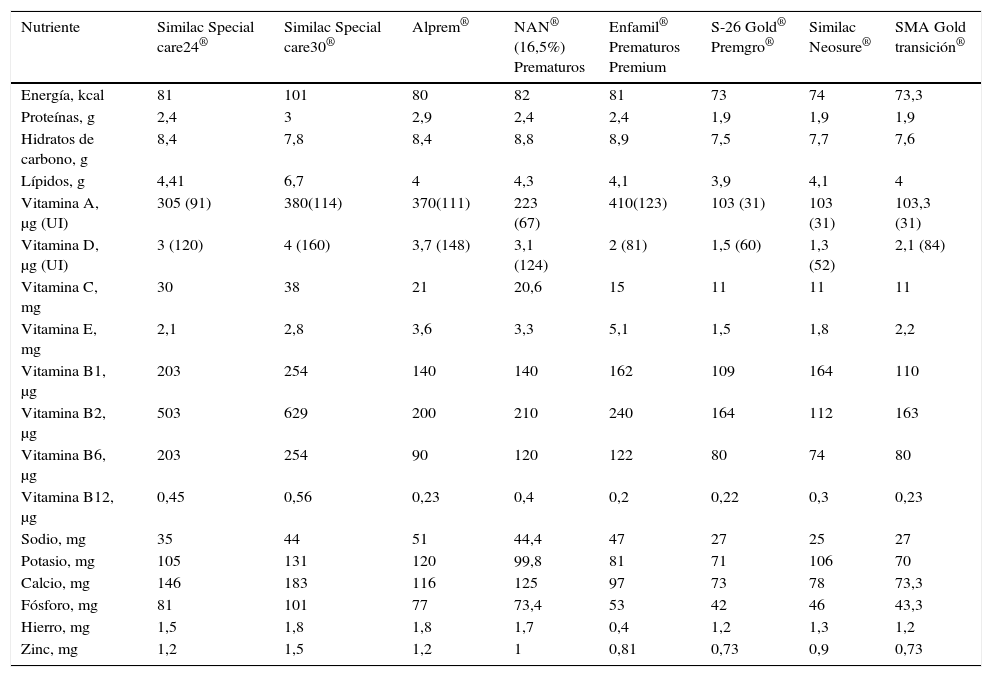
FórmulasLas fórmulas para prematuros son más concentradas en proteínas (60%) y energía (20%), y en todos los nutrientes, que las fórmulas de término. Fueron desarrolladas para cubrir requerimientos de prematuros entre 1.000 y 2.000g, y no del EBPN que tiene mayores requerimientos de proteínas. Idealmente la cantidad de proteínas por 100kcal debiera ser mayor de 3,5 para el EBPN, eventualmente más, si tuvo RCIU y está en crecimiento recuperacional26. Existe una fórmula alta en proteínas, pero desafortunadamente no está disponible en Chile. En caso de limitación del aporte de volumen, el uso de fórmula con 101kcal por 100ml permite un buen aporte con 130 a 150ml/kg/día. Las fórmulas están preparadas para que con 230 a 300ml diarios, según la marca, se cubran la recomendaciones completas de vitaminas y minerales. La relación calcio:fósforo en mMol es de 1,5:1 a 2:1, dada la menor absorción de calcio por vía oral (tablas 4 y 5).
Recomendaciones nutrientes por vía enteral para prematuros (por kg/día)
| Nutriente | Recomendación Koletzko82 | ESPGHAN, 201083 |
|---|---|---|
| Proteínas, g | 3,5-4,5 | 4-4,5 |
| Lípidos, g | 4,8-6,6 | 4,8-6,6 |
| Linoleico, mg | 385-1.540 | 385-1.540 |
| α-Linolénico, mg | >55 | >55 |
| ARA, mg | 35-45 | 18-42 |
| DHA, mg | 55-60 | 12-30 |
| Hidratos de carbono, g | 11,6-13,2 | 11,6-13,2 |
| Vitamina A, μg ER | 400-1.100 | 400-1.000 |
| Vitamina D, UI | 400-1.000 | 800-1.000 |
| Vitamina E, mg α TE | 2,2-11 | 2,2-11 |
| Vitamina K, μg | 4,4-28 | 4,4-28 |
| Tiamina, μg | 140-300 | 140-300 |
| Riboflavina, μg | 200-400 | 200-400 |
| Vitamina B6, μg | 50-300 | 45-300 |
| Vitamina B12, μg | 0,1-0,8 | 0,1-0,77 |
| Niacina, mg | 1-5,5 | 0,38-5,5 |
| Ácido fólico, μg | 35-100 | 35-100 |
| Ácido pantoténico, mg | 0,5-2,1 | 0,33-2,1 |
| Biotina, μg | 1,7-16,5 | 1,7-16,5 |
| Vitamina C, mg | 20-55 | 11-46 |
| Colina, mg | 8-55 | 8-55 |
| Inositol, mg | 4,4-53 | 4,4-53 |
| Calcio, mg | 120-200 | 120-140 |
| Fósforo, mg | 60-140 | 60-90 |
| Magnesio, mg | 8-15 | 8-15 |
| Hierro, mg | 2-3 | 2-3 |
| Zinc, mg | 1,4-2,5 | 1,1-2 |
| Manganeso, μg | 1-15 | <27,5 |
| Cobre, μg | 100-230 | 100-132 |
| Iodo, μg | 10-55 | 11-55 |
| Selenio, μg | 5-10 | 5-10 |
| Sodio, mg | 69-115 | 69-115 |
| Potasio, mg | 78-195 | 66-132 |
| Cloro, mg | 105-177 | 105-177 |
Contenido de nutrientes en fórmulas para prematuros (por 100ml de fórmula)
| Nutriente | Similac Special care24® | Similac Special care30® | Alprem® | NAN® (16,5%) Prematuros | Enfamil® Prematuros Premium | S-26 Gold® Premgro® | Similac Neosure® | SMA Gold transición® |
|---|---|---|---|---|---|---|---|---|
| Energía, kcal | 81 | 101 | 80 | 82 | 81 | 73 | 74 | 73,3 |
| Proteínas, g | 2,4 | 3 | 2,9 | 2,4 | 2,4 | 1,9 | 1,9 | 1,9 |
| Hidratos de carbono, g | 8,4 | 7,8 | 8,4 | 8,8 | 8,9 | 7,5 | 7,7 | 7,6 |
| Lípidos, g | 4,41 | 6,7 | 4 | 4,3 | 4,1 | 3,9 | 4,1 | 4 |
| Vitamina A, μg (UI) | 305 (91) | 380(114) | 370(111) | 223 (67) | 410(123) | 103 (31) | 103 (31) | 103,3 (31) |
| Vitamina D, μg (UI) | 3 (120) | 4 (160) | 3,7 (148) | 3,1 (124) | 2 (81) | 1,5 (60) | 1,3 (52) | 2,1 (84) |
| Vitamina C, mg | 30 | 38 | 21 | 20,6 | 15 | 11 | 11 | 11 |
| Vitamina E, mg | 2,1 | 2,8 | 3,6 | 3,3 | 5,1 | 1,5 | 1,8 | 2,2 |
| Vitamina B1, μg | 203 | 254 | 140 | 140 | 162 | 109 | 164 | 110 |
| Vitamina B2, μg | 503 | 629 | 200 | 210 | 240 | 164 | 112 | 163 |
| Vitamina B6, μg | 203 | 254 | 90 | 120 | 122 | 80 | 74 | 80 |
| Vitamina B12, μg | 0,45 | 0,56 | 0,23 | 0,4 | 0,2 | 0,22 | 0,3 | 0,23 |
| Sodio, mg | 35 | 44 | 51 | 44,4 | 47 | 27 | 25 | 27 |
| Potasio, mg | 105 | 131 | 120 | 99,8 | 81 | 71 | 106 | 70 |
| Calcio, mg | 146 | 183 | 116 | 125 | 97 | 73 | 78 | 73,3 |
| Fósforo, mg | 81 | 101 | 77 | 73,4 | 53 | 42 | 46 | 43,3 |
| Hierro, mg | 1,5 | 1,8 | 1,8 | 1,7 | 0,4 | 1,2 | 1,3 | 1,2 |
| Zinc, mg | 1,2 | 1,5 | 1,2 | 1 | 0,81 | 0,73 | 0,9 | 0,73 |
Para las recomendaciones específicas se han considerado 3 etapas: adaptación (considera la primera semana de vida), estabilización (entre la semana de vida y el aporte enteral exclusivo) y crecimiento (paciente con aporte enteral, en crecimiento y maduración) y tres grupos de prematuros según su peso de nacimiento: menor de 1000, 1000-1500 y de 1500 a 2000.
Nutrición del menor de 1.000 gPeriodo de adaptaciónPara el EBPN esta etapa es una emergencia nutricional debido a sus limitadas reservas y a la asociación con neurodesarrollo a largo plazo. Es fundamental reducir la pérdida de peso, el catabolismo y la pérdida de masa magra en la primera semana y proveer nutrición que se aproxime al ritmo de crecimiento y composición de un feto normal de similar edad posconcepcional muy precozmente.
Aporte parenteralProteínasLa rapidez de la malnutrición proteica es crítica. La pérdida de nitrógeno es alrededor de 1,5gr/kg/día en los pretérminos menores de 28 semanas. La utilización diaria de proteínas es de 2-3g/kg/día, lo que significa que los requerimientos son de alrededor de 3,5-4,5g/kg/día. Mayor si el RN es muy prematuro, se asocia un estado catabólico o un RCIU.
Varios trabajos apoyan un aporte de 3,5 a 4g/kg/día en la primera semana para obtener mejor crecimiento de cráneo, peso y talla27,28. El mayor aporte de proteínas debe acompañarse de un mayor aporte de energía y optimizar la composición de la parenteral para realmente observar mejor crecimiento y desarrollo. Varios estudios observacionales han reportado aumento del riesgo de sepsis con mayor aporte de proteínas, lo que se ha explicado por disminución del fósforo asociado al alto aporte de proteínas, pero las evidencias no son suficientes.
El aporte máximo de proteínas está limitado por el nivel sérico de NU mayor de 30-40. Sobre este nivel se recomienda reducir el aporte de aminoácidos, especialmente si se usan soluciones que no son específicas para recién nacidos. Los niveles de NU en este período no se relacionan con el aporte de proteínas, sino con condiciones metabólicas y patológicas del niño.
Los aminoácidos debieran iniciarse en las primeras 2h o al menos no retrasarse más de las 6h de vida. Si no es posible obtener una mezcla parenteral puede usarse infusión de aminoácidos en llave en Y con la solución glucosada. Una mezcla de solución glucosada, aminoácidos, calcio, fósforo y magnesio puede permanecer refrigerada hasta 7 días para su uso de emergencia en estos pacientes.
El aporte alto de proteínas puede producir hipofosfemia precoz, por ingreso de fósforo a la célula, con lo cual se moviliza calcio y fósforo del hueso, agregándose una hipercalcemia a la hipofosfemia. El aporte parenteral debe ajustarse aumentando el fósforo y disminuyendo el calcio, manteniendo la solubilidad. Este riesgo es mayor en el RCIU, que ya viene con menores niveles de fosfemia29,30.
LípidosInicio 1-2g/kg/día, recomendaciones de expertos. Aumentar hasta 3-4g/kg/día. Sin evidencias que apoyen aportes mayores a 4g/kg/día. El inicio precoz contribuye a reducir el RCPN31.
Hidratos de carbonoEl aporte debe iniciarse en la primera hora de vida, entre 7 a 12mg/kg/min. Monitorizar con glucemia. Valores superiores hasta 150mg/dl.
Con hiperglucemia, bajar cargas hasta 3mg/kg/min. El uso rutinario precoz de insulina en los recién nacidos de muy bajo peso al nacer puede significar una mejoría en el control de la glucemia y un aumento del aporte energético, pero su uso está asociado a un aumento de los episodios de hipoglucemia con el potencial riesgo de compromiso del neurodesarrollo posterior. El estudio de Beardsall no muestra diferencias en la mortalidad entre los 2 grupos al alta; la mortalidad a los 28 días en el análisis por intención de tratar es mayor en el grupo de los tratados con insulina32. Evitar el uso de insulina en forma rutinaria, pero si la hiperglucemia persiste con niveles sobre 200 debe iniciarse en dosis de 0,01 a 0,1UI/kg/h en administración endovenosa continua, con albúmina o con impregnación previa, de la jeringa y de la vía de administración. La respuesta es poco predecible, por lo que debe controlarse y suspenderse si los niveles llegan a 180mg/dl o menos. Existe el riesgo de acidosis láctica si la entrada de glucosa a la célula acumula ácido pirúvico por ineficiencia del ciclo de Krebs.
Relación proteína/energíaEl gasto metabólico en reposo es de 50 a 60kcal/kg/día, pero es mayor en condiciones de patologías. El aporte de 80-100kcal/kg/día permite un adecuado crecimiento. Inicialmente el aporte alto de proteínas no se asocia con una óptima cantidad de energía, pero posteriormente, hacia fines de la primera semana de vida se espera aportar unas 20 a 25kcal no proteicas por gramo de aminoácidos (tabla 6).
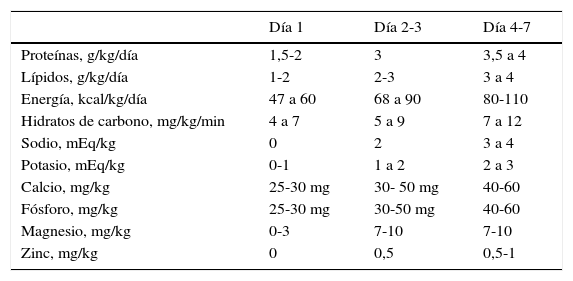
Recomendaciones de parenteral período adaptación en menor de 1.000 g (0-7 días)
| Día 1 | Día 2-3 | Día 4-7 | |
|---|---|---|---|
| Proteínas, g/kg/día | 1,5-2 | 3 | 3,5 a 4 |
| Lípidos, g/kg/día | 1-2 | 2-3 | 3 a 4 |
| Energía, kcal/kg/día | 47 a 60 | 68 a 90 | 80-110 |
| Hidratos de carbono, mg/kg/min | 4 a 7 | 5 a 9 | 7 a 12 |
| Sodio, mEq/kg | 0 | 2 | 3 a 4 |
| Potasio, mEq/kg | 0-1 | 1 a 2 | 2 a 3 |
| Calcio, mg/kg | 25-30 mg | 30- 50 mg | 40-60 |
| Fósforo, mg/kg | 25-30 mg | 30-50 mg | 40-60 |
| Magnesio, mg/kg | 0-3 | 7-10 | 7-10 |
| Zinc, mg/kg | 0 | 0,5 | 0,5-1 |
El aporte precoz de aminoácidos y la reducción de la pérdida de peso ha determinado que sodio y potasio deben iniciarse en el primer a segundo día, y calcio y fósforo desde el inicio del aporte de aminoácidos.
El aporte de vitaminas y oligoelementos debe iniciarse alrededor del 4.° o 5.° día de vida (disminuir fenómenos oxidativos y lipoperoxidación) e interrumpir al alcanzar volúmenes adecuados de alimentación enteral (80-100ml/kg/día). No hay mezclas especiales para prematuros, y no hay modificaciones de sus aportes (vitaminas hidrosolubles 1,5ml/kg y liposolubles 4ml/kg y 0,2ml/100ml de parenteral de oligoelementos).
Monitoreo de nutrición parenteral básico en la primera semana en el menor de 1.000g:
- 1.
Glucosa y ELP 1 a 2 veces al día en los primeros 3 a 5 días.
- 2.
Gases mínimo día por medio.
- 3.
Fosfemia y calcemia 2 veces por semana (mínimo 2.° o 3.er día y al 5.°-7.° día).
- 4.
Triglicéridos: 2 veces por semana.
- 5.
NU no es un indicador sensible del estado nutricional en los primeros días, pero su aumento puede indicar dificultades en la utilización de proteínas.
- 6.
No son útiles: concentración sérica de proteínas y/o albúmina.
Hay cada vez mayor consenso de iniciar la alimentación enteral el primer día de vida en el prematuro que no esté muy críticamente enfermo. Se retrasa el inicio en el menor de 1.000g con RCIU y/o doppler alterado no más allá de 48h33,34. Una de las dificultades del inicio precoz es la consideración de los residuos gástricos alimentarios o mucosos. En los primeros días siempre habrá residuo, incluso en volúmenes mayores del aporte entregado35. No medir residuos es una posibilidad sugerida, o establecer protocolos de manejo del residuo36. La presencia de residuos no anticipa ni se asocia al riesgo de ECN35-37. Grupos europeos inician aporte enteral muy lento: cada 6h, aumentando la frecuencia diariamente. Los residuos biliosos (verde musgo) o hemáticos son patológicos y deben llevar a una evaluación clínica.
La primera alternativa es la leche de su propia madre o leche donada, pero si no están disponibles no debe retrasarse el inicio de aporte enteral, con fórmula en volúmenes mínimos. Diluir la fórmula no ofrece ventajas significativas. El inicio con fórmula hidrolizada muestra mejor tolerancia. Los objetivos de la nutrición parenteral y enteral en la primera semana son alcanzar a los 7 días: 3,8g de proteínas/kg y 120cal/kg. Observar pérdida de peso los primeros 3 a 4 días. Obtener recuperación del PN a los 9+3días. Iniciar el aporte enteral el primer a tercer día (tabla 2) y obtener leche materna muy precozmente (tabla 7).
Aporte enteral en periodo de adaptación según peso de nacimiento
| Día 1 (0-24 h) | Día 2-3 | Día 5-7 | |
|---|---|---|---|
| 400-700 | 1ml cada 4 o 6 h | 1ml cada 4 h | 1-2ml cada 3 h |
| 700-1.000 | 1ml cada 4 h | 1-2ml cada 3 h | 3-5ml cada 3 h |
| <1000 con RCIU o doppler alterado | 0 | Desde 48 h: 1ml cada 4 h | Incrementos de 10-15 ml/kg/día según tolerancia |
| 1.000-1.500 | 2ml cada 3 h | 2-4 ml/kg/3 h | 5-10 ml/kg/cada 3 h |
| 1-1,5 con RCIU con doppler alterado | 0 | Desde 48h: 15 ml/kg/día | Incrementos de 15 ml/kg/día |
| 1.500-2.000 | 5-20 ml/cada 3 h | Incrementos 25-35 ml/kg/día | Incrementos 25-35 ml/kg/día |
| 1,5-2 con RCIU con doppler alterado | 0 | Desde 48h: 15 ml/kg/día | Incrementos 15-20 ml/kg/día |
Después de la primera semana de vida, el objetivo es una precoz recuperación del peso de nacimiento y una velocidad de crecimiento similar a la intrauterina para la edad gestacional. El aporte nutricional se entrega a través de parenteral y enteral. Si el aporte enteral es de 0 a 30ml/kg, debe mantenerse la NP completa, adecuando el volumen a los requerimientos según edad y morbilidad concomitante (ductus, requerimientos de oxígeno, función renal). En este período es fácil que el aporte nutricional sea insuficiente y puede impactar significativamente en el grado de RCPN4,38.
En el EBPN con RCIU o con peso menor de 800g, especialmente si ha presentado deterioro en período de adaptación, se recomienda mantener un aporte enteral de 100 a 120ml/kg/día con un aporte parenteral del 30 al 40% de requerimientos nutricionales varios días antes de suspender la parenteral. Los EBPN con RCIU tienen menor absorción intestinal por la desnutrición intrauterina. El aporte de proteínas debe mantenerse adecuado, ya que se ha documentado aporte insuficiente al suspender la parenteral, mientras se alcanza buen aporte enteral con repercusión en el ritmo de crecimiento4,38.
En el mayor de 800g, adecuado para edad gestacional (AEG) sin mayor deterioro en la primera semana, se puede completar aporte enteral de 100 a 130ml/kg en algunos días y suspender el aporte parenteral.
Si el aporte enteral es mayor de 80ml/kg, los oligoelementos y las vitaminas parenterales pueden suspenderse.
Ajustar el aporte de calcio y fósforo al máximo posible durante la parenteral, modificándolo según los niveles de calcemia y fosfemia. Nunca aportar solo uno de ellos.
Velocidad de incremento del aporte enteralEl incremento del aporte enteral en este grupo es de 15 a 20ml/kg/día, pero muchos EBPN no toleran estos incrementos, especialmente los EBPN con RCIU y doppler fetal alterado34, por lo que alcanzar el aporte enteral puede demorar. Los menores de 750g pueden beneficiarse con un incremento de 10ml/kg/día cada 48h, en especial si el riesgo local de ECN es alto39.
En este período los residuos gástricos pueden ser un obstáculo para el avance del aporte. La recomendación de devolverlos y completar el volumen indicado puede facilitar el alcanzar el aporte enteral total40.
Aporte enteralPreferentemente leche materna de su madre. La fortificación puede iniciarse con 50ml/kg/día si la tolerancia alimentaria es buena (sin mayor distensión abdominal, residuos escasos). Esto permitirá no producir insuficiente aporte de proteínas. Si la tolerancia es regular, iniciar el fortificante con 80 a 100ml/k/día. Solo para probar tolerancia el fortificante se inicia a la mitad de la concentración estándar, por 2 a 3 días, y se indica completo a continuación
Fórmula para prematuros. No cubren recomendaciones de proteínas en este grupo, salvo que el aporte sea mayor de 180ml/kg/día. Considerar suplementar si es necesario, especialmente en EBPN con RCIU.
Leche donada. Considerar el contenido de proteínas, y medirlo si es posible. Seleccionar de donante madre de prematuro o leche madura precoz (menor de un mes). Fortificar como lo anterior. Individualizar aporte según contenido de proteínas y energía o por BUN y evolución (tablas 8 y 9).
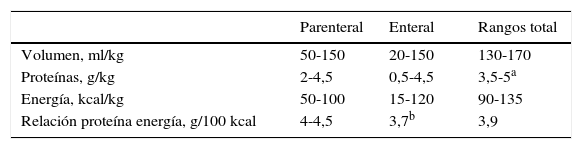
Aporte nutricional EBPN, periodo de estabilización
| Parenteral | Enteral | Rangos total | |
|---|---|---|---|
| Volumen, ml/kg | 50-150 | 20-150 | 130-170 |
| Proteínas, g/kg | 2-4,5 | 0,5-4,5 | 3,5-5a |
| Energía, kcal/kg | 50-100 | 15-120 | 90-135 |
| Relación proteína energía, g/100 kcal | 4-4,5 | 3,7b | 3,9 |
El EBPN con RCIU en crecimiento de recuperación podría requerir hasta 5-5,5g/kg/día de proteínas por aporte mixto o enteral26.
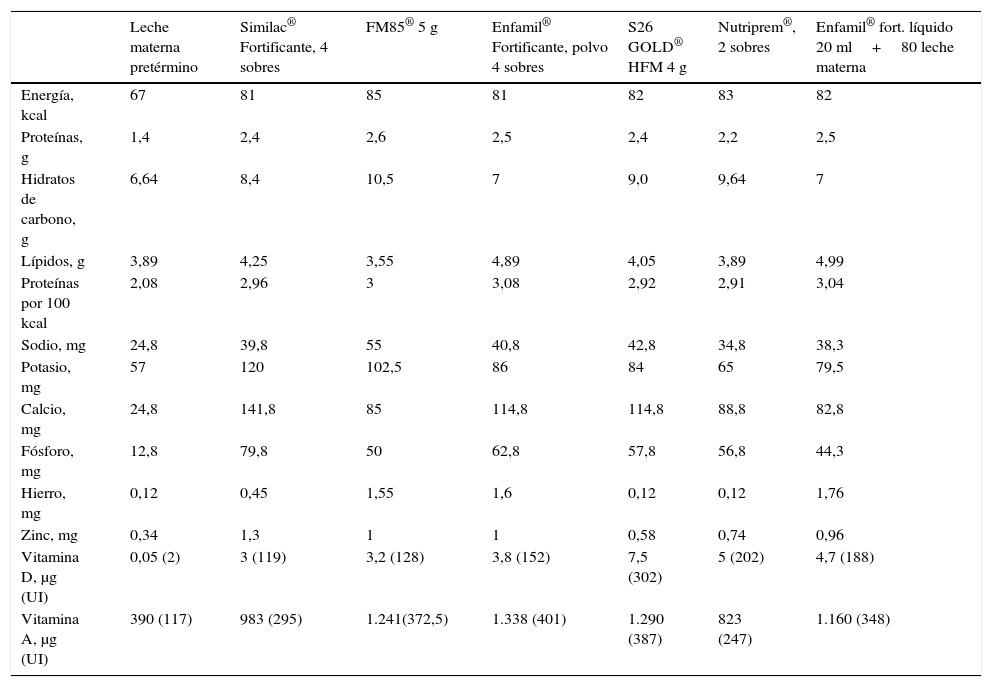
Contenido de leche materna con fortificante (100ml de mezcla)
| Leche materna pretérmino | Similac® Fortificante, 4 sobres | FM85® 5 g | Enfamil® Fortificante, polvo 4 sobres | S26 GOLD® HFM 4 g | Nutriprem®, 2 sobres | Enfamil® fort. líquido 20 ml+80 leche materna | |
|---|---|---|---|---|---|---|---|
| Energía, kcal | 67 | 81 | 85 | 81 | 82 | 83 | 82 |
| Proteínas, g | 1,4 | 2,4 | 2,6 | 2,5 | 2,4 | 2,2 | 2,5 |
| Hidratos de carbono, g | 6,64 | 8,4 | 10,5 | 7 | 9,0 | 9,64 | 7 |
| Lípidos, g | 3,89 | 4,25 | 3,55 | 4,89 | 4,05 | 3,89 | 4,99 |
| Proteínas por 100 kcal | 2,08 | 2,96 | 3 | 3,08 | 2,92 | 2,91 | 3,04 |
| Sodio, mg | 24,8 | 39,8 | 55 | 40,8 | 42,8 | 34,8 | 38,3 |
| Potasio, mg | 57 | 120 | 102,5 | 86 | 84 | 65 | 79,5 |
| Calcio, mg | 24,8 | 141,8 | 85 | 114,8 | 114,8 | 88,8 | 82,8 |
| Fósforo, mg | 12,8 | 79,8 | 50 | 62,8 | 57,8 | 56,8 | 44,3 |
| Hierro, mg | 0,12 | 0,45 | 1,55 | 1,6 | 0,12 | 0,12 | 1,76 |
| Zinc, mg | 0,34 | 1,3 | 1 | 1 | 0,58 | 0,74 | 0,96 |
| Vitamina D, μg (UI) | 0,05 (2) | 3 (119) | 3,2 (128) | 3,8 (152) | 7,5 (302) | 5 (202) | 4,7 (188) |
| Vitamina A, μg (UI) | 390 (117) | 983 (295) | 1.241(372,5) | 1.338 (401) | 1.290 (387) | 823 (247) | 1.160 (348) |
En este período algunos EBPN no han logrado avance significativo en el aporte enteral por problemas de tolerancia alimentaria. La intolerancia se expresa por la presencia de residuos y distensión abdominal persistentes, que impide avanzar en el volumen de aporte enteral y que no es ECN, si bien siempre se plantea como diagnóstico diferencial41. Es más frecuente en el EBPN, con RCIU, hijo de madre hipertensa42.
Como medidas se recomienda:
- •
Evitar prolongar el ayuno enteral (inicio a las 48h de vida a más tardar).
- •
Uso de succión no nutritiva (uso de chupete), si es que no está con tubo orotraqueal.
- •
Uso de alimentación enteral continua.
- •
Uso de leche materna o fórmula con hidrolizado proteico.
- •
Uso de enemas si hay distensión y dificultad de eliminación de meconio. La distensión enteral recurrente puede finalizar en una ECN, por lo cual debe evitarse con el uso de enemas de solución fisiológica y glicerina en volumen de hasta 10ml/kg por vez.
- •
El uso sistemático de enemas, sin distensión, no contribuye a mejorar el aporte enteral.
- •
Tránsito intestinal o enema con medio de contraste con solución hidrofílica hiperosmolar diluida al 1/3 si hay distención de asas, descartada la ECN. Permite descartar alteración anatómica o funcional y generalmente produce vaciamiento intestinal y mejoría de la tolerancia.
- •
Eritromicina como estímulo de motilidad intestinal, 10mg/kg inicial por 48h y 6mg/kg cada 6h oral por 5 a 7 días. El riesgo de hipertrofia pilórica es de baja frecuencia.
La alimentación en bolos lentos cada 2 o 3h, por sonda orogástrica, es la recomendada, pero para el menor de 850g, o si hay problemas de tolerancia alimentaria o compromiso respiratorio importante, el uso de alimentación continua es más adecuado43.
Objetivos nutricionalesIncremento de peso. La evolución intrauterina en este período es de 18-19g/kg/día (previo a 30 semanas)44. Estos niveles son difíciles de alcanzar durante la estabilización. Dependiendo de la situación de morbilidad, alcanzar 15g/kg/día es un objetivo suficiente. La recuperación del peso de nacimiento se espera en este período: entre los 8 y 12 días de vida. Mayor tiempo traduce aporte nutricional insuficiente.
La estimación de la cantidad de proteínas y energía total recibida es fundamental para adecuar los aportes. Este aspecto del cuidado neonatal tiende a no considerarse y la presencia de protocolos estandarizados y un sistema de vigilancia nutricional permite minimizar los aportes insuficientes y, con esto, reducir la incidencia de RCPN4,38.
Etapa de crecimientoDesde el momento en que logra alimentación enteral completa, ya se ha recuperado el peso de nacimiento y la tarea es tener un crecimiento en peso, talla, crecimiento craneano y composición corporal similar al intrauterino de la misma edad gestacional. Además, debe recuperarse el período de adaptación, en el que generalmente no hay crecimiento y hay morbilidad que afecta el crecimiento. Hasta ahora el crecimiento posnatal del prematuro es diferente al intrauterino, con mayor acumulación de tejido adiposo visceral y menor crecimiento longitudinal. El avance debe estar centrado en producir adecuado crecimiento craneano y longitudinal y evitar el depósito desproporcionado de grasa visceral. En este contexto, el énfasis está dado por una adecuada cantidad y calidad de proteínas y menos en el aporte de energía. El crecimiento posnatal del prematuro es desproporcionado en los distintos parámetros: el perímetro cefálico crece relativamente bien, el peso es más lento y la talla es la que experimenta mayor retraso. Hoy se ha puesto énfasis no solo en lograr crecimiento antropométrico, similar al intrauterino, sino también en lograr una composición corporal adecuada y proporcional. Necesitamos contar con una herramienta que permita evaluar la composición corporal midiendo idealmente la cantidad de tejido adiposo depositado, actualmente disponible a nivel internacional con densitometría corporal total (Pea Pod®) pero muy caro para aplicación clínica rutinaria45. La evaluación del P/T o el IMC pudieran ser los instrumentos alternativos. La publicación reciente de curvas de IMC en el prematuro46 puede contribuir a este objetivo.
La leche materna de su propia madre y fortificada es la alimentación más recomendada.
El uso de leche materna de banco, en el caso de no contar con leche materna de su propia madre, disminuye algunas complicaciones, pero el crecimiento es menor, por lo que debe ser muy bien fortificada, idealmente con análisis de composición macronutricional y fortificación proporcional24,25.
Hay que considerar que las ventajas de la alimentación con leche materna se relacionan con el volumen ingerido y la continuidad de su aporte: a mayor volumen, mayor beneficio. Volumen mínimo 50ml/kg/día. Idealmente, >50% del requerimiento.
Si la leche materna no está disponible, el aporte con fórmulas para prematuros es adecuado en la mayoría de los casos, pero hay que recordar que estas leches no han sido diseñadas para el EBPN y su contenido de proteínas puede ser insuficiente para las recomendaciones actuales, especialmente en prematuros con RCIU que requieren crecimiento recuperacional y también en RCPN derivado de morbilidad severa e insuficiente aporte en las primeras semanas de vida. Contar con una fórmula alta en proteínas es más adecuado, pero no está disponible actualmente en el país. El aumento de fortificante a un cuarto o medio de la dosis habitual para agregar a la fórmula es una alternativa (tabla 9), o agregar 0,3 a 1% de concentrado de proteínas.
Se ha recomendado un aporte enteral de 180ml/kg/día en este período, pero si el prematuro no tiene problemas cardiopulmonares que requieran limitar el volumen, algunos prematuros requieren más, especialmente si han nacido con RCIU. Esto es observado con frecuencia después de las 33 a 34 semanas de edad posconcepcional por manifestaciones de hambre entre las alimentaciones.
Fortificadores de leche maternaLa fortificación estandarizada asume una composición promedio de nutrientes en leche de la madre del prematuro de 2 semanas de lactancia y agrega una dosis fija de fortificante. Dado la variabilidad de la composición de la leche materna, la fortificación estándar puede no ser la correcta. No logra los aportes para crecimiento similar al alimentado con fórmula, especialmente si el contenido de proteínas está bajo el promedio. Se propone fortificación individualizada:
- •
Fortificación basada en análisis de leche materna (espectroscopia infrarroja y análisis periódico).
- •
Fortificación ajustable dependiendo de la respuesta metabólica: evaluar con NU periódicamente; el rango objetivo es de 9 a 15mg/dl24,47,48. Intervenir con valor menor a 8mg/dl, aumentando la concentración del fortificante, correlacionando con velocidad de crecimiento: niños que crecen <15g/kg/día o desaceleran, probablemente necesiten más proteína; la adición de 0,5-1g/kg/día de proteína es razonable, se puede usar el fortificante al 5 o 6%. Pretérminos pequeños para edad gestacional (PEG) en rápido crecimiento recuperacional pueden requerir más proteínas26.
- •
Lograr crecimiento recuperacional (catch up) y evitar desnutrición extrauterina. Evaluar el crecimiento posnatal midiendo velocidad de crecimiento y graficando las mediciones prospectivamente sobre curvas de referencia o asignando percentiles. Evaluar con Fenton (percentiles); caída en los percentiles significa desnutrición extrauterina. Puede considerarse el peso del 3.er día de vida (en general es el menor peso) como el valor de referencia para evaluar el crecimiento y observar los ascensos en los percentiles o puntajeZ49. El crecimiento en esta etapa es dinámico, la velocidad de crecimiento aumenta con el incremento de la edad gestacional hasta el término, donde desacelera. Midiendo solo velocidad de crecimiento no tenemos la referencia respecto del crecimiento normal. En general, peso mayor de 20g/kg/día, talla 1-1,2cm/semana, crecimiento craneano 0,8-1cm/semana. El crecimiento lineal refleja masa magra y crecimiento de órganos, incluido cerebro, y junto con el perímetro cefálico, debe ser evaluado semanalmente y graficado en las curvas de referencia. Mejor crecimiento se asocia a mejor neurodesarrollo. La fórmula más adecuada para calcular los incrementos en un periodo de n días es: peso día n − peso día 1/((peso día n+peso día 1)/2)/n50.
- •
Controles hematológicos y recuento de reticulocitos cada 10-15 días.
- •
Controlar electrólitos plasmáticos (el sodio debe mantenerse sobre 130mEq/dl), NU, calcemia, fosfemia, fosfatasas alcalinas cada 10-15 días.
La calcemia se mantiene normal en la osteopenia hipofosfémica después del mes de vida; si está alterada, puede haber patología paratiroidea o de vitaminaD.
La forma de asegurar un aporte adecuado para la mineralización ósea es la excreción urinaria de Ca y P, que debe ser >1,2mmol/l o >4,8mg/dl para el calcio y >0,4mmol/l o >1,2mg/dl para el fósforo51-53.
Si la fosfemia es menor de 5,5mg/dl o la fosfaturia está bajo los niveles indicados:
- •
Incrementar aporte de calcio y fósforo.
- •
Asegurar suplemento de vitaminaD 400UI diarias, eventualmente aumentar a 800 según evolución y antecedentes.
- •
Incrementar el uso de ejercicios pasivos.
- •
Revisar medicamentos y suspender diuréticos y corticoides si es posible (tabla 10).
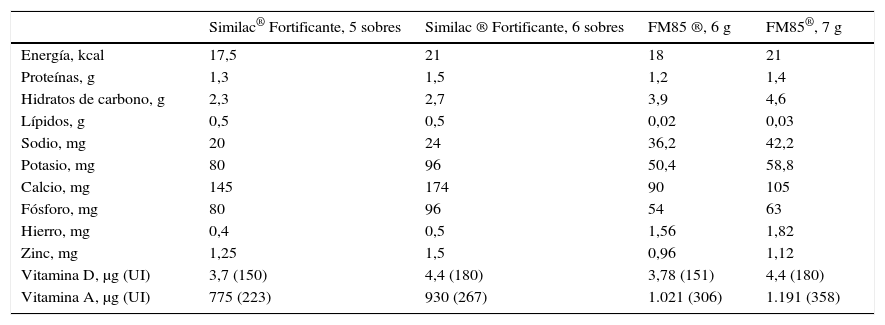
Tabla 10.Contenido de nutrientes adicionales con fortificación máxima
Similac® Fortificante, 5 sobres Similac ® Fortificante, 6 sobres FM85 ®, 6 g FM85®, 7 g Energía, kcal 17,5 21 18 21 Proteínas, g 1,3 1,5 1,2 1,4 Hidratos de carbono, g 2,3 2,7 3,9 4,6 Lípidos, g 0,5 0,5 0,02 0,03 Sodio, mg 20 24 36,2 42,2 Potasio, mg 80 96 50,4 58,8 Calcio, mg 145 174 90 105 Fósforo, mg 80 96 54 63 Hierro, mg 0,4 0,5 1,56 1,82 Zinc, mg 1,25 1,5 0,96 1,12 Vitamina D, μg (UI) 3,7 (150) 4,4 (180) 3,78 (151) 4,4 (180) Vitamina A, μg (UI) 775 (223) 930 (267) 1.021 (306) 1.191 (358)
Dentro de este grupo de peso, el menor de 1.200g, y especialmente el PEG, deberán recibir nutrición parenteral en forma similar al menor de 1.000g. Inicio precoz y aportes adecuados de proteínas y energía. El grupo mayor de 1.200g se debe apoyar con nutrición parenteral desde el primer o segundo día y al alcanzar aportes cercanos de 90 a 100ml/kg por vía enteral, con buena tolerancia y curva de peso en ascenso. Es posible retirar la nutrición parenteral con vigilancia estricta de sus aportes nutricionales y curva de peso. El aporte de proteínas recomendado diario es de 3,5g/kg/día.
EnteralEl aporte enteral se inicia precozmente, en el 1.er o 2.° día, si el niño está estable. Se retrasa si hay antecedentes de doppler alterado, RCIU o asfixia severa. El incremento en niños de bajo riesgo de ECN puede ser de 20 a 30ml/kg/día, y en el que tiene riesgo, de 15 a 20ml/kg/día.
Período de estabilizaciónLos RN entre 1.000 y 1.500 pueden estar a los 7 días con enteral y parenteral o enteral y solución glucosada y electrólitos. Algunos pueden estar con solo aporte enteral, ya que el incremento diario puede ser de 20 a 30ml/kg/día si no han tenido mayor morbilidad o severo RCIU.
El aporte enteral es por sonda orogástrica o nasogástrica cada 3h en bolo lento.
Se espera recuperación del peso de nacimiento entre los 6 y 10 días.
El incremento ponderal del período es de 15 a 24g/kg/día.
Algunos niños con RCIU y peso menor de 1.200g pueden tener intolerancia alimentaria, pero es poco frecuente. En estos niños, incrementos de aporte de 15 a 20ml/kg/día cada 24 a 72h pueden ser necesario y seguir recomendaciones de intolerancia alimentaria.
Inicio de fortificante de leche materna con volúmenes de 50 a 80ml/kg/día.
Período de crecimientoLa observación del crecimiento es similar a la descrita en el grupo menor de 1.000g. Tanto la antropometría como los exámenes de laboratorio tienen similares recomendaciones. El riesgo de osteopenia es bajo y asociado a manejo o morbilidad como DBP, intestino corto, parenteral prolongada.
Nutrición de 1.500 a 2.000 gPeríodo de adaptaciónEste grupo no requiere nutrición parenteral de inicio. Si no alcanza un aporte enteral mínimo a los 5 días de 40 a 50ml/kg y se agrega alguna situación de patología que impida su alimentación por vía enteral, se le apoyará con nutrición parenteral el mínimo necesario hasta su recuperación. El balance de una ligera mejor nutrición tiene que pesarse contra las potenciales complicaciones. Existe una práctica de dejar a los prematuros sin alimentación al ingreso a la unidad de neonatología que en este grupo tiene aún menos justificación. En la mayoría de los casos no podrán recibir alimentación completa por boca, pero sí por sonda nasogástrica e ir aportando por vía oral según su edad gestacional. Pretérminos de 32 a 33 semanas ocasionalmente toleran aporte oral gradual. Iniciar enteral de 20 a 30ml/kg/día y avanzar de 30 a 35ml/kg/día permitirá rápidamente obtener un aporte nutricional adecuado. En caso de morbilidad muy importante o pretérmino PEG con doppler alterado, el inicio del aporte enteral debe diferirse 48h.
Período de estabilizaciónEste período es muy corto o inaparente en prematuros sanos, pero si ha presentado morbilidad o es un paciente de alto riesgo de ECN requiere combinar la nutrición parenteral y un lento ascenso del aporte enteral de 15 a 20ml/kg/día. Con sobre 80ml de aporte enteral bien tolerado, se puede suspender el aporte parenteral.
Período de crecimientoEn estos pacientes el uso de leche materna sin fortificar puede lograr buen crecimiento, especialmente si no hay limitación de volumen, pero no habría una óptima osificación. Fortificar con calcio (60-80mg/kg/día) y fósforo (40-60mg/kg/día) durante la hospitalización ayudará a una mejor osificación. Si el volumen de aporte está restringido, la alimentación con leche materna debe considerarse fortificante.
Suplementos, vitaminas y mineralesVitamina DLos niveles de vitamina D al nacer dependen principalmente de depósitos maternos, menos de la edad gestacional, pero hay niveles más bajos en los menores de 28 semanas al nacer. Los contenidos de vitamina D en las fórmulas para prematuros son variables, pero sobre 270ml de consumo diario aportan 400UI o más, según la fórmula en uso. Algo similar ocurre con el fortificante, que aumenta el contenido en la leche materna fortificada para aportar entre 130 a 330ml diarios según el fortificante que se utilice. El metabolismo y la absorción de vitamina D en el prematuro son similares a los del niño de término, de manera que lo importante es garantizar el aporte de 400UI diarias en el período en que los volúmenes enterales son menores, lo que significa gran parte de la hospitalización54. La neonatología europea se inclina por niveles mayores, considerando que pueden nacer deficientes, por lo que amplían la recomendación entre 400-1.000; cifras más cercanas al último valor podrían ser adecuadas en latitudes del extremo sur55. En la práctica, una vez que el prematuro está con aporte enteral total, se pueden aportar 400UI adicionales sin mayor riesgo. En caso de sospecha de déficit se recomienda medir los niveles plasmáticos, que debe estar sobre 20ng/ml (50nmol/l)56.
Vitamina ALos prematuros nacen con niveles menores que los de término y no tiene una óptima absorción por vía enteral. Las dosis adecuadas para producir óptimos niveles y reducción de muerte o DBP son de 5.000UI 3 veces a la semana por 4 semanas por vía intramuscular. La disponibilidad de vitamina A intramuscular ha dificultado este aporte. El uso de altas dosis por vía oral no ha mostrado los mismos efectos, pero dadas las dificultades en el mercado internacional de la vitamina, nuevos estudios con altas dosis por vía oral se encuentran en marcha57,58. Como aporte oral se recomiendan entre 400 y 3.330UI/kg/día. Las fórmulas para prematuros aportan 1.250UI por 100ml, y los fortificantes agregan de 400 a 1.000UI por 100ml. En Chile se aportan 2.000UI de vitamina A al aportar 400UI diarias de vitamina D en forma farmacológica oral.
HierroAdemás de su rol fundamental en el transporte de oxígeno, el hierro participa en la proliferación neuronal, la mielinización, el metabolismo energético, la neurotransmisión y varios sistemas enzimáticos en el sistema nervioso central.
El 80% del hierro del recién nacido de término se acumula entre las semanas 24 y 40 de edad gestacional, a una velocidad de entre 1,6 y 2mg/kg/día. Los recién nacidos pretérmino absorben entre el 34 y el 42% del hierro inorgánico ingerido, lo que supera entre el 7 y el 12% de la ingesta de hierro observada en los recién nacidos de término59.
Estimulan la absorción en los pretérmino: la edad posnatal, la deficiencia de hierro, la dosis de hierro entre las comidas y el nivel normal de vitamina C. Inhiben la absorción de hierro: el uso de fórmula alimentaria, comparada con la leche materna, y las transfusiones de glóbulos rojos60.
La priorización del hierro hacia los eritrocitos, incluso sobre el encéfalo en caso de anemia ferropriva, es responsable de los efectos adversos de la deficiencia de hierro sobre el neurodesarrollo en el recién nacido.
El suplemento de hierro debe iniciarse alrededor de las 2 semanas de vida, con 2 a 4mg/kg/día, con esto mejoran los niveles de ferritina, la hemoglobina y el hematócrito a las 12 semanas. Variables que influyen en esta recomendación son la cantidad de hierro extraído por muestras para exámenes, el número de transfusiones de glóbulos rojos y el tratamiento con eritropoyetina. En el caso de que la alimentación sea básicamente leche materna incluso se ha observado reducción del número de transfusiones con el inicio precoz. Las fórmulas para prematuros aportan de 2 a 2,7mg/kg/día y la leche materna fortificada de 0,2 a 2,4mg/kg/día con volumen de 150ml/kg, lo que se debe considerar en la estimación de suplemento. El aporte adecuado de hierro debe garantizarse todo el primer año de vida, con un aporte diario máximo de 15mg58.
ZincLas recomendaciones actuales de Zn varían entre 1 y 3mg/kg/día. Estas cantidades podrían estar cubiertas según el volumen recibido durante la hospitalización. Con las fórmulas se obtienen de 1,5 a 2,2mg en 150ml/kg/día, y con la leche materna fortificada, de 0,9 a 2mg/150ml. En casos con limitación al aporte de volumen, de 130 a 150ml/kg/día, y en la lactancia a largo plazo, sin fortificante, el suplemento está indicado. Se ha observado déficit clínico de Zn en prematuros con dermatitis periorificial persistente en niños con ileostomía y en alimentados con leche materna después de las 40 semanas de edad posconcepcional61.
Basándose en el impacto que ha tenido el suplemento de Zn en morbimortalidad en niños vulnerables, se ha publicado un estudio de altas dosis de Zn (10mg/día) en el prematuro, para reducir morbilidad en general. Este no documenta la conocida interacción que puede haber en la absorción de cationes divalentes: hierro, zinc y cobre, por lo que parece importante mantener esta posibilidad bajo protocolos clínicos. Por otra parte, el suplemento de Zn en niños con DBP tratados con diuréticos mejora el crecimiento y el estado nutricional de Zn, importante de considerar en el uso crónico de diuréticos62.
Considerando los altos requerimientos del crecimiento recuperacional, la falta de posibilidad de evaluar el estado nutricional de Zn y la frecuencia de déficit reportado, se recomienda asegurar un aporte de 2mg/kg/día, estimando el aporte diario administrado.
El contenido de 1mg corresponde a 4,5mg de sulfato de Zn.
Aspectos adicionales del manejo nutricionalEs importante usar succión no nutritiva durante la alimentación por sonda. Se ha documentado una maduración más rápida de la succión nutritiva, acortamiento de la hospitalización y, en algunos estudios, mejor ganancia de peso62. La estimulación orokinésica perioral ayuda a una transición más rápida de sonda a oral. Los niños con más dificultades para adquirir succión madura son los prematuros menores de 28 semanas, los con DBP y los con RCIU, por lo que el trabajo de estimulación debe ser persistente en estos casos63.
La optimización de la evolución nutricional incluye el masaje moderado, al menos 15min 3 veces al día, realizado por profesionales, técnicos o por los padres capacitados. El tono vagal produce aumento de la actividad gástrica y aumento de la secreción de insulina. El incremento de peso por el masaje se asocia también a aumento de IGF164. Además, se ha descrito modificación en la composición corporal en prematuros varones, disminuyendo la masa grasa y mejorando la masa magra, y con masaje disminuyen los niveles circulantes de adiponectina al disminuir el estrés65.
La kinesiterapia de movilización muestra variables resultados sobre la ganancia de peso, pero es muy consistente en mejoría de la mineralización ósea66. La movilización pasiva y la compresión articular disminuyen la reabsorción ósea e incrementan la formación ósea67.
Casos especialesPrevención de osteopeniaLos niños en mayor riesgo son los menores de 1.000 o menores de 29 semanas, especialmente si tienen patología intestinal, displasia severa, uso de diuréticos o corticoides y nutrición parenteral prolongada (mayor a 4 semanas). El cuidado debe iniciarse la primera semana de vida, controlando y tratando el riesgo de hipofosfemia, especialmente en el RCIU, y si los aportes de aminoácidos son altos. Si hay hipofosfemia en las primeras 3 semanas, se producirá hipercalcemia por la movilización ósea y una insuficiente excreción renal. Posteriormente la calcemia se normaliza, por hipercalciuria.
Los cambios bioquímicos más frecuentes son:
- 1.
Hipofosfemia, que puede ser tan precoz como en la primera semana de vida. El fósforo es un importante constituyente de tejidos blandos (ATP, membranas celulares), donde se privilegia cuando hay rápido crecimiento, incluso removiéndolo del hueso. La respuesta renal es aumentar al máximo la reabsorción tubular de fosfato.
- 2.
Aumento de las fosfatasas alcalinas mayor a 800UI/dl. El compromiso radiológico suele ser tardío. La densitometría ósea DXA, que mide el contenido de mineral del hueso, no es un examen que esté disponible frecuentemente.
El enfoque actual está dirigido a la prevención, y esta debe ser desde los primeros días de vida, manteniendo no solo los niveles séricos de mineral, sino remedando la acreción intrauterina.
En alimentación parenteral, el P debe ser aportado precozmente y, en caso de hipofosfemia, privilegiarlo en la relación Ca:P. Posteriormente, el uso de leche materna fortificada, o las fórmulas de uso habitual de prematuros con altos aportes de Ca y P si no hay leche materna. Tener presente que la alimentación parenteral no aporta mineral en cantidades suficientes para los requerimientos y la restricción de volumen, y el uso de diuréticos interfiere para lograr los aportes requeridos. Se debe evaluar prospectivamente para corregir los déficits. Cuando con la alimentación no se logran los aportes de mineral requeridos, la suplementación con fosfato de K, formulación endovenosa, es la preferida por ser mejor tolerada que otras sales de fosfato. Dosis inicial 10-20mg/kg/día, hasta 40-50mg/kg/día. La inadecuada mineralización ósea puede comprometer la función pulmonar y contribuir a un menor crecimiento.
Las recomendaciones de mineral varían ampliamente: Ca enteral: 120-210mg/kg/día, y P enteral: 80-130mg/kg/día.
Ductus y tratamiento farmacológicoEl ductus arterioso persistente provoca disminución del flujo mesentérico, lo que podría aumentar el riesgo de ECN. Los inhibidores de la ciclooxigenasa para el tratamiento farmacológico del ductus (indometacina, ibuprofeno) disminuyen el flujo mesentérico pero no alteran el aumento normal del flujo intestinal posprandial ni se asocian a mala tolerancia enteral68. Ibuprofeno tiene menor efecto que indometacina en el flujo mesentérico y se asocia a menor incidencia de ECN que indometacina69. Las prácticas clínicas de aporte enteral durante el tratamiento farmacológico del ductus son muy variadas. Clyman y Wickremasinghe70 mostraron que los pacientes que mantienen estímulo trófico durante el tratamiento con indometacina o ibuprofeno demoran menos en alcanzar el volumen enteral total, sin aumento significativo del riesgo de ECN, por lo que se recomienda mantener estímulo enteral con el tratamiento farmacológico precoz. Aportes mayores que el estímulo enteral deberían evaluarse individualmente; por ejemplo, en una reapertura tardía del ductus. Suspender la alimentación posdosis y mantener un aporte de alrededor del 50% del volumen previo por las siguientes 48h puede ser prudente, pero no hay evidencias demostradas. Sobre riesgo de ECN y uso de paracetamol no hay información.
Transfusiones sanguíneasAunque no se ha establecido una relación causal, algunos estudios han mostrado asociación entre transfusiones de glóbulos rojos y ECN, que podría resultar en mayor morbimortalidad y mayor necesidad de resolución quirúrgica. Un metaanálisis de estudios observacionales reportó aumento de la incidencia de enterocolitis 48 a 72h posteriores a transfusión de glóbulos rojos, especialmente en los recién nacidos de menor edad gestacional, menor peso y más graves71. Diversas hipótesis han tratado de explicar el aumento del riesgo de enterocolitis frente a transfusiones. Una de ellas sería que frente a la anemia se produce déficit en la oxigenación intestinal y las transfusiones originarían lesión por reperfusión. Otro factor sería que la isquemia intestinal se produciría como resultado del aumento de la viscosidad, disminución del flujo arterial mesentérico y una reacción inmunológica a nivel intestinal que ocurre frente a la exposición a mediadores biológicamente activos como la hemoglobina libre, citoquinas o fragmentos de glóbulos rojos71-73. Transfusiones de hemoderivados obtenidos hace más de 14días no aumentan el riesgo de enterocolitis comparado con hemoderivados más recientes74. Existe controversia acerca si el momento de la alimentación en relación con la transfusión podría afectar la incidencia de enterocolitis. Algunos estudios muestran que la suspensión de la alimentación durante la transfusión y un aporte del 50% en las 12h siguientes disminuiría la incidencia de enterocolitis73,75. Sin embargo, no hay estudios aleatorizados y controlados que evalúen esta práctica.
Displasia broncopulmonarEl manejo nutricional tiene un impacto importante en modificar el riesgo de DBP, y posteriormente en el tratamiento de esta. El riesgo de DBP aumenta con el mayor aporte de volumen endovenoso, menor aporte nutricional precoz, especialmente proteína y energía total, el retraso del aporte enteral, el uso de aminoácidos y vitaminas vía parenteral sin fotoprotección, el tipo y la duración de lípidos endovenosos, el uso de fórmula versus leche materna, la ausencia de suplemento de vitaminaA y selenio y la restricción del crecimiento intrauterino. Intervenciones nutricionales que reducen estos factores de riesgo contribuyen a disminuir muy significativamente la incidencia de DBP. El uso de vitaminaA, 5.000UI 3 veces a la semana, intramuscular, por un mes, ha reducido su incidencia, pero esta práctica no se ha generalizado por problemas de disponibilidad y rechazo al uso intramuscular.
Por otra parte, el niño con DBP tiene un mayor gasto energético basal, mayor excreción fecal de nutrientes, tolera menos una carga de hidratos de carbono por limitación en la excreción de CO2 y tiene limitación al aporte de volumen; el uso de corticoides y los períodos hipóxicos afectan su crecimiento, el aporte en bolo reduce su eficiencia ventilatoria y aumenta el gasto energético. Estos pacientes requieren el uso de alimentación continua con succión no nutritiva, usar fórmulas concentradas, con muy buena digestibilidad, mantener niveles adecuados de oxigenación y vigilar el aporte nutricional y el crecimiento76,77. La fórmula con 101kcal/100ml ha sido una excelente alternativa. Con esta muy ocasionalmente se puede requerir energía adicional en DBP graves con crecimiento insuficiente. Si no se cuenta con esta leche, se requiere suplemento de energía y probablemente proteínas, y controlar la necesidad de agregar calcio y fósforo según evolución. Eventualmente, usar fortificante de leche materna y energía adicional. Es fundamental estimar los aportes nutricionales de macronutrientes y minerales, incluyendo Zn. En DBP leve generalmente no se requiere un manejo especial y debe evitarse la restricción de volumen, salvo que clínicamente se produzca retención hídrica.
Intestino cortoEsta condición clínica se define como la insuficiencia en la capacidad absortiva del intestino delgado para mantener la hidratación y para proporcionar nutrición suficiente para el crecimiento. En los niños prematuros, la causa más frecuente es la ECN que requiere resección intestinal.
El factor aislado más importante que determina la gravedad de la malabsorción en el síndrome de intestino corto es la longitud intestinal resecada. La longitud del intestino delgado normal a las 25 semanas es de 125cm, a las 30 de 180cm y al término, de 260-275cm. Se requieren al menos 20cm de intestino remanente para lograr independencia de la nutrición parenteral a medio plazo. Otros factores son la conservación de la válvula ileocecal, la capacidad funcional del intestino delgado y del intestino grueso remanentes, y la capacidad del intestino restante de experimentar cambios adaptativos.
El uso precoz de bloqueadores de la bomba de H+ contrarresta el efecto de la hipergastrinemia poscirugía Debe prestarse atención al balance hidroelectrolítico, sobre todo en los niños con ostomías, en los cuales la cuantificación de las pérdidas es muy útil. La alimentación enteral debe realizarse desde un período temprano posterior a la cirugía para generar un efecto trófico, pero el incremento debe ser muy lento, según la magnitud esperada de compromiso intestinal, para no producir diarrea y mayor daño intestinal. Existe controversia en la forma de administración de la alimentación enteral, considerando que la alimentación en bolos produce aumento intermitente de la osmolaridad a nivel intestinal, pudiendo ocasionar diarrea osmótica. Sin embargo, la alimentación en bolos favorece el vaciamiento de la vesícula biliar, por lo que puede alternarse el aporte continuo con bolos una o dos veces al día78.
Con respecto a los componentes óptimos de la dieta, una serie retrospectiva mostró que la alimentación con leche materna o con una fórmula basada en aminoácidos por vía enteral disminuye la duración del requerimiento de nutrición parenteral. La leche materna es una opción que promovería aumento en inmunoglobulinaA secretora y en otros factores inmunológicos y de crecimiento, los cuales son importantes en el fenómeno de adaptación intestinal79. Se recomienda el uso de fórmulas basadas en péptidos, sin lactosa, y con mezcla de lípidos. Los triglicéridos de cadena media se utilizan para mejorar la absorción de grasas en casos de insuficiencia pancreática o disfunción biliar. El uso de triglicéridos de cadena larga disminuye la motilidad intestinal, reduce el flujo por ostomía y podría ayudar en la ganancia de peso, además de favorecer la proliferación de enterocitos y la adaptación de la mucosa intestinal80. Debe mantenerse una cantidad de triglicéridos de cadena larga que asegure aporte de AGE. Generalmente las fórmulas modulares no están adaptadas al prematuro, por lo que requerirán aporte adicional de calcio, fósforo y proteínas, evaluando la tolerancia al agregado de fortificante. La nutrición parenteral requiere catéter central y debe completar los aportes necesarios según la edad gestacional; no debe suspenderse antes de asegurar una buena adaptación intestinal. Debe considerarse la pérdida por ileostomía de Na, K, Cl y Zn. Las pérdidas de Zn son muy elevadas y pueden duplicar los requerimientos normales (800μg/kg/día). El aporte debe avanzar según el volumen de pérdida por la ostomía, que debe ser menor de 20ml/kg/día. Si al suspender la nutrición parenteral la curva de crecimiento se reduce, aunque las pérdidas en la ostomia sean menores de 20ml, la absorción no es suficiente y puede requerir reiniciar nutrición parenteral.
Estos pacientes requieren soporte nutricional parenteral por períodos prolongados, por lo que una complicación secundaria frecuente es la colestasia. Hasta un 25% de los recién nacidos con síndrome de intestino corto desarrollan además colelitiasis.
Para la frecuente complicación de colestasia se usa ácido ursodeoxicólico, derivado hidrófilo del ácido quenodesoxicólico que actúa desplazando ácidos biliares tóxicos endógenos hidrófobos. Puede detener aumento de fosfatasas alcalinas y disminuir la bilirrubina. Vía oral, dosis de 20mg/kg/día distribuidos en 2 tomas por 4 a 6 semanas. La parenteral puede ciclarse solo después de las 44 semanas para evitar hipoglucemia.
En pacientes con pérdida de íleon hay una interrupción de la circulación enterohepática de los ácidos biliares. Los ácidos biliares no absorbidos llegan al colon y causan irritación, que conduce a diarrea secretora. La colestiramina es beneficiosa en el tratamiento de diarrea secretora inducida por ácidos biliares.
Se recomienda que en los niños con ileostomía o yeyunostomía se reconstituya el tránsito intestinal tan pronto como su condición clínica y nutricional lo permita, evaluando la condición intestinal. No hay evidencias claras respecto a las ventajas de disminuir o alargar el período antes de reconstituir, pero es importante evitar el deterioro nutricional y las complicaciones de la parenteral prolongada81.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consenti-miento/asentimiento informado, comité de ética, financia-ción, estudios animales y sobre la ausencia de conflicto deintereses según corresponda.