El osteosarcoma es el tumor óseo maligno más común en la niñez y la adolescencia. Se desarrolla por orden de frecuencia en metáfisis distal de fémur, proximal de tibia y húmero proximal. La variedad de presentación de osteosarcoma telangectásico es rara, y afecta principalmente a niños y adolescentes.
Las opciones de tratamiento quirúrgico son cirugía de salvamento y radical. Actualmente la mayoría de los tumores óseos malignos de la cintura escapular pueden seguir la primera opción.
ObjetivoPresentar una técnica modificada de tenosuspensión para la reconstrucción de defectos humerales en el tratamiento quirúrgico del osteosarcoma de húmero.
Reporte de casoSe presenta el caso de un varón de 16 años de edad con diagnóstico de osteosarcoma telangectásico de húmero tratado con cirugía de salvamento mediante técnica modificada de suspensión con peroné libre vascularizado para la reconstrucción del defecto humeral posterior a resección S345B según la Musculoskeletal Tumour Society (MSTS) y los resultados a 6 y 12 meses.
ResultadosA 6 meses del posquirúrgico existió consolidación del injerto sin complicaciones. A los 12 meses no se encontraron complicaciones. Los resultados funcionales fueron del 82 y 86% MSTS, respectivamente.
ConclusionesLa técnica modificada de suspensión de hombro utilizando peroné vascularizado y tendón del manguito rotador residual otorga resultados satisfactorios en el caso presentado, sin embargo, se requiere de mayor investigación para considerarla como modalidad de tratamiento generalizado en defectos humerales posterior a resección en bloque como tratamiento quirúrgico.
Nivel de evidenciaV.
Osteosarcoma is the most common malignant bone tumour in paediatric patients. The most frequent locations of osteosarcoma are the distal femur, the proximal tibia, and the proximal humerus. Telangiectatic osteosarcoma is rare, most commonly affecting children and adolescents.
Surgical treatment options include limb sparing procedures and amputation, with most shoulder tumours currently being able to be treated without amputation.
ObjectiveTo present a modified sling procedure to reconstruct humeral defects after bone resections in humeral osteosarcoma.
Case reportA 16 year-old male patient with telangiectatic osteosarcoma of the proximal humerus was treated with limb sparing surgery. A modified sling procedure was performed using a vascularised fibular graft to reconstruct the humerus after in-block resection. Results at 6 and 12 months follow up are presented.
ResultsGraft consolidation was observed at 6 months follow-up, and no complications were observed at 6 and 12 months follow-up. Functional results, according to the Musculoskeletal Tumour Society (MSTS), at 6 and 12 months were 82% and 86%, respectively.
ConclusionsThis modified sling procedure using a vascularised fibular graft and rotator cuff tendon showed satisfactory results in this case. Future studies should further evaluate its role in treating humeral defects after in-block resection.
Evidence levelV.
El osteosarcoma presenta una incidencia de 3 casos por millón de habitantes en los Estados Unidos y afecta a 560 niños y adolescentes cada año. El osteosarcoma telangectásico comprende menos del 4% de los casos1–3. En el Instituto Mexicano del Seguro Social, el osteosarcoma se encuentra en el quinto lugar de las neoplasias malignas sólidas en niños3, con un pico de incidencia en la segunda década de la vida1–3. En húmero, ocupa el tercer lugar de frecuencia de presentación con el 11,7% de los casos3.
La resección quirúrgica es la piedra angular del tratamiento del osteosarcoma; la cirugía radical y la de salvamento son las opciones terapéuticas primarias1,2. Entre el 80 y el 90% de los tumores óseos malignos de la cintura escapular pueden ser resecados con seguridad a través de algunos procedimientos de rescate4: el aspecto clave es la conservación de la función de la mano y del codo5–7.
Para la reconstrucción en húmero proximal, existen 2grupos principales de procedimientos: artrodesis5,8–10 y suspensión del hombro5.
Diferentes estudios han documentado que la utilización de injertos para el tratamiento de estas lesiones posterior a resección amplia presenta resultados adecuados5,6. El objetivo de este caso es presentar los resultados obtenidos después de la reconstrucción del defecto humeral por resección en bloque en el tratamiento quirúrgico del osteosoarcoma, utilizando injerto de peroné autógeno vascularizado con una técnica modificada de tenosuspensión.
Caso clínicoSe obtuvo el consentimiento informado del paciente y del tutor y no se cuentan datos que hagan posible la identificación del sujeto.
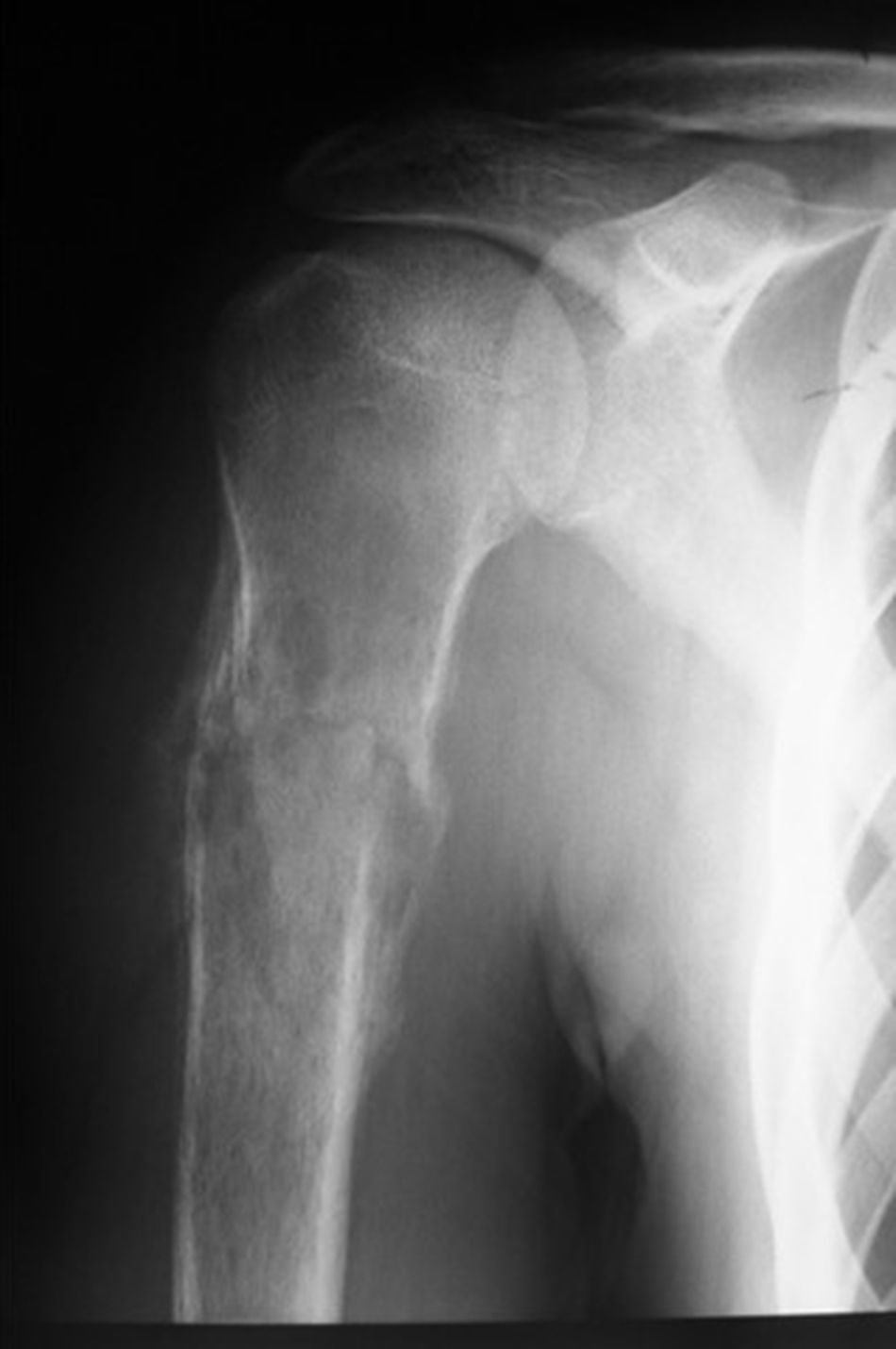
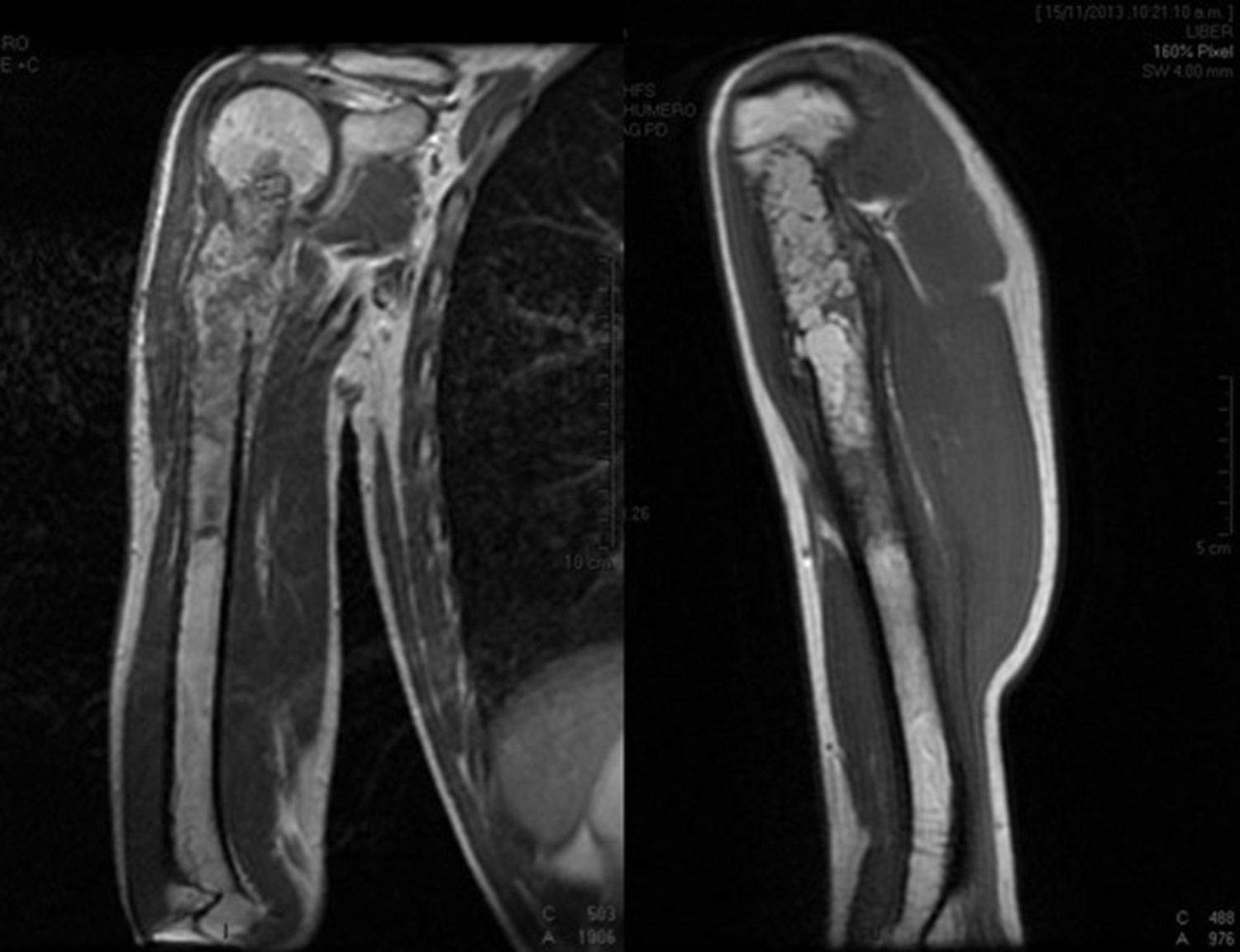
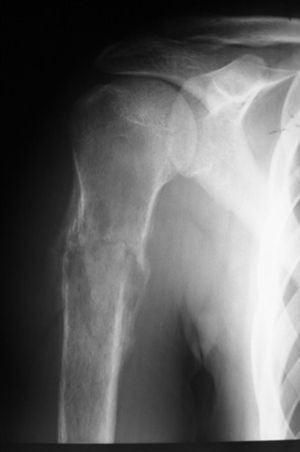
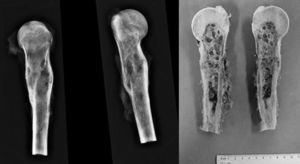
Paciente masculino de 16 años de edad con diagnóstico de osteosarcoma telangectásico estadio Enneking IIB (figs. 1 y 2).
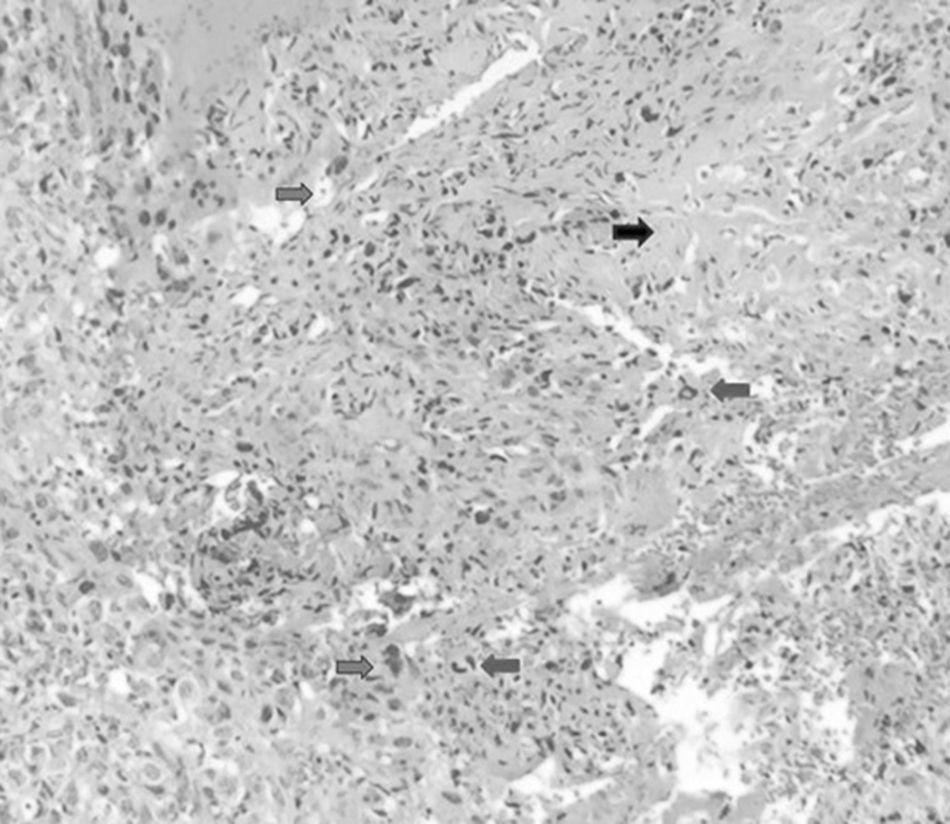
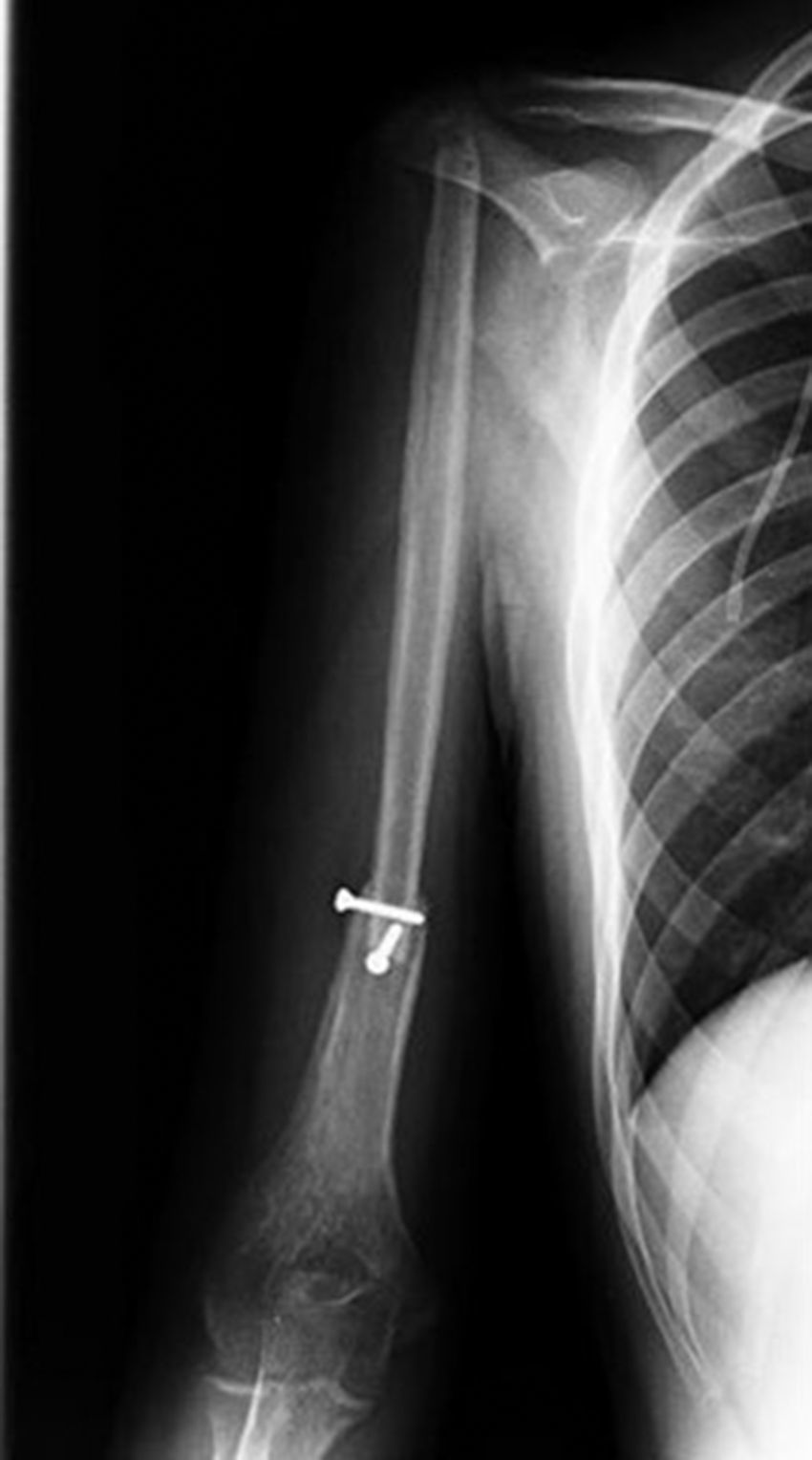
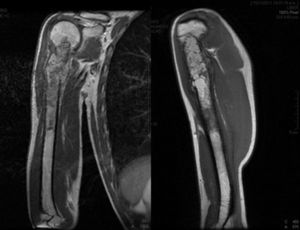
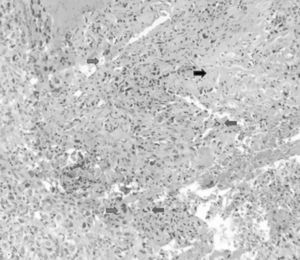
Inicio de padecimiento con dolor en hombro derecho relacionado con estrés; mejoría parcial con reposo y uso de antiinflamatorios no esteroides, de predominio nocturno. Fractura en diáfisis humeral en tejido previamente lesionado al cargar 25kg. Sigue tratamiento conservador con inmovilizador de hombro por 2 meses. Se realiza biopsia incisional con reporte de osteosarcoma telangectásico (fig. 3), y sigue quimioterapia neoadyuvante con adecuada respuesta.
Clínicamente, el miembro torácico derecho presenta calor local en región proximal del brazo, cicatriz por biopsia longitudinal en hombro de 7cm, limitación en movimientos de flexión, rotación externa y abducción activa, sin compromiso neurovascular.
Exámenes de laboratorio sin alteraciones.
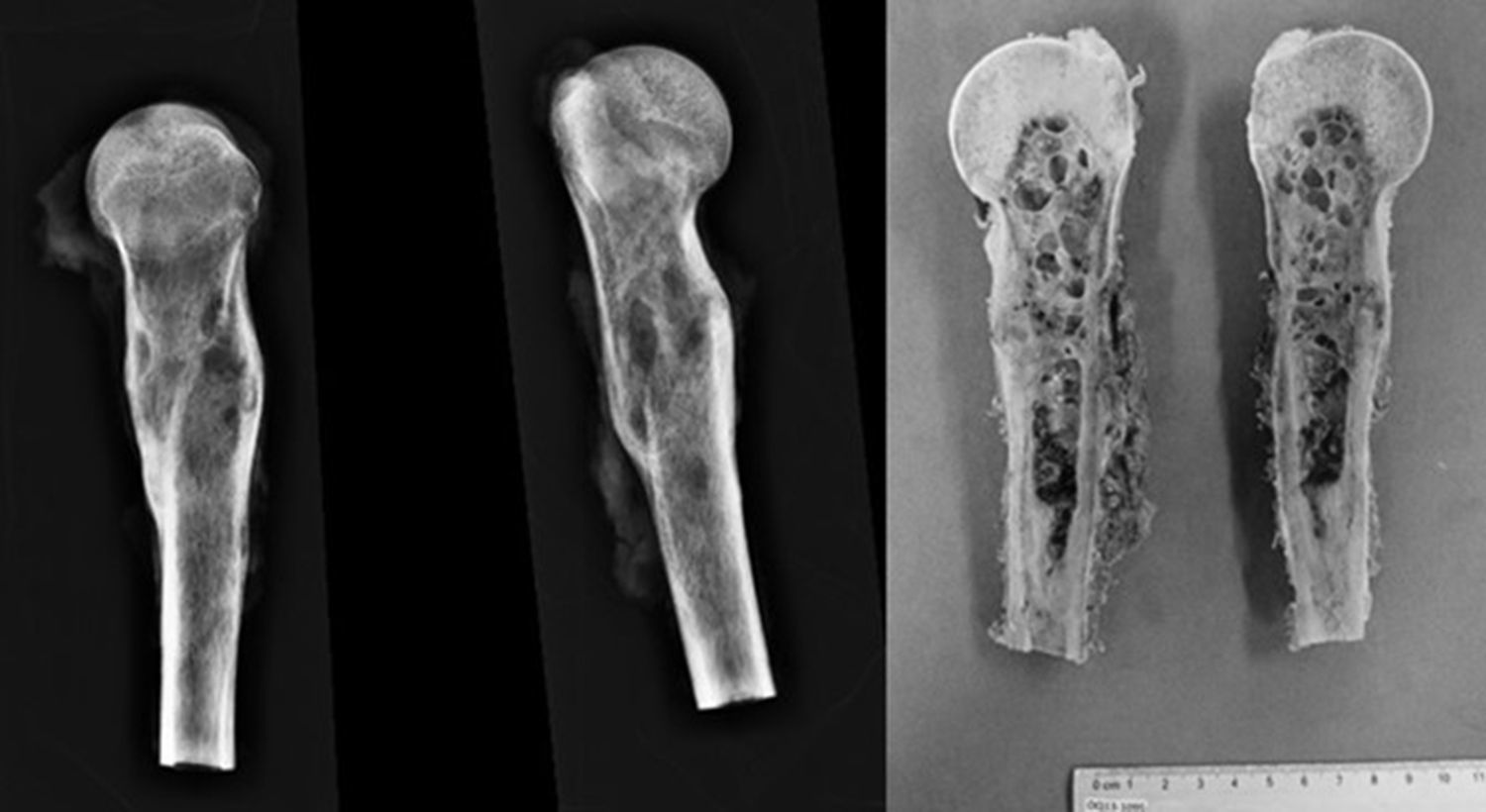
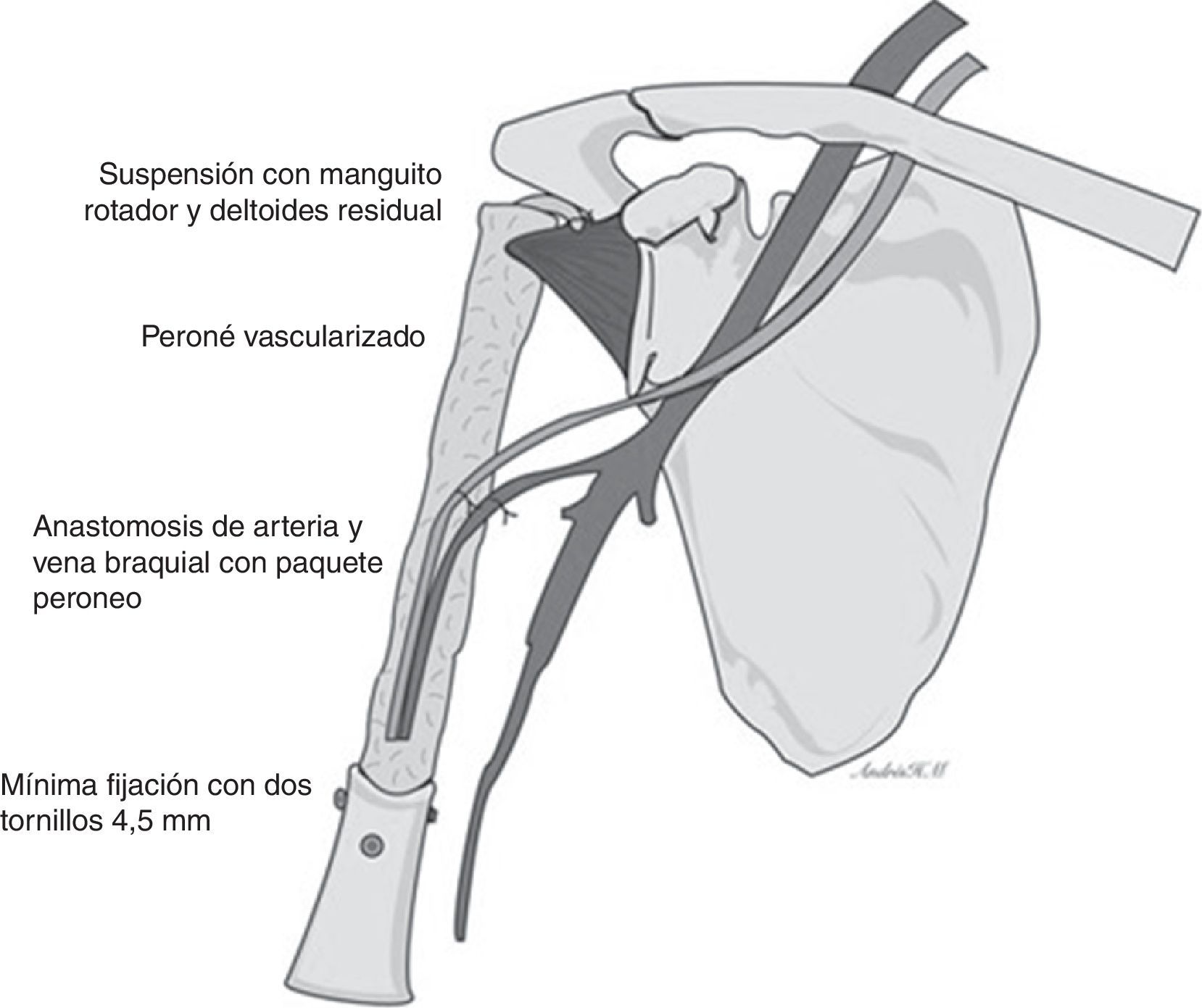
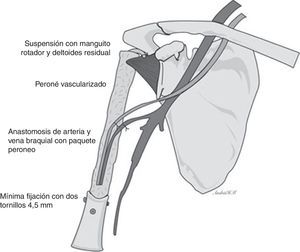
El tratamiento quirúrgico fue de resección marginal S345B de la Musculoskeletal Tumor Society (MSTS) (resección de diáfisis, metáfisis proximal y cabeza humeral con resección parcial de mecanismo abductor) (fig. 4) y reconstrucción esquelética con peroné vascularizado con técnica de tenosuspensión y reconstrucción de partes blandas con colgajo muscular de deltoides.
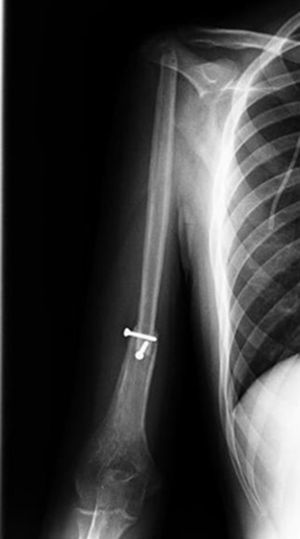
Técnica quirúrgicaSe posiciona al paciente en decúbito dorsal en silla de playa. El equipo de cirugía ortopédica realiza abordaje deltopectoral ampliado hasta tercio distal del brazo, se identifica la vena cefálica y refiere hacia lateral y se avanza en el plano entre el bíceps braquial y pectoral mayor en proximal y hacia distal a través del tabique medial del brazo. Se identifica el nervio radial y se refiere a medial. A nivel de la cintura escapular se alcanza la cápsula de la articulación del hombro y se incide. Se luxa hacia anterior la cabeza humeral. Se realiza osteotomía transversa del húmero 18cm distal al borde articular de la cabeza humeral con sierra oscilante, con preservación parcial del manguito rotador. El servicio de cirugía plástica y reconstructiva toma el injerto de peroné vascularizado con longitud de 20cm y un pedículo de la arteria peronea bajo técnica estándar, evitando la toma de la cabeza a 5cm distal, previa identificación del nervio ciático poplíteo externo. El equipo de cirujanos ortopédicos coloca el injerto de peroné endomedular en el húmero residual y se fija con mínima osteosíntesis: 2tornillos de 4,5mm en extremo superior de diáfisis humeral restante y ortogonales con técnica estándar; acto seguido se realiza suspensión del húmero reconstruido previa perforación del extremo proximal al injerto vascularizado de peroné con broca de 4,5mm para la reinserción del manguito rotador residual. Se realiza capsuloplastia y finalmente el cirujano plástico y reconstructor realiza la anastomosis término-terminal del pedículo vascular del peroné a la arteria braquial por medio de microcirugía, además de rotar un colgajo del deltoides para asegurar la reconstrucción de las partes blandas, y se sutura por planos (figs. 5 y 6).
El estudio histopatológico muestra necrosis tumoral mayor a 95% (Huvos 1) con patrón telangectásico y afección multifocal de la cortical sin rotura. El 5% estaba constituido por áreas sólidas con células atípicas aisladas reactivas, cambios asociados a tratamiento quimioterápico. Márgenes y médula ósea libres de tumor.
Posteriormente al tratamiento quirúrgico siguió con quimioterapia adyuvante. A los 2 meses del posquirúrgico se observó consolidación radiográfica, sin evidencia de hipertrofia del injerto ni complicaciones en sitio donador y receptor a los 6 y 12 meses del posquirúrgico. Los resultados funcionales obtenidos de acuerdo con la clasificación de la MSTS de miembro superior11 fueron 82 y 86%, respectivamente.
DiscusiónLa cirugía de rescate con resección S345 (resección de diáfisis, metáfisis proximal y cabeza humeral) de acuerdo con el sistema de clasificación de la MSTS12, y la Malawer I (resección humeral proximal intraarticular)13 A y B (sin y con resección parcial o total del mecanismo abductor, respectivamente) se encuentran indicadas cuando los tumores óseos de húmero proximal no invaden la articulación glenohumeral y el defecto residual puede ser reparado con injerto libre vascularizado de peroné y suspensión del hombro4. Tal como lo describen Wada et al.5 y, de acuerdo con la evidencia disponible, el peroné vascularizado posee mejor incorporación y supervivencia celular ósea, lo que disminuye la tasa de complicaciones frente a los injertos no vascularizados y los aloinjertos7.
El aspecto clave en cirugía de salvamento posterior a la resección de tumores de húmero proximal es conservar la función de la mano y del codo, lo cual fue conseguido en nuestro paciente5–7. Sin embargo, ninguna de las técnicas actualmente disponibles compensa adecuadamente la pérdida funcional después de la resección. En la reconstrucción presentada, intencionadamente se provoca un hombro suspendido5.
El defecto del húmero postresección del tumor así como las preferencias del equipo quirúrgico favorecieron la utilización de un injerto libre vascularizado de peroné14,15, el cual se fijó con 2tornillos de 4,5mm, lo cual no ha sido descrito previamente ya que las técnicas de fijación interna del injerto están contraindicadas por la desvascularización16.
La consolidación ósea fue conseguida en 6 meses de acuerdo con lo reportado17.
Wada et al. describieron la utilización de injerto libre vascularizado de peroné como espaciador funcional, y un procedimiento de suspensión. Estos autores incluyen la cabeza del peroné en el injerto, consiguen la fijación con una placa de compresión dinámica, utilizan tendón del bíceps y palmar mayor y alambre de Kirschner para la suspensión en la porción restante de la escápula, y rotan un colgajo del dorsal ancho para conseguir una adecuada cobertura muscular. Nosotros hemos hecho modificaciones, puesto que creemos ocasionar menor daño neurológico sobre el nervio ciático poplíteo externo con la modificación de la toma del injerto; no utilizamos la placa de compresión dinámica para evitar la desvascularización; preferimos utilizar el manguito rotador residual para no ocasionar mayor detrimento de la función de la extremidad superior y no hemos necesitado utilizar alambre de Kirschner. Estos autores obtuvieron resultados funcionales del 79% en MSTS para miembro superior con esta técnica5, mientras que Masamichi et al. obtuvieron resultados del 80% en MSTS16. Sin embargo, los márgenes quirúrgicos del mecanismo abductor influyen en el resultado funcional6.
El procedimiento de suspensión es técnicamente fácil y resulta innecesaria la inmovilización posquirúrgica, con bajas tasas de fractura5.
Con respecto a la consolidación con utilización de injerto vascularizado de peroné en húmero proximal, conseguimos datos radiológicos a los 2meses de seguimiento e hipertrofia a los 6 meses de posquirúrgico. Hsu18 y Minami19 en 2series separadas reportaron consolidación del 90%, mientras que Yajima20 la reportó en un promedio de 4,4 meses. Ihara21 describió defectos óseos promedio de 13cm, con consolidación en 5,2 meses. Eward, después de la reconstrucción primaria, observó consolidación del 77% a los 6 meses22. Masamichi evaluó 3tumores de húmero proximal con estadificación Enneking IIB, utilizó además técnicas de suspensión y reportó consolidación en 3,4 meses, e hipertrofia leve del injerto16. Hriscu, posteriormente a la resección tipo S345B de MSTS, reportó longitud media del injerto de 22cm sin procedimientos de suspensión, con hipertrofia del injerto de 6 a 7 meses después de la cirugía en 3 casos23.
Las complicaciones del sitio receptor incluyen seudoartrosis, consolidación viciosa, infección, fractura por fatiga, problemas de cicatrización de la herida, lesión nerviosa, síndrome compartimental, falla del injerto y disfunción de los tendones flexores y extensores. La incidencia de complicaciones va del 25 al 50%7,24. Tanaka25, Eward22 y Kühner26 han reportado contractura isquémica de Volkmann, reabsorción y fracturas del injerto, entre otras. Igualmente ha sido descrita la morbilidad en el sitio donador16.
Sin embargo, existen múltiples opciones de reconstrucción tales como: aloinjerto osteoarticular, peroné autógeno, transposición clavicular autógena (clavicula pro húmero), reimplantación ósea con tumores desvitalizados, reemplazo con prótesis tumorales, composites aloinjerto-prótesis, entre otros. Cada método tiene sus ventajas y desventajas, ya que no hay una estrategia reconstructiva óptima.
Getty et al.27 reportaron que el puntaje funcional promedio en MSTS fue del 70% en 16 pacientes y concluyeron que, aunque el injerto osteoarticular fue una opción del húmero proximal, no fue rutinariamente utilizado este procedimiento a causa de la tasa de complicaciones extremadamente alta. Rödl et al.28 reportaron entre 17 aloinjertos osteoarticulares, solo 7 con supervivencia de 5 años, y 4no requirieron de cirugías adicionales. Por ello, creen que el uso de aloinjertos en el tratamiento de tumores malignos de alto grado debería ser considerado como una solución temporal. Kitawaga et al.29 reportaron que, para artrodesis con aloinjerto, artroplastia protésica y clavícula pro húmero, tasas funcionales MSTS promedio de 83, 76 y 72%. Rödl et al.30 reportaron resultados funcionales promedio del 79% MSTS para aloinjertos osteoarticulares, clavícula pro húmero y prótesis tumorales. Además el grupo de Rödl encontró que el reemplazo protésico del húmero proximal fue el procedimiento más seguro y la clavícula pro húmero requirió de más revisiones y fue una alternativa en situaciones especiales. Tsukushi et al.31 encontraron una evaluación funcional MSTS promedio del 69% en 7 pacientes con reconstrucción a través de clavícula pro humero y concluyeron que este procedimento fue un método útil, especialmente en pacientes jóvenes y en pacientes con involucro de la extremidad no dominante. Krieg et al.32 reportaron 31 pacientes, quienes fueron tratados con un injerto no vascularizado de peroné después de la resección de tumores musculoesqueléticos y concluyeron que este método fue más simple, menos costoso y con reconstrucción biológica con mejores resultados a largo plazo. Kassab et al.33 reportaron que los puntajes promedio MSTS y las estrategias reconstructivas fueron respectivamente del 88% para prótesis reversas en 7 pacientes, del 76% para aloprótesis en 3, del 72,6% para prótesis masivas en 15, del 75% para artrodesis escapulohumeral en 3 y del 80% para clavo endomedular cementado en un paciente.
El grupo de Kassab atribuye que el resultado funcional después de resección y reconstrucción de húmero proximal depende del tipo de resección ósea, del estatus de sistema abductor y del método de reconstrucción y, así, propusieron un algoritmo de reconstrucción. En este grupo, las estrategias reconstructivas de húmero proximal después de la resección y sus puntajes funcionales MSTS fueron: clavo endomedular cementado en un caso (57%), prótesis proximal humeral en 7 (promedio 70%), aloinjertos osteoarticulares en 3(70, 73, 87%), desvitalización tumoral ósea y reimplante en 4(promedio 84%), e injerto autógeno de peroné en 2(83 y 80%). El puntaje funcional promedio fue del 78%.
Por tanto, a pesar del pequeño número de casos para diferentes opciones, existen muchas estrategias de reconstrucción para después de la resección de húmero proximal, y, las extremidades rescatadas pueden recuperar la mayoría de sus funciones en el contexto de puntajes funcionales discrepantes, incluso si los componentes de reconstrucción funcionan solo como espaciadores.
El injerto utilizado posee ventajas frente a los no vascularizados y aloinjertos7, muchos tumores de la cintura escapular pueden ser tratados con varias técnicas de rescate, incluyendo el reemplazo protésico, el auto- o aloinjerto osteoarticular, la desvitalización tumoral y el reimplante, que dependen en gran medida de la evaluación y planificación preoperatoria, de la extensión de la resección y de la preferencia del cirujano.
ConclusionesLa técnica modificada de suspensión de hombro presentada utilizando peroné vascularizado y tendón del manguito rotador residual otorgó buenos resultados en este caso en particular. Sin embargo, se requiere de mayor investigación y de estudios prospectivos controlados para la validación de esta técnica posterior a la resección en bloque de húmero proximal en el salvamento de extremidad como tratamiento quirúrgico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEn la elaboración del presente artículo, no se requirieron inversiones adicionales ni aportaciones económicas por terceros.
Conflicto de interesesEl equipo de investigadores no presentó aportaciones por terceros ni patrocinios.
A Andrés Herrera Mandujano por la elaboración de la esquematización de la técnica quirúrgica.