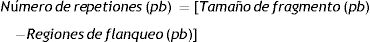Se describe el primer aislamiento y la tipificación molecular de Leptospira borgpetersenii serovar Hardjo Bovis en Argentina, obtenido a partir de orina de vacas abortadas de un rodeo de cría ubicado en Saladillo, provincia de Buenos Aires. Los abortos coincidieron con un período de importantes inundaciones, en el que varios animales presentaron títulos serológicos sospechosos y posterior seroconversión. El porcentaje de abortos alcanzó el 3,5% del total del rodeo, compuesto por 1700 vacas, y se aisló el microorganismo en 7 de 20 muestras de orina obtenidas.
We here describe the first isolation and molecular typing of Leptospira borgpetersenii serovar Hardjo Bovis in Argentina, obtained from urine of aborted cows from a breeding herd located in Saladillo, Buenos Aires Province. The abortions occurred in coincidence with important floods with many cows presenting suspicious serological titers and subsequent seroconversion. The percentage of abortions was 3.5% of a herd of 1700 cows and the microorganism was isolated from 7 of the 20 urine samples obtained.
La leptospirosis bovina ha sido descripta en muchas regiones ganaderas del mundo. Provoca elevadas pérdidas económicas debido a abortos, infertilidad, disminución de la producción láctea y muerte de animales, constituyendo siempre un factor de riesgo para los humanos que trabajan en estrecho contacto con animales portadores14.
El avance de la biología molecular permitió poner de manifiesto una enorme diversidad genética en el género Leptospira y ha modificado radicalmente su taxonomía. La comparación de la cepa de referencia Hardjoprajitno con cepas aisladas de bovinos en Estados Unidos permitió establecer importantes diferencias a nivel genético, a pesar de que serológicamente eran indistinguibles8. Se comenzó a discriminar al serovar Hardjo en tipos o genotipos Hardjoprajitno y Hardjo Bovis.
En la actualidad, la clasificación genética refleja estas diferencias, ya que el genotipo Hardjoprajitno está incluido dentro de la genomoespecie Leptospira interrogans y el genotipo Hardjo Bovis dentro de la genomoespecie Leptospira borgpetersenii.
La importancia epidemiológica de esta diferenciación es que el hospedero de mantenimiento de L. borgpetersenii serovar Hardjo tipo Hardjo Bovis es el bovino, especie animal a la cual está adaptado. Dicho serovar se encuentra ampliamente distribuido en todo el mundo2.
En Argentina, existen numerosos reportes de aislamientos de leptospiras de casos clínicos en bovinos, donde el serovar predominante ha sido Pomona, con algunos aislamientos esporádicos de Canicola1,4,7.
Hasta la fecha no existen reportes de aislamiento de L. borgpetersenii serovar Hardjo Bovis de casos clínicos de leptospirosis bovina. Sin embargo, dentro de la región, se han reportado aislamientos de L. borgpetersenii serovar Hardjo Bovis en Chile13, Brasil3 y Uruguay14.
El objetivo de este trabajo es describir el primer aislamiento de L. borgpetersenii serovar Hardjo Bovis a partir de un caso clínico de leptospirosis bovina en Argentina.
El brote se presentó en un establecimiento de cría próximo a la localidad de Saladillo (35° 38’ 22.1“S 59° 46’ 57.6”W), provincia de Buenos Aires, durante los meses de abril y mayo del 2017, en un período de elevadas precipitaciones e inundaciones, que afectaron a gran parte de la región pampeana. En el establecimiento se vacunó para la prevención de enfermedades reproductivas, entre ellas leptospirosis. La vacuna incluía únicamente al serovar Pomona. Se presentaron abortos en aproximadamente un 3,5% de un total de 1.700 vacas entre abril y mayo. El veterinario asesor remitió muestras pareadas de suero a un laboratorio privado para estudios serológicos. Se encontraron títulos positivos (entre 1:800 a 1:1.600) por microaglutinación y seroconversión frente a los serovares Wolffi y Hardjo.
Para intentar el aislamiento de leptospiras, se extrajo orina de animales abortados. Se aplicó furosemida (Salix, 10ml por animal, por vía intravenosa) (MSD, N.J. USA.) a 20 vacas. La orina (50ml) se colectó en un frasco plástico estéril de boca ancha a partir del chorro medio.
De cada muestra de orina se sembraron 0,2ml en un tubo que contenía 5ml de medio EMJH semisólido con 5-fluorouracilo. La siembra se hizo in situ, pocos minutos después de obtenida la muestra, al abrigo de la llama de un mechero.
De cada tubo sembrado se efectuaron inmediatamente 2diluciones seriadas (1:10 y 1:100) en el mismo medio de cultivo.
Los tubos sembrados se llevaron al laboratorio a temperatura ambiente y se incubaron a 28-30°C. La presencia de leptospiras se observó al microscopio de campo oscuro entre los 10 y 15 días de incubación. Las cepas aisladas se repicaron a medio EMJH líquido para poder efectuar una tipificación por microaglutinación hasta nivel de serogrupo. Las 7 cepas aisladas se identificaron como pertenecientes al serogrupo Sejroe utilizando sueros hiperinmunes de referencia (Royal Tropical Institute [KIT]). Los títulos aglutinantes fueron de 1:12.800 con suero anti-Hardjo.
Los aislamientos se trasladaron desde Biogénesis Bagó al Laboratorio de Leptospirosis de INTA Castelar para su tipificación molecular.
Para la extracción de ADN genómico se tomaron 20μl del cultivo en medio EMJH semisólido utilizando una resina quelante Chelex-100 (BIO-RAD, CA, USA). Una vez obtenido el ADN purificado, se congeló a−20°C5.
Se puso a punto una PCR en tiempo final para la detección específica del serovar Hardjo Bovis utilizando un par de primers que amplifican el gen IS1533, el cual corresponde a 85 copias del genoma de L. borgpetersenii serovar Hardjo Bovis10. Los primers utilizados fueron los siguientes: P1805 5́- GCGGAAAGTGAACCGTATCGAG-3́ y P1809 ́5-CTGATATTCGCGGGTTGGAAGG-3́. Los amplicones tienen 630 pares de bases. El volumen final de reacción fue de 25μl y cada reacción de PCR contenía buffer (20mM Tris-HCl, pH 8,4; 50mM KCl), 200μM dNTPs, 2μM de cada primer, 1mM MgCl2, 1,25 U Taq DNA polimerasa (Invitrogen) y 5μl de templado de ADN. El programa de ciclado fue 94°C durante 2min, seguido de 30 ciclos de 94°C por 1,5min, 67°C durante 2min, 72°C durante 1min, con una extensión final de 10 min a 72°C. Los amplicones obtenidos (15μl) se corrieron en un gel de agarosa al 2% en buffer TAE 2X (40mM Tris-acetato, 1mM EDTA) y teñido con bromuro de etidio 0,2μg/ml durante 60 min a 100 V. El tamaño de los amplicones fue visualizado en un transiluminador de luz UV de cabina cubierta (Uvi Tec modelo BTS-20.M) (Uvi Tec, Cambridge, UK
Embiotec, CABA, Argentina). Para ver el tamaño de las bandas obtenidas se corrió el gel con un marcador de 100 pb (Embiotec).
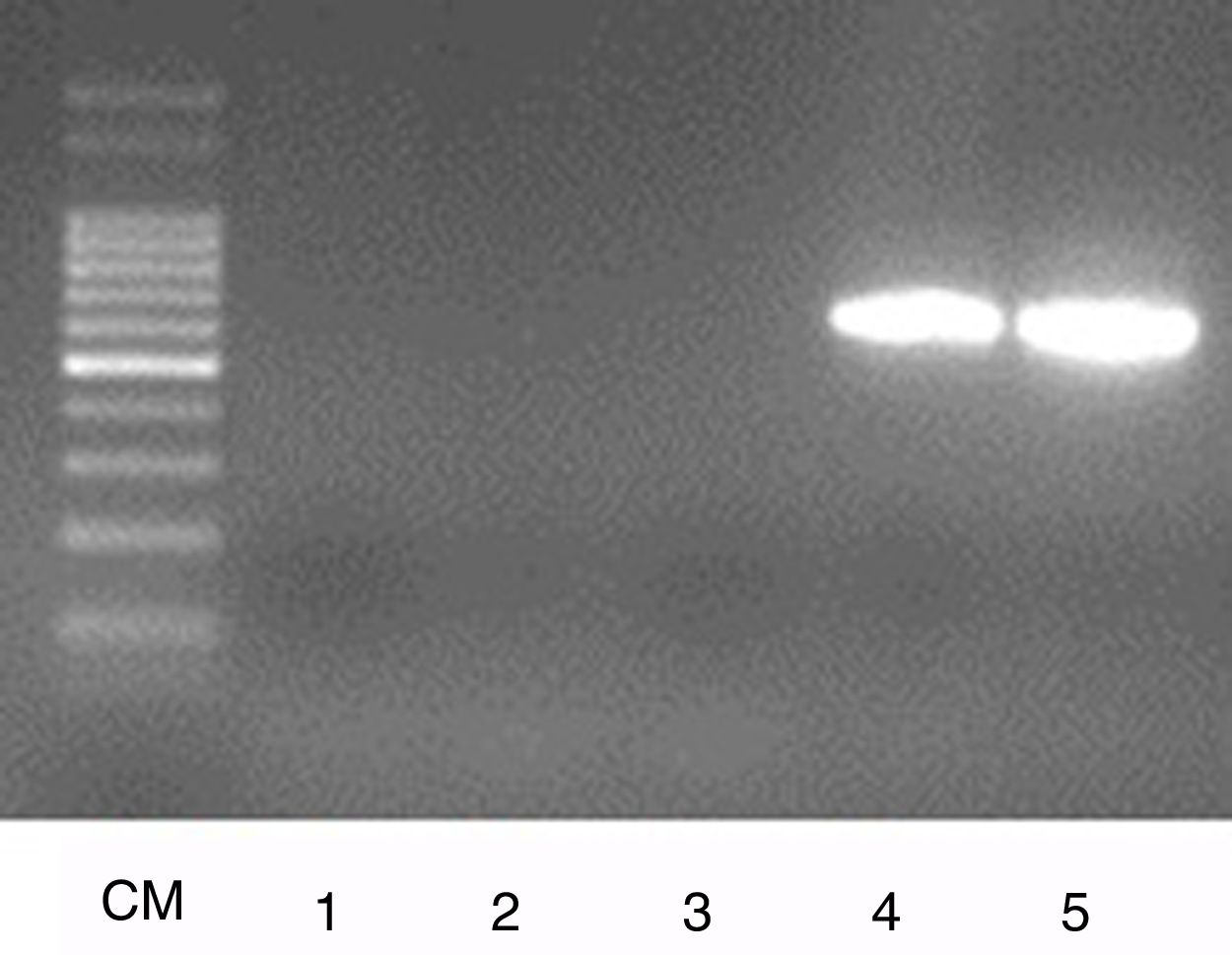
Se pueden observar, en la figura 1, los productos obtenidos con la PCR para el serovar Hardjo Bovis, lo cual confirma que las cepas aisladas pertenecen a este serovar.
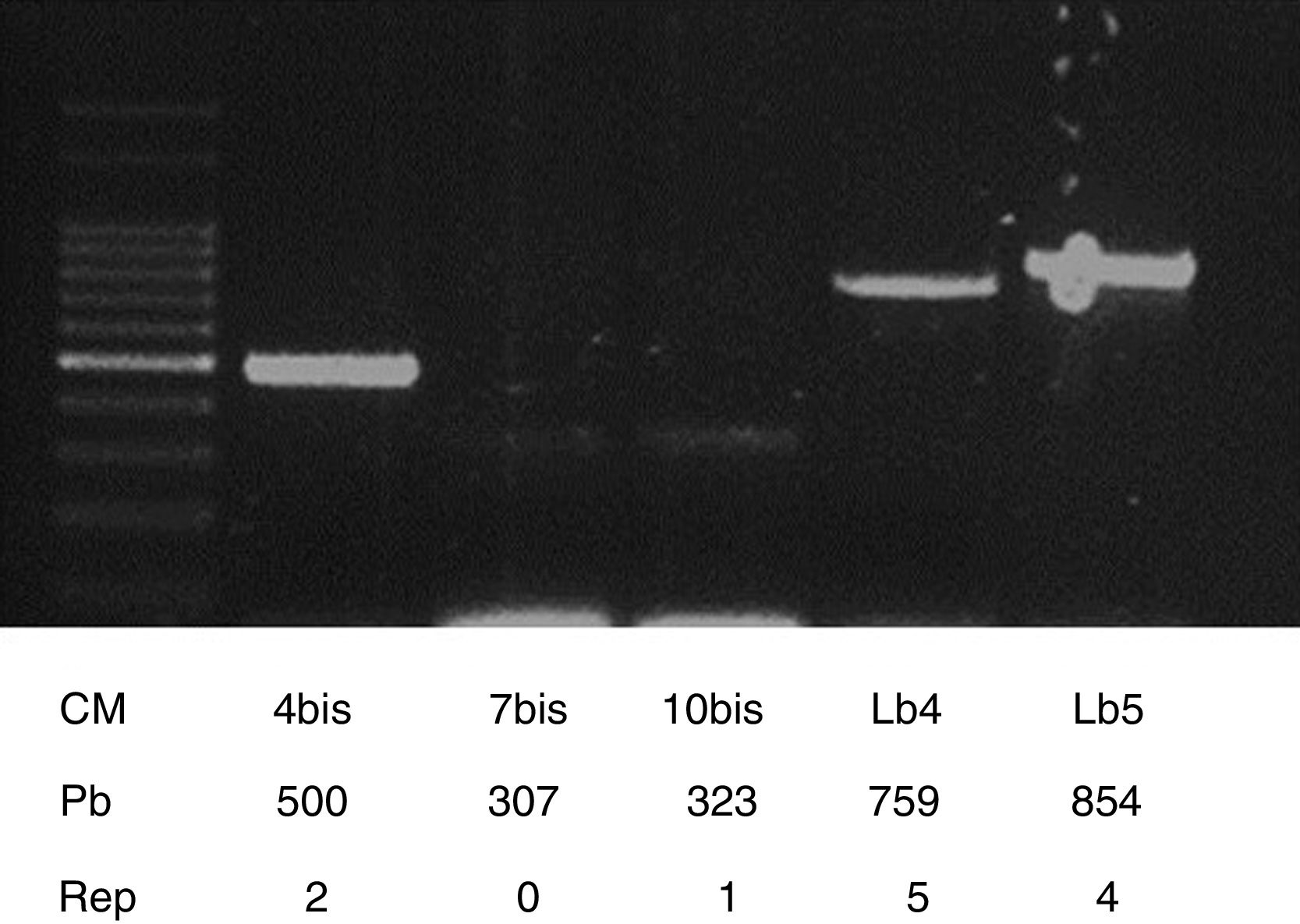
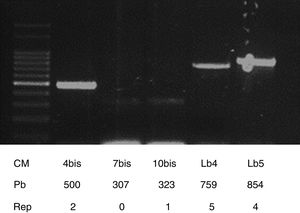
Para la tipificación molecular de la cepa aislada se realizó MLVA, utilizando los primers propuestos por Salaün et al.10 para flanquear los loci: VNTR4 (4a_bis: 5́- AAGTAAAAGCGCTCCCAAGA-3́; 4b_bis 5́-: ATAAAGGAAGCTCGGCGTTT), VNTR7 (7a_bis: 5́-GATGATCCCAGAGAGTACCG-3́; 7b: 5́- TCCCTCCACAGGTTGTCTTG-3́), VNTR10 (10a_bis: 5́- GAGTTCAGAAGAGACAAAAGC-3́; 10b_bis 5́-: ACGTATCTTCATATTCTTTGCG-3́), VNTRLb4 Lb4a: 5́-AAGAAGATGATGGTAGAGACG-3́; Lb4b: 5́- ATTGCGAAACCAGATTTCCAC-3́) y VNTRLb5 (Lb5a: AGCGAGTTCGCCTACTTGC-3́; Lb5b: 5́- ATAAGACGATCAAGGAAACG-3́). El volumen final de reacción fue de 50μl y cada reacción de PCR contenía buffer (20mM Tris-HCl, pH 8,4; 50mM KCL), 200μM dNTPs, 2μM de cada primer, 2mM MgCl2, 1,25 U Taq DNA polimerasa (Invitrogen) y 5μl de templado de ADN.
El programa de ciclado fue 94°C durante 5min, seguido de 35 ciclos de 94°C por 30 s, 55°C durante 30 s, 72°C durante 90 s, con una extensión final de 10 min a 72°C. Los productos obtenidos se corrieron en un gel de agarosa, de acuerdo con lo descripto en el punto anterior. Se utilizó el programa GelAnalyzer 2010ª (Gel Analizer 19.1, Istvan Lazar Jr., PHD e Itsvan Lazar Sr. PHD) (http://www.gelanalyzer.com), para determinar con exactitud los tamaños correspondientes a las bandas. A partir de esos datos se pudo calcular la cantidad de repeticiones o números de copias presentes (alelos), con la siguiente fórmula:
Con el número de repeticiones o copias para cada VNTR flanqueado ya determinado, se obtiene un código numérico de la cepa tipificada. Este código representa el genotipo de la cepa y se compara con la tabla de repeticiones publicada en el trabajo de Salaün et al.10. De esta manera, se determinó que la cepa aislada presentaba un perfil genético idéntico a L. borgpetersenii serovar Hardjo Bovis cepa Sponselee (2, 0, 1, 5, 4) (fig. 2).
Una vez finalizada la tipificación en Argentina, se remitieron las cepas aisladas al KIT con sede en Holanda, para obtener la confirmación en un laboratorio de referencia a nivel mundial. La tipificación serológica confirmó que los aislamientos remitidos pertenecían al serogrupo Sejroe, serovar Hardjo. La identificación a nivel de serovar se realizó por microaglutinación con un panel de anticuerpos monoclonales, según Terpstra et al.12.
Esta tipificación se complementó con PCR para discriminar entre L. interrogans serovar Hardjoprajitno y L. borgpetersenii serovar Hardjo Bovis, dado que no pueden ser diferenciadas serológicamente. El resultado confirmó que los aislamientos remitidos pertenecen a L. borgpetersenii serovar Hardjo Bovis.
En este trabajo se describe por primera vez la caracterización molecular de cepas aisladas de un caso clínico bovino como L. borgpetersenii serovar Hardjo Bovis en el país, confirmando su implicancia como agente causal de abortos en bovinos.
La presentación clínica difiere bastante respecto de los casos en los que está involucrado el serovar Pomona, considerando que en esas ocasiones los abortos suelen presentarse en forma de tormenta, en el último tercio de la gestación y en porcentajes muy elevados, que pueden alcanzar hasta el 50%. Los abortos, en el caso descripto en este trabajo, se produjeron en el tercio medio de la gestación y en un porcentaje de animales mucho más bajo (3,5% sobre un rodeo de 1.700 animales), en un período de aproximadamente 2 meses.
Estos últimos 2factores dificultan la visualización del problema por parte del personal responsable de la hacienda: un porcentaje relativamente bajo de pérdidas y con abortos más tempranos y, por ende, de menor tamaño, que no se encuentran en el campo y no disparan una alerta para consultar al veterinario. El resultado final suele ser un porcentaje de vacas sin ternero al pie al final de la parición, cuando la confirmación del diagnóstico resulta muy dificultosa, si no imposible.
La identificación precoz de este rodeo en el momento en que se estaban produciendo los abortos, la toma de muestras, la siembra inmediata de la orina (en el campo) y la selección de los medios de cultivo resultaron claves para poder aislar este microorganismo en 7 de 20 animales muestreados.
Desde hace muchos años existe evidencia serológica que indica la presencia del serovar Hardjo en nuestro país, sumado a escasos aislamientos a partir de material obtenido en frigoríficos9.
Este primer aislamiento de un caso clínico constituye solamente un primer paso, considerando que se deben seguir obteniendo aislamientos y efectuar estudios que permitan caracterizar la enfermedad en nuestro entorno.
Se debe desarrollar conocimiento a fin de entender la epidemiología y la patogenia a nivel local y regional, así como reproducir experimentalmente la enfermedad en animales jóvenes, en hembras que van a recibir servicio y en hembras preñadas. Asimismo, es importante investigar su presencia en el aparato genital, donde también está descripta su localización.
Es necesario estudiar el papel de este serovar en explotaciones lecheras, donde en teoría debería estar mucho más difundido dado el estrecho contacto entre animales.
El papel potencial de L. borgpetersenii serovar Hardjo Bovis como agente zoonótico no ha sido aún suficientemente investigado, dado que los casos reportados de leptospirosis rural en humanos son escasos, y cuando se han efectuado aislamientos o serología de los pacientes, el serovar involucrado fue Pomona6,11.
La metodología utilizada para la toma de muestras con aplicación de diurético, siembra inmediata en el campo, medio de cultivo y diluciones permitió aislar L. borgpetersenii serovar Hardjo Bovis en 7 de 20 animales muestreados (35%), un porcentaje de recuperación elevado considerando la dificultad intrínseca de aislar leptospiras y, más aún, tratándose particularmente de este serovar.
La tipificación realizada en Argentina por microaglutinación hasta nivel de serogrupo, PCR y MLVA fue confirmada por los resultados efectuados en un centro de referencia mundial como el KIT. De este modo, se demostró la participación de este serovar como agente causal de abortos bovinos en Argentina.
FinanciaciónLaboratorio Biogénesis Bagó.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Dra. Julie Collins-Emerson, de Nueva Zelanda, por compartir desinteresadamente sus métodos para el aislamiento.