La neurocisticercosis es la enfermedad parasitaria más frecuente del sistema nervioso central. Es causada por las larvas de Taenia solium, las cuales pueden estar alojadas en distintas localizaciones anatómicas. En países como España existe una prevalencia en ascenso debido, principalmente, a la inmigración desde regiones endémicas. Las formas extraparenquimatosas son menos frecuentes, pero más graves por su tendencia a producir complicaciones. La neuroimagen desempeña un papel primordial en el diagnóstico y seguimiento de esta enfermedad, apoyada en la serología y un contexto clínico-epidemiológico compatible. El tratamiento de elección son los fármacos cisticidas albendazol y praziquantel, habitualmente se asocian a estos corticoides y, cuando corresponde, la cirugía. Se presenta un caso de neurocisticercosis con afectación simultánea intraventricular y subaracnoidea en su forma racemosa gigante.
Neurocysticercosis is the most frequent parasitic disease of the central nervous system. It is caused by the larvae of Taenia solium, which can affect different anatomical sites. In Spain there is an increasing prevalence mainly due to immigration from endemic areas. The extraparenchymal forms are less common, but more serious because they usually develop complications. Neuroimaging plays a major role in the diagnosis and follow-up of this disease, supported by serology and a compatible clinical and epidemiological context. First-line treatments are cysticidal drugs such as albendazole and praziquantel, usually coadministered with corticosteroids, and in some cases surgery is indicated. We here report a case of neurocysticercosis with simultaneous intraventricular and giant racemose subarachnoid involvement.
La neurocisticercosis (NCC) es la patología causada por la localización en el sistema nervioso central (SNC) de la larva del helminto Taenia solium. Es una enfermedad endémica en la mayor parte de países en vías de desarrollo. Según el lugar en el que se alojan los quistes del parásito, la NCC se clasifica en parenquimatosa y extraparenquimatosa. Esta última forma suele presentar un comportamiento agresivo, dada su gran predisposición a producir complicaciones. Si las vesículas se alojan en cisternas amplias, como la silviana, pueden crecer libremente hasta adquirir un tamaño gigante (> 50mm), dando lugar a la denominada forma racemosa. Presentamos un caso en el que coexisten en el mismo paciente 2 formas infrecuentes de esta enfermedad, una NCC racemosa gigante y una NCC intraventricular con afectación del tercer ventrículo.
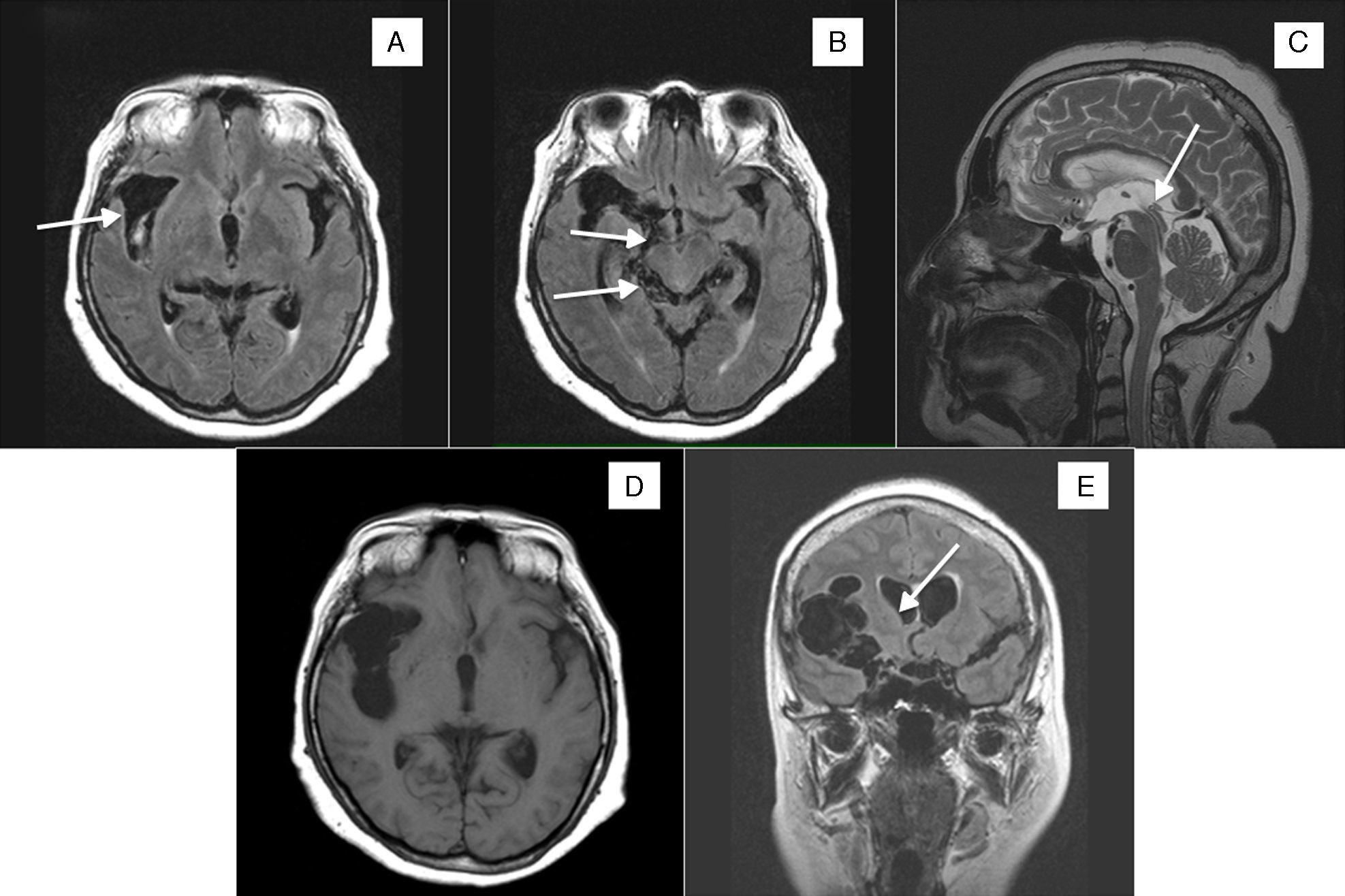
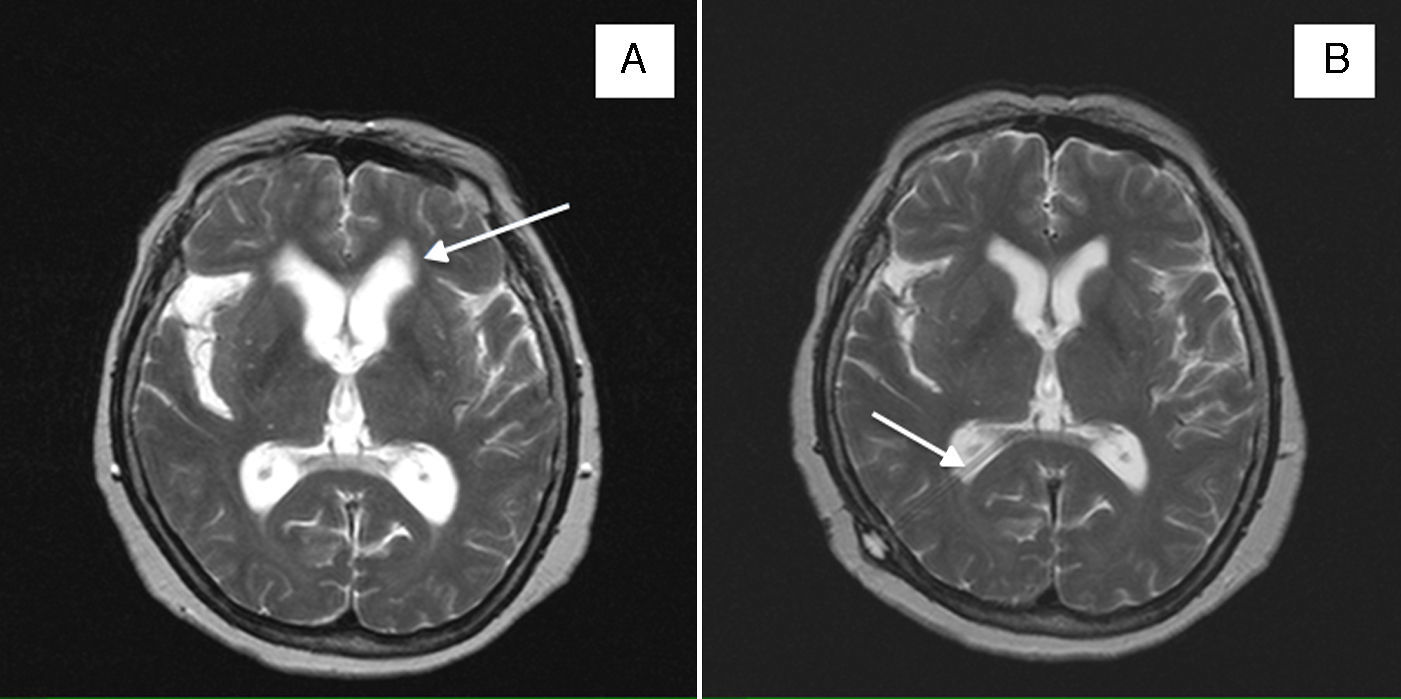
Mujer de 58 años natural de Ecuador, residente en España durante los últimos 10 años. La paciente había realizado durante ese tiempo varias visitas a su país, la última un año antes. Entre sus familiares no existían antecedentes de enfermedades parasitarias y no presentaba antecedentes personales médicos de interés, salvo una cefalea episódica recurrente de características tensionales desde hacía años. Consultó por el incremento durante los últimos meses en la frecuencia e intensidad de dichos episodios de cefalea, la que se había vuelto prácticamente diaria y refractaria a los analgésicos habituales. La exploración física tanto sistémica como neurológica era normal, incluyendo el fondo de ojo. Se solicitó una tomografía computarizada craneal y se objetivó una dilatación quística extraaxial en el espacio subaracnoideo silviano derecho y supraselar, sin efecto de masa y sin edema perilesional. Dados estos hallazgos se realizó una resonancia magnética (RM) que mostró una lesión quística polilobulada localizada en la cisura de Silvio derecha y temporal anterior, que se extendía a cisternas basales y perimesencefálica. En el tercer ventrículo se apreció una pequeña imagen hiperintensa en T1, esta probablemente se correspondía con un quiste intraventricular que podría condicionar la hidrocefalia triventricular leve (fig. 1A-C). Todos estos hallazgos en conjunto eran compatibles con una NCC subaracnoidea racemosa gigante e intraventricular. Se completó el estudio con una radiografía simple muscular, en la cual no se detectaron calcificaciones en partes blandas. En el hemograma se apreció eosinofilia y mediante enzyme linked immunosorbent assay (ELISA) resultaron positivos en suero tanto los anticuerpos IgG como los antígenos de T. solium. Se inició tratamiento con 4mg al día de dexametasona por vía oral durante 2 meses y un ciclo de 30 días de albendazol, a razón de 15mg/kg al día (400mg cada 12 h). Se obtuvieron una buena respuesta clínica y una disminución del tamaño de las alteraciones radiológicas. Esta situación se mantuvo durante 2 años, con controles radiológicos de RM craneal estables. Tras ese tiempo recurrió la cefalea y en una nueva RM craneal se apreció una reactivación de la NCC con aumento de tamaño de las lesiones previas (la subaracnoidea pasó a medir 70×59×36mm), las que condicionaban un efecto de masa sobre el ventrículo lateral derecho (fig. 1D y E). Se inició un nuevo ciclo de dexametasona y albendazol, con la misma pauta utilizada previamente, que se tuvo que suspender al día 20 de tratamiento por hepatotoxicidad (elevación de la transaminasa glutámico-oxalacética, la transaminasa glutámico-pirúvica y la gamma glutamil transpeptidasa hasta 5 veces los valores normales). Se propuso el inicio de praziquantel, pero la paciente no pudo costearse este medicamento. Se valoró entonces el tratamiento quirúrgico, pero finalmente se desestimó esta opción puesto que, a pesar de la suspensión precoz del tratamiento cisticida, la cefalea remitió y las vesículas disminuyeron de tamaño en la neuroimagen de control. La paciente se mantuvo estable durante un año, pero comenzó entonces con una clínica rápidamente progresiva de cefalea, ataxia, bradipsiquia y disartria. Se solicitó una nueva RM craneal en la que se objetivó hidrocefalia activa, con exudados periventriculares y signos de sufusión transependimaria; se mantenía la mejoría de las lesiones de la NCC en relación con controles previos (fig. 2A). Se decidió realizar una derivación ventrículo-peritoneal urgente; tras ello mejoró la clínica y disminuyeron las alteraciones radiológicas antes descritas (fig. 2B). En controles posteriores la paciente se mantuvo clínicamente estable y sin nuevas alteraciones en la neuroimagen.
A) RM craneal axial FLAIR, con ocupación de la cisura de Silvio por múltiples imágenes quísticas (flecha). B) RM craneal axial FLAIR con NCC racemosa en cisura de Silvio derecha y temporal anterior, que se extiende a cisternas perimesencefálicas (flechas). C) RM craneal sagital TSE T2 con quistes en cisterna supraselar, prepontinos y en tercer ventrículo (flecha). D) RM craneal axial T1 FFE y RM coronal FLAIR (E), con aumento de la ocupación de la cisura de Silvio por múltiples imágenes quísticas y leve efecto masa sobre el ventrículo ipsolateral (flecha).
A) RM craneal axial T2 en la que se aprecian los quistes en la cisura de Silvio e hidrocefalia con sufusión transependimaria (flecha). B) RM craneal axial T2 con válvula de derivación ventricular en asta occipital derecha (flecha), disminución del tamaño de los quistes en la cisura de Silvio y mejoría de la hidrocefalia.
La NCC es la localización de larvas de T. solium en el SNC y se produce cuando el ser humano ingiere los huevos del parásito, convirtiéndose en huésped intermediario en el ciclo biológico de este helminto. Constituye la enfermedad parasitaria más frecuente del SNC. Es endémica en varios países de Latinoamérica (principalmente México, Brasil, Colombia, Ecuador y Perú)4, en Asia y en África. En países como España, Argentina o Chile, que no son zonas endémicas de alta prevalencia4,15, la NCC representa de todos modos un relevante problema de salud pública. Aunque en Chile existen datos de que la incidencia de esta afección se encuentra en descenso9, en España y Argentina se trata de una patología emergente debido a la inmigración proveniente de países con la endemia7,15.
Según el lugar en el que el cisticerco se aloje, la NCC puede ser parenquimatosa, subaracnoidea, ventricular o medular. Aunque infrecuente, es posible su coexistencia en diferentes localizaciones; la afectación subaracnoidea y a nivel del tercer ventrículo, como la observada en nuestro caso, es excepcional1.
El diagnóstico no siempre es fácil, especialmente en zonas que no son endémicas de la enfermedad. Este se fundamenta en la neuroimagen, que en ocasiones permite apreciar hallazgos patognomónicos, aunque en general se requiere de un contexto clínico y epidemiológico adecuado y positividad serológica (tablas 1 y 2). La RM es la técnica con mayor sensibilidad; mediante ella puede objetivarse el número y tipo de lesiones, así como su localización y su estado evolutivo. Cuando los quistes se localizan en el espacio subaracnoideo o en el sistema ventricular, pueden desarrollarse y proliferar como quistes polilobulados que crecen simulando racimos de uva, dando lugar a la forma racemosa de la enfermedad12. Estos quistes no presentan edema perilesional, realce con administración de contraste, ni se aprecia la imagen del escólex. Pueden alcanzar un gran tamaño cuando están localizados en una cisura amplia como la de Silvio, como en el caso que nos ocupa, y se denomina la enfermedad NCC racemosa gigante cuando el tamaño de las vesículas es mayor de 50 mm13. Aunque esta imagen es bastante característica, el diagnóstico puede ser difícil, ya que el quiste es isointenso con el líquido cefalorraquídeo (LCR) y puede no visualizarse con nitidez. La secuencia FLAIR es útil en estas situaciones, ya que en esta los quistes suelen ser de mayor intensidad con respecto al LCR14. La disposición intraventricular es poco frecuente y el tercer ventrículo se encuentra afectado únicamente en el 10% de estos casos14. Respecto de los estudios serológicos, estos en general muestran sensibilidad y especificad variable, y aún no se dispone de una prueba serológica ideal. La técnica ELISA se ha utilizado para detectar anticuerpos específicos y antígenos parasitarios. La principal desventaja radica en su baja especificidad en suero en relación con falsos positivos en casos de parásitos fuera del sistema nervioso central o en pacientes que tuvieron contacto con el parásito, pero no desarrollan clínicamente NCC. Para mejorar los parámetros de la prueba se han utilizado antígenos de interés purificados, recombinantes o sintéticos, sin que se hayan alcanzado por el momento resultados completamente satisfactorios. La detección de anticuerpos en LCR, aunque es específica, presenta poca sensibilidad en casos con parásitos localizados en el parénquima o en los surcos de la convexidad2.
Criterios diagnósticos de neurocisticercosis
| Criterios absolutos |
| Demostración histológica del parásito en material de biopsia cerebral o espinal |
| Presencia de lesiones quísticas con escólex en TC o RM |
| Visualización directa del parásito subretiniano mediante oftalmoscopia |
| Criterios mayores |
| Lesiones altamente sugestivas de NCC en estudios de neuroimagen. La presencia de 2 tipos de lesiones altamente indicativas debe ser considerada como 2 criterios mayores distintos |
| Identificación de anticuerpos anticisticerco en sangre mediante enzyme-linked immunoelectrotransfer blot (EITB) usando antígenos purificados de T. solium |
| Resolución de lesiones quísticas con albendazol o praziquantel |
| Resolución espontánea de lesiones anulares hipercaptantes únicas < 20mm de diámetro en paciente con crisis, sin otros síntomas ni evidencia de otra enfermedad activa |
| Criterios menores |
| Lesiones compatibles con NCC en estudios de neuroimagen (presencia en TC o RM de hidrocefalia, o captación anormal del contraste en leptomeninges basales o mielograma) |
| Manifestaciones clínicas indicativas de NCC (crisis convulsivas, focalidad neurológica, hipertensión endocraneal o deterioro cognitivo) |
| ELISA positivo para detección de anticuerpos o antígenos de cisticerco en LCR |
| Presencia de cisticercosis fuera del SNC (demostración histológica de cisticercos subcutáneos o musculares, calcificaciones en partes blancas por radiografía, visualización directa de cisticercos en la cámara anterior del ojo) |
| Criterios epidemiológicos |
| Evidencia de un contacto doméstico infectado con T. solium |
| Individuos que residan o provengan de zonas endémicas |
| Historia de viajes frecuentes a áreas endémicas |
Modificado de Del Brutto et al.8.
Grados de certeza diagnóstica de neurocisticercosis
| Grados de certeza diagnóstica |
| Diagnóstico definitivo |
| 1. Un criterio absoluto |
| 2. Dos criterios mayores más uno menor y uno epidemiológico |
| Diagnóstico probable |
| 1. Un criterio mayor más dos menores |
| 2. Un criterio mayor más uno menor y uno epidemiológico |
| 3. Tres criterios menores más uno epidemiológico |
Modificado de Del Brutto et al.8.
Las manifestaciones clínicas son variadas y están en relación con el número, la localización y el tamaño de los quistes. Los hallazgos más frecuentes son epilepsia, déficits neurológicos focales, cefalea y deterioro cognitivo; estos síntomas se encuentran con mayor frecuencia asociados a las formas parenquimatosas5. Las complicaciones en las formas extraparenquimatosas son frecuentes, entre ellas es habitual la hipertensión intracraneal cuando existen vesículas subaracnoideas de gran tamaño, como en nuestro caso. Con frecuencia también se observa hidrocefalia, la cual puede ser producida por aracnoiditis, ependimitis granular o quistes intraventriculares5,6,12. En este último caso, si el quiste se encuentra adherido a la pared ependimaria se producirá una hidrocefalia obstructiva progresiva de presentación aguda o subaguda, pero si dicho quiste se encuentra flotando libre en las cavidades ventriculares puede producir obstrucciones intermitentes del flujo del LCR cursando con episodios súbitos de cefalea, papiledema y pérdida de conciencia, con rápida recuperación, inducidos por movimientos cefálicos, entidad conocida como síndrome de Bruns3,14.
El tratamiento recomendado en la actualidad para la NCC son los fármacos cisticidas, tanto praziquantel (dosis usual de 50mg/kg por día durante 2 semanas), como albendazol (dosis usual de 15mg/kg por día durante 2 semanas). No existe superioridad demostrada de un fármaco con respecto al otro, aunque la evidencia parece favorecer al albendazol3. Un estudio reciente ha evaluado la eficacia del tratamiento combinado con albendazol y praziquantel en la NCC intraparenquimatosa, con un porcentaje elevado de resolución de los quistes en el grupo del tratamiento combinado frente al grupo de albendazol monoterapia, sin que la combinación de ambos fármacos produjera mayor número de efectos adversos10. Para la forma subaracnoidea se recomienda el tratamiento con corticoides, por riesgo a que la acción de estos fármacos produzca una intensa reacción inflamatoria secundaria a la destrucción de los quistes, con agravamiento del cuadro clínico3,11. En el caso de la NCC racemosa gigante el tratamiento es controvertido, puesto que tanto la resección quirúrgica del quiste como el tratamiento con albendazol y corticoides podrían ser igualmente efectivos10,11. En las formas ventriculares, si bien los fármacos antiparasitarios pueden utilizarse de inicio, es preciso realizar un estrecho seguimiento clínico y radiológico debido a que estos casos presentan complicaciones con elevada frecuencia. La cirugía es un pilar importante en el tratamiento de este tipo de NCC y en muchas ocasiones debe plantearse como primera opción terapéutica11. En la actualidad existe una creciente evidencia del beneficio del abordaje transventricular y la utilización de endoscopios flexibles para la exéresis de los quistes accesibles3,11. Cuando existe hidrocefalia sintomática, el tratamiento es la realización de una derivación ventricular urgente6. Nuestra paciente presentó sintomatología de hipertensión intracraneal en el curso evolutivo de su enfermedad, probablemente por un mecanismo combinado de compresión secundaria al quiste gigante subaracnoideo y de hidrocefalia obstructiva secundaria al quiste del tercer ventrículo. El quiste subaracnoideo presentó buena respuesta al tratamiento con albendazol, pero por el contrario, el intraventricular no respondió a dicho tratamiento y hubo empeoramiento de la hidrocefalia, esto requirió finalmente la implantación de un catéter de derivación ventrículo-peritoneal.
Concluimos, por tanto, que la NCC constituye un importante problema de salud pública y que sus formas extraparenquimatosas presentan con frecuencia graves complicaciones en su curso evolutivo, por lo que es fundamental el seguimiento tanto clínico como radiológico, para su detección precoz. Si bien el tratamiento de elección de la NCC son los fármacos cisticidas (albendazol y praziquantel), para el tratamiento de las formas extraparenquimatosas también hay que tener en cuenta los corticoides y la cirugía.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado delpaciente referido en el artículo. Este documento obra enpoder del autor de correspondencia.
FinanciaciónNo se ha recibido financiación de ningún tipo.
Conflicto de interesesLos autores no declaran conflictos de intereses.