Nuestro objetivo fue conocer la presencia de anticuerpos neutralizantes contra el virus de la encefalitis de San Luis (St. Louis encephalitis virus [SLEV]) y el virus del Nilo Occidental (West Nile virus [WNV]) en sueros de aves silvestres y domésticas de la Ciudad Autónoma de Buenos Aires, Argentina. Desde octubre del 2012 hasta abril del 2013 se colectaron 180 muestras que fueron procesadas por la técnica de microneutralización. El 7,2% de las aves muestreadas resultaron seropositivas para SLEV, mientras que no se detectaron aves seropositivas para WNV.
Our goal was to determine the presence of neutralizing antibodies against St. Louis encephalitis virus (SLEV) and West Nile virus (WNV) in sera of wild and domestic birds from Buenos Aires City, Argentina. From October 2012 to April 2013, 180 samples were collected and processed by the microneutralization technique. A 7.2% of the sampled birds were seropositive for SLEV, while no seropositive birds for WNV were detected.
El virus de la encefalitis de San Luis (St. Louis encephalitis virus [SLEV]), al igual que el virus del Nilo Occidental (West Nile virus [WNV]), pertenecen al género Flavivirus. Estos virus son mantenidos en la naturaleza en un ciclo enzoótico que involucra a mosquitos, principalmente del género Culex, y a aves de los órdenes Passeriformes y Columbiformes. Ambos arbovirus pueden ser neuroinvasivos en el hombre, aunque en muy bajo porcentaje, ya que la mayoría de las infecciones son asintomáticas o se presentan con un cuadro febril indiferenciado11.
El SLEV circula desde el sur de Canadá hasta Argentina, donde es considerado endémico14. Los porcentajes de seroprevalencia se encuentran entre el 3 y el 50% en los lugares más cálidos de Argentina15. A partir del primer brote de encefalitis en humanos ocurrido en Córdoba en el año 200517 y, posteriormente, en el área metropolitana de Buenos Aires en 201016, se ha incluido su diagnóstico en el Sistema Nacional de Vigilancia Intensificada de Febriles del Sistema Nacional de Vigilancia en Salud (http://www.snvs.msal.gov.ar/). En este sistema se incluye a los pacientes que llegan a la consulta médica pública o privada con síndrome febril inespecífico con temperatura > 38°C, sin signos clínicos o enfermedad respiratoria.
El ciclo de transmisión viral en los EE. UU. es bien conocido: el virus es mantenido y amplificado por transmisión vectorial en un ciclo enzoótico primario que involucra a aves silvestres (principalmente Passeriformes —gorriones Passer domesticus— y Columbiformes —palomas Zenaida macroura—) y mosquitos del género Culex14.
Existen antecedentes de actividad enzoótica del SLEV en diversas especies de aves silvestres y domésticas en provincias del centro y norte de Argentina. En Córdoba, en el año 1977, en un área de montes cercanos a la localidad de Piquillín se demostró un 13,6% de anticuerpos neutralizantes en palomas de la especie Zenaida auriculata. Individuos de otra especie, Columbina picui (torcacita), también se encuentran frecuentemente infectados en regiones templadas del país. Entre 1977 y 1980 se detectó la presencia de anticuerpos neutralizantes en especies de aves pertenecientes a varias familias, entre ellas Furnaridae (4,6%), Columbidae (5,9%), Tyranidae (2,4%), Fringilidae (4,9%), Icteridae (1,6%), Ardeide (4,7%) y Phytotomidae (7,1%), colectadas en las provincias de Chaco, Córdoba, Corrientes y Santa Fe12.
Recientemente, las investigaciones realizadas en el país han demostrado que las especies Z. auriculata (torcaza) y C. picui (torcacita) son hospedadores competentes, por desarrollar viremias elevadas durante varios días, ampliando la oferta de virus a las poblaciones de mosquitos8. Asimismo, Culex quinquefasciatus y secundariamente Culex interfor serían las especies de mosquitos intervinientes en el ciclo7.
En la Argentina, el WNV fue aislado a partir de equinos deportivos con encefalitis en el año 2006 en la provincia de Buenos Aires13. Sin embargo, previamente se habían detectado aves silvestres seropositivas en las provincias de Chaco, Córdoba y Tucumán6, lo que demuestra que su introducción había ocurrido antes del 2006. A la luz de las evidencias existentes en nuestro país, se reconoce que este virus posee un comportamiento diferente del de los EE.UU., ya que se caracteriza por una marcada actividad enzoótica, amplia distribución geográfica y baja actividad epidémica en aves, equinos y humanos9. Los casos humanos registrados con infecciones sintomáticas en el país han sido escasos2. Un estudio epidemiológico realizado en la ciudad de Córdoba determinó una prevalencia serológica en la población humana del 0,8%18.
Nuestro objetivo fue investigar la presencia de anticuerpos neutralizantes (AcNT) para SLEV y WNV en sueros de aves silvestres y domésticas de la CABA durante un período que abarcó desde octubre del 2012 hasta abril del 2013.
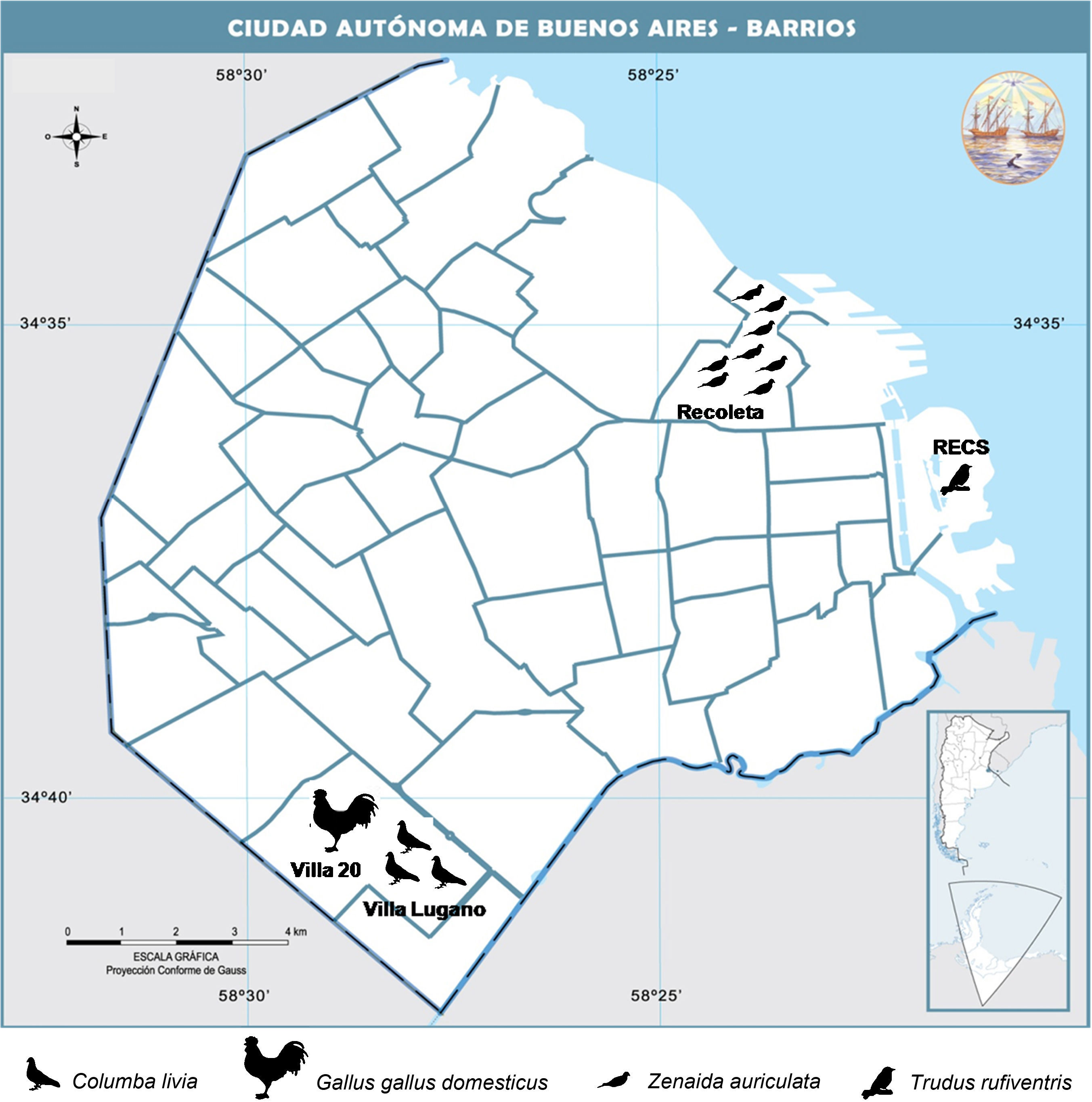
Materiales y métodosA partir de octubre del 2012 y hasta marzo del 2013 se produjo el ingreso de grandes bandadas de torcazas (Z. auriculata), que se asentaron en edificios del barrio de Recoleta. Los vecinos denunciaron el hecho a las autoridades del municipio y se organizó un operativo de captura a fin de relocalizar a las mismas. Para ello se utilizaron trampas tipo jaulón cebadas con maíz. Durante el operativo (noviembre y diciembre del 2012) se tomaron 157 muestras de sueros de torcazas por punción de la vena alar.
Por otro lado, en octubre del 2012 y abril del 2013 se obtuvieron muestras de sueros de aves domésticas en cautiverio que estaban incluidas en otras actividades de vigilancia que realiza el Instituto de Zoonosis Luis Pasteur: 6 palomas comunes (Columba livia) de Villa Lugano y 4 gallinas (Gallus gallus domesticus) de Villa 20. En octubre del 2012, mediante el uso de redes de niebla, se capturaron, sangraron y liberaron en la Reserva Ecológica Costanera Sur (RECS) 4 chingolos (Zonotrichia capensis), un zorzal colorado (Turdus rufiventris), un chinchero chico (Lepidocolaptes angustirostris), un sietevestidos (Poospiza nigrorufa), un fiofío pico corto (Elaenia parvirostris) y una gaviota cocinera (Larus dominicanus). En abril del 2013, ocurrió lo mismo con 3 zorzales colorados (T. rufiventris) y una gaviota cocinera. Las gaviotas habían sido rescatadas para tratamiento veterinario.
En total, se obtuvieron 180 sueros que fueron procesados y analizados para la detección de anticuerpos neutralizantes por la técnica de microneutralización en línea celular VERO19. Se utilizaron las cepas virales VESL CbaAr400510 y VNO E/7229/0613.
Resultados y discusiónEl 7,2% de los 180 sueros tuvieron AcNT contra SLEV. En la tabla 1 se muestran las especies aviares positivas y sus títulos, y en la figura 1 su distribución espacial. No se detectaron AcNT contra WNV en ninguna de las muestras procesadas.
Especies de aves seropositivas para SLEV
| Familia | Especie | N.° sueros positivos/total | Títulos de anticuerpos neutralizantes |
|---|---|---|---|
| Passeridae | Zorzal colorado (Turdus rufiventris) | 1/4 | 1:20 |
| Phasianidae | Gallina (Gallus gallus domesticus) | 1/4 | 1:160 |
| Columbidae | Paloma común (Columba livia) | 3/6 | 1:20 |
| Torcaza (Zenaida auriculata) | 8/157 | 1:10-1:40 |
Las especies de aves seropositivas para SLEV detectadas en este estudio (torcaza, gallina, zorzal colorado y paloma común) coinciden con aquellas detectadas en regiones templadas y subtropicales de Argentina (Córdoba, Chaco, Corrientes, Santa Fe)12. Los individuos de G. gallus domesticus suelen encontrarse infectados naturalmente, pero solo los individuos menores de 5 días son capaces de desarrollar viremias elevadas5. Algo similar podría ocurrir con la paloma común, cuyos individuos adultos no generan viremias elevadas para SLEV por lo que no cumplen un papel en la cadena de transmisión del virus (Díaz, datos no publicados). Sin embargo, resta aún evaluar el potencial intrínseco amplificador de los pichones y juveniles.
Por otro lado, se ha demostrado que la paloma torcaza puede generar viremias elevadas, suficientes para infectar a los mosquitos C. quinquefasciatus, vectores urbanos de SLEV8. Teniendo en cuenta la abundancia con la que se encuentra esta paloma en los diferentes ambientes urbanos y espacios verdes de la CABA, su presencia podría estar colaborando como un hospedador amplificador y de mantenimiento más dentro ciclo de transmisión del SLEV.
Durante el brote de encefalitis ocurrido en Córdoba en 2005, la prevalencia de AcNT contra el SLEV en aves urbanas aumentó del 0,7 al 7%, lo que indica que las aves actuaron como amplificadores del SLEV4. La evidencia serológica detectada en nuestro estudio para la torcaza fue del 5%. Cabe señalar que, en marzo del 2013, se determinó durante una vigilancia entomo-virológica realizada en Recoleta el genotipo iii del SLEV a partir de mosquitos Culex3. Este genotipo ya había sido identificado previamente en 2 casos humanos en la CABA, en 2007 y 201020.
En el Boletín Integrado de Vigilancia del Ministerio de Salud de la Nación, durante 2012 y hasta el 30 de marzo del 2013, se confirmaron por laboratorio 2 casos de encefalitis en Buenos Aires, uno de ellos en la CABA1. Estas evidencias indican que el SLEV, al igual que en el resto del país, es un virus endémico, de circulación enzoótica y que bajo ciertas circunstancias provoca casos aislados o brotes epidémicos.
En nuestro trabajo, no se pudieron detectar AcNT contra WNV en ninguno de los especímenes analizados. En la CABA, según el Boletín Integrado de Vigilancia del Ministerio de Salud de la Nación, tampoco pudo confirmarse ninguno de los casos notificados dentro del mismo período de nuestro estudio1.
Los conglomerados urbanos representan una fuente de alimentación, refugio y cría para aves hospedadoras y mosquitos vectores de agentes virales. Nuestros resultados, sumados a datos previos obtenidos para la CABA, confirman la existencia de ciclos de mantenimiento y de amplificación del SLEV.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que el protocolo de investigación fue aprobado por el Comité de Ciencia e Investigación del Instituto de Zoonosis Luis Pasteur (CODEI). Todas las muestras de procedencia animal se obtuvieron previo consentimiento del propietario por escrito. La investigación se realizó conforme con los “Principios rectores internacionales aplicables a las investigaciones biomédicas con animales”, del Consejo de Organizaciones Internacionales de las Ciencias Médicas, aprobados por el Comité Consultivo de Investigaciones Médicas de la Organización Mundial de la Salud (Crónica de la OMS 39:5560. 1985) y las “Normas Internacionales para la investigación biomédica con animales” de la Organización Panamericana de la Salud (Bol. Of. Panam. 108/5-6. 1990).
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEl presente trabajo ha sido financiado por los Institutos de Virología Dr. J. M. Vanella (Facultad de Ciencias Médicas, UNC) y de Zoonosis Luis Pasteur (Ministerio de Salud, CABA).
Conflicto de interesesNo existen conflictos de interés.
Veterinaria Inés Ardiles y Lic. en Ciencias Biológicas Carolina Zotter, por su asistencia técnica. Bibl. Claudia Inga, del Centro de Información en Salud (CEDOS).