La toxocariosis es una zoonosis causada por la ingestión de huevos infectivos de Toxocara spp. El diagnóstico de la enfermedad se basa en la detección de anticuerpos en el suero u otros fluidos biológicos. La técnica serológica más utilizada es el ELISA, que usa como antígeno los productos de excreción-secreción de larvas de tercer estadio (ES/L3). Estos productos antigénicos son glicoproteínas que se originan en los órganos secretorios del parásito y no son específicos de especie. Para evaluar la especificidad de la técnica de ELISA con el antígeno ES/L3, se emplearon sueros de personas con otras helmintiasis y con patologías no parasitarias. Se observó que estos sueros presentaron reactividad entre el 11 y el 70 % de los casos. El Western blot con suero de los mismos pacientes reveló que la glicoproteína que corresponde al triplete de 120kDa fue la más inespecífica. Teniendo en cuenta estos resultados y con el propósito de purificar el antígeno se realizó una cromatografía de intercambio iónico. Cuando se analizaron los sueros de los pacientes con diferentes enfermedades parasitarias y no parasitarias con el antígeno ES/L3 purificado, solo fueron reactivos entre un 10 y un 20 % de ellos. La sensibilidad del test de ELISA determinada por el programa Epidat 3.0 para los dos antígenos fue del 100 %, pero se observaron diferencias en la especificidad: para el antígeno ES/L3 total esta fue del 84 % y para el ES/L3 purificado del 99 %. Empleando el antígeno ES/L3 purificado se puede considerar que los sueros que son reactivos, en presencia de una sintomatología compatible, corresponden a pacientes que fueron o están parasitados con Toxocara canis.
Toxocarosis is a zoonotic disease caused by the ingestion of infective eggs of Toxocara spp. The diagnosis is based on the detection of antibodies in serum or other biological fluids. One of the current serological techniques for the diagnosis of toxocariasis is ELISA using excretory - secretory antigens of third stage larvae (ES/L3). These antigens are glycoproteins, which originate in the secretory organs of the parasite and are non speciesspecific. Sera from patients with other helminthiases and non- parasitic diseases were used to evaluate the specificity of ELISA using the excretory - secretory antigen (ES/L3). The reactivity of these sera was between 11 and 70%. Western blot using patients’ sera revealed that the glycoprotein triplet having a molecular weight of 120kDa was responsible for cross-reactivity. With these results, and for the purpose of purifying the antigen, ion exchange chromatography was performed. When the sera from patients with various parasitic and non-parasitic diseases were analyzed with the purified antigen ES/L3, they were only reactive between 10 to 20%. The sensitivity of the ELISA test determined by program Epidat 3.0 for the two antigens was 100%, but the following differences in specificity were observed: 84% for the total antigen ES/L3 and 99% for purified ES/L3. Using the ES/L3 purified antigen, it can be considered that the reactive sera, with compatible symptoms correspond to patients who are or were parasitized with Toxocara canis.
La toxocariosis es una zoonosis causada por la ingestión de huevos embrionados de Toxocara canis, que es un helminto propio de los perros, y también, probablemente, por los huevos de Toxocara cati, que parasita a los gatos8.
Esta parasitosis afecta sobre todo a niños que están en contacto con cachorros no desparasitados o que juegan en las plazas, donde suelen defecar los animales8.
En el hombre, el diagnóstico de la enfermedad es problemático, ya que el estadio larval de Toxocara spp. no puede ser detectado directamente, salvo por estudios histológicos que se realizan posmortem. Por otra parte, las larvas no completan su evolución, lo cual les impide la postura de huevos, esto hace que el diagnóstico parasitológico tampoco sea posible. Además, los signos y síntomas que presenta son comunes con otras enfermedades infecciosas. El único medio posible de diagnóstico es indirecto, recurriendo a la detección de anticuerpos en la sangre u otros fluidos biológicos8.
Los test serológicos adquirieron mayor confiabilidad al emplearse técnicas inmunoenzimáticas con antígeno excretorsecretor (ES/L3), el cual se obtiene por cultivo de larvas de tercer estadio en un medio de cultivo libre de proteínas6,7,17.
Sin embargo, este antígeno ES/L3 no es específico de especie, está altamente glicosilado y tiene en su composición un 40% de carbohidratos, lo que da lugar a reactividades cruzadas confronte a otras patologías, como fascioliosis, estrongiloidosis, triquinosis y anisakiosis3,9-11,14–16,18.
El antígeno ES/L3 está compuesto por cinco moléculas antigénicas mayores, de peso molecular 32, 55, 70, 120 y 400kDa, que se originan en las glándulas secretoras y esofágicas y salen al exterior por el conducto esofágico o por el poro secretorio; estas sustancias cubren a la larva y la protegen de la acción de los anticuerpos2,12,19.
El objetivo de este trabajo fue evaluar glicoproteínas específicas de los productos de excreción-secreción de larvas L3 de Toxocara canis para el diagnóstico serológico de la toxocariosis humana.
Materiales y métodosObtención de larvas L3 y del antígeno total excretor-secretor (ES/L3)Se realizó de acuerdo con el procedimiento descrito por De Savigny7.
Obtención de la fracción purificada del antígeno excretor-secretor (ES/L3)Se empleó un equipo FPLC LKB Pharmacia con una columna de intercambio iónico mono Q. Como buffer de comienzo se empleó buffer Tris 20mM, pH 8,4, y para el gradiente buffer Tris 20mM con NaCl, pH 6,4, este se efectuó entre los 10 y 25ml, se mantuvo un flujo constante de 0,5ml/min y se recolectaron fracciones de 0,7ml.
Estudio con sueros de pacientesSe utilizaron 54 sueros de pacientes con datos de laboratorio y síntomas compatibles con toxocarosis (eosinofilia, leucocitosis, problemas respiratorios, hepatomegalia y fiebre). El estudio fue oportunamente aprobado por el Comité de Docencia e Investigación del Hospital de Niños Ricardo Gutiérrez1.
Como controles negativos se emplearon 10 sueros de pacientes con examen parasitológico de materia fecal donde no se observaron elementos o formas parasitarias y presentaban eosinofilia normal.
Para determinar la inmunorreactividad cruzada se utilizaron sueros de personas que tenían serología positiva para triquinosis (n=10), estrongiloidosis (n=4), neurocisticercosis (n=10) e hidatidosis (n=10) y sueros de personas que eliminaron ascaris (n=10). También se emplearon sueros de individuos que tenían serología positiva para sífilis (n=5) o hepatitis A (n=10) y sueros de personas con eosinofilia elevada de causa indeterminada (n=9).
ELISA con antígeno total y antígeno purificado excretor-secretorSe realizó de acuerdo a la técnica descripta por Coltorti et al.5, con modificaciones efectuadas en el Departamento de Parasitología del INEI. En policubetas de fondo plano inmunolon II se colocaron 50μl del antígeno ES/L3 total, a una concentración de 7μg/ml, durante 18h en la heladera. Se lavó 3 veces con buffer P/T (PBS pH 7,2/0,1% Tween 20) durante 5 min. Se bloqueó con buffer PBS pH 7,2/leche descremada 1,5%, durante 1h a 37 °C.
Se incubó con 50μl de la dilución de los sueros de los pacientes y de los sueros controles durante 30min a 37 °C, en cámara húmeda. Se lavaron las policubetas nuevamente y se incubaron con 50μl de anti-IgG humana (Sigma A 8667) marcada con peroxidasa, a una concentración de 1/5000, diluida con P/T. Se repitieron los lavados y la reacción se reveló por el agregado de 100μl de sustrato ácido 2,2’-azino- bis (3-etilbenzotiazolin-6) sulfónico (ABTS), Se incubaron las placas 10min, la reacción se detuvo con 100μl de ácido fluorhídrico 0,1 N, pH 3,2, y se leyó a 410nm en un equipo Dynatech MR 4100.
La técnica de ELISA con ES/L3 purificado se realizó como se describió anteriormente, variando la concentración del antígeno para sensibilizar las policubetas a 5μg/ml.
Electroforesis en gel de poliacrilamidaLos productos del antígeno ES/L3 total se analizaron por electroforesis en gel de poliacrilamida (SDS-PAGE) en un Mini Protean III (Bio-Rad) usando un gel de empaquetamiento de 4 % y un gel de corrida de 10 %; las muestras se diluyeron en buffer disociante, la electroforesis se realizó a 60mA durante aproximadamente 1 hora. El peso molecular se calculó usando patrones preteñidos Biorad (161-0309).
Western blotLa transferencia a membranas de nitrocelulosa del ES/L3 se realizó de acuerdo a la técnica de Towbin et al.20, empleando un equipo Mini Trans Blot Cell (Bio-Rad), durante 1h a 250mA. Las membranas de nitrocelulosa se bloquearon con buffer PBS pH 7,4/0,5 % de Tween 20, leche descremada 5 %, durante 1h, luego se lavaron 3 veces durante 5 min con buffer PBS pH 7,2/0,5 % Tween 20. Se guardaron en el freezer a −20 °C hasta el momento de usar. Las tiras de nitrocelulosa se incubaron con suero de personas que tenían otras enfermedades parasitarias y no parasitarias, con sueros controles de personas con toxocarosis y con sueros de personas con examen parasitológico donde no se observaron formas parasitarias. Los sueros se diluyeron 1/100 en el buffer P/T/L (PBS pH 7,2/0,1 % Tween 20/0,5 % leche descremada) y se incubaron 1h con agitación a temperatura ambiente. Las membranas se lavaron como antes, se incubaron con anti-IgG humana (Sigma A: 8667) marcada con peroxidasa y diluida en el buffer P/T/L 1/1000, 1h a temperatura ambiente, con agitación permanente; la reacción se reveló con diaminobencidina.
Análisis de los resultadosLos resultados obtenidos en las técnicas de ELISA fueron analizados por el programa de análisis epidemiológico de datos tabulados Epidat 3.0.
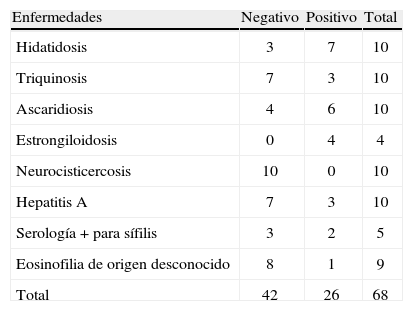
ResultadosELISA con antígeno excretor-secretorLos resultados obtenidos empleando el antígeno ES/L3 total de T. canis con los sueros de pacientes con otras patologías parasitarias y no parasitarias se observan en la tabla 1.
ELISA con antígeno excretor-secretor total con sueros de individuos con distintas enfermedades parasitarias y no parasitarias
| Enfermedades | Negativo | Positivo | Total |
| Hidatidosis | 3 | 7 | 10 |
| Triquinosis | 7 | 3 | 10 |
| Ascaridiosis | 4 | 6 | 10 |
| Estrongiloidosis | 0 | 4 | 4 |
| Neurocisticercosis | 10 | 0 | 10 |
| Hepatitis A | 7 | 3 | 10 |
| Serología + para sífilis | 3 | 2 | 5 |
| Eosinofilia de origen desconocido | 8 | 1 | 9 |
| Total | 42 | 26 | 68 |
Fueron positivos 20 sueros de pacientes con enfermedades parasitarias y 6 sueros de pacientes con enfermedades no parasitarias.
La sensibilidad de la técnica de ELISA ES/L3 utilizando el programa Epidat 3.0 fue del 100 % (99,55-100,00), mientras que la especificidad fue del 84 %.
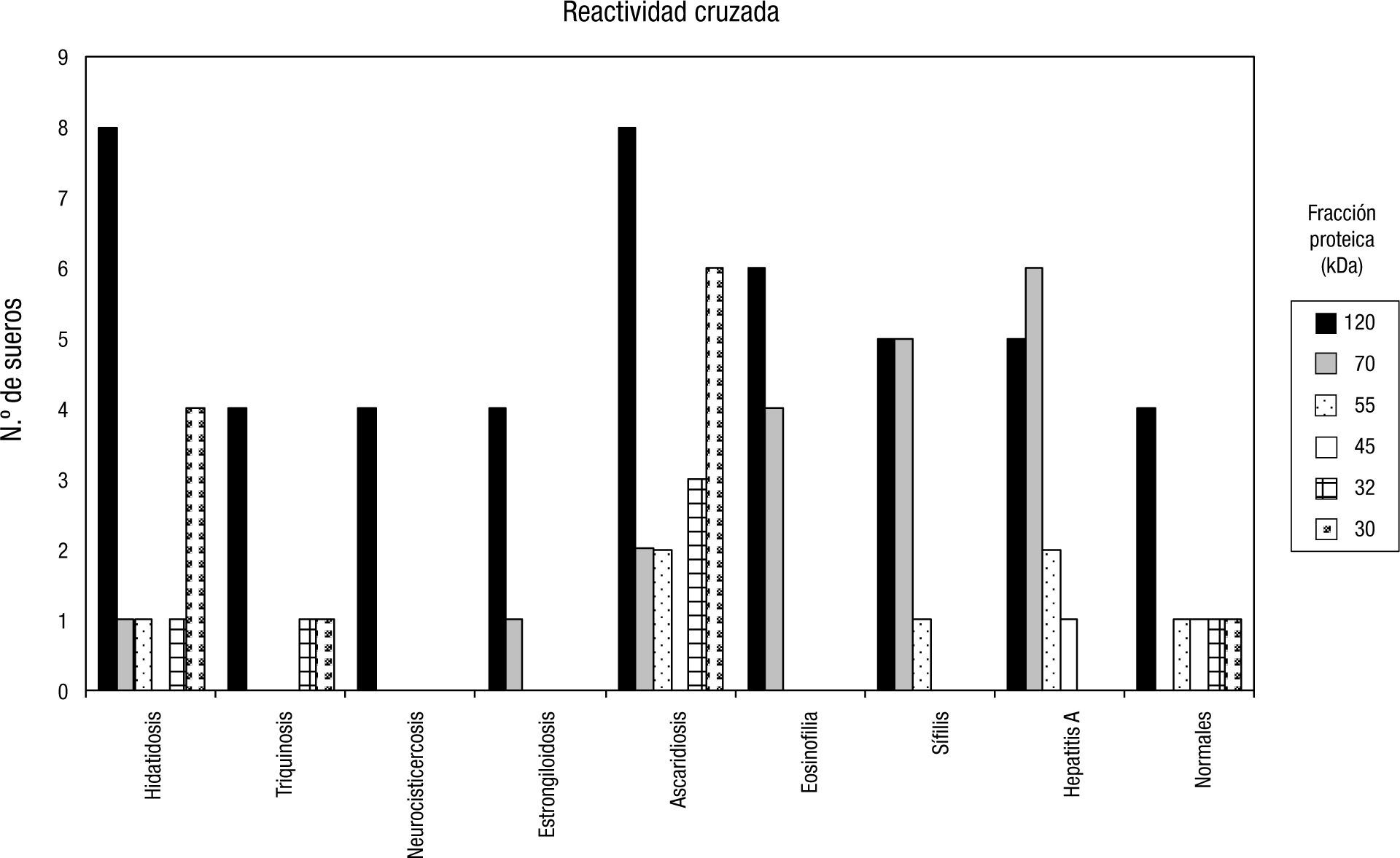
Western blot antígeno excretor-secretorLa glicoproteína más reactiva con los sueros de los pacientes de las diferentes patologías parasitarias y no parasitarias fue el triplete de 120kDa, como se observa en la figura 1.
De los sueros provenientes de individuos con diferentes parasitosis, 8 reconocieron el triplete de 120kDa. Al considerar patologías no parasitarias, el triplete fue reconocido por 6 sueros de pacientes con eosinofilia de origen desconocido y 5 de los sueros de pacientes que tenían serología positiva para sífilis.
De los sueros controles negativos pertenecientes a personas con examen parasitológico de materia fecal donde no se observaron formas parasitarias, 4 reconocieron el triplete de 120kDa.
Otras bandas polipeptídicas que presentaron reactividad y que se encontraron junto con la de 120kDa fueron la de 30kDa, que se reconoció en pacientes con nematodes (Ascaris) o con cestodes (hidatidosis), y la de 70kDa, que fue reactiva con sueros de patologías no parasitarias, como el caso de hepatitis y eosinofilia de origen desconocido.
Purificación del antígeno excretor-secretor de T. canisPara eliminar el triplete de 120kDa, que fue el responsable de la mayoría de las reacciones cruzadas, se realizó una cromatografía de intercambio iónico que presentó 11 picos diferentes, cada uno de los cuales se recolectó en fracciones de 0,7ml. Cuando los picos tenían más de un tubo estos se unificaron.
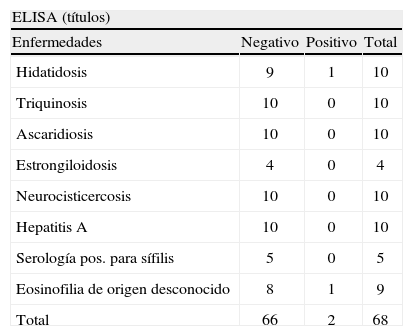
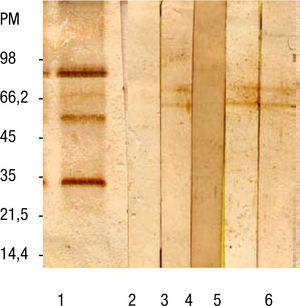
Con los tubos correspondientes a cada pico se realizó un SDS-PAGE, coloración de plata y Western blot, y se reveló con sueros controles positivos y negativos (fig. 2). Se seleccionaron los tubos que no tenían la fracción de 120kDa (antígeno ES/L3 purificado), con los que se realizó la técnica de ELISA, como se describió anteriormente (tabla 2).
Western blot de sueros de pacientes. Línea 1: suero control positivo con antígeno total, línea 2: suero control negativo con antígeno total, línea 3: suero control positivo con antígeno purificado, línea 4: suero control negativo con antígeno purificado, líneas 5 y 6: sueros de pacientes con sospecha clínica de toxocariosis con antígeno purificado. PM: peso molecular.
ELISA con antígeno excretor-secretor purificado frente a sueros de pacientes con distintas enfermedades parasitarias y no parasitarias
| ELISA (títulos) | |||
| Enfermedades | Negativo | Positivo | Total |
| Hidatidosis | 9 | 1 | 10 |
| Triquinosis | 10 | 0 | 10 |
| Ascaridiosis | 10 | 0 | 10 |
| Estrongiloidosis | 4 | 0 | 4 |
| Neurocisticercosis | 10 | 0 | 10 |
| Hepatitis A | 10 | 0 | 10 |
| Serología pos. para sífilis | 5 | 0 | 5 |
| Eosinofilia de origen desconocido | 8 | 1 | 9 |
| Total | 66 | 2 | 68 |
La sensibilidad de la técnica del ELISA con el ES/L3 purificado fue del 100 %, igual que con el antígeno total, pero la especificidad fue del 99 %.
DiscusiónLos primeros antígenos utilizados para el diagnóstico de la toxocariosis fueron homogeneizados del parásito adulto, que, entre otros componentes, son ricos en fosforilcolina, hapteno común de los helmintos y responsable de numerosas reacciones cruzadas6.
Las técnicas serológicas adquirieron mayor confiabilidad al mejorar la especificidad, cuando se emplearon antígenos de excreción-secreción, que tienen la ventaja de no poseer fosforilcolina. Sin embargo, son glicoproteínas, por SDS-PAGE y Western blot revelan que están compuestos por una mezcla compleja, donde la fracción reconocida por los sueros de los pacientes no siempre corresponde a T. canis, por lo tanto es común observar reacciones cruzadas con otras enfermedades14.
En este trabajo se observó en el Western blot que el triplete de aproximadamente 120kDa es el responsable de la reactividad cruzada con las distintas patologías. Esto ya fue observado por otros autores, quienes encontraron que el triplete de 120kDa era reconocido por el suero de pacientes con otras helmintiasis4,13. Por esta razón, para purificar el antígeno ES/L3 y separar esta glicoproteína, se realizó una cromatografía de intercambio iónico.
Se analizaron sueros de pacientes con sospecha clínica de toxocarosis por ELISA, utilizando el antígeno total y el purificado, y se observó que eran reactivos con los dos antígenos (ES/L3 total y purificado), la sensibilidad del test de ELISA no mostró diferencias en el comportamiento de los dos antígenos, pero la especificidad para el ELISA con antígeno purificado fue del 99 %.
De acuerdo a estas observaciones, se puede considerar que los sueros que son positivos empleando el antígeno ES/L3 purificado podrían ser considerados reaccionantes, e indicarían que las personas fueron o están parasitadas con T. canis. El empleo del antígeno ES/L3 purificado en la técnica de ELISA aumenta la especificidad de dicha técnica al disminuir las reacciones cruzadas, sobre todo con otras helmintiasis, por lo tanto, se puede tener un mejor diagnóstico de toxocariosis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los Dres. Jaime Altchet y Hector Freilij del Hospital de Niños «Ricardo Gutiérrez», por la provisión de los sueros de pacientes con sospecha clínica de toxocariosis. Al Dr. Prof. J-F. Magnaval, MD, DSC Service de Parasitologie, CHU Rangueil Toulouse, Francia, por los sueros controles humanos.