La leptospirosis es la zoonosis de mayor distribución mundial. El objetivo del presente trabajo fue desarrollar una técnica molecular que diferencie leptospiras patógenas. Se amplificó mediante PCR y se secuenció una región de la adhesina ligB, presente solo en las especies patógenas. Se utilizaron los iniciadores ligBFpet y ligBRpet. Dichos iniciadores lograron amplificar el ADN blanco de 6 cepas patógenas referenciales de Leptospira interrogans (serovar Pomona cepa Pomona, serovar Canicola cepa Hond Utrecht IV, serovar Copenhageni cepa M 20, serovar Wolffi cepa 3705, serovar Pyrogenes cepa Salinem y serovar Hardjo cepa Hardjoprajitmo) y el de Leptospira borgpetersenii serovar Castellonis cepa Castellon 3; también el de 4 cepas patógenas aisladas de bovino, porcino, rata y comadreja. En las 2 cepas referenciales no patógenas utilizadas, Leptospira biflexa serovar Patoc cepa Patoc I y L. biflexa serovar Andamana cepa Andamana, no hubo amplificación. La secuenciación de los productos amplificados expuso una suficiente variación entre los serovares estudiados, que permite diferenciarlos.
Leptospirosis is a zoonosis having worldwide distribution. The objective of this work was to develop a molecular technique to differentiate pathogenic Leptospira spp. A region of adhesin ligB, present only in the pathogenic species was amplified by PCR and sequenced. ligBRpet and ligBFpet primers were used, which amplified the target DNA from pathogenic L. interrogans reference strains serovars Pomona strain Pomona, Canicola strain Hond Utrecht IV, Copenhageni strain M 20, Wolffi strain 3705, Pyrogenes strain Salinem, Hardjo strain Hardjoprajitmo, L. borgpetersenii serovar Castellonis strain Castellon 3 and 4 pathogenic strains isolated from bovines, pigs, rats and opossums. L. biflexa serovars Patoc strain Patoc I and Andamana strain Andamana were not amplified. Sequencing of the amplified products exhibited sufficient variation among serovars, which differentiates them
La leptospirosis es la zoonosis de mayor distribución mundial y representa una enfermedad infecciosa potencialmente grave, causada por serovares patógenos del género Leptospira. En el hombre, la enfermedad causa desde un estado gripal hasta compromiso multiorgánico. En los animales de producción, en especial en bovinos y porcinos, produce grandes pérdidas económicas debido a los problemas reproductivos que ocasiona. La transmisión se produce principalmente a través del contacto con agua o con el medio contaminados con leptospira, producto de la presencia de animales domésticos portadores y animales silvestres que excretan las bacterias con la orina1,3. Esta bacteria se mantiene en muchos reservorios animales, que son los que contribuyen en gran medida al mantenimiento de leptospira, por lo que esta enfermedad es difícil de erradicar, pero sí puede controlarse con medidas profilácticas adecuadas y continuas. La detección de ADN bacteriano en muestras clínicas se utiliza cada vez más y se han desarrollado varios ensayos de PCR para el diagnóstico de la leptospirosis2-4,6,7,10,11,13. En la fase aguda de la enfermedad, la bacteria está presente en grandes cantidades en la sangre y en el líquido cefalorraquídeo. Por lo tanto, se puede obtener una alta sensibilidad en los ensayos de PCR cuando se toman las muestras antes del inicio de la terapia antimicrobiana2,11,14.
En el presente estudio fueron diseñados iniciadores de PCR basados en secuencias conservadas de Leptospira spp. con el programa Primer-BLAST. Dichos iniciadores amplifican una región específica de 1.044 nucleótidos del gen que codifica la adhesina ligB, presente solo en las leptospiras patógenas (GenBank: AF534640.1)12, y precisamente por tal motivo se seleccionó esta región. La expresión de ligB está controlada por las señales ambientales y la osmolaridad, y es necesaria para alcanzar la unión de la bacteria a las células del hospedador. Estas proteínas son factores de virulencia en las especies patógenas de Leptospira5,8,9,12. Debido a la naturaleza altamente conservada de los genes ligB, es probable que la mayoría de los polimorfismos evidenciados en la secuenciación sirvan para poder discriminar entre los diferentes serovares de Leptospira spp.
El objetivo del presente estudio fue desarrollar una técnica molecular que identifique y diferencie serovares de leptospiras patógenas mediante la amplificación y la secuenciación de una región del gen de la adhesina ligB.
Se utilizaron las siguientes cepas patógenas referenciales y aislamientos de Leptospira obtenidos del Laboratorio de Leptospirosis del Instituto de Patobiología, Centro de Investigación en Ciencias Veterinarias y Agronómicas (CICVyA), Centro Nacional de Investigaciones Agropecuarias (CNIA) del Instituto Nacional de Tecnología Agropecuaria (INTA), Buenos Aires, Argentina: L. interrogans serovar Pomona cepa Pomona, L. interrogans serovar Canicola cepa Hond Utrecht IV, Leptospira borgpetersenii serovar Castellonis cepa Castellon 3, L. interrogans serovar Wolffi cepa 3705, L. interrogans serovar Pyrogenes cepa Salinem, L. interrogans serovar Hardjo cepa Hardjoprajitmo y L. interrogans serovar Copenhageni cepa M 20; las cepas no patógenas que se emplearon fueron Leptospira biflexa serovar Patoc cepa Patoc I y L. biflexa serovar Andamana cepa Andamana. También se emplearon 4 cepas de L. interrogans aisladas de casos clínicos de animales: bovino (serovar Pomona cepa Pomona), porcino (serovar Pomona cepa Pomona), rata (serovar Copenhageni cepa M20) y comadreja (serovar Canicola cepa Hond Utrecht IV). Para la caracterización molecular de una región del gen que codifica la adhesina ligB de las cepas utilizadas, se obtuvo el ADN genómico de la bacteria utilizando el método del hervido a 100°C durante 10 min. Las amplificaciones de ADN se realizaron con los iniciadores ligBpetF (sentido): 5′-ATCGTTACTCCAGCAGCCTT-3′ y ligBpetR (antisentido): 5′-GCGGATATTTCACTCGATCC-3′, en un termociclador MyCyclertm (Biorad Thermal Cycler, EE. UU.). El volumen de la reacción final fue de 50μl; se utilizó Tris-HCl 20mM pH 9, KCl 50mM, MgCl2 2mM, dNTPs 250μM, 50 pmoles de cada iniciador, 1 U de Taq polimerasa (Invitrogen, EE. UU.) y 5μl de templado. Se incubó inicialmente a 94°C durante 5 min, luego se sometió a 35 ciclos de amplificación, cada ciclo consistió en una etapa de desnaturalización de 30 s a 94°C, una etapa de alineación de 30 s a 55°C y una etapa de extensión de 1,5 min a 72°C. Luego se sometió a una extensión final de 10 min a 72°C.
Para la detección de los productos de amplificación, se separaron 10μl de amplicones mediante electroforesis en gel de agarosa al 1% teñido con Sybr Safe DNA Gel Stain (Invitrogen, EE. UU.) en solución amortiguadora TAE 1X. El gel se corrió durante 30 min a 100V y se visualizó en un transiluminador Safe Imager (Invitrogen, EE. UU.). Una muestra se consideró positiva al revelarse una banda de 1kb. Luego, los amplicones fueron purificados usando el kit Wizard SV Gel and PCR Clean-Up System (Promega, Madison, WI, EE. UU.), para su posterior secuenciación. La secuenciación (ambos sentidos) se llevó a cabo mediante la técnica de Sanger y electroforesis por capilares en un secuenciador automático ABI 3500xL Genetic Analyzer (Applied Biosystem, California, EE. UU.) en la unidad de Genómica del Instituto de Biotecnología, CICVyA, CNIA, INTA (Buenos Aires, Argentina). Las secuencias obtenidas se analizaron utilizando los programas bioinformáticos BLAST y ClustalW2. Se construyó una secuencia consenso para visualizar polimorfismos de secuencia en los serovares de Leptospira spp. utilizando el programa BioEdit.
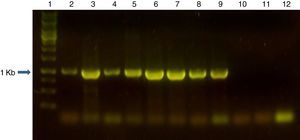
La amplificación por PCR de una región específica de la secuencia génica de la adhesina ligB mostró una única banda de 1kb en el 100% de las cepas de leptospiras patógenas que se evaluaron: L. interrogans serovar Pomona cepa Pomona, L. interrogans serovar Canicola cepa Hond Utrecht IV, L. borgpetersenii serovar Castellonis cepa Castellon 3, L. interrogans serovar Wolffi cepa 3705, L. interrogans serovar Pyrogenes cepa Salinem, L. interrogans serovar Hardjo cepa Hardjoprajitmo y L. interrogans serovar Copenhageni cepa M 20 (fig. 1). En las cepas no patógenas ensayadas, que fueron L. biflexa serovar Patoc cepa Patoc I y L. biflexa serovar Andamana cepa Andamana, no hubo amplificación (fig. 1). Se controló la integridad del ADN del templado de las muestras negativas mediante la corrida en gel de agarosa al 1% y mediante PCR del gen del 16S ARNr10 (datos no publicados). En los 4 aislamientos de los casos clínicos de animales, entre los que se incluyeron diversos serovares, también hubo amplificación de una única banda de 1kb en el 100% de los casos (fig. 1 y datos no publicados).
Gel de agarosa al 1% en solución amortiguadora TAE, mostrando los productos de PCR de 1kb generados con los iniciadores ligBFpet y ligBRpet en las especies patógenas de Leptospira spp. y la ausencia de amplificación en las especies no patógenas de Leptospira spp. Calle 1: marcador de ADN 1 kpb (INBIO Highway, Argentina); calle 2: L. interrogans serovar Pomona cepa Pomona; calle 3: L. interrogans serovar Canicola cepa Hond Utrecht IV; calle 4: L. borgpetersenii serovar Castellonis cepa Castellon 3; calle 5: L. interrogans serovar Wolffi cepa 3705; calle 6: L. interrogans serovar Pyrogenes cepa Salinem; calle 7: L. interrogans serovar Hardjo cepa Hardjoprajitmo; calle 8: L. interrogans serovar Copenhageni cepa M 20; calle 9: L. interrogans serovar Canicola cepa Hond Utrecht IV aislada de una comadreja; calle 10: L. biflexa serovar Patoc cepa Patoc I; calle 11: L. biflexa serovar Andamana cepa Andamana; calle 12: control de contaminación sin templado.
Las secuencias de nucleótidos obtenidas a partir de los productos de PCR de las cepas referenciales L. interrogans serovar Pomona cepa Pomona, L. interrogans serovar Canicola cepa Hond Utrecht IV, L. interrogans serovar Wolffi cepa 3705, L. interrogans serovar Pyrogenes cepa Salinem, L. interrogans serovar Hardjo cepa Hardjoprajitmo y L. interrogans serovar Copenhageni cepa M 20 fueron analizadas y comparadas mediante BLAST con otras secuencias disponibles en el GenBank y mostraron una máxima similitud (100% identidad) con las secuencias de ADN de la adhesina ligB de los diferentes serovares presentes en el banco de genes. En un alineamiento múltiple de las secuencias mediante ClustalW2, la secuencia consenso obtenida con el programa BioEdit permitió visualizar diferencias entre los serovares analizados. Se pudo observar la presencia de polimorfismos, es decir, el cambio de bases (A, T, C, G) dentro de la secuencia del ADN (fig. 2).
Alineamiento múltiple mediante ClustalW2 de las secuencias de nucleótidos obtenidas de un fragmento 1kb del gen ligB de las cepas referenciales L. interrogans serovar Pomona cepa Pomona, L. interrogans serovar Canicola cepa Hond Utrecht IV, L. interrogans serovar Wolffi cepa 3705, L. interrogans serovar Pyrogenes cepa Salinem, L. interrogans serovar Hardjo cepa Hardjoprajitmo y L. interrogans serovar Copenhageni cepa M 20.
Los puntos denotan homología con la secuencia de la cepa referencial L. interrogans serovar Canicola cepa Hond Utrecht IV. Nótese el primer polimorfismo en el nucleótido número 27, las cepas L. interrogans serovar Pyrogenes cepa Salinem, L. interrogans serovar Hardjo cepa Hardjoprajitmo y L. interrogans serovar Copenhageni cepa M 20 presentan una «A» en lugar de una «G».
La secuenciación de los productos de PCR de una región del gen ligB pone en evidencia una suficiente variación entre los serovares estudiados, que permite una diferenciación clara de los serovares de Leptospira spp. En el presente trabajo fueron secuenciados 6 serovares de cepas referenciales de Leptospira spp.; se prevé sumar mayor cantidad de serovariedades para poder ampliar la cantidad de patrones. Mediante la comparación de esta secuencia con los patrones ya estudiados es posible identificar el serovar implicado en un aislamiento.
La importancia del presente trabajo radica en que es la primera vez que se diferencian serovares de leptospiras patógenas a partir de la comparación de secuencias del producto de amplificación de una secuencia específica de la adhesina ligB. El conocimiento del serovar de Leptospira que circula en una región determinada es de suma importancia a la hora de decidir el tipo de vacuna que se debe aplicar, dado que las vacunas comercialmente disponibles son serovar-específicas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo fue financiado por el laboratorio de Leptospirosis del Instituto de Patobiología CICVyA, CNIA, Instituto Nacional de Tecnología Agropecuaria, los subsidios PICT-0618 2012 y el proyecto Nacional del Instituto Nacional de Tecnología Agropecuaria PNSA 1115052.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.