Reportamos un brote de rabia paresiante bovina en un engorde a corral ubicado en un área libre de esta enfermedad en el sur de Santa Fe, Argentina. Tras manifestar signos neurológicos murieron 6/122 novillos (morbimortalidad = 4,9%), no vacunados. Todos los afectados habían sido transportados desde un establecimiento de Formosa 40-75 días antes del inicio del brote. El examen patológico encefálico de tres novillos reveló gliosis, meningoencefalitis linfoplasmocítica y cuerpos de inclusión intracitoplasmáticos en neuronas; en dos casos hubo detección intralesional de antígeno del virus rábico mediante inmunohistoquímica. Se confirmó la presencia del virus rábico mediante inmunofluorescencia directa en cerebro; se identificó la variante 3a, típica de murciélagos hematófagos, mediante inoculación en ratones seguida de inmunofluorescencia indirecta. Esta es la primera comunicación de rabia paresiante en la llanura pampeana argentina y evidencia que el transporte de bovinos desde áreas endémicas hacia áreas libres podría representar un mecanismo de diseminación de esta enfermedad zoonótica de denuncia obligatoria.
We report an outbreak of bovine paralytic rabies in a feed lot in a disease-free area in southern Santa Fe, Argentina. Six of 122 unvaccinated steers died after showing neurological signs (morbimortality = 4.9%) for 24-72 hours, 40-75 days after being transported to the feed lot from a farm located in Formosa. Pathologic examination of the brain in 3 steers revealed gliosis, lymphoplasmacytic meningoencephalitis, and intracytoplasmic inclusion bodies in neurons, along with intralesional detection of the rabies virus antigen by immunohistochemistry in 2 cases. Rabies virus was confirmed by direct immunofluorescence in the brain, and further identified as variant 3a, typical of hematogenous bats, by inoculation in mice followed by indirect immunofluorescence. This represents the first communication of bovine paralytic rabies described in the Pampas plain in Argentina, and evidences that the transport of cattle from endemic to disease-free areas could represent a mechanism of dissemination of this communicable zoonotic disease.
La rabia es una enfermedad infecciosa zoonótica causada por el virus de la rabia, un virus neurotrópico del género Lyssavirus, familia Rhabdoviridae. Este virus tiene un genoma de ARN de cadena simple, envuelto, con viriones con forma de bala, de 75 nm de diámetro y 180 nm de longitud7,11,15. En el mundo se han identificado siete genotipos dentro del género Lyssavirus. En Argentina solo se ha detectado el genotipo 1, que corresponde al virus rábico clásico y, dentro de este, se han descrito variantes antigénicas en función de diferencias estructurales en la proteína N. Estas incluyen la variante 1, detectada en caninos, felinos y humanos; la variante 2, detectada en caninos silvestres; la variante 3, identificada en murciélagos hematófagos, bovinos, equinos y humanos; y las variantes 4, 6 y otras detectadas en murciélagos insectívoros7. Identificar la variante viral tiene importancia epidemiológica, dado que permite determinar el reservorio original de un caso.
En el ganado, el principal transmisor del virus de la rabia (variante 3) es el murciélago hematófago (vampiro) Desmodus rotundus, que se alimenta de los animales; el contagio se produce por la saliva a través de la mordida7,15. Esta enfermedad es conocida como rabia paralítica o paresiante y ocurre más frecuentemente en bovinos y equinos, aunque puede afectar a otras especies domésticas, como ovinos, cabras y cerdos13, así como a especies silvestres y al hombre. Se trata de una enfermedad de denuncia obligatoria ante las autoridades sanitarias (SENASA)7. La morbilidad en el ganado puede ser alta (> 50%), según el tamaño de la población de vampiros y las medidas de prevención y control utilizadas, y la letalidad es del 100%7. Además de ser una enfermedad de alto impacto económico en la industria ganadera por la mortandad que ocasiona7, la rabia paresiante representa una amenaza para la salud pública, con creciente impacto en los seres humanos10,15. Se han identificado casos de rabia transmitida por murciélagos en pobladores rurales de la Argentina7.
En Argentina, hay un área endémica y un área libre de rabia paresiante7,15. El área endémica se extiende al norte del paralelo 31°S y al este del meridiano 66°O, abarcando las provincias de Misiones, Corrientes, Chaco, Formosa, Santiago del Estero y Tucumán; también parte de las provincias de Catamarca, La Rioja, Salta y Jujuy, así como el norte de Córdoba y Santa Fe7. La presencia del vampiro transmisor se extiende más al sur, hasta el paralelo 34°7. En el área endémica, la rabia paresiante es recurrente; por lo general, los brotes son seguidos por períodos sin casos, que pueden durar entre 5 a 12 años3. Históricamente, la región de Argentina con la mayor proporción de casos incluye el este de Chaco y Formosa y el norte de Corrientes, y, en segundo lugar, la región abarcada por Salta, Jujuy, Tucumán y Santiago del Estero15. En 2019 se detectaron varios casos bovinos en zonas sin precedentes de rabia paresiante, como el centro de la provincia de Córdoba1,12 y San Luis6. Varios de estos focos ocurrieron en localidades que están aproximadamente a 200 kilómetros al sur del paralelo 31.
El objetivo del presente trabajo es describir los hallazgos epidemiológicos, clínicos, patológicos y virológicos de un brote de rabia paresiante bovina, que tuvo lugar en un área libre de la enfermedad en la provincia de Santa Fe, Argentina.
El brote ocurrió en julio de 2015 en un establecimiento ubicado en el sur de la provincia de Santa Fe (sector suroeste del departamento Belgrano). El establecimiento tenía un total de 1.890 bovinos en engorde a corral (feed lot), con un tiempo de permanencia en los corrales de dos a cuatro meses. El problema se manifestó en una tropa de 122 novillos cruzas índicas en terminación, originarios de dos establecimientos de cría, localizados uno en la provincia de Formosa y el otro al norte de la provincia de Corrientes. Los animales no habían sido vacunados contra rabia. La mortalidad ocurrió por goteo y comenzó con un animal (caso 1), que mostró signos neurológicos 40 días luego del arribo al establecimiento de Santa Fe. A los 20 y 35 días del caso 1, otros dos novillos (casos 2 y 3) desarrollaron signos nerviosos. Durante 45 días, sobre un total de 122 novillos, murieron 6 (4,9%), todos luego de manifestar cursos clínicos neurológicos de 24 a 72 horas de duración. Los signos clínicos observados incluyeron andar tambaleante, incoordinación, permanencia en decúbito esternal, pedaleo y opistótono. Todos los novillos afectados procedían del establecimiento de Formosa.
Se realizaron tres visitas al establecimiento y durante estas se efectuaron tres necropsias (casos 1, 2 y 3), donde se recolectaron muestras de líquido cefalorraquídeo (LCR) y encéfalo. Los encéfalos fueron seccionados en su plano medio, y se acondicionó una mitad en refrigeración para realizar estudios bacteriológicos y virológicos, y la mitad restante se colocó en formalina tamponada al 10% para estudios histopatológicos e inmunohistoquímicos. Las muestras para bacteriología incluyeron hemisferio cerebral, médula oblonga y LCR; dichas muestras fueron sembradas en agar sangre y agar MacConkey e incubadas en aerobiosis y microaerobiosis durante 48 horas a 37°C.
Para el diagnóstico virológico de rabia, las muestras refrigeradas de cerebro fueron remitidas al Departamento de Rabia de la Dirección General de Laboratorios y Control Técnico (DILAB) de SENASA, donde se realizó la técnica de inmunofluorescencia directa (IFD) y el aislamiento viral por inoculación intracerebral en ratones (prueba biológica), siguiendo un procedimiento previamente descrito4. Con las diferentes regiones del encéfalo de los bovinos se realizaron improntas, que luego fueron sometidas a IFD incubándolas con un conjugado antirrábico comercial antinucleocápside (BIO-RAD®) y observadas bajo microscopio de fluorescencia. Para la prueba biológica, se realizó un macerado de encéfalo de cada novillo, que fue inoculado intracerebralmente en ratones adultos y lactantes de hasta tres días de vida; estos animales fueron monitoreados clínicamente. Luego de comenzada la signología compatible con rabia, los ratones se eutanasiaron, se extrajeron los cerebros y se realizaron improntas, que luego fueron sometidas a serotipificación viral por inmunofluorescencia indirecta (IFI), como fue descrito anteriormente4, utilizando un panel de ocho anticuerpos monoclonales cedidos por el Centers for Disease Control and Prevention (CDC) de Atlanta, Georgia, Estados Unidos. Para el estudio histopatológico, luego de 72 horas de fijación en formalina, se realizaron reducciones de diferentes sectores del encéfalo de los tres novillos necropsiados, incluyendo médula oblonga, puente troncoencefálico, colículos rostrales, tálamo, cerebelo y regiones frontales y occipitales del hemisferio cerebral. Las muestras fueron deshidratadas en alcoholes, incluidas en parafina, cortadas a 4 μm de espesor y teñidas con hematoxilina-eosina. Se realizó inmunohistoquímica (IHQ) para la detección de antígeno del virus de la rabia, según descripciones anteriores14, en secciones de médula oblonga y cerebelo de los tres casos, siguiendo un procedimiento estandarizado en el University of Minnesota Veterinary Diagnostic Laboratory (Saint Paul, Minnesota, Estados Unidos).
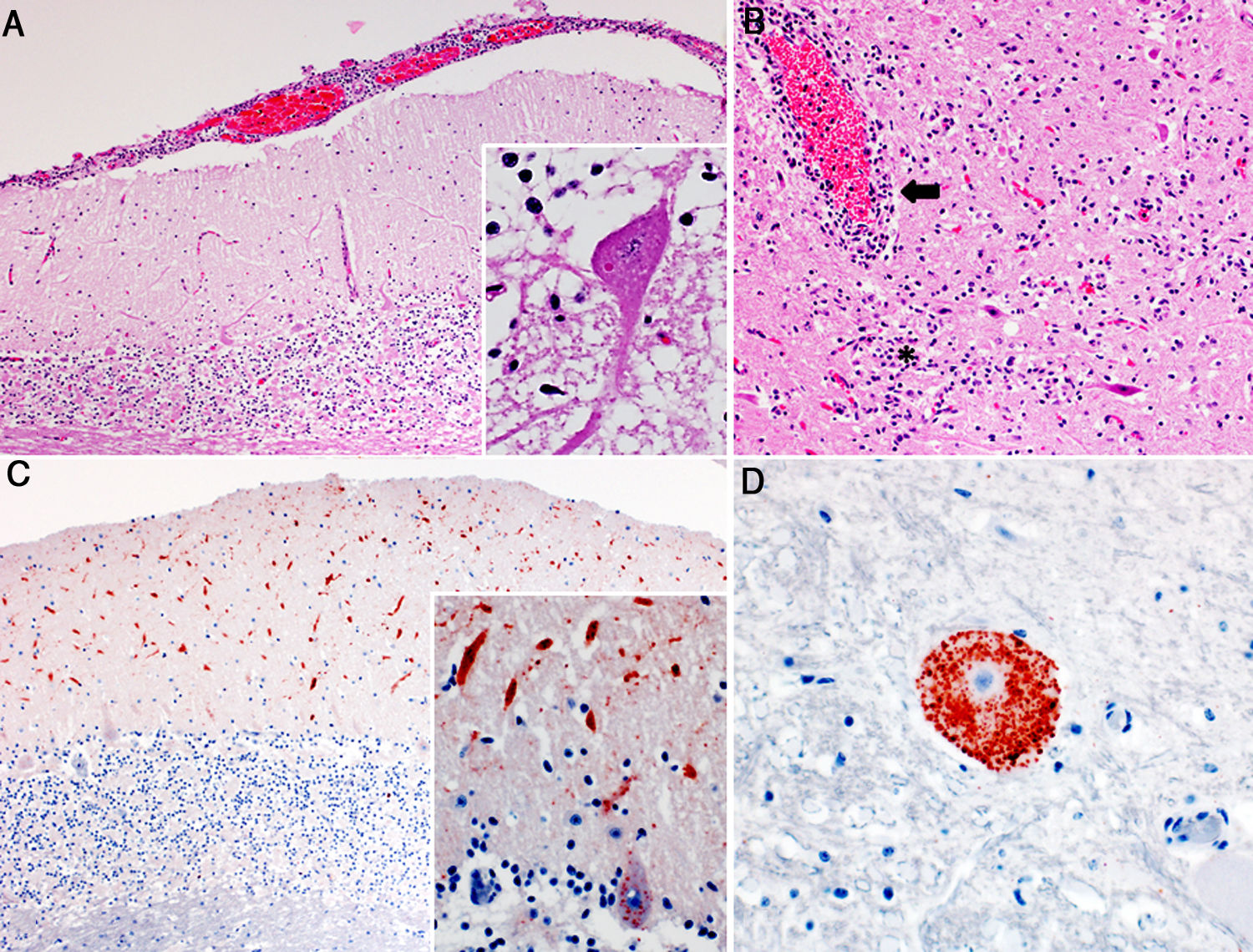
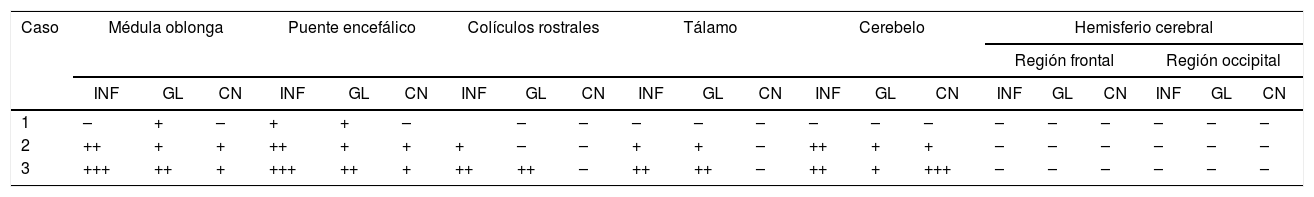
En los casos 1 y 2, no se observaron lesiones en las necropsias. En el caso 3, se observó distensión de la vejiga. En los tres casos examinados, el análisis histológico reveló grados variables de gliosis, meningoencefalitis linfoplasmocítica y/o cuerpos de inclusión intracitoplasmáticos eosinofílicos en neuronas (corpúsculos de Negri). Las diferencias en las lesiones histológicas observadas en las distintas regiones del encéfalo y entre los tres casos se presentan en la tabla 1. Resumidamente, en el caso 1 se observó leve gliosis en la sustancia gris de la base cerebral. En los casos 2 y 3, se observó infiltrado linfoplasmocítico, principalmente en las meninges, en el cerebelo y tronco encefálico y en los espacios perivasculares del tronco encefálico, focos de gliosis en la sustancia gris y necrosis en neuronas de Purkinje cerebelares y de los núcleos del tronco encefálico (fig. 1). Los corpúsculos de Negri se observaron más frecuentemente en células de Purkinje cerebelares y, con menor frecuencia, en las neuronas de los núcleos del tronco encefálico. La IHQ para detección de antígeno del virus de la rabia reveló inmunomarcación intralesional en la médula oblonga y el cerebelo de los casos 2 y 3, que tenían lesiones en estas regiones, no así en el caso 1, donde no había lesiones inflamatorias significativas en estas dos regiones anatómicas.
Hallazgos histopatológicos en las diferentes secciones de cerebros de los bovinos necropsiados
| Caso | Médula oblonga | Puente encefálico | Colículos rostrales | Tálamo | Cerebelo | Hemisferio cerebral | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Región frontal | Región occipital | ||||||||||||||||||||
| INF | GL | CN | INF | GL | CN | INF | GL | CN | INF | GL | CN | INF | GL | CN | INF | GL | CN | INF | GL | CN | |
| 1 | – | + | – | + | + | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | |
| 2 | ++ | + | + | ++ | + | + | + | – | – | + | + | – | ++ | + | + | – | – | – | – | – | – |
| 3 | +++ | ++ | + | +++ | ++ | + | ++ | ++ | – | ++ | ++ | – | ++ | + | +++ | – | – | – | – | – | – |
INF: inflamación perivascular y meníngea linfoplasmocítica (meningoencefalitis); GL: focos de gliosis; CN: corpúsculos de Negri.
+ + +: intenso, + +: moderado, +: leve, −: ausente
Hallazgos histopatológicos en cerebros de bovinos con rabia paresiante. A. Meningitis linfoplasmocítica en el cerebelo. H&E, 50x. Recuadro: cuerpo de inclusión intracitoplasmático eosinofílico (corpúsculo de Negri) en una neurona de Purkinje. H&E, 400x. B. Inflamación linfoplasmocítica perivascular (flecha) y del neuroparénquima circundante (asterisco) en el tálamo. H&E, 100x. C. Inmunomarcación antigénica del virus de la rabia (precipitados granulares marrón ocre) en la capa molecular del cerebelo. IHQ, 50x. Recuadro: mayor detalle de la inmunomarcación en las dendritas en la capa molecular y citoplasma de las células de Purkinje. IHQ, 400x. D. Inmunomarcación antigénica del virus de la rabia en el citoplasma de una neurona del mesencéfalo; nótese la ausencia de marcación en el área central, correspondiente al núcleo de la misma neurona. IHQ, 400x.
Los encéfalos de los tres casos fueron positivos por IFD a antígeno del virus de la rabia. En la prueba biológica, solo los ratones inoculados con la muestra del caso 3 mostraron signos nerviosos típicos de rabia. La caracterización antigénica viral fue compatible con la variante 3a del virus de la rabia. No se aislaron bacterias patógenas en los cultivos bacteriológicos del encéfalo y LCR en ninguno de los casos.
El diagnóstico de rabia en este brote se realizó a partir de los hallazgos clínicos, patológicos, inmunohistoquímicos y virológicos. Luego de realizada la denuncia a SENASA y confirmado el brote de rabia mediante IFD, el establecimiento fue interdictado, por lo que interrumpieron la comercialización de animales por aproximadamente 70 días y se vacunaron todos los animales en el establecimiento donde ocurrió el brote y el establecimiento de origen de los animales afectados. En bovinos de esta categoría, algunas enfermedades neurológicas que pueden compartir signos clínicos con la rabia incluyen, entre otras, polioencefalomalacia, listeriosis nerviosa, coccidiosis nerviosa, meningoencefalitis trombótica y encefalitis por herpesvirus bovino tipo 55. También pueden ocasionar, esporádicamente, signos nerviosos en bovinos el botulismo, las meningitis bacterianas (incluyendo tuberculosis meníngea), la fiebre catarral maligna, la enfermedad de Aujeszky y varias otras enfermedades virales5. Estas enfermedades deben tenerse en cuenta en el diagnóstico diferencial de la rabia paresiante, y, aunque la rabia puede manifestarse con signos neurológicos sugestivos, como paresia de los miembros posteriores o parálisis con cursos de 5 a 14 días7, estos pueden no estar presentes, como observamos en este brote y según refieren otros reportes de rabia en animales jóvenes8.
Los diagnósticos clínicos presuntivos iniciales en este brote por parte de los veterinarios del establecimiento fueron listeriosis cerebral y polioencefalomalacia, debido a que, en los años 2012 y 2013, se habían confirmado brotes de ambas enfermedades en el establecimiento, a través de estudios histológicos y bacteriológicos realizados en los laboratorios de Sanidad Animal de INTA Marcos Juárez. Además, la rabia no fue inicialmente sospechada debido a que los signos clínicos no eran los típicos y a que el establecimiento se encontraba en el área libre de esta enfermedad. Esta situación remarca la necesidad de considerar como potencialmente rábico a cualquier bovino con enfermedad neurológica, independientemente de su edad, manifestación clínica y ubicación geográfica, sobre todo cuando son animales recientemente trasladados de áreas endémicas a regiones libres.
La llanura pampeana es una de las principales regiones de producción de carne de Argentina. Una gran cantidad de bovinos que son engordados en el centro de Argentina provienen del noreste y noroeste del país9, donde la rabia paresiante es endémica3,7. Incluso actualmente, el establecimiento sigue incorporando terneros que provienen del norte de Argentina. Es probable que los bovinos enfermos de rabia en el brote aquí descrito ya estuvieran infectados e incubando la enfermedad al momento de su llegada al establecimiento en Santa Fe, a diferencia de lo reportado en los casos de Córdoba y San Luis, que ocurrieron en bovinos autóctonos de esas regiones. Se han informado casos similares en Texas, Estados Unidos, donde una vaca importada de México desarrolló rabia después de su llegada2, y en México9, en bovinos de engorde a corral, donde se transportan animales para engordar de áreas endémicas de rabia paresiante a áreas libres. Si bien la región donde ocurrió este brote es endémica respecto de la presencia del vampiro7, no se encontraron colonias en un radio de 3 km desde el establecimiento, que es la distancia que pueden recorrer desde su refugio los vampiros para alimentarse3. Tampoco los propietarios mencionaron haber observado la presencia de vampiros alimentándose de los bovinos, ni se observaron en los animales necropsiados lesiones en la piel indicativas de mordidas de vampiros. Hasta donde llega nuestro conocimiento, tampoco hay reportes de detección del virus rábico en colonias de vampiros de esta región de Argentina. Por lo antedicho, consideramos como causa más probable del brote la llegada de estos casos importados desde la zona norte de Argentina, como fue descrito en otros países2,9. El hecho de que todos los animales afectados hayan provenido del predio de Formosa representa una evidencia adicional en favor de esta hipótesis. Nuestro informe da cuenta del primer caso descrito en la literatura científica de rabia paresiante en la llanura pampeana, en Argentina, y evidencia que la circulación de animales de zonas endémicas a áreas libres de rabia paresiante podría ser un mecanismo de diseminación de la enfermedad, además de exponer a personas de la zona libre.
En cuanto a lo histológico, en la rabia paresiante se observa meningoencefalitis, meningomielitis, ganglioneuritis, gliosis focal y, en el 50-70% de los casos, corpúsculos de Negri, principalmente en células de Purkinje del cerebelo16. Estas lesiones suelen ser más graves en la médula espinal, tronco encefálico y cerebelo13, como fue observado en los tres casos estudiados en este brote. Las pruebas oficiales para el diagnóstico de rabia en Argentina son la IFD, la prueba biológica en ratones y la reacción en cadena de la polimerasa (PCR)7. La IFD es todavía la prueba de referencia para el diagnóstico de rabia por su rapidez, precisión y sensibilidad, cercana al 100%4,14. La prueba biológica es considerada más específica para el diagnóstico y permite caracterizar las cepas involucradas en el brote, aunque tiene varias desventajas, entre ellas, el tiempo que demora (requiere alrededor de cuatro semanas) y la necesidad de disponer de bioterios y laboratorios de nivel 3 de bioseguridad. La técnica de PCR tiene alta sensibilidad y especificidad, es más económica y puede ser utilizada para diagnosticar la enfermedad en encéfalos en descomposición o que resultaron negativos en la prueba biológica16. Aunque la IHQ no es una prueba de diagnóstico oficial en Argentina, en determinadas situaciones puede resultar de utilidad, por ejemplo, cuando no existe posibilidad de tener tejidos refrigerados o fácil acceso a un centro diagnóstico de referencia; también cuando se desea realizar estudios retrospectivos o remitir muestras a zonas distantes, ya que aquellas pueden ser formoladas, y por tanto, pasar a ser muestras no infecciosas. Además, el envío de este tipo de muestras representa menor riesgo durante el traslado14.
Respecto de la variante 3 del virus rábico, detectada en este trabajo, es la más extendida en todo el continente americano asociada a brotes de rabia paresiante y la única identificada hasta la fecha en bovinos de Argentina. Las variantes antigénicas 5, 8 y 11 tienen una limitada distribución en algunos países de las Américas15. Torres et al.15 secuenciaron la proteína N de 183 cepas del virus de la rabia (variante 3) procedentes de la región noreste (NEA) y noroeste de Argentina. En ese trabajo, hicieron un análisis filogenético y observaron que la región del NEA tuvo más variedad de grupos filogénicos, y en algunos de estos, con secuencias similares a las de países limítrofes, lo que sugiere múltiples introducciones del virus rábico desde Brasil.
En los laboratorios de Sanidad Animal de INTA, frecuentemente recibimos casos de bovinos afectados con signología nerviosa. En Argentina, los laboratorios oficiales que realizan el diagnóstico de rabia en animales (Laboratorios de Red de SENASA) no están en los mismos laboratorios (públicos o privados) donde se realiza el diagnóstico de otras enfermedades neurológicas que suelen afectar a los bovinos. Para el diagnóstico de enfermedades neurológicas, estos laboratorios utilizan diferentes procedimientos (virológicos, patológicos y bacteriológicos), como es sugerido por Dore y Smith5. Por tal razón, los profesionales que trabajan en el diagnóstico de estas afecciones deben dividir las muestras de cerebro, una vez extraído del cráneo bovino, y remitirlas a diferentes laboratorios, para poder hacer un diagnóstico acabado de las enfermedades neurológicas. La rabia es una enfermedad zoonótica. El contacto con la saliva o tejidos durante el examen post mortem7 y la manipulación de cerebros en la faena de animales rabiosos es un riesgo ocupacional7,16. Es importante que los profesionales veterinarios, los operarios de engordes a corral y las personas que trabajan en contacto con animales de laboratorios públicos y privados, así como quienes manipulan tejido nervioso de bovinos, estén alertas del riesgo de contraer rabia y que utilicen elementos de protección personal al momento de hacer revisaciones clínicas, necropsias o procesamientos de tejido nervioso, aunque los animales provengan de áreas libres de la enfermedad. En este caso particular, cuatro de los médicos veterinarios que trabajaron en relación con este brote de rabia debieron ser vacunados siguiendo el esquema de vacunación de postexposición a virus rábico.
En Argentina, se realiza la vacunación del ganado en áreas endémicas con vacunas con virus rábico inactivado. Dentro del área endémica, existen emprendimientos ganaderos que, por sus características, deben ajustarse a regímenes obligatorios de vacunación contra la rabia, tales como establecimientos de engorde a corral, donde se vacunan los animales al ingreso7. Sin embargo, lamentable e injustificadamente, no existe esta normativa para los terneros que viajan hacia zonas libres del centro y sur del país. Este brote demuestra, también, que vacunar a los animales antes de su traslado a zonas libres es fundamental y, por tanto, sería conveniente que ello fuera obligatorio, ya que el transporte de animales sin vacunar puede ser un mecanismo de diseminación de esta enfermedad inmunoprevenible.
Responsabilidades éticasLos autores declaran que los procedimientos seguidos para el manejo y cuidado de los animales de laboratorio fue de acuerdo con las recomendaciones de la Guide for the Care and Use of Laboratory Animals, 8th edition, publicada por el National Research Council (US) Committee. Los ensayos de inoculación en ratones fueron evaluados y aprobados por el Comité Institucional de Cuidado y Uso de Animales de Laboratorio (CICUAL) de SENASA.
FinanciaciónEl presente trabajo fue financiado con fondos de proyectos del Instituto Nacional de Tecnología Agropecuaria [INTA-PNSA-1115052], Servicio Nacional de Sanidad y Calidad Agroalimentaria (SENASA) y Fundación ArgenINTA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.