CASO CLÍNICO
Presentamos el caso de una paciente de 50 años de edad, que acude a consulta por haberle encontrado 3 meses antes alteraciones bioquímicas enzimáticas de la función hepática, coincidiendo con una revisión ginecológica.
En los antecedentes personales destacaba haber sido diagnosticada de quiste ovárico, colon espástico y síndrome menopáusico actual. Hace un año presentó un episodio urticarial que fue estudiado sin encontrar patología, por lo que fue tratada con el diagnóstico de urticaria/angioedema crónico idiopático. En aquella época la analítica mostraba un hematocrito de 37,3% con una hemoglobina de 12,6 g/dl, volumen corpuscular medio 93 um. Eosinófilos: 2%. Gammaglutamil transpeptidasa (GGT): 28 U/l con una fofatasa alcalina (FAL) total de 89 U/l.
Reinterrogada, refería desde 6 meses antes pérdida de peso progresivo con alteraciones del estado general y cansancio vespertino sin fiebre. En el estudio actual, el hematocrito es del 30,3% con una hemoglobina de 9,9 g/dl, VCM 83 um y 1,3 de eosinófilos. GGT: 267 U/l y FAL: 223 U/l.
En la exploración física se obtuvieron los siguientes datos: talla 163; peso: 58.500; tensión arterial 120/80; palpación abdominal negativa; no había alteraciones dérmicas ni ictericia u otros estigmas hepáticos.
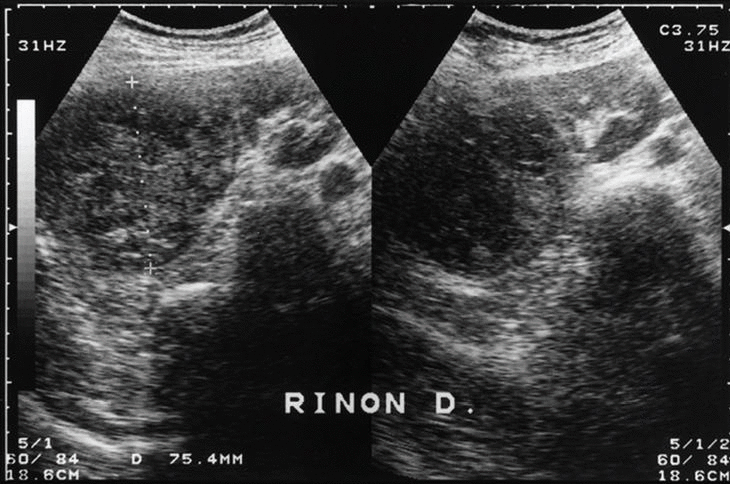
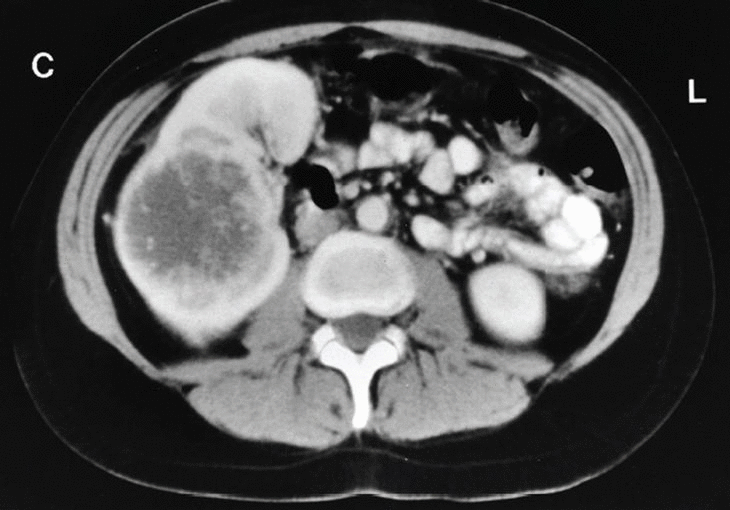
Para completar su estudio se practicó una determinación de anticuerpos e Echinococcus, toxoplasma y Yersinia que fueron negativos. En la ecografía abdominal no se apreciaban alteraciones a nivel de hígado, vía biliar o vesícula, llamando la atención una formación sólida, de estructura ecográfico-inhomogénea y 75 mm de diámetro máximo en el polo superior del riñón derecho (fig. 1). Esta imagen se confirma en la tomografía axial computarizada abdominal, que sugiere una tumoración renal con necrosis central. La vena renal es permeable y no hay adenopatías retroperitoneales (fig. 2).
Fig. 1.
Fig. 2.
La enferma fue intervenida con el diagnóstico de carcinoma de células renales (CCR). Se realizó una nefrectomía derecha total. El informe macroscópico describe una neoformación bien delimitada de 8 ´ 7 ´6,5 cm y 350 g, localizada entre la parte media y el polo superior del riñón. Constituida por tejido amarillento con múltiples cavidades quísticas de tamaño variable entre 0,2 y 1 cm de diámetro, de contenido hemático. Ni el uréter ni los vasos están afectados. La tumoración no infiltra la cápsula renal. En la grasa perirrenal no se aislaron ganglios. Diagnóstico anatomopatológico: carcinoma de células renales claras de grado nuclear I a III. Extremos de resección libres (estadio I de Robson, T2).
Clínicamente la enferma mejora subjetivamente y pasado un mes tras la intervención refiere que no ha vuelto a presentar episodios de prurito y ha ganado peso y vitalidad. En la analítica, la hemoglobina sube a 11,5 g/dl con un hematocrito del 36% y VCM 89 um, mientras las enzimas hepáticas se han reducido a GGT 27 U/l y FAL 93 U/l; fracción isoenzimática 100% hepática.
COMENTARIOS
El número de formas de FAL humana se caracteriza por su movilidad electroforética, termolabilidad, propiedades inmunoquímicas y enzimáticas. Las isoformas las podemos clasificar en: a) tejido-inespecíficas y se expresan en hígado, riñón y hueso; b) la isoforma intestinal y c) la isoforma placentaria. Los genes de la FAL intestinal y placentaria ocupan posiciones vecinas en el cromosoma 2, mientras que la isoenzima tisular inespecífica se localiza en el cromosoma 11-3. La determinación de las isoenzimas tejido-inespecíficas puede realizarse por termolabilidad y electroforesis. Actualmente el método de mayor sensibilidad es mediante la utilización de autoanticuerpos monoclonales.
Ante la presencia de enzimas hepáticas anormales, sobre todo con una separación isoenzimática estrictamente hepática, el procedimiento más eficaz es la ecografía abdominal, ya que permite diagnosticar patología obstructiva al tiempo que una participación parenquimatosa, aunque en nuestro caso las enzimas eran específicas espacio-ocupantes. Ante la demostración ecográfica de una masa renal, el paso siguiente es la tomografía computarizada, que descarta la participación hepática, la evidencia de metástasis a nivel del abdomen o pelvis, la participación de la vena renal y, por supuesto, las características anatómicas de la masa renal, que eran sugestivas de una enfermedad maligna.
El CCR, con su tríada clásica de hematuria, dolor abdominal y masa palpable, sólo se aprecia en el 10% de los enfermos y nuestra paciente no presentaba ninguno de ellos. Frente a ello, la detección incidental de masa renal puede presentarse entre el 25% y el 40%. Algunos síntomas como la fiebre, el malestar general, la anorexia y la pérdida de peso, presentes en nuestra enferma, son absolutamente inespecíficos y pueden preceder a la evidencia del tumor renal entre semanas y años5.
Hasta el 20% de los pacientes con CCR presentan síntomas paraneoplásicos. Éstos están en relación con la elaboración de distintas sustancias: hormonas y precursores de hormonas, prostaglandinas, enzimas, proteínas activas, polipéptidos e inmunoglobulinas6. Entre ellos se ha descrito la hipercalcemia, la producción ectópica de corticotropina, de hormona coriónica y de prolactina. También se ha descrito policitemia por la producción ectópica de eritropoyetina e hipertensión arterial7.
Un hallazgo frecuente en el CCR es la disfunción hepática no metastásica con la elevación de la FAL. Aunque en la mayoría de los casos no se realizó el estudio isoenzimático, éste parece no ser óseo. Su imagen podría ser tumoral8 y de hecho, una enzima conocida como isoenzima de Reagan es una FAL similar a la forma placentaria que se ha descrito en una gran variedad de neoplasias. Puede ser que cada tumor produzca un tipo de isoenzima peculiar en los distintos pacientes9. También se ha documentado elevación de la α-2 globulina, que en la mayoría de los casos se debe al incremento de la haptoglobulina10.
La afectación de las enzimas hepáticas puede estar en relación con la infiltración metastásica del hígado o bien también por una disfunción no metastásica como fue descrita por primera vez por Stauffer en 1961 como «esplenomegalia nefrogénica», también llamado «síndrome de disfunción hepatonefrogénica no metastásica»11.
Acontece entre el 10% y el 15% de los casos con tumor renal. Estas alteraciones incluyen elevación de las transaminasas y de la FAL o hipoprotrombinemia y retornan a la normalidad tras la cirugía del tumor.
En caso de que no haya normalización de estas alteraciones bioquímicas el pronóstico es significativamente peor11,12. Hay varios trabajos recientes sobre el papel de la FAL en el pronóstico del CCR13-15. En uno de estos estudios Chuang et al encuentran que el 21% de los pacientes analizados tenían elevados niveles de FAL no encontrando diferencias significativas entre los estadios II, III y IV aunque sí menor elevación en el estadio I. La persistencia de FAL elevada tras nefrectomía radical o el aumento tras niveles normales se correlacionó con recidiva local o lesión metastásica. Aproximadamente el 60% de estos pacientes tenían además otras manifestaciones paraneoplásicas, lo cual ensombrecía el pronóstico.
Frente a ello, en un estudio realizado por la Escuela de Medicina de Atlanta16, donde se revisaron 723 pacientes con CCR metastásico con el fin de determinar la relación entre la FAL y la metástasis ósea de CCR, los resultados no fueron significativos y concluyen que la FAL es un indicador poco sensible de metástasis óseas.
La GGT se sintetiza en el tubo contorneado proximal, reticuloendoplásmico liso del hígado, páncreas y próstata17,18. La GGT circulante en el suero es mayoritariamente de origen hepático en los sujetos sanos. Sandock et al19 en un estudio retrospectivo de 53 pacientes con CCR metastásico y 29 con CCR local demostraron niveles elevados de GGT en un gran porcentaje de pacientes con CCR metastásico frente a niveles normales en CCR localizado. Quizá esto pueda ser explicado porque las células metastásicas sean las que segreguen GGT.
El resto de las manifestaciones inespecíficas que presentó nuestra enferma, como la caquexia, el malestar general y la pérdida de peso se asocian hasta en un tercio de los enfermos. La fiebre aparece en un 10% al 20%; a veces es el único síntoma clasificado como fiebre no filiada o de origen desconocido que se ve entre el 2% y el 4% de los enfermos20,21.
El cuadro de prurito también se ha descrito en relación con diversas enfermedades malignas y en otras enfermedades de la medicina interna. Las más frecuentes están asociadas a ictericia colestásica o a la hipercalcemia22,23.
Este prurito también ha sido descrito en la enfermedad de Hodgkin, la policitemia vera, el déficit de hierro y la uremia, el linfoma no Hodgkin, la leucemia, el mieloma múltiple, los tumores sólidos y en el síndrome mielodisplásico, así como en enfermedades endocrinas como la diabetes, el hipertiroidismo, el hipotiroidismo y el síndrome carcinoide. También en enfermedades neurológicas focales como tumores cerebrales, infarto cerebral y en la esclerosis múltiple y, por supuesto, en diferentes enfermedades infecciosas como las parasitosis y la infección por el virus de la inmunodeficiencia humana.
Un trabajo de la Clínica Mayo demuestra el papel del CCR como síndrome multifuncional, por lo que ha sido llamado «el tumor del internista», donde el prurito fue su primera manifestación. En la presentación de este prurito, aparte de la ictericia colestásica, también parece jugar un papel importante la serotonina y la histamina; de manera que en su tratamiento puede ser útil la paroxetina o el tropisetrón24.
En casos como el nuestro, el hallazgo de alteraciones enzimáticas hepáticas asintomáticas debe obligar a un estudio completo del enfermo y descartar la participación paraneoplásica de un tumor renal.
NOTICIAS
PREMIOS AL MEJOR TRABAJO EN REEMO 2001
EDICIONES DOYMA, S.A.
CONVOCA
LOS PREMIOS AL MEJOR TRABAJO ORIGINAL Y AL MEJOR TRABAJO CLÍNICO PUBLICADOS EN LA REVISTA ESPAÑOLA DE ENFERMEDADES METABÓLICAS ÓSEAS DURANTE EL AÑO 2001
1. Concurren a él todos los trabajos originales y clínicos publicados en la REVISTA ESPAÑOLA DE ENFERMEDADES METABÓLICAS ÓSEAS, durante el año 2001.
2. El Consejo Editorial realizará para cada grupo una selección de los tres mejores trabajos.
3. El Comité Editorial posteriormente otorgará un premio de 100.000 ptas, acompañado de un diploma, al mejor trabajo de cada grupo. El premio será entregado al primer firmante del trabajo.
4. Las decisiones de los Jurados responderán a criterios de independencia y de objetividad.
5. El resultado será hecho público en el Congreso SEIOMM de 2002.