Evaluar la seguridad y eficacia de la biopsia guiada cognitivamente (BGC) con la resonancia magnética multiparamétrica (RMmp) para obtener muestras del nódulo dominante del cáncer de próstata.
Material y métodosRealizamos una BGC en 53 pacientes por elevación progresiva del PSA tras hacer una RMmp. Todos los pacientes firmaron el consentimiento informado. Las biopsias se realizaron por vía transperineal con control ecográfico. Las 3 primeras muestras se obtuvieron de la lesión diana determinada por la RMmp, utilizando criterios PIRADS (corresponden a las BGC). Posteriormente se obtuvieron 9 cilindros del resto de los segmentos de la próstata (biopsias sistemáticas). El anatomopatólogo valoró los 12 cilindros sin saber cuáles correspondían a las BGC y cuáles a las biopsias sistemáticas. Definimos como lesión dominante la de mayor valor Gleason y volumen tumoral en lesiones multifocales y a la única lesión detectada en tumores unifocales.
ResultadosDiagnosticamos 29 tumores de próstata. En el 89,7% (26/29), el nódulo dominante fue diagnosticado por las BGC. De haber realizado únicamente las BGC no se hubieran diagnosticado 2 pacientes (3,8%, 2/53) y se hubiera infraestadificado solo uno (1,8%, 1/53) en el que no se obtuvo muestra de la lesión con mayor valor Gleason. La tasa de positividad de la BGC fue del 50,9% (27/53), y en los pacientes con biopsias previas negativas del 46,3% (19/41). No observamos complicaciones significativas inmediatas ni tardías.
ConclusiónLa BGC es una técnica segura y eficaz para detectar la lesión dominante del cáncer de próstata.
To evaluate the safety and efficacy of cognitive targeting in multiparametric MRI-guided biopsy to obtain samples of the dominant nodule in prostate cancer.
Material and methodsWe performed cognitive-targeted biopsy after multiparametric MRI in 53 patients with progressive elevation of PSA. All patients provided written informed consent. Biopsies were done via a transperineal route under ultrasound guidance. The first three samples were obtained by cognitive targeting, with the target lesion determined by multiparametric MRI according to the PI-RADS (prostate imaging, reporting, and data system) criteria. Then 9 cylinders were obtained from the remaining segments of the prostate (systematic biopsies). The pathologist evaluated the 12 cylinders without knowing which ones were obtained by cognitive targeting. In patients with multifocal lesions, we defined the dominant lesion as the one with the highest Gleason score and tumor volume; in patients with unifocal lesions, we defined the dominant lesion as the lesion identified.
ResultsWe diagnosed 29 prostate tumors. In 89.7% (26/29), the dominant nodule was diagnosed by the cognitive-targeted biopsy. If only cognitive-targeted biopsy had been done, the dominant nodule would not have been diagnosed in two (3.8%, 2/53) patients and only one (1.8%, 1/53) patient, in whom no sample was obtained from the lesion with the highest Gleason score, would have been understaged. The rate of positivity of cognitive-targeted biopsy was 50.9% (27/53) in the entire group of patients and 46.3% (19/41) in the group of patients with previous negative biopsies. No significant immediate or late complications were observed.
ConclusionCognitive targeting is safe and efficacious for detecting the dominant lesion in prostate cancer.
El cáncer de próstata (CP) es el tumor más frecuente en el hombre1. La mayoría se diagnostican con una biopsia transrectal ecoguiada (BTE). El porcentaje de positividad en una primera BTE es del 40-50%2 y el de una segunda entre el 18-32%3,4. Manejar un paciente con elevación progresiva del antígeno prostático específico (PSA) y BTE repetidamente negativas es un reto para urólogos y radiólogos.
Aunque el CP es un tumor multifocal, hay estudios que demuestran que hasta el 90% del volumen tumoral es atribuible a una lesión dominante5 y es esta la que progresa en agresividad. Esta lesión es difícil de detectar con ecografía y la BTE no asegura que la muestra provenga de ella, sobre todo si se sitúa en la zona apical o anterior. El resultado puede ser la infraestadificación del CP, cuyo porcentaje publicado es del 38%6,7.
La resonancia magnética multiparamétrica (RMmp) es más precisa que otras técnicas diagnósticas para detectar y caracterizar el CP8,9. Es la técnica más fiable para dirigir la biopsia prostática hacia la lesión dominante. En los últimos años se han desarrollado varios métodos para dirigir las biopsias mediante RMmp (cognitiva, programas de fusión, biopsia en la resonancia magnética)10,11. La biopsia dentro de la resonancia magnética necesita aparatos robotizados compatibles, es cara y aumenta el tiempo de estudio11. Los programas informáticos de fusión entre las imágenes de RMmp y la ecografía suponen un coste adicional en los equipos ecográficos y no mejoran los resultados de la biopsia guiada cognitivamente (BGC)12. En la BGC, el operador hace una correlación «mental» entre las imágenes de la RMmp y las de la ecografía en el momento de la biopsia. Para ello se puede ayudar de imágenes impresas o de una pantalla accesoria.
El objetivo de este estudio es evaluar la seguridad y eficacia de la BGC por los hallazgos de la RMmp para obtener muestras del nódulo dominante del CP.
Material y métodosPacientesEntre enero y diciembre del 2013 incluimos 53 pacientes en quienes la biopsia prostática estaba indicada por elevación progresiva del PSA y a los que se había realizado una RMmp como máximo 2 meses antes. De ellos, 41 tenían BTE previas negativas y PSA elevado desde la última biopsia, 9 no tenían biopsias previas y un PSA mayor de 4ng/ml, y 3 presentaban un PSA superior a 2ng/ml del NADIR, tras ser tratados con radioterapia externa por su CP. Todos los pacientes fueron informados del procedimiento y firmaron un consentimiento informado escrito. No se solicitó autorización al comité de ética de nuestro hospital por tratarse de un estudio de carácter retrospectivo que no supuso un cambio en el manejo del paciente.
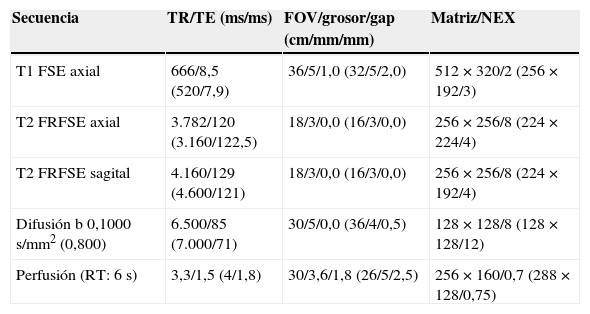
TécnicaRMmp. Los estudios se realizaron en una resonancia de 1,5T (Signa, GE, Milwaukee, WI, EE. UU.) en 28 pacientes y de 3T (Signa, GE, Milwaukee, WI, EE. UU.) en 25. En todos se utilizó una antena de superficie de 8 canales sin sonda endorrectal. Los parámetros de las secuencias se describen en la tabla 1. En el informe de la RMmp se describió la lesión diana como la de mayor tamaño y agresividad siguiendo los criterios PIRADS13 (fig. 1).
Parámetros técnicos de las secuencias de la RM multiparamétrica*
| Secuencia | TR/TE (ms/ms) | FOV/grosor/gap (cm/mm/mm) | Matriz/NEX |
|---|---|---|---|
| T1 FSE axial | 666/8,5 (520/7,9) | 36/5/1,0 (32/5/2,0) | 512×320/2 (256×192/3) |
| T2 FRFSE axial | 3.782/120 (3.160/122,5) | 18/3/0,0 (16/3/0,0) | 256×256/8 (224×224/4) |
| T2 FRFSE sagital | 4.160/129 (4.600/121) | 18/3/0,0 (16/3/0,0) | 256×256/8 (224×192/4) |
| Difusión b 0,1000s/mm2 (0,800) | 6.500/85 (7.000/71) | 30/5/0,0 (36/4/0,5) | 128×128/8 (128×128/12) |
| Perfusión (RT: 6s) | 3,3/1,5 (4/1,8) | 30/3,6/1,8 (26/5/2,5) | 256×160/0,7 (288×128/0,75) |
FOV: campo de visión; FRFSE: fast relaxation fast spin echo; FSE: fast spin echo; NEX: número de excitaciones; RT: resolución temporal; TE: tiempo de Eco; TR: tiempo de repetición.
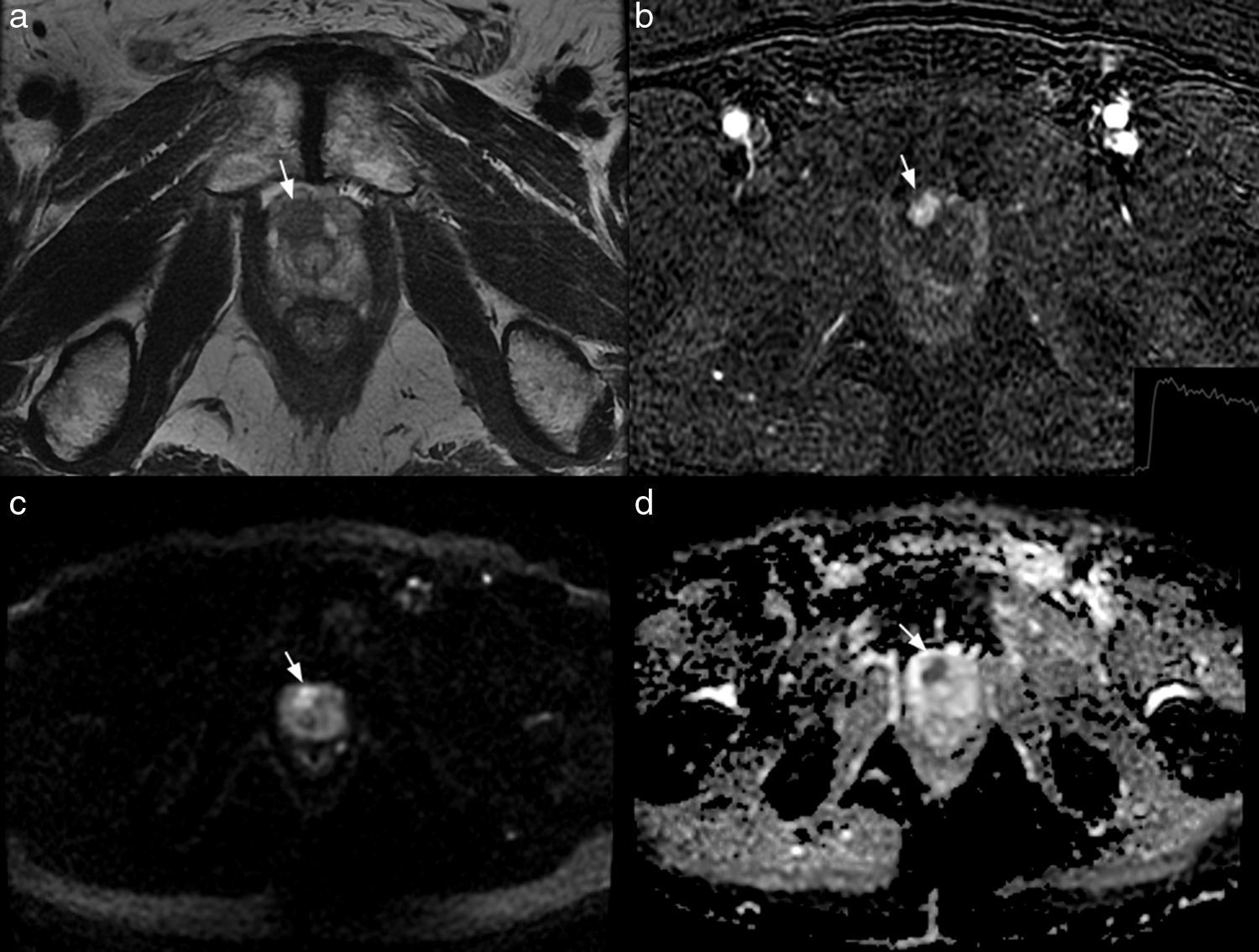
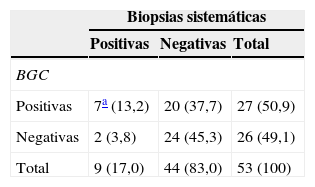
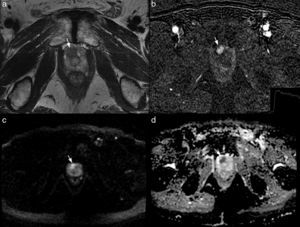
RM multiparamétrica 3T en un paciente de 70 años con PSA de 6,3ng/ml y una biopsia transrectal ecoguiada previa negativa. La imagen axial potenciada en T2 muestra una lesión focal hipointensa (flecha en a) localizada en el segmento apical anterior derecho, PIRADS 4. La lesión realza precozmente en la imagen de sustracción (flecha en b) y muestra un lavado tardío (gráfico en b), PIRADS 5. La lesión es hiperintensa en la secuencia de difusión, valor b-1.000 (flecha en c) y tiene un coeficiente de difusión bajo (flecha en d), PIRADS 5.
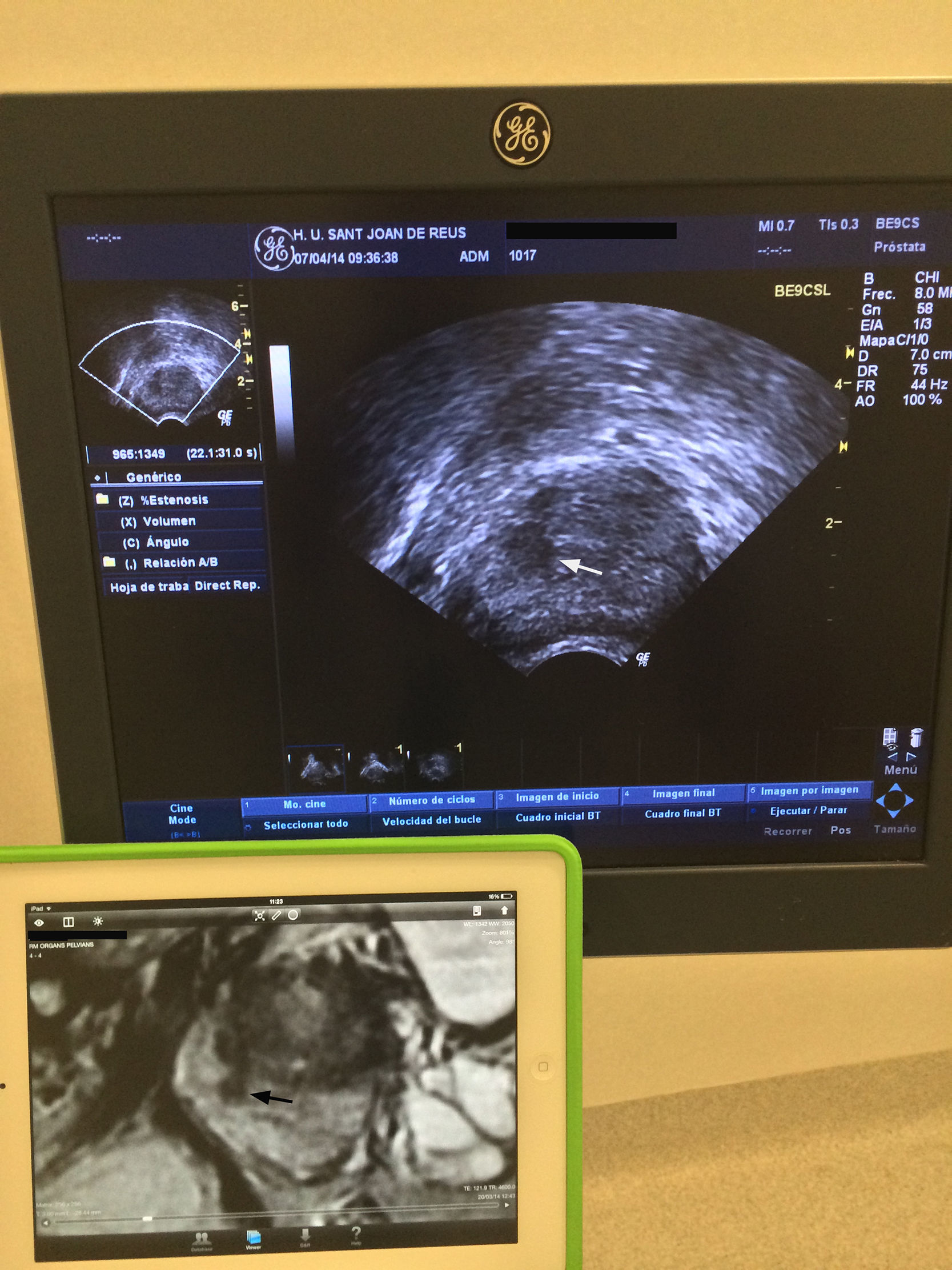
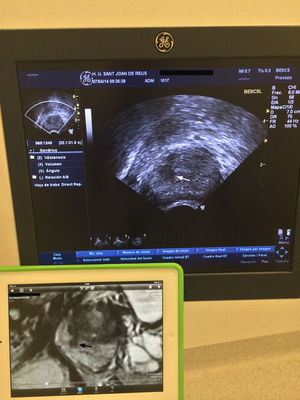
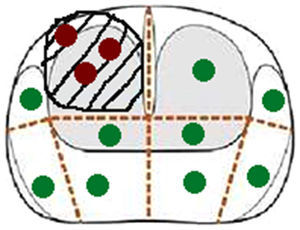
Biopsia transperineal. Los pacientes recibieron tratamiento profiláctico antibiótico (ceftriaxona 1g i. v. antes de la biopsia, y ciprofloxacino 500mg oral/12 horas los 5 días siguientes). Las biopsias se realizaron con el paciente en posición de litotomía y se utilizó una sonda transrectal biplana (BE9CS, GE Healthcare, Milwaukee, WI, EE. UU.) para obtener imágenes sagitales de la próstata. Estas imágenes se correlacionaron con las sagitales potenciadas en T2 de la RMmp, disponibles en una pantalla adyacente (fig. 2). Después de aplicar yodo en la piel del periné se bloqueó la próstata con 10ml de mepivacaína 1% para cada lóbulo, utilizando una aguja Chiba de 22Gx15cm. Desde 2 puntos marcados en la piel se obtuvieron una media de 6 cilindros por cada lóbulo, utilizando una aguja de 18Gx20cm y una pistola de biopsia automática (Bard, Magnum Biopsy instrument, AZ, EE. UU.). Los primeros 3 cilindros se obtuvieron de la lesión diana y correspondieron a las BGC. El resto de los cilindros se obtuvieron de los demás segmentos de la próstata (biopsias sistemáticas) (fig. 3). En total fueron 12 cilindros que se separaron en 4 botes, uno con la BGC.
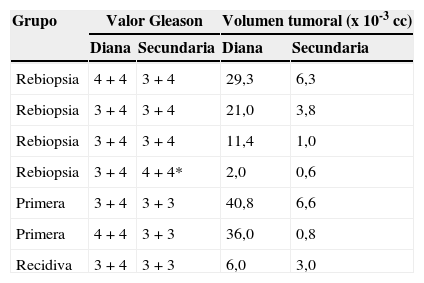
Relación en el momento de realizar la biopsia guiada cognitivamente, entre la imagen de la ecografía transrectal con visión longitudinal y la imagen sagital potenciada en T2 de la RM multiparamétrica, en una pantalla accesoria. Lesión focal hipointensa en la glándula periférica intermedia derecha (flecha negra) que se ve hipoecoica en la ecografía (flechas blancas).
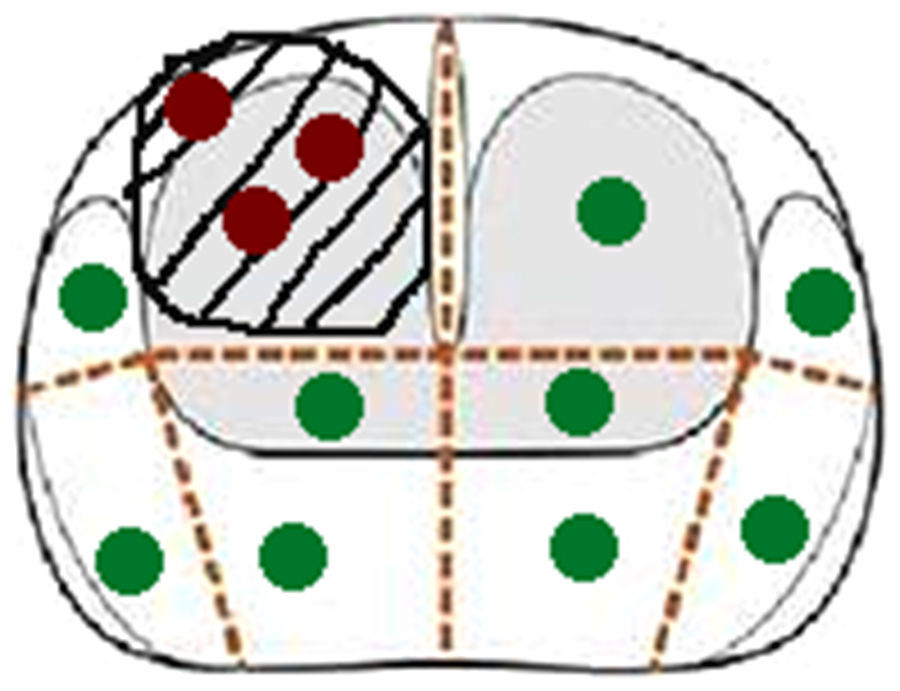
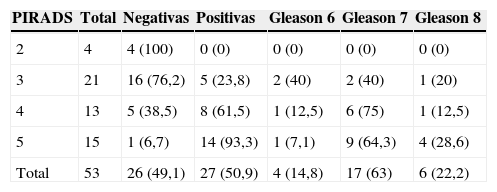
Esquema de planificación de la biopsia transperineal del mismo paciente de la figura 1. Los puntos rojos corresponden a los cilindros de la biopsia guiada cognitivamente, y los verdes a los cilindros de la biopsia sistemática.
El anatomopatólogo analizó las muestras sin conocer el resultado de la RMmp y qué bote contenía las BGC. Se definió como tumor multifocal aquel en que tanto las BGC como las sistemáticas fueron positivas, excluyendo las sistemáticas positivas por extensión de la lesión diana a segmentos adyacentes. Se definió como lesión dominante la de mayor valor Gleason y volumen tumoral en las lesiones multifocales, y a la única lesión de las unifocales. El volumen tumoral se calculó sumando el volumen de los cilindros positivos multiplicado por su porcentaje de afectación.
En el momento de la biopsia se registraron las complicaciones inmediatas como el sangrado por los puntos de punción del periné y la uretrorragia. Se mantuvo al paciente en observación 5 horas durante las que se evaluó la temperatura corporal y la tensión arterial. Seguimos a los pacientes durante los 3 meses posteriores, con el sistema de información hospitalaria de nuestro hospital, para detectar posibles complicaciones tardías (visitas a urgencias o ingresos hospitalarios).
ResultadosLa edad media de los pacientes fue de 65 (48-71) años y el del PSA de 12,6 (2,3-90)ng/ml. El número medio de biopsias previas en el grupo de pacientes con biopsias negativas fue de 21–5. Dos pacientes cuyas lesiones diana se situaban junto a la uretra prostática sufrieron una uretrorragia pospunción autolimitada. Ningún paciente presentó fiebre, hipotensión ni requirió transfusiones o ingreso después de controlarlo durante 5 horas. En los 3 meses siguientes solo un paciente acudió a urgencias, un mes después de la biopsia, por dolor perineal, sin signos inflamatorios en la exploración ni en el análisis, que cedió con analgesia.
El resultado de las BGC y de sus biopsias sistemáticas se resume en la tabla 2. De los 53 pacientes biopsiados, 29 tenían un CP. En 20, las BGC fueron positivas y las biopsias sistemáticas negativas; en 7, las BGC y las sistemáticas fueron positivas (tumores multifocales); y en 2, las BGC fueron negativas y las sistemáticas positivas (un paciente con sospecha de recidiva y otro sin biopsias previas). Los resultados del valor Gleason y del volumen tumoral de la lesión diana y los focos secundarios en los 7 tumores multifocales se resumen en la tabla 3. En 6 de las 7 lesiones el Gleason de la lesión diana fue mayor o igual al de los focos secundarios, y en una lesión fue menor (un paciente con biopsias previas negativas).
Tabla de contingencia del resultado de las BGC y las respectivas biopsias sistemáticas
| Biopsias sistemáticas | |||
|---|---|---|---|
| Positivas | Negativas | Total | |
| BGC | |||
| Positivas | 7a (13,2) | 20 (37,7) | 27 (50,9) |
| Negativas | 2 (3,8) | 24 (45,3) | 26 (49,1) |
| Total | 9 (17,0) | 44 (83,0) | 53 (100) |
Entre paréntesis se muestran los porcentajes.
Comparación de los valores Gleason y los volúmenes tumorales entre la lesión diana y los focos secundarios
| Grupo | Valor Gleason | Volumen tumoral (x10-3cc) | ||
|---|---|---|---|---|
| Diana | Secundaria | Diana | Secundaria | |
| Rebiopsia | 4+4 | 3+4 | 29,3 | 6,3 |
| Rebiopsia | 3+4 | 3+4 | 21,0 | 3,8 |
| Rebiopsia | 3+4 | 3+4 | 11,4 | 1,0 |
| Rebiopsia | 3+4 | 4+4* | 2,0 | 0,6 |
| Primera | 3+4 | 3+3 | 40,8 | 6,6 |
| Primera | 4+4 | 3+3 | 36,0 | 0,8 |
| Recidiva | 3+4 | 3+3 | 6,0 | 3,0 |
En un paciente (*) la lesión secundaria mostró un Gleason mayor al de la lesión diana.
Sumando el total de tumores detectados en las biopsias, en el 89,7% (26/29) el nódulo dominante fue diagnosticado con la BGC. De haber realizado únicamente la BGC en los 53 pacientes, no se hubieran diagnosticado 2 (3,8%, 2/53) y se hubiera infraestadificado solo uno (1,8%, 1/53). El porcentaje de positividad de la BGC fue del 50,9% (27/53) y en los subgrupos con biopsia previa, sin biopsia previa y con recidiva bioquímica del 46,3 (19/41), 66,7 (6/9) y 66,7% (2/3), respectivamente. El porcentaje de lesiones diana en los segmentos anteriores y posteriores fue del 64 (34/19) y 36% (19/53), respectivamente. La relación entre el PIRADS de las lesiones diana y el resultado de su BGC se resume en la tabla 4. El porcentaje de lesiones positivas en las lesiones PIRADS 2, 3, 4 y 5 fue del 0, 23,8, 61,5 y 93,3%, respectivamente. El porcentaje de lesiones Gleason >6 en las lesiones PIRADS 3, 4 y 5 fue del 60, 87,5 y del 92,9%, respectivamente.
Relación entre el valor PIRADS de las lesiones diana y el resultado de las BGC
| PIRADS | Total | Negativas | Positivas | Gleason 6 | Gleason 7 | Gleason 8 |
|---|---|---|---|---|---|---|
| 2 | 4 | 4 (100) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| 3 | 21 | 16 (76,2) | 5 (23,8) | 2 (40) | 2 (40) | 1 (20) |
| 4 | 13 | 5 (38,5) | 8 (61,5) | 1 (12,5) | 6 (75) | 1 (12,5) |
| 5 | 15 | 1 (6,7) | 14 (93,3) | 1 (7,1) | 9 (64,3) | 4 (28,6) |
| Total | 53 | 26 (49,1) | 27 (50,9) | 4 (14,8) | 17 (63) | 6 (22,2) |
En paréntesis se muestra el porcentaje de lesiones positivas y negativas, y el porcentaje de lesiones Gleason 6, 7 y 8, para cada valor PIRADS.
En este estudio, el nódulo dominante fue diagnosticado por las BGC en prácticamente el 90% de los casos, sin complicaciones inmediatas o tardías significativas, y las tasas de detección del nódulo dominante y de positividad de las BGC fueron altas.
Nuestros resultados son similares y corroboran los ya publicados. En un estudio en el que se incluyeron 95 pacientes con y sin biopsias previas, las biopsias guiadas diagnosticaron la lesión más agresiva en 63 (88%) de los 72 tumores diagnosticados12. De haber realizado únicamente las biopsias guiadas no se hubieran diagnosticado 6 (6,3%) de los 95 pacientes estudiados y en 3 se hubiera infradiagnosticado el CP (3,2%). En nuestro estudio, las BGC no diagnosticaron 2 pacientes (3,8%, 2/53) e infraestadificaron solo uno (1,8%, 1/53). En otro estudio que comparó el resultado de las BGC con las biopsias sistemáticas en 555 pacientes sin biopsias previas, la BGC no detectó 13 tumores clínicamente significativos (2,3%) y el porcentaje de positividad fue del 43%14.
Las complicaciones de las biopsias transperineales han sido descritas previamente15. Las biopsias guiadas requieren manipular más la aguja de biopsia al ajustar su trayecto a la lesión diana. Algunas de las lesiones se sitúan adyacentes a la uretra prostática con el riesgo de producir uretrorragia, que se produce en el 1,5-3% de las biopsias transperineales no guiadas y aumenta con el número de disparos realizados15. En nuestro estudio, 2 pacientes presentaron uretrorragia (3,8%) y ambos tenían una lesión periuretral. En un 6-14% de las biopsias transperineales no dirigidas, el paciente visita urgencias en los 20 días posteriores15. Solo uno de nuestros pacientes (1,9%) lo hizo, un mes después, por dolor perineal. Ningún paciente requirió transfusiones ni ingreso después del periodo de observación de 5 horas.
Las biopsias guiadas por RMmp permiten diagnosticar lesiones que no son accesibles por biopsias convencionales y su uso está aumentando10. Una de las dudas que surge al realizar biopsias guiadas es si es necesario obtener muestras del resto de los segmentos de la próstata. El beneficio de no hacerlas supondría menos complicaciones15 y evitaría detectar cánceres indolentes14,16. Nuestros resultados muestran que en la mayoría de los tumores detectados, las BGC se dirigieron a la lesión más agresiva, que va a marcar el pronóstico del CP, sin dejar de diagnosticar tumores en el grupo de pacientes con biopsias previas, y solo infraestadificando uno.
Nuestro estudio tiene varias limitaciones. Es un estudio descriptivo retrospectivo y el número de pacientes es reducido en el grupo sin biopsia previa y en el de sospecha de recidiva. Por otro lado, no pudimos comparar los valores Gleason de las biopsias con los de la prostatectomía ya que la mayoría de nuestros pacientes fueron tratados con radioterapia externa. Otra limitación es el bajo porcentaje de tumores multifocales, solo un 13,2% (7/53). La mayoría de nuestros pacientes tenían BTE previas negativas y, por tanto, hay un sesgo de selección hacia tumores unifocales en segmentos anteriores, lo que ha podido mejorar el rendimiento de las BGC. Por lo tanto, será interesante poder repetir este estudio valorando solo pacientes sin biopsias previas, con una muestra más homogénea de lesiones posteriores y anteriores, y un mayor número de tumores multifocales.
En conclusión, la BGC por los hallazgos de la RMmp es una técnica segura y capaz de obtener una muestra de la lesión dominante del CP, sobre todo en pacientes con biopsias previas negativas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes
Autorías- 1.
Responsable de la integridad del estudio JGB, ACO, DP, JAAC.
- 2.
Concepción del estudio JGB, ACO, ER, DP.
- 3.
Disen¿o del estudio JGB, ACO, ER, JAAC.
- 4.
Obtención de los datos CHS, ESA, ACO.
- 5.
Análisis e interpretación de los datos JGB, ACO, DP, ER, JAAC.
- 6.
Tratamiento estadístico: no hay.
- 7.
Búsqueda bibliográfica JGB, CHS, ESA.
- 8.
Redacción del trabajo JGB, ACO, CHS, ESA, JAAC.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes JGB, ACO, ER, DP, JAAC.
- 10.
Aprobación de la versión final JGB, ACO, CHS, ESA, ER, DP, JAAC.
Los autores declaran no tener ningún conflicto de intereses.