Evaluar la frecuencia de tromboembolismo pulmonar agudo (TEPA), el uso de escalas de probabilidad clínica (EPC) y la adecuación del manejo de los pacientes a los que se solicitó angiografía pulmonar por tomografía computarizada (angio-TC) por sospecha de TEPA desde el servicio de urgencias.
Materiales y métodosEstudio observacional retrospectivo de las angio-TC solicitadas desde el servicio de urgencias para descartar TEPA. Se analizaron variables clínicas y el uso explícito de EPC. Se determinó la adecuación del manejo en función de las escalas de Wells (EW) y Ginebra (EG) y sus versiones simplificadas (EWs y EGs), calculadas retrospectivamente.
ResultadosSe incluyeron 534 pacientes (52,8% mujeres, mediana de edad: 73 años). La frecuencia de TEPA fue del 23,0% y el uso explícito de la EW, del 15,2%. La adecuación del manejo fue variable dependiendo de la EPC (54,5-75,8%) y del dímero D estándar o ajustado por edad.
ConclusionesLa baja utilización explícita de la EW no conlleva un manejo inadecuado, y el juicio clínico global puede ofrecer un rendimiento similar a las EPC, pero es necesario realizar estudios específicos para comprobar esta hipótesis.
To evaluate the frequency of acute pulmonary embolism, the use of clinical probability scores, and the appropriateness of the management of patients for whom computed tomography angiography (CTA) was requested from the emergency department for suspected acute pulmonary embolism.
Materials and methodsThis was a retrospective observational study of CTA studies requested from the emergency department to rule out acute pulmonary embolism. We analyzed clinical variables and the explicit use of clinical probability scores. We determined the appropriateness of management according to the Wells Score and Geneva Score and the simplified versions of these two scores, calculated retrospectively.
ResultsWe included 534 patients (52.8% women; mean age, 73 years). The frequency of acute pulmonary embolism was 23.0% and the Wells Score was explicitly used in 15.2%. The appropriateness of the management varied depending on the clinical probability score used to assess it (54.5%-75.8%) and on whether the standard D-dimer or age-adjusted D-dimer was used.
ConclusionsThe failure to use the Wells Scores in all cases does not necessarily imply inappropriate management, and the performance of global clinical judgment can be similar to that of clinical probability scores; however, specific studies are necessary to confirm this hypothesis.
El tromboembolismo pulmonar agudo (TEPA) es una de las urgencias cardiovasculares más frecuentes y asocia una importante morbimortalidad, solo superada por la isquemia miocárdica y el ictus1. No se han demostrado diferencias significativas entre sexos y su prevalencia aumenta exponencialmente con la edad2–4. El espectro de manifestaciones clínicas es muy variado y las pruebas complementarias de rutina (analítica sanguínea, radiografía de tórax, electrocardiograma), realizadas en el servicio de urgencias, presentan una baja especificidad, por lo que son necesarias técnicas especializadas para su detección2,3. La prueba de elección para el diagnóstico de TEPA es la angiografía pulmonar por tomografía computarizada (angio-TC)5,6, que además posibilita otros diagnósticos alternativos7. Sin embargo, conlleva costes económicos significativos, así como riesgos derivados de la radiación y del uso de contraste yodado intravenoso, por lo que su utilización debe regirse por una adecuada relación riesgo-beneficio8,9.
Pese a los indudables avances en el diagnóstico del TEPA que se han producido en las últimas décadas, el pronóstico de los pacientes no ha mejorado de forma paralela6,10,11. Las escalas de probabilidad clínica (EPC), como la Escala de Wells (EW) y la Escala de Ginebra (EG) revisada (tabla 1), han sido validadas para identificar a pacientes con riesgo de TEPA, lo que ha servido de ayuda en la toma de decisiones clínicas6,12,13. Las versiones simplificadas de estas EPC (EWs y EGs, respectivamente) presentan un rendimiento similar9,14 y son recomendadas por las guías de práctica clínica (GPC) en combinación con la determinación del dímero D (DD) para indicar la realización de angio-TC4,6.
Ítems de las escalas de probabilidad clínica reconstruidas
| Ítems | Puntuación en la escala | |
|---|---|---|
| Versión original | Versión simplificada | |
| Escala de Wells | ||
| TVP o TEPA previo | 1,5 | 1 |
| FC> 100 lpm | 1,5 | 1 |
| Cirugía o inmovilización en el último mes | 1,5 | 1 |
| Hemoptisis | 1 | 1 |
| Cáncer activo | 1 | 1 |
| Signos clínicos de TVP | 3 | 1 |
| Diagnóstico alternativo menos probable que TEPA | 3 | 1 |
| Probabilidad clínica de TEPA | ||
| TEPA no probable | ≤4 | ≤1 |
| TEPA probable | >4 | >1 |
| Escala de Ginebra | ||
| TVP o TEPA previo | 3 | 1 |
| FC: | ||
| 75-94 lpm | 3 | 1 |
| ≥95 lpm | 5 | 2 |
| Cirugía o fractura en el último mes | 2 | 1 |
| Hemoptisis | 2 | 1 |
| Cáncer activo | 2 | 1 |
| Dolor unilateral en miembro inferior | 3 | 1 |
| Dolor a la palpación en venas profundas de miembros inferiores y edema unilateral | 4 | 1 |
| Edad> 65 años | 1 | 1 |
| Probabilidad clínica de TEPA | ||
| TEPA no probable | ≤5 | ≤2 |
| TEPA probable | >5 | >2 |
FC: frecuencia cardíaca; TEPA: tromboembolismo pulmonar agudo; TVP: trombosis venosa profunda.
Sin embargo, varios estudios han encontrado una baja aplicación de las EPC en el manejo de esta entidad4,8,15, lo que podría implicar que no se siguen adecuadamente las GPC8,9,12. Además, en un estudio reciente4 se ha descrito una adherencia variable en función de la edad de los pacientes, si bien los motivos por los que esto puede ocurrir no han sido identificados. La falta de aplicación de las EPC puede tener consecuencias negativas, como el incremento de pruebas innecesarias y costes derivados, la demora en la atención al paciente y la morbimortalidad12.
Pese al conocimiento e interés por el TEPA, existen discrepancias entre estudios en cuanto a variables sociodemográficas, uso de EPC, adherencia a GPC y rendimiento de angio-TC, particularmente entre series europeas y norteamericanas16. En nuestro país, la adherencia a las GPC y sus implicaciones en el proceso diagnóstico de TEPA han sido poco estudiadas, aunque existen algunos trabajos recientes al respecto en nuestro entorno17. El objetivo principal de este estudio es evaluar la frecuencia de TEPA, el uso de EPC y la adecuación del manejo de los pacientes a los que se realiza angio-TC por sospecha de TEPA desde el servicio de urgencias.
Material y métodosDiseño del estudio y obtención de la serie de pacientesSe ha realizado un estudio observacional retrospectivo (serie de casos) mediante el análisis de las angio-TC solicitadas desde el servicio de urgencias de nuestro hospital por sospecha de TEPA entre el 1 de enero y el 31 de diciembre de 2018. El estudio fue aprobado por nuestro comité ético de investigación provincial.
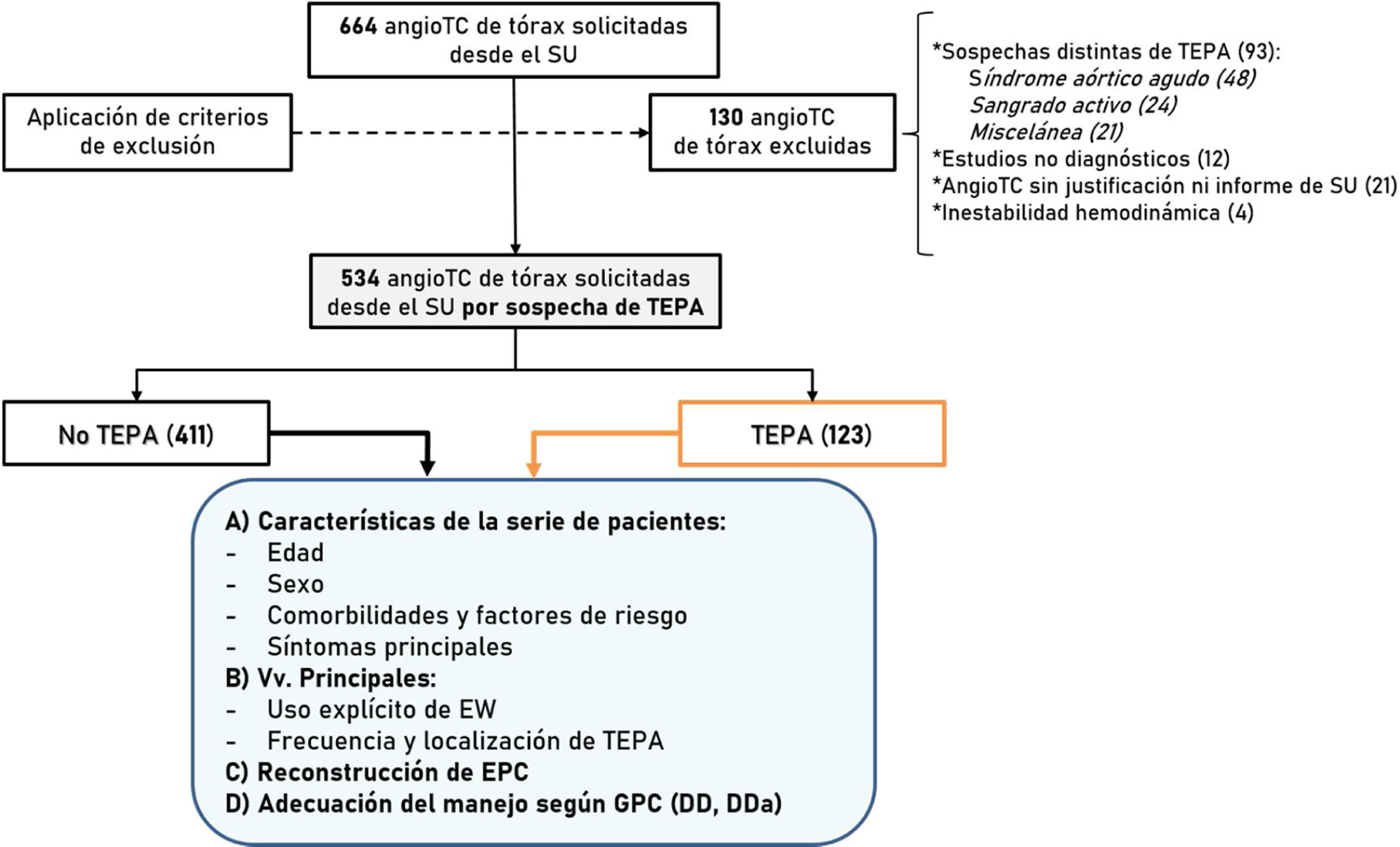
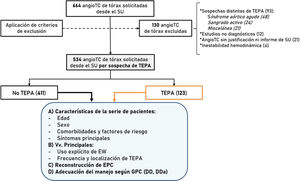
Los casos se seleccionaron del registro de angio-TC de tórax existentes en el PACS de nuestro centro. A partir de las angio-TC de tórax solicitadas desde el servicio de urgencias se incluyeron aquellas realizadas por sospecha de TEPA. Los criterios de exclusión fueron: edad inferior a 18 años, inestabilidad hemodinámica, calidad subóptima de la exploración (no diagnóstica), sospecha distinta de TEPA, ausencia de justificación en la petición electrónica y no disponibilidad del informe del episodio de urgencias. En la figura 1 se muestra el diagrama de flujo seguido para la obtención de los casos.
Variables analizadasVariables principales: frecuencia de angio-TC positivas para TEPA según el informe radiológico (“hallazgos compatibles con tromboembolismo pulmonar agudo” o equivalente); constancia de la EPC utilizada por protocolo en nuestro centro (EW) en la petición electrónica de angio-TC o en el informe de urgencias.
Características de la serie de pacientes: edad y sexo, enfermedades y factores de riesgo asociados (neoplasia activa en los últimos 6 meses, enfermedad pulmonar obstructiva crónica (EPOC), diabetes mellitus, hipertensión, obesidad, tabaquismo activo, toma de anticoagulantes orales, toma de anticonceptivos orales, inmovilización prolongada), síntomas principales (disnea, tos, síncope, dolor torácico, hemoptisis, signos de trombosis venosa profunda [TVP]).
Dímero D estándar y ajustado por edadEl valor del DD en nuestro hospital se obtiene mediante el método ELISA (patrón de referencia)5 y presenta un punto de corte estándar de 500 ng/ml para considerarse positivo. Se analizaron los parámetros de validez intrínseca y extrínseca del DD estándar y ajustado por edad (DDa). Respecto a este último, se estableció el punto de corte en los mayores de 50 años según la fórmula validada por Righini et al.18: edad (años)×10 ng/ml.
Reconstrucción de las escalas de probabilidad clínica y adecuación del manejo según las guías de práctica clínicaA partir de los datos del informe de urgencias y/o la petición electrónica de angio-TC, dos autores (AJLRB y RGL) recogieron los ítems de las distintas EPC para reconstruir dichas escalas en su versión completa (EW, EG) y simplificada (EWs y EGs, respectivamente) de manera independiente y retrospectiva (tabla 1). En caso de desacuerdo, este se resolvió mediante puesta en común. Con esta información, se estratificó a los pacientes de manera dicotómica (“TEPA probable” vs. “no probable”)14. El ítem de la EW “presencia de un diagnóstico clínico menos probable que TEPA” se puntuó de manera positiva si la primera orientación diagnóstica mencionada en la historia clínica fue TEPA4.
Por otra parte, la adecuación del manejo se evaluó mediante GPC y algoritmos internacionalmente aceptados basados en la estratificación de riesgo según una EPC validada y el valor del DD para justificar la realización de la angio-TC5,6,19. Así, en el grupo “TEPA probable”, la adherencia se consideró adecuada si se realizó la angio-TC sin haber pedido previamente el DD, y en el grupo “TEPA no probable”, la adherencia a las GPC fue adecuada ante un valor de DD positivo. Además, se evaluó la diferencia en la adecuación del manejo en función del uso de DD estándar y DDa.
Como medida indirecta del sesgo derivado de reconstruir retrospectivamente las EPC, se determinó la discordancia en el porcentaje de pacientes clasificados como “TEPA probable” y “TEPA no probable” según la EW explícita y según la EW retrospectiva.
Análisis estadísticoLos casos se registraron en una base de datos de manera anonimizada. Las variables cualitativas se expresaron como frecuencias absolutas y relativas, y las cuantitativas continuas, como media y desviación estándar (DE). Se realizaron análisis uni- y bivariantes de las variables estudiadas en función de la presencia o no de TEPA. Se aplicaron las pruebas estadísticas t de Student para comparación de medias y χ2 para variables cualitativas, previa verificación de las condiciones de aplicación. En caso de no cumplirse dichas condiciones, se aplicaron las pruebas no paramétricas correspondientes. Para ello se utilizó el paquete estadístico IBM SPSS Statistics versión 22.0. Se consideraron significativos valores de p < 0,05.
ResultadosDescripción de la serieTras descartar los casos que cumplían algún criterio de exclusión (fig. 1), se incluyeron un total de 534 pacientes a los que se realizó angio-TC por sospecha de TEPA desde el servicio de urgencias (52,8% mujeres). La mediana de edad fue de 73 años (rango 18-101).
Las patologías más frecuentemente asociadas fueron la hipertensión arterial (54,4%), la diabetes mellitus (29,6%) y la EPOC (16,6%). Se encontraron diferencias significativas en la distribución de los pacientes con EPOC (p < 0,05) y en la distribución de los pacientes en tratamiento anticoagulante (p=0,001), que fueron más frecuentes en el grupo sin TEPA en los dos casos. Por otro lado, los signos de TVP (p=0,001) fueron más frecuentes en los pacientes del grupo con TEPA. No se hallaron diferencias significativas entre los grupos TEPA vs. No TEPA para el resto de enfermedades, factores de riesgo y síntomas estudiados. El análisis detallado de estos datos queda reflejado en la tabla 2.
Características y sintomatología de los pacientes incluidos en el estudio
| Variable | N (%) | p (TEPA vs.no TEPA a) |
|---|---|---|
| Sexo | ||
| Hombres | 252 (47,2) | - |
| Mujeres | 282 (52,8) | - |
| Edad x(s) | 69,6 (17,1) | - |
| Enfermedades y FR asociados | ||
| HTA | 292 (54,4) | 0,196 |
| DM | 159 (29,6) | 0,109 |
| EPOC | 89 (16,6) | 0,023 b |
| Fumador | 72 (13,4) | 0,654 |
| Obesidad | 50 (9,3) | 0,380 |
| Neoplasia activa <6 meses | 74 (13,9) | 0,892 |
| Toma de anticoagulantes orales | 51 (9,6) | 0,001 b |
| Toma de anticonceptivos orales | 6 (1,1) | 0,053 c |
| Inmovilización prolongada | 80 (15,0) | 0,902 |
| Sintomatología en el SUH | ||
| Disnea | 367 (68,7) | 0,430 |
| Tos | 137 (25,7) | 0,712 |
| Síncope | 110 (20,6) | 0,337 |
| Dolor torácico | 195 (36,5) | 0,233 |
| Signos TVP | 57 (10,7) | 0,001 d |
| Hemoptisis | 13 (2,4) | 0,319 |
La frecuencia de angio-TC positivas para TEPA según el informe radiológico fue de 123 pacientes (23,0%), de los cuales 68 fueron centrales y 55 periféricos. La EW constó en la historia de forma explícita en 81 pacientes (15,2%).
Reconstrucción de las escalas de probabilidad clínica y adecuación del manejo según las guías de práctica clínicaLa frecuencia total de casos en que se siguieron adecuadamente las GPC (se solicitaron DD y angio-TC justificadas) de acuerdo con la estratificación de cada EPC fue superior para la EW (75,8%) seguida de la EWs (68,4%), la EGs (55,4%) y la EG (54,5%).
Según la EW, 69 pacientes fueron estratificados como “TEPA probable” (12,9%), frecuencia que, de acuerdo con la EWs, ascendió a 141 casos (26,4%). La discrepancia entre las categorías de estratificación de la EW explícita (en los pacientes en los que esta constaba) vs. las de la EW retrospectiva fue de 8 casos (9,8%). Por otro lado, la EG mostró un total de 243 casos (45,5%) de “TEPA probable”, cifra que apenas descendió a 232 (43,4%) en la EGs. Al comparar los grupos “TEPA probable” y “TEPA no probable” en función de si la angio-TC fue positiva para TEPA o no, se encontraron diferencias significativas para todas las EPC empleadas.
Respecto al DD, de las 471 peticiones realizadas, 409 estaban justificadas según la EW por tratarse de “TEPA no probable” y 62 DD se solicitaron en pacientes clasificados como “TEPA probable”. De las peticiones justificadas según la EW, 398 fueron positivas y 11, negativas según el valor estándar (>500 ng/ml).
La proporción de angio-TC no justificadas (según GPC) fue del 2,3-3,0% empleando el DD estándar y del 6,5-7,0% utilizando el DDa; y la proporción de angio-TC injustificadas fue mayor cuando se empleó la EGs y menor con la EWs. De haber ajustado el DD por edad se podrían haber evitado 10 y 14 angio-TC injustificadas, respectivamente. El análisis detallado de estos datos queda reflejado en las tablas 3 y 4.
Estratificación del riesgo, frecuencia de TEPA y DD solicitados en función de las escalas de probabilidad clínica retrospectivas
| EPC retrospectiva | N (%) a | TEPA | Valor de p | Solicitud DD |
|---|---|---|---|---|
| N (%)b | (TEPA vs. No TEPA) | N (%) b | ||
| Escala de Wells | ||||
| TEPA no probable | 465 (87,1) | 98 (21,1) | p=0,009 | 409 (88,0) |
| TEPA probable | 69 (12,9) | 25 (36,2) | 62 (90,0) | |
| Escala de Wells simplificada | ||||
| TEPA no probable | 393 (73,6) | 73 (18,6) | p <0,001 | 352 (89,6) |
| TEPA probable | 141 (26,4) | 50 (35,5) | 119 (84,4) | |
| Escala de Ginebra | ||||
| TEPA no probable | 291 (54,5) | 45 (15,5) | p <0,001 | 263 (90,4) |
| TEPA probable | 243 (45,5) | 78 (32,1) | 208 (85,6) | |
| Escala de Ginebra simplificada | ||||
| TEPA no probable | 302 (56,6) | 51 (16,9) | p <0,001 | 272 (90,0) |
| TEPA probable | 232 (43,4) | 72 (31,0) | 199 (85,8) | |
Los puntos de corte para “TEPA no probable” fueron los mismos que los utilizados por Douma et al.16: EW: <5; EWs: <2; EG: <6; EGs: <3; “TEPA probable” en caso contrario.
Adecuación del manejo en función de las escalas de probabilidad clínica retrospectivas
| EPC retrospectiva | Angio-TC no justificadas empleando DD a | Angio-TC no justificadas empleando DDa a | Diferencia DD y DDa b | Manejo adecuado según GPC c N (%) |
|---|---|---|---|---|
| Escala de wells | 11 (2,4) | 27 (6,6) | 16 (4,2) | 405 (75,8) |
| Escala de Wells simplificada | 9 (2,3) | 23 (6,5) | 14 (4,2) | 365 (68,4) |
| Escala de Ginebra | 7 (2,4) | 18 (6,8) | 11 (4,4) | 291 (54,5) |
| Escala de Ginebra simplificada | 9 (3,0) | 19 (7,0) | 10 (4,0) | 296 (55,4) |
En nuestro estudio se encontró una frecuencia de angio-TC con hallazgos compatibles con TEPA del 23%. La EW constó de forma explícita en 81 pacientes (15,2%). El grado de adecuación a las GPC varió en función de la EPC utilizada, y fue superior para la EW (75,8%). Además, se encontró que el ajuste por edad del DD habría evitado entre un 4 y 4,4% de angio-TC innecesarias. La frecuencia de TEPA en nuestro estudio (23%) coincide con la de Douma et al.14 y es similar a la de otros trabajos del entorno europeo como los de Lozano-Polo et al. (próxima al 25%)4, García-Gómez et al. (20,8%)17, Sanjuán et al. (18,23%)8 y Righini et al.18 (19%), y ligeramente mayor que la encontrada por Lekerika et al. (15,1%)21. Sin embargo, en series norteamericanas, la frecuencia de angio-TC positivas para TEPA es menor (cercana al 10%)16,20,23, lo que se ha atribuido a diversas causas, como una sobreutilización de angio-TC (medicina defensiva)12,24, la prisa en los relevos de guardia o la demanda de los propios pacientes20,25.
La frecuencia de TEPA en función de la estratificación de riesgo (grupo “TEPA no probable”: 15,5-21,1%; grupo “TEPA probable”: 31,0-36,2%) es similar a la del entorno europeo (“TEPA no probable”: 11,5%; “TEPA probable”: 36,7%), y significativamente mayor en comparación con series de EE. UU. (6,5% y 32,9%, respectivamente)16. Además, la frecuencia de TEPA encontrada en nuestro estudio muestra una ligera variabilidad entre escalas, corroborada por otros autores. Por ejemplo, Van der Pol et al.26 encontraron una frecuencia del 15% y 42% (“TEPA no probable” y “probable”, respectivamente) para la EW, mientras que en la EWs estas cifras fueron del 12% y 37%, respectivamente. Análogamente, Gibson et al.27, encontraron una frecuencia del 13% y 39% en la EW, y del 11% y 36%, respectivamente, con la EWs. Estas ligeras divergencias concuerdan con nuestros resultados y redundan en la importancia de conocer las EPC más útiles en los distintos centros, puesto que los valores predictivos de la angio-TC varían según el riesgo7,28 y la actitud terapéutica se modifica, estando indicada la administración de heparina en pacientes con riesgo alto5,21. Por tanto, es recomendable realizar estudios prospectivos que puedan arrojar luz sobre la EPC más idónea en función de factores como la prevalencia y el manejo local.
En nuestra serie se ha constatado un bajo registro de la EW en la historia del paciente (15,2%), en consonancia con otros estudios8,29. Un 9,8% de los casos en que sí constó la EW en el informe fueron clasificados en una categoría distinta cuando se reconstruyó la EW con los datos de la historia clínica, lo que puede interpretarse como una medida indirecta del sesgo cometido por la reconstrucción retrospectiva. En este sentido, el sesgo estimado derivado de la reconstrucción retrospectiva de las EPC (<10% de los casos) es poco significativo dado el propósito del estudio. No obstante, nuestros resultados deberían confirmarse mediante la inclusión de todas las sospechas de TEPA y no solo la cohorte de pacientes a los que se realizó angio-TC.
La adecuación del manejo en los pacientes con sospecha de TEPA se evaluó mediante GPC, analizando la solicitud justificada de angio-TC en función del riesgo estimado según la EPC empleada y el valor del DD5,6,19. La adecuación del manejo en nuestra serie fue variable en función de la EPC utilizada (55,4-75,8%), y fue superior con la EW. Otros autores han encontrado una menor adherencia a las GPC. Por ejemplo, Lozano-Polo et al. reportaron una adherencia del 39,2% (según la EG) y del 53,2% (EW)4, Sanjuán et al. del 45,8% (EW)8 y Molaee et al. del 43,9% (EW)15. Por otra parte, el análisis de las peticiones de DD según la EW muestra que estas estuvieron justificadas en un elevado número de pacientes con TEPA no probable en nuestro estudio (88%), observándose una tendencia similar con las otras escalas (89,6-90,4%). La proporción de angio-TC no justificadas fue del 2,3-3,0% empleando el DD estándar y del 6,5-7,0% utilizando el DDa. De haber ajustado el DD por edad se podrían haber evitado entre 10 y 16 angio-TC injustificadas en nuestra serie. Varios autores han señalado la utilidad del DDa, particularmente a partir de 75 años30, y actualmente se recomienda emplearlo en el manejo del TEPA6,31. Se ha comprobado que el valor predictivo negativo aumenta entre un 12,7%4 y un 24,6%18 respecto al valor estándar del DD, lo que justifica que no se recomiende realizar pruebas de imagen con DDa negativo12. Además, se ha descrito un aumento del 7,6% en la adecuación del manejo cuando se combina el DDa con la EWs4, porcentaje que en nuestro estudio ha sido algo menor (2,8%). En este sentido, conviene volver a señalar que el incremento observado es respecto a las angio-TC realizadas y no al conjunto de sospechas, donde el rendimiento podría ser aún mayor.
La discrepancia entre el bajo uso explícito de la EW y el alto porcentaje de casos en que el manejo de la sospecha fue adecuado según la EW retrospectiva podría explicarse fundamentalmente por dos razones. Por un lado, los médicos del servicio de urgencias podrían utilizar la EW de manera implícita, es decir, sin dejar constancia de esta en la petición electrónica o en el informe de urgencias. Otra posibilidad es que la toma de decisiones se base en el juicio clínico global y coincida en gran medida con la que se habría producido aplicando la EW. Autores como Righini et al.31 reseñan que, aunque menos reproducible, la evaluación por clínicos expertos es tan fiable como las EPC. Por su parte, Lucassen et al.32 proponen utilizar las EPC de mayor sensibilidad (EWs y EG) y la valoración clínica en entornos con baja prevalencia de TEPA. Sea como fuere, ninguna EPC debe sustituir a una adecuada anamnesis, examen físico y síntesis de la información clínica33.
En nuestra serie, la distribución de las variables sociodemográficas y la comorbilidad de los pacientes es semejante a la de otros estudios4,8,17,20,21. La alta frecuencia de pacientes con EPOC en el grupo sin TEPA podría estar justificada por la existencia de síntomas comunes en la exacerbación de esta patología y el TEPA, así como por la elevación de los niveles de DD en ambas22. Por otra parte, el efecto protector del tratamiento anticoagulante podría explicar la distribución asimétrica de los pacientes anticoagulados hallada en nuestro estudio. Los síntomas más frecuentes de los pacientes con sospecha de TEPA coinciden también con los referidos por otros autores4,17,21, aunque encontramos una mayor frecuencia de pacientes con signos de TVP, especialmente en el grupo con TEPA, respecto a la descrita en estudios previos14,17,21.
Existen algunas limitaciones en nuestro estudio. El cálculo retrospectivo de la EW implica la posible introducción de sesgos16, entre los que destaca la exclusión de casos en los que no hay información suficiente sobre la justificación de la angio-TC, que en nuestro estudio ha supuesto un porcentaje significativo de pérdidas. Por otra parte, nuestros resultados no son directamente comparables con series en las que se han evaluado todas las sospechas de TEPA, pues solamente hemos incluido a los pacientes a los que se realizó angio-TC. Por último, el estudio es unicéntrico, por lo que estos datos deberían ser considerados junto a los descritos por otros autores en otras localizaciones geográficas y periodos en aras de una mayor representatividad.
ConclusionesNuestros resultados muestran que la adecuación del manejo de las sospechas de TEPA varió en función de la EPC empleada y el ajuste por edad del DD. Además, se encontró un bajo uso explícito de la EW en urgencias, lo que sin embargo no parece conllevar un manejo inadecuado de los pacientes con sospecha de TEPA. El juicio clínico global podría ofrecer un rendimiento similar al uso de EPC en nuestro medio. No obstante, nuestros resultados deben verificarse en series más amplias, idealmente prospectivas.
Autoría- 1.
Responsable de la integridad del estudio: AJLRB.
- 2.
Concepción del estudio: AJLRB y SMS.
- 3.
Diseño del estudio: AJLRB, SMS y MCPG.
- 4.
Obtención de los datos: AJLRB y RGL.
- 5.
Análisis e interpretación de los datos: AJLRB y MRI.
- 6.
Tratamiento estadístico: MRI.
- 7.
Búsqueda bibliográfica: MCPG, FGS y RGL.
- 8.
Redacción del trabajo: AJLRB y SMS.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: AJLRB, SMS, MCPG y FGS.
- 10.
Aprobación de la versión final: AJLRB, SMS, MCPG, FGS, RGL.
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.
Los autores deseamos agradecer a los doctores Antonio Medina Benítez y Luis Guzmán Álvarez, del Servicio de Radiodiagnóstico del Hospital Universitario Virgen de las Nieves, su valiosa guía, resolución de dudas y facilidades ofrecidas en relación con el diseño y orientación de este manuscrito.