Congreso Nacional SERAM Málaga 2022: Informe radiológico: ¿qué y cómo?
Más datosLa TC multimodal en el paciente con ictus isquémico agudo ha adquirido un papel fundamental para el manejo clínico y terapéutico. La inclusión de las pruebas de imagen realizadas por TC como criterios definitorios de tratamiento en los ensayos clínicos de los pacientes con ictus isquémico agudo hace necesario que el informe radiológico sea claro, preciso, homogéneo y rápido. La introducción de los softwares semiautomáticos de procesamiento de las imágenes hace que en ocasiones se tomen decisiones basadas en pruebas de imagen sin la adecuada supervisión técnica. La protocolización exhaustiva del informe radiológico es necesaria para cumplir estos criterios de calidad y utilidad. En este trabajo se expone un informe radiológico protocolizado del código ictus mediante el uso de TC multimodal.
Multimodal CT has taken on a fundamental role in the clinical and therapeutic management of patients with acute ischemic strokes. Because CT findings are included in the criteria for deciding on treatment options for patients with acute ischemic strokes in clinical trials, the radiology report must be clear, precise, homogeneous, and fast. The introduction of semi-automatic image-processing software has occasionally led to decision making based on imaging tests that lack the necessary quality and appropriate technical supervision to ensure optimal diagnosis. To fulfill the criteria of quality and usefulness, the radiology report must be thoroughly protocolized. This paper describes a protocolized radiology report for multimodal CT studies in patients with suspected ischemic strokes.
La tomografía computarizada (TC) multimodal en el paciente con ictus isquémico agudo ha adquirido un papel fundamental para el manejo clínico y terapéutico del paciente con ictus agudo. Está incluida de forma constante entre las pruebas diagnósticas que se realizan a estos pacientes de forma urgente, junto con el resto de las medidas asociadas al traslado, la preferencia y el tratamiento, que se conocen como «código ictus».
La inclusión de las pruebas de imagen realizadas por TC como criterios definitorios y definidos en los ensayos clínicos de los pacientes con ictus isquémico agudo hace que sea necesario que el informe radiológico sea claro, preciso, homogéneo y rápido. La estandarización del informe de la TC multimodal en el servicio de Radiología permite que el informe cumpla estos criterios de calidad.
Además, el uso de programas de interpretación de imágenes mediante inteligencia artificial puede llevar a la toma de decisiones basadas en pruebas diagnósticas poco precisas y de mala calidad técnica, por lo que incluir e interpretar los resultados de estas pruebas en el informe radiológico estándar permite una mayor calidad y eficacia en el diagnóstico y en la toma de decisiones terapéuticas.
Pruebas diagnósticas incluidas en la TC multimodalTC craneal sin contrasteSu principal función es descartar la presencia de hemorragias intracraneales y otras causas de seudoictus que justifiquen la clínica del paciente, como masas intra o extraxiales, lesiones causantes de epilepsia o infecciones cerebrales.
La segunda función de esta prueba de imagen es realizar una lectura correcta de la escala Alberta Stroke Program Early CT Score (ASPECTS) que actualmente es uno de los criterios fundamentales en las indicaciones para la realización de trombectomía mecánica en las primeras horas de la instauración de los síntomas1,2.
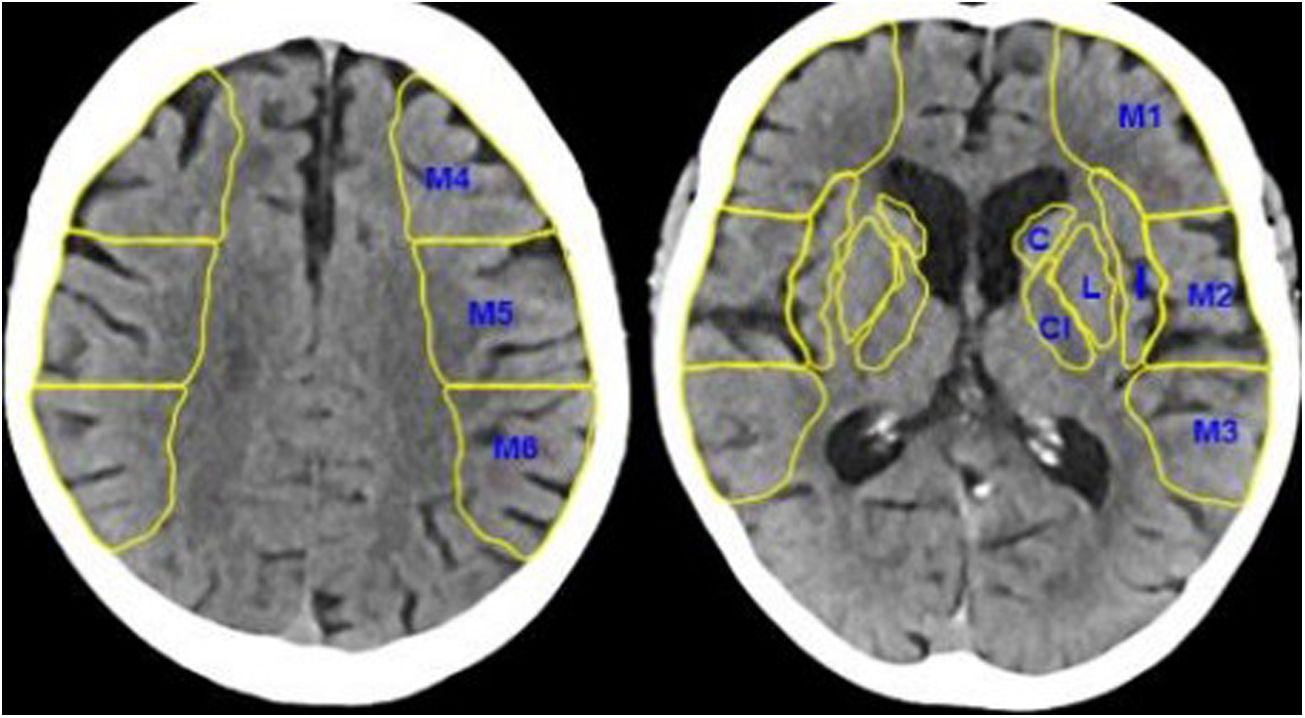
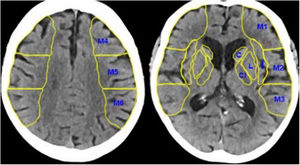
La escala ASPECTS analiza cuantitativamente, en una escala del 1 al 10, el grado de infarto establecido en el territorio de la arteria cerebral media. Se calcula evaluando la hipodensidad de 10 territorios irrigados por la arteria cerebral media, 4 de ellos profundos (cabeza de núcleo caudado, núcleo lenticular, ribete insular y cápsula interna) y 6 superficiales-corticales (M1 u opérculo frontal, M2 o corteza lateral al ribete insular, M3 o parietal posterior, correspondiendo a la región posterior del lóbulo temporal en un corte ganglionar, M4 o región superior a M1 en cortes supraganglionares, M5 o superior a M2 supraganglionar y M6 o superior a M3 en cortes supraganglionares) (fig. 1). Un valor de 10 en la escala ASPECTS significa que ningún territorio de los mencionados se encuentra afectado; un valor de 0, que todos están afectados así que, cuanto más bajo es el ASPECTS, más territorio irrigado por la arteria cerebral media está infartado, con un consecuente peor pronóstico.
TC craneal sin contraste. En esta figura se observan los 10 puntos del ASPECTS, los 4 territorios profundos, la cabeza del núcleo caudado (C), la cápsula interna (CI), la ínsula (I) y el núcleo lenticular (L), y los 6 territorios superficiales de la arteria cerebral media (M1, M2, M3, M4, M5 y M6).
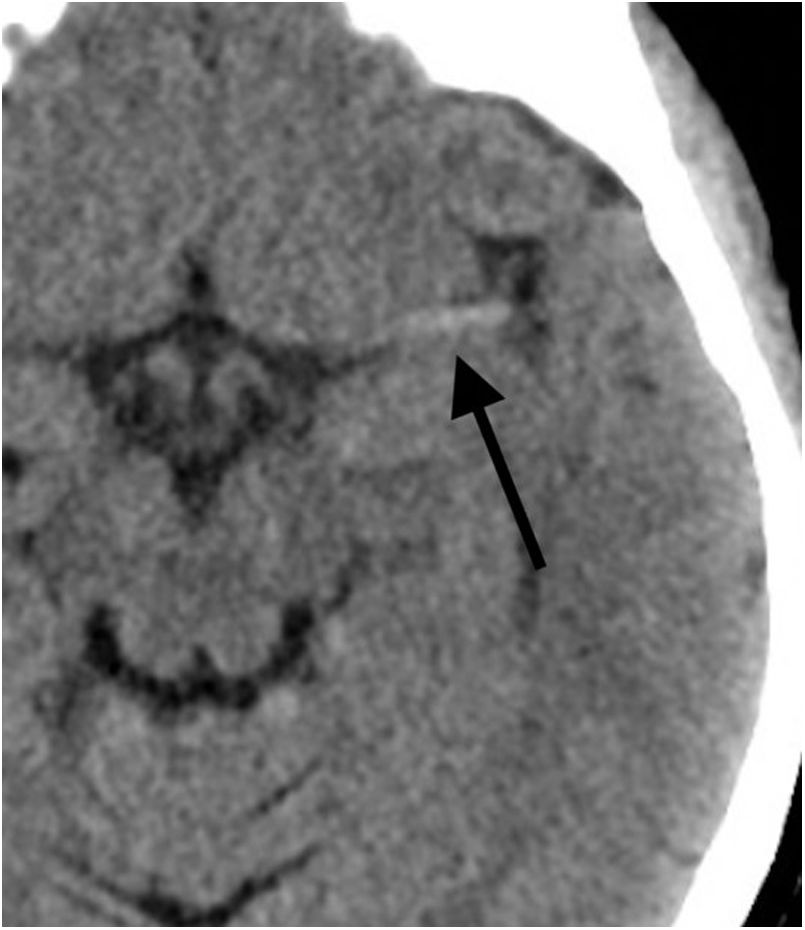
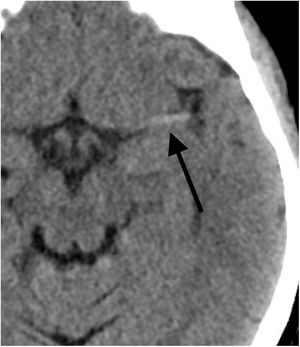
La tercera función de esta prueba diagnóstica es la valoración de la hiperdensidad asociada a la presencia del trombo, que puede tener relación con la efectividad del tratamiento endovascular. Se puede observar como una imagen lineal hiperdensa en la arteria cerebral media (signo de la arteria cerebral media hiperdensa) o como un punto hiperdenso en una rama M2 insular (dot sign) o en la arteria basilar, por ejemplo (fig. 2).
La hiperdensidad dentro de la arteria se relaciona con la presencia de trombo en su interior, ya sea de origen cardiogénico, aterotrombótico u otro. A mayor tamaño o longitud de esta hiperdensidad, se ha demostrado una menor efectividad del tratamiento fibrinolítico por vía intravenosa. Además, se ha comprobado que este aumento de la densidad se correlaciona con un mayor contenido de glóbulos rojos en el trombo, lo que a su vez se relaciona con una mayor tasa de recanalización en el primer pase de la trombectomía mecánica. Recientemente, en un intento por determinar qué técnica endovascular de trombectomía (stent retriever o aspiración directa) realizar, se ha publicado una mayor efectividad de la técnica con stent retriever para los trombos más hiperdensos y, por tanto, más ricos en glóbulos rojos3.
Se ha demostrado que esta hiperdensidad es un hallazgo específico, pero poco sensible, ya que un porcentaje importante de los pacientes con oclusión de vaso mayor no presentarán hiperdensidad. Además, también se ha demostrado que existe una diferencia en la sensibilidad para identificar este hallazgo según el grosor de corte analizado en la TC sin contraste, siendo más sensible con grosores más finos4–7.
TC de perfusión cerebralLa principal utilidad de la TC de perfusión es añadir información sobre la viabilidad del tejido isquémico que puede ser utilizada dentro de los protocolos de decisión terapéutica, como veremos más adelante, en pacientes de tiempo de evolución desconocido y en pacientes con más de seis horas de inicio de los síntomas8,9.
Los principales valores de la perfusión con TC son los siguientes:
Flujo sanguíneo cerebral (FSC): Sería el volumen de sangre por unidad de tiempo por unidad cerebral. Es decir la cantidad de sangre por cada 100 g de tejido en 1 minuto.
Tiempo de tránsito medio (TTM): Tiempo promedio catalasa ventricular a través de la vasculatura cerebral es decir desde la entrada en la arteria hasta la salida de la vena.
Tiempo de drenaje (TTD): Sería el tiempo que tarda en una vena en llegar el contraste, alcanzar su máxima concentración y lavar el contraste.
Volumen sanguíneo cerebral (VSC): Sería la cantidad (ml) de sangre por cada 100 g de tejido.
Los parámetros indicadores del territorio en riesgo en un determinado área cerebral los marcaría el flujo(FSC), el tiempo de tránsito medio (TTM) y el tiempo de drenaje, por otra parte el core del infarto lo indicaría el volumen (VSC). El método standard que normalmente realizamos para calcular la penumbra sería restar al territorio en riesgo (flujo, tiempo de tránisto medio y tiempo de drenaje) el core (marcado por el volumen).
Los principales parámetros de perfusión que utilizan los programas de procesamiento automáticos serían los siguientes:
- 1.
Flujo sanguíneo cerebral (CBF): hace referencia al flujo cerebral; cuando este es menor del 30% se corresponde con el core del territorio en isquemia.
- 2.
Tmáx> 6 s (tiempo al pico de flujo mayor de 6 s): territorio en el que se encuentra aumentado el tiempo por encima de 6 s, lo que corresponde con el territorio hipoperfundido o en isquemia. El Tmáx es el tiempo que pasa en la adquisición de la fase de perfusión desde que llega el bolo de contraste a un vaso mayor intracraneal hasta que se detecta en el parénquima.
- 3.
Volumen sanguíneo cerebral (CBV): el CBV se define como el volumen de sangre que hay en determinada cantidad de tejido cerebral, se expresa comúnmente en ml de sangre por 100g de tejido cerebral. El CBV se suele calcular evaluando el área bajo la curva concentración de contraste en el tiempo.
- 4.
Mismatch o volumen en penumbra: es el resultado de restar al volumen cerebral con un Tmáx> 6 s el volumen con CBF <30% y nos daría el territorio potencialmente salvable en mililitros.
- 5.
Mismatch ratio: sería el cociente de dividir el Tmáx> 6 entre el CBF 30%. Este parámetro es fundamental y calcula qué proporción del tejido cerebral en isquemia está ya infartada, por ejemplo, una ratio de 2 significa que el 50% del tejido isquémico ya está infartado.
También presenta otras utilidades secundarias, como la detección de áreas de isquemia, lo que facilita la búsqueda de vasos de pequeño calibre obstruido. También permite, al detectar estas áreas, buscar la oclusión arterial en territorios que no se relacionan directamente con la clínica del paciente.
Otra función secundaria es ayudar en el diagnóstico de entidades relacionadas con la enfermedad isquémica, como los estados epilépticos, los síndromes de hiperperfusión o las áreas de perfusión de lujo. Ocasionalmente las imágenes fuente de la TC de perfusión también permiten la valoración de la escala ASPECTS y la búsqueda de áreas de necrosis establecida, ayudando en la interpretación de la TC craneal sin contraste8,9.
Angiografía con tomografía computarizada de los troncos supraaórticosEsta técnica, conocida como angio-TC, permitirá identificar las obstrucciones vasculares en los troncos supraaórticos (TSA) o en las arterias cerebrales intracraneales que son la causa del ictus isquémico. Deberá incluir desde el margen caudal del arco aórtico hasta el vértex craneal.
Presenta 2 aplicaciones clínicas más, la valoración de las colaterales asociadas a la isquemia cerebral, que presentan un valor pronóstico en el grado de necrosis cerebral, y la valoración de la escala ASPECTS en los cortes fuentes de la angio-TC, que también se ha asociado al pronóstico funcional de los pacientes.
La colateralidad cerebral en el ictus es la capacidad que tiene el volumen cerebral bajo isquemia de suplir este bajo aporte sanguíneo desde otros territorios a través de anastomosis que existen en la circulación pial. Por ejemplo, ante una oclusión de la arteria cerebral media, el volumen irrigado por la misma que se encuentra en isquemia puede recibir un aporte transitorio de vascularización a través de las conexiones arteriales piales desde la arteria cerebral anterior ipsilateral.
La principal escala es la escala TAN (single-phase CT angiography collateral scores), que valora de cero a 3, de manera semicuantitativa, el grado de colateralidad relativa respecto a la colateralidad del hemisferio contralateral, siendo cero el peor escenario y 3 el mejor (cero equivale al 0% de colateralidad relativa, 1 equivale al 0-50%, 2 al 50-99% y 3 al 100% de colateralidad)10,11.
Criterios de tratamiento de los pacientes con ictus isquémico agudoA continuación, se muestran los principales criterios de tratamiento endovascular y de fibrinólisis por vía intravenosa poniendo especial énfasis en los criterios de imagen que posteriormente introduciremos en el informe estructurado12,13.
- A.
Criterios para el uso de fibrinólisis intravenosa:
- a.
Criterios de inclusión:
- 1.
Edad comprendida entre los 18 y los 80 años.
- 2.
Diagnóstico clínico de ictus isquémico agudo que provoca un déficit neurológico con un National institute of Health Stroke Scale (NIHSS) igual o mayor de 4.
- 3.
Comienzo de los síntomas en menos de 4,5h.
- 4.
Síntomas de ictus presentes durante al menos 30min y que no hayan mejorado de forma significativa antes del tratamiento. Los síntomas deben ser distinguibles de los de un episodio de isquemia generalizada (síncope), de una convulsión o de un trastorno migrañoso.
- 5.
Pacientes que acepten el tratamiento trombolítico y que estén de acuerdo en otorgar su consentimiento informado en lo relativo a su recuperación de los datos y a los procedimientos de seguimiento, de acuerdo con las regulaciones de los países participantes.
- 6.
Voluntad y capacidad de cumplir el protocolo de seguimiento.
- b.
Criterios de exclusión para el tratamiento con activador del plasminógeno tisular (rt-PA), según los métodos de imagen:
- 1.
Evidencia de hemorragia intracraneal en la TC.
- 2.
Síntomas indicativos de hemorragia subaracnoidea (HSA), incluso si la TC es normal.
- 3.
Sospecha de HSA o alteración después de haber presentado una HSA provocada por un aneurisma.
- 4.
Cualquier antecedente de lesión del sistema nervioso central (neoplasia, aneurisma, cirugía intracraneal o espinal).
- 5.
Presencia de un aneurisma arterial o una malformación arteriovenosa.
- B.
Criterios para el tratamiento con trombectomía mecánica: clínicamente el paciente debería ser previamente independiente (mRS <3), ser mayor de 18 años y la situación clínica actual debe corresponder con un valor en la escala NIHSS igual o mayor de 612,13:
- a.
Criterios de imagen en menos de 6h de evolución:
- 1.
Valor en la escala ASPECTS igual o mayor de 6.
- 2.
Obstrucción del primer segmento de la arteria cerebral media (M1) o de la arteria carótida interna.
- 3.
Lugares para valorar de forma individualizada: circulación posterior, arterias cerebrales anteriores y ramas distales de la arteria cerebral media.
- b.
Criterios de imagen para una evolución por encima de las 6h:
- 1.
Si utilizamos la perfusión simple sin sistema de procesamiento automático, utilizamos los criterios DEFUSE 3 donde la penumbra tiene que ser al menos el 50% del territorio en riesgo (Mismatch ratio mayor de 1,8).
- 2.
Criterios en función del ensayo clínico DEFUSE 314 con el programa Rapid Processing of Perfusion and Diffusion Software (RAPID), donde se utilizan los siguientes parámetros para elección del paciente:
- -
Tiempo evolución de los síntomas 6-16h.
- -
Core (ischemic core volume)> 15ml y <70ml.
- -
TC-perfusión con un 30% del volumen relativo cerebral normal.
- -
Mismatch ratio> 1,8.
- 3.
Criterios en función del ensayo clínico DAWN15:
- -
NIHSS> 10.
- -
Edad> 18 años.
- -
Tiempo de evolución inicio síntomas 6-24h.
- -
Grupos poblacionales:
- •
Grupo A:> 80 años, NIHSS> 10, volumen de infarto <21ml.
- •
Grupo B: <80 años, NIHSS> 10, volumen de infarto <31ml.
- •
Grupo C: <80 años, NIHSS> 20, volumen de infarto 31-51ml.
Cada vez en más centros se están utilizando los programas de análisis automático de las pruebas de imagen que permiten una valoración prácticamente instantánea de las imágenes de los pacientes con ictus isquémico agudo.
Presentan como principal ventaja su rapidez en el procesamiento de la imagen y la capacidad de enviar de forma prácticamente instantánea la información a los dispositivos móviles y correo electrónico del personal que se hace cargo de la atención urgente a estos pacientes. Además, influidos por los ensayos clínicos, permiten homogeneizar las decisiones terapéuticas.
Como principal inconveniente presentan un error nada desdeñable que está relacionado directamente con 2 factores. Por un lado, la incapacidad del ordenador para integrar la información clínica del paciente, lo que provoca errores de lateralidad y sensibilidad en la imagen y, por otro lado, la presencia de errores en la adquisición técnica que provocan que, en ocasiones, los resultados que entregan no sean precisos.
Debido a estas 2 causas son necesarias la supervisión, la interpretación y la inclusión de estos valores en el informe radiológico, lo que equivale a la validación médica de los valores entregados.
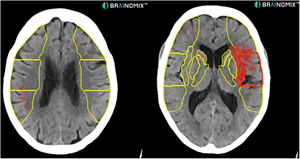
Actualmente se están utilizando programas de procesamiento semiautomático de imágenes, que calculan la escala ASPECTS, el volumen en penumbra, el punto de oclusión arterial e incluso el grado de colateralidad arterial. Principalmente existen 2 plataformas en el mercado RAPID (iSchemaView) y Brainomix (con sus softwares e-ASPECTS, e-CTA y e-CTP) (fig. 3)13,14.
TC craneal sin contraste. En esta imagen se observa procesamiento automático del programa Brainomix que, en amarillo, marca los territorios de la arteria cerebral media que se valoran en la escala ASPECTS y en rojo, las zonas del parénquima afectadas (8 en este caso) en una paciente de 73 años con déficit completo de la arteria cerebral media izquierda.
Los epígrafes que debe cubrir el informe radiológico estructurado son los siguientes.
Información clínicaEl informe deberá comenzar con un breve resumen de la historia clínica del paciente y la justificación clínica para la realización del estudio. Es preciso indicar la lateralidad, el valor en la escala NIHSS, los principales signos de focalidad (lenguaje, movimiento del brazo, pierna y parálisis facial) y si es posible el nivel de consciencia y la sospecha del territorio afectado.
Descripción del estudioEn segundo lugar, se deben incluir los estudios realizados y el orden de realización, incluyendo si se ha tenido que repetir alguno de los estudios y la causa y probables problemas técnicos en su adquisición.
Informe radiológico de cada prueba diagnósticaPosteriormente, informaremos cada prueba diagnóstica por separado incluyendo los valores de las escalas que es preciso incluir y que serán la base de la decisión terapéutica.
- A.
TC Craneal sin contraste intravenoso:
- a.
Señalar si se observan signos de sangrado intra o extraxial u otras causas de enfermedades simuladoras de ictus que pudiesen justificar la clínica.
- b.
Señalar si existen signos precoces de isquemia, la densidad de la arteria cerebral media y si existen puntos de hiperdensidad en alguna arteria intracraneal.
- c.
Indicar alteraciones en la densidad del parénquima encefálico en los territorios de la arteria cerebral media y la valoración de la escala ASPECTS por parte del radiólogo.
- d.
Describir si se observan otras alteraciones en el resto del parénquima cerebral, sin olvidar la fosa posterior.
- e.
Comprobar las cisternas de la base.
- f.
Describir si la línea media está centrada.
- g.
Ver que el sistema ventricular está normal para la edad del paciente.
- h.
Especificar si existen alteraciones óseas.
- B.
TC de perfusión cerebral:
- a.
Describir mediante el software normal de posprocesado la valoración de las imágenes de perfusión incluyendo si es compatible con lesión isquémica o lesiones simuladores de ictus y una estimación del porcentaje de necrosis establecida y del mismatch.
- b.
Incluir los datos obtenidos por el análisis automático de la perfusión:
- 1.
Volumen del territorio en isquemia.
- 2.
Volumen del core o tejido necrótico.
- 3.
Volumen de tejido salvable.
- 4.
Relación entre penumbra y necrosis.
- C.
Angio-TC de TSA y arterias cerebrales:
- a.
Señalar si existe o no oclusión arterial y su localización.
- b.
Valorar la escala TAN de colateralidad.
- c.
Señalar si hay signos que indiquen que sea una estenosis o bien de origen tromboembólico.
- d.
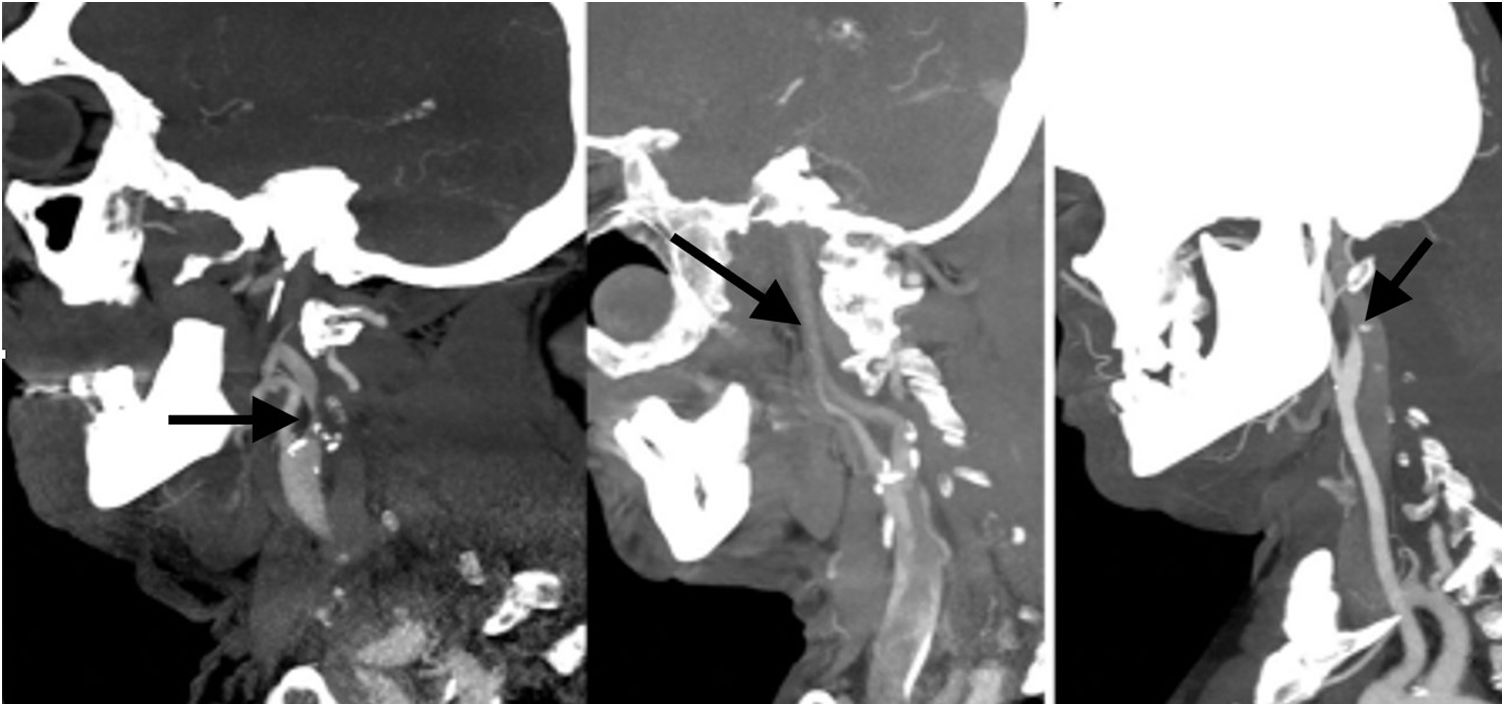
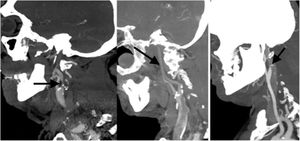
Describir si existe una oclusión o una estenosis significativa a nivel de la carótida interna; es importante describir el origen de la oclusión, si es por una placa de ateroma o por una disección o la presencia de estasis de contraste por oclusión distal (fig. 4).
Figura 4.Angio-TC de TSA, MPR sagital. Izquierda: estenosis significativa en el origen de la ACI izquierda secundaria a placa de ateroma mixta (fibrolipídica y calcificada) con oclusión por trombo en M1 izquierda (no visualizado en esta imagen). Centro: dilución distal progresiva de la columna de contraste como signo indirecto de oclusión en la carótida terminal por trombo. Derecha: afilamiento brusco con oclusión en la región distal del bulbo carotídeo con imagen del pico de pájaro como signo de disección intimal.
(0,09MB). - e.
Descartar la presencia de otros hallazgos vasculares, como aneurismas u otras malformaciones vasculares, ya que pueden condicionar dificultades técnicas en el abordaje de tratamiento endovascular y contraindican la fibrinólisis por vía intravenosa.
- f.
Describir si existe o no elongación del origen de los TSA o variantes anatómicas que pueden presentar problemas para la cateterización de las arterias o para decidir la vía de abordaje.
- g.
Incluir los valores de los softwares semiautomáticos de valoración de la imagen (e-CTA de Brainomix) (fig. 5):
Figura 5.Angio-TC de las arterias intracraneales. Valoración de la colateralidad, de la densidad del vaso (en naranja) y del punto de oclusión vascular (círculo rojo) con el software de interpretación de imágenes en un paciente varón de 81 años con un déficit completo de la arteria cerebral media derecha.
(0,11MB).
- 1.
Punto de oclusión.
- 2.
Coeficiente en porcentaje de la disminución de la densidad de la vascularización en el lado afectado.
- 3.
Grado de colateralidad en escala cuantitativa del 0 al 3.
Describir otros hallazgos en vértices pulmonares, planos blandos del cuello y estructuras óseas.
Conclusiones del informe- A.
Si el estudio es indicativo de lesión isquémica.
- B.
Valoración de la penumbra, las colaterales, la escala ASPECTS y el lugar de oclusión vascular (fig. 6)
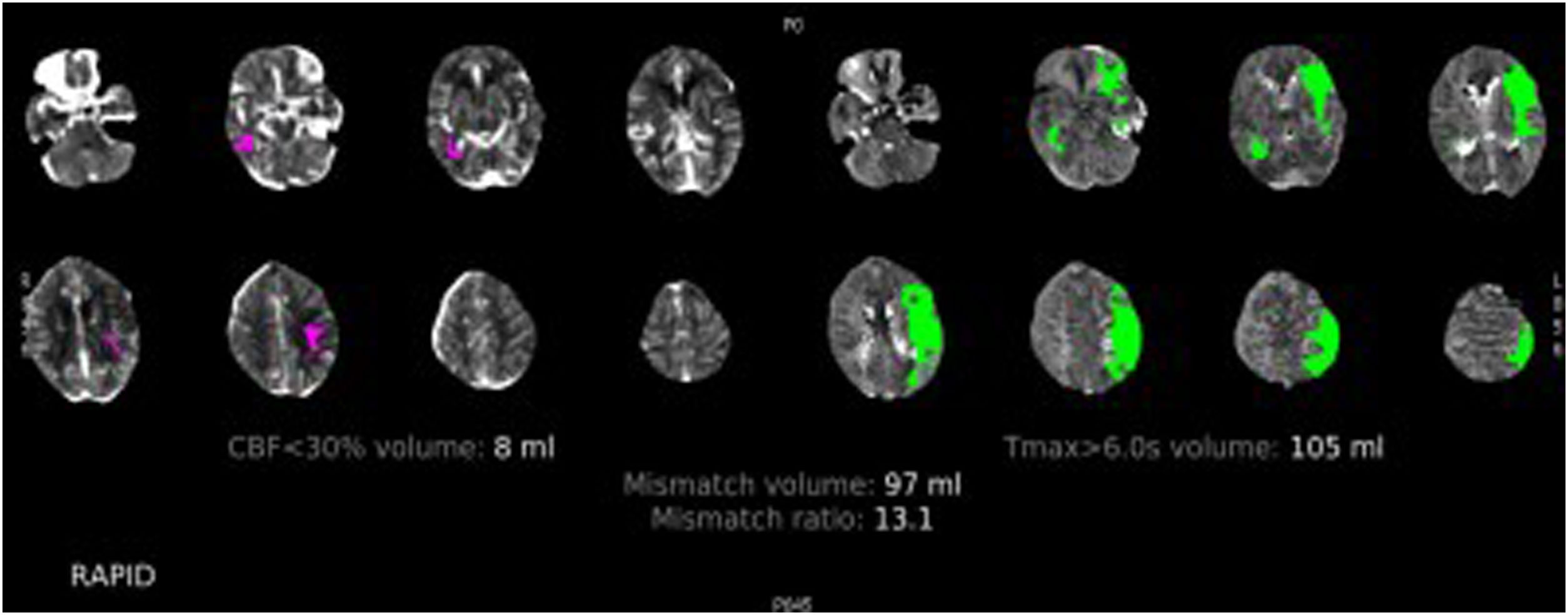
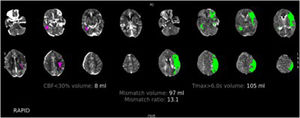
Figura 6.TC de perfusión cerebral con contraste por vía intravenosa. Paciente varón de 78 años con un déficit completo de la arteria cerebral media izquierda de 2h de evolución. En esta imagen podemos ver el procesamiento automático del software RAPID, donde se observa en rosa el CBF<30% en este caso de 8ml (tejido cerebral no recuperable, el core) y en verde el Tmáx> 6 s (tejido cerebral afectado). El volumen de mismatch nos da una idea del tejido cerebral recuperable y la mismatch ratio nos muestra la relación entre el tejido cerebral en riesgo y el infarto establecido, en este caso de 13,1, que estaría muy por encima del parámetro de los criterios DEFUSE 3 (mayor de 1,8), por lo que estaría indicada la realización de trombectomía mecánica.
(0,14MB). - C.
Si existen diferencias entre los valores obtenidos por el software semiautomático y la valoración radiológica de los hallazgos, cuál es la estimación más correcta y por qué (fig. 7)
- D.
Indicar si existen contraindicaciones para el tratamiento endovascular o la fibrinólisis por vía intravenosa.
La protocolización de las indicaciones del tratamiento de los pacientes con ictus isquémico agudo y la introducción de los softwares semiautomáticos de procesamiento de las imágenes, asociadas a la premura en la aplicación de decisiones, hacen necesaria la protocolización exhaustiva del informe radiológico. Este informe debe incluir los valores calculados por este software adecuadamente validados por el radiólogo y la calidad de la prueba de imagen realizada.
Autoría- 1.
Responsable de la integridad del estudio: EMQ.
- 2.
Concepción del estudio: EMQ y JCB.
- 3.
Diseño del estudio: EMQ y JCB.
- 4.
Obtención de los datos: JMJP y JCG.
- 5.
Análisis e interpretación de los datos: JMJP y JCG.
- 6.
Tratamiento estadístico: JMJP y JCG.
- 7.
Búsqueda bibliográfica: JMJP y JCG.
- 8.
Redacción del trabajo: EMQ, JMJP y JCG.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: EMQ, JMJP, JCB y JCG.
- 10.
Aprobación de la versión final: EMQ, JMJP, JCG y JCB.
Los autores declaran no tener ningún conflicto de intereses.