La evaluación de la respuesta a los diferentes tratamientos aplicados es un factor decisivo en el manejo clínico de los pacientes con carcinoma hepatocelular. Con ella se logra determinar la eficacia del tratamiento y detectar de forma precoz la recidiva del tumor tratado o la aparición de nuevas lesiones que puedan ser candidatas a nuevos tratamientos. Cuando se aplican tratamientos locorregionales, que inducen necrosis, o terapias moleculares, que tienen efectos antiangiogénicos, las lesiones tratadas suelen presentar un cambio en su comportamiento por imagen. Cabe resaltar que no suelen presentar una disminución de su tamaño, al menos inicialmente, e incluso algunas lesiones pueden aparentemente aumentar de tamaño. Por ello es imprescindible conocer el mecanismo de acción de cada tratamiento utilizado y el espectro de imagen que pueden producir esos tratamientos en las distintas técnicas que se emplean en su valoración.
Evaluating the response to different treatments is a decisive factor in the clinical management of patients with hepatocellular carcinoma because it can determine the efficacy of the treatment and because it can detect the recurrence of treated tumors or the appearance of new lesions that can be candidates for new treatments. When locoregional treatments that induce necrosis or molecular therapies are applied, the treated lesions usually change their behavior on imaging studies. It is important to point out that the size of the lesions does not usually decrease, at least initially, and some lesions can even appear to increase in size. For this reason, it is essential to know the mechanisms of action for each treatment applied and the spectrum of findings that these treatments can cause in the different imaging techniques used to assess the response.
Actualmente, los pacientes con carcinoma hepatocelular (CHC) disponen de varias opciones terapéuticas cuyo objetivo es prolongar su supervivencia. El aspecto clave para asegurar una buena respuesta terapéutica es la correcta selección de los pacientes. La clasificación del BCLC (Barcelona Clinic Liver Cancer) es la recomendada por la mayoría de las guías clínicas para el manejo del CHC1–3. Esta clasificación define 5 perfiles de pacientes basados en factores pronósticos (estadios del BCLC) y recomienda la primera opción de tratamiento4. La clasificación BCLC no implica una decisión terapéutica rígida de acuerdo con la figura. No es infrecuente que pacientes que son clasificados en un estadio BCLC determinado no puedan recibir el tratamiento recomendado debido a comorbilidades o contraindicaciones. En esta situación se aplicaría el concepto de migración terapéutica5, y si el paciente no presenta contraindicaciones, se recomendaría realizar el tratamiento del siguiente estadio. Otro concepto que contempla la clasificación del BCLC es el de la progresión intratable; pese a que el paciente no cambie de estadio tras la progresión, se le ofrece el tratamiento del siguiente estadio por el hecho de haber progresado a pesar del tratamiento indicado.
Por todo ello, la evaluación objetiva de la respuesta terapéutica es un factor decisivo en el manejo clínico de los pacientes con CHC, ya que permite determinar la eficacia de un tratamiento determinado y detectar de forma precoz la recidiva del tumor tratado o la aparición de nuevas lesiones que puedan ser candidatas a nuevos tratamientos. Para valorar correctamente la respuesta tumoral es imprescindible conocer el mecanismo de acción de cada tratamiento y el espectro de imagen que pueden producir en las distintas técnicas que se emplean en su valoración. Así mismo, es importante conocer los cambios inflamatorios y las posibles complicaciones que puede causar el propio tratamiento para evaluar correctamente el grado de respuesta tumoral.
Control de la eficacia, valoración de la respuesta y seguimiento de los pacientes con carcinoma hepatocelular sometidos a tratamientos locorregionalesEl objetivo de los tratamientos locorregionales es conseguir la necrosis tumoral local, mediante la aplicación de calor o sustancias químicas dentro de las lesiones, la oclusión vascular del tumor y el efecto local de los agentes quimioterápicos o de la radiación, sin afectación del parénquima hepático adyacente ni efectos sistémicos. Gracias a que la mayoría de CHC son lesiones hipervasculares, y por tanto captan contraste endovenoso en la fase arterial de los estudios de imagen con contraste (ecografía con contraste [CEUS]/tomografía computarizada [TC]/resonancia magnética [RM]), una vez completado el tratamiento, la zona de necrosis se puede delimitar de modo preciso por la ausencia de captación en la zona tratada, pero las lesiones no suelen disminuir de tamaño, al menos inicialmente, e incluso algunas pueden aparentemente crecer.
Los criterios objetivos de respuesta tumoral más ampliamente utilizados en oncología, los criterios RECIST 1.16, son criterios morfológicos que valoran la carga tumoral en función de la evolución del tamaño de las lesiones a lo largo del tratamiento. Son útiles básicamente para pacientes con tumores sólidos que reciben tratamiento quimioterápico con efecto citotóxico cuyo objetivo es la disminución del volumen tumoral, pero no son buenos indicadores de la respuesta tumoral y no se correlacionan correctamente con la supervivencia global después de tratamientos que inducen necrosis.
Los criterios radiológicos recomendados para la evaluación de la respuesta a los tratamientos locorregionales son aquellos que valoran la viabilidad tumoral en función del área de la lesión que presenta captación del contraste endovenoso2,7, como los criterios de la EASL (European Association for the Study of the Liver)8, que han sido validados en pacientes con CHC tratados locorregionalmente9–11. También existen los criterios RECICL (Response Evaluation Criteria in Cancer of the Liver)12, utilizados habitualmente en Japón, y los criterios mRECIST (modified RECIST)13 o los criterios BCLC-Refined RECIST5, propuestos para la valoración de pacientes con CHC avanzado.
Las guías aconsejan que el seguimiento del tratamiento locorregional del CHC se realice mediante TC o RM cada 3 meses durante el primer año y cada 6 meses hasta completar como mínimo los 2 años1.
Ablación percutáneaActualmente, la técnica de elección para la ablación del CHC es la radiofrecuencia, y su máxima eficacia se obtiene en lesiones de menos de 3cm de diámetro. En los últimos años ha aparecido la ablación por microondas, que tiene un radio de acción más amplio y por tanto permitiría tratar lesiones de mayor tamaño. A pesar de que la ablación con alcohol etílico ha demostrado una excelente eficacia para lesiones de menos de 2cm14, actualmente ha quedado reservada para casos en los que la radiofrecuencia está contraindicada por la localización del tumor o en combinación con esta para completar la ablación cuando existe mínima actividad residual3.
El mecanismo de acción de estas técnicas se basa en la inyección de alcohol o en la aplicación de calor (radiofrecuencia, microondas) dentro del tumor, y el efecto que producen consiste en una necrosis coagulativa15, lo que determina el aspecto que presentan las lesiones tratadas en las técnicas de imagen14–16.
El tratamiento con alcohol suele realizarse en varias sesiones. Durante la inyección se produce un aumento de ecogenicidad en la lesión tratada debido a la difusión del alcohol que lleva microburbujas de aire en su interior. Si la hiperecogenicidad abarca la totalidad de la lesión, se asume que la difusión ha sido correcta, pero en ocasiones existen septos dentro del tumor que impiden una buena difusión. Antes del siguiente tratamiento, la administración de contraste permite detectar la zona de tumor viable y por tanto incidir en ella. En el momento en que no se observan áreas de captación puede darse por finalizada la ablación. Debido a las múltiples inyecciones, el contorno del área tratada puede ser irregular.
Durante la ablación con radiofrecuencia o microondas se ve también una zona hiperecogénica resultado de la producción de gas en las células por la necrosis térmica (fig. 1). Excepto si se hacen varias inserciones, los límites son esféricos u ovales y bien definidos. En las lesiones menores de 3cm, lo más frecuente es que se produzca una necrosis inicial completa. Si hay dudas de haber incidido sobre toda la lesión, al final del tratamiento es posible realizar un estudio con CEUS para confirmar si la ablación es completa y la zona de necrosis tiene un tamaño superior a la lesión tratada, asumiendo que se ha abarcado toda la lesión y el margen de seguridad17.
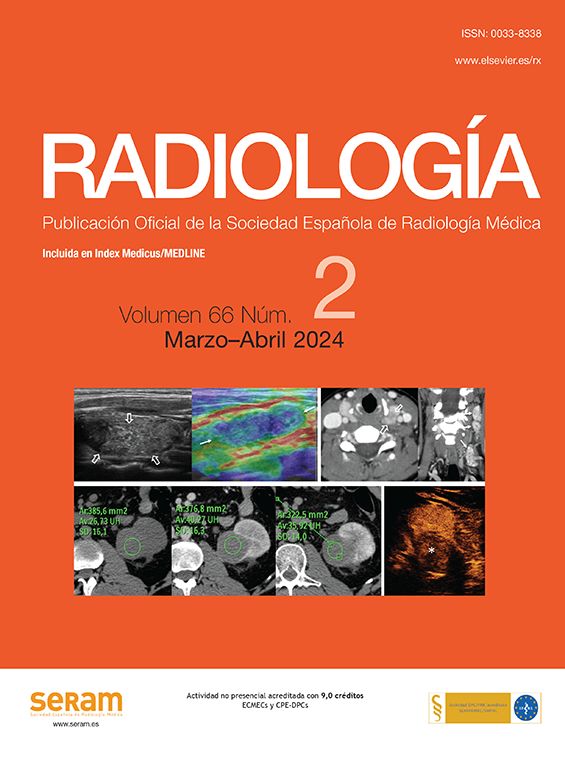
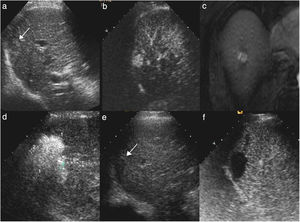
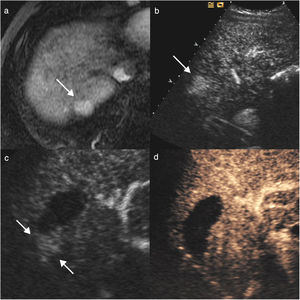
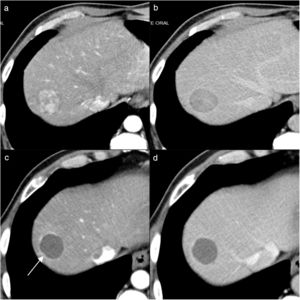
Hombre de 68 años, con cirrosis hepática por virus de la hepatitis C. En la ecografía de cribado (a) se visualiza un nódulo hipoecoico de 17mm (flecha) en la cúpula del segmento VIII. En la ecografía con contraste (CEUS) (b) el nódulo tiene un intenso realce en la fase arterial. Su comportamiento es característico de carcinoma hepatocelular por resonancia magnética, y es hipercaptante en la fase arterial (c) con lavado en la fase portal. Se realizó tratamiento con radiofrecuencia (d) y durante el mismo se visualizó un área ecogénica de mayor tamaño que el nódulo, en relación con el gas producido durante la necrosis térmica. En la ecografía basal postratamiento al mes (e) se visualiza el nódulo hipoecoico (flecha) similar al estudio basal. En la CEUS (f) se ve un área ovalada que no muestra realce, de mayor tamaño que el nódulo original, y que corresponde al área de necrosis, indicativo de respuesta inicial completa.
La incidencia de complicaciones inmediatas relacionadas con el tratamiento es muy escasa y por tanto solo se recomienda realizar un control posprocedimiento en pacientes sintomáticos. Además, la evaluación de la respuesta inmediata es difícil debido a la presencia de captaciones arteriales relacionadas con los cambios inflamatorios producidos por el propio tratamiento y la persistencia de mínimos restos tumorales puede no detectarse precozmente18,19. Por todo ello, se recomienda realizar el primer control para valorar la respuesta al mes del tratamiento.
La mayoría de los centros utilizan la TC o la RM para valorar la eficacia de la ablación. La CEUS ha demostrado en diferentes estudios una eficacia similar a la TC en la valoración de la necrosis tumoral inicial al mes18,20, y por tanto puede utilizarse, como alternativa a la TC/RM, en los controles durante los primeros 6 meses para detectar restos viables dentro de las lesiones tratadas.
En los controles iniciales (al mes y a los 3 meses) debe valorarse el área de necrosis tumoral que se define como la zona sin captación de contraste21,22. El tamaño del área de necrosis inicialmente debe ser mayor que el del tumor antes del tratamiento, lo que asegura unos márgenes de ablación peritumoral suficientes (5mm)23. Esto se conoce como zona de seguridad, cuyo objetivo es eliminar las posibles micrometástasis satélites no detectadas y la invasión de pequeños vasos adyacentes, que suelen ser habituales en lesiones de más de 2cm. En caso de que exista una amplia zona sin captación, se considerará respuesta inicial completa (fig. 1).
La identificación de áreas focales de captación arterial en el interior del área tratada indica persistencia de zonas vascularizadas y por tanto representativas de tumor viable (fig. 2). Estas captaciones arteriales del tumor residual suelen ser nodulares e irregulares, generalmente situadas en la periferia del tumor y pueden presentar lavado en fases venosas24,25. No deben confundirse con la captación anular uniforme que rodea toda el área tratada (zona de hiperemia) que suele identificarse en los controles inmediatos postratamiento y que representa una reacción inflamatoria debida a la agresión térmica o química producida por el propio mecanismo de ablación26 y que suele desaparecer al cabo de unas 2-4 semanas (fig. 3).
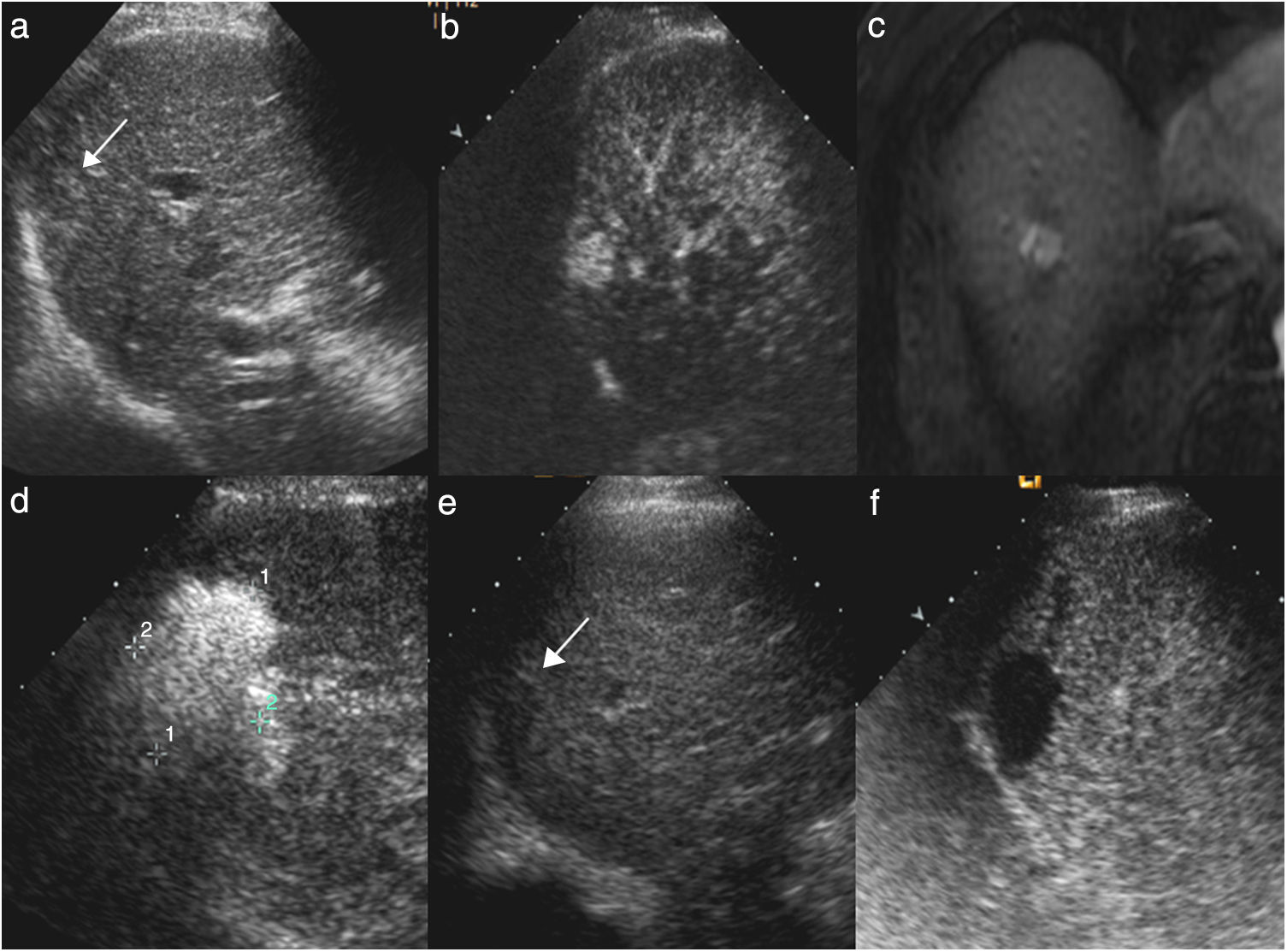
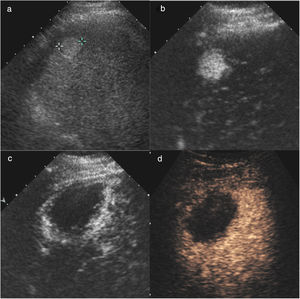
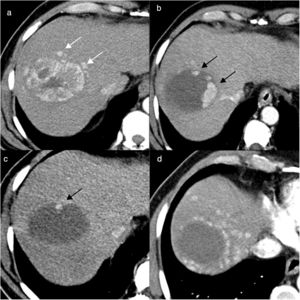
Hombre de 70 años, con cirrosis hepática por alcohol y antecedentes de carcinoma hepatocelular tratado con radiofrecuencia. En la resonancia magnética se identifica un nuevo nódulo de 20mm en el segmento VII, hipercaptante en fase arterial (flecha en a) y con lavado posterior. En la ecografía con contraste (CEUS) se identifica el nódulo hipercaptante en la fase arterial (flecha en b), que no era visible en la ecografía basal, lo que permitió realizar ablación con radiofrecuencia. En el control al mes, en la CEUS se visualiza un área hipercaptante adyacente al margen posterior del área necrótica (flechas en c), indicativo de persistencia tumoral. Se realizó una nueva sesión de radiofrecuencia y en el control (d) al mes se ve la zona de necrosis de mayor tamaño, sin realce patológico, indicativo de respuesta completa.
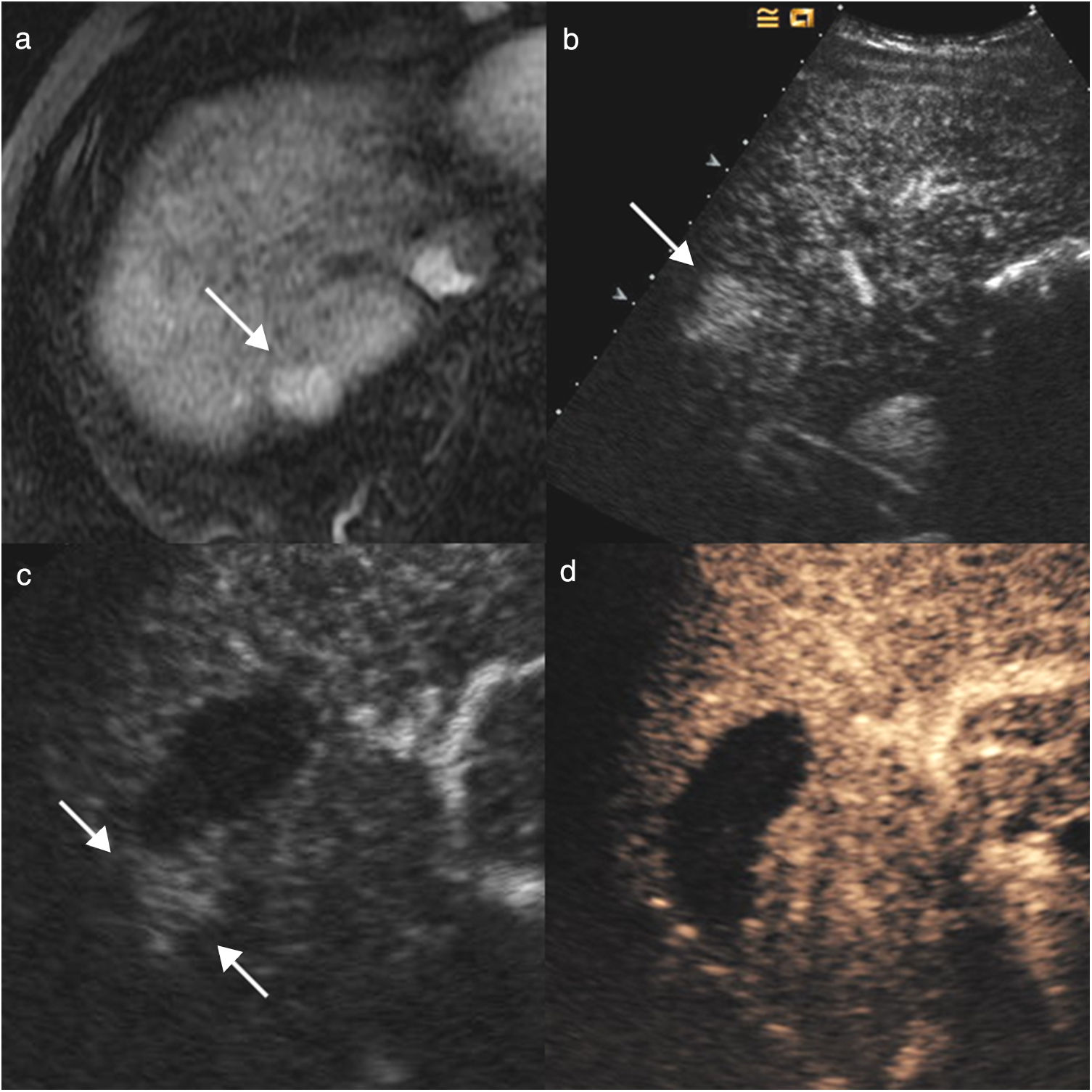
Hombre de 62 años, con cirrosis hepática por virus de la hepatitis C y carcinoma hepatocelular único de 17mm en el segmento VIII, pendiente de trasplante hepático, al que se realizó tratamiento puente con radiofrecuencia. En la ecografía basal pretratamiento (a) se ve un nódulo hiperecoico que realza en la fase arterial de la CEUS (b). Se realizó control con CEUS a las 24 horas (c) para valorar la extensión del área tratada, y se visualizó una hipercaptación en anillo alrededor de la zona necrótica, que corresponde a la reacción inflamatoria secundaria a la agresión térmica. En el control al mes por CEUS (d) se identifica respuesta completa inicial.
Aunque raramente, en los primeros controles pueden detectarse complicaciones que deben conocerse para su correcta interpretación, como son: abscesos hepáticos en la zona de necrosis, pseudoaneurismas, fístulas arteriovenosas, dilataciones biliares adyacentes al tumor, bilomas que envuelven la zona necrosada o infartos hepáticos24,25. Es importante remarcar que en los primeros días postratamiento no es infrecuente ver gas en el interior de las lesiones tratadas –relacionado con el propio tratamiento– que no indican necesariamente la existencia de un absceso; estas burbujas desaparecen con el tiempo25. Ocasionalmente, aparecerán trombosis vasculares segmentarias asociadas al tratamiento que no deben confundirse con trombosis por invasión tumoral. En estos casos, la CEUS es de gran utilidad, ya que la captación de contraste dentro del trombo es indicativa de invasión tumoral.
En la TC, las lesiones correctamente tratadas se ven hipodensas respecto al parénquima hepático y no presentan captaciones de contraste21,25–27. En los estudios iniciales pueden observarse unas áreas centrales hiperdensas que suelen corresponder a la zona de inserción de las agujas de radiofrecuencia, las cuales desaparecen con el paso del tiempo.
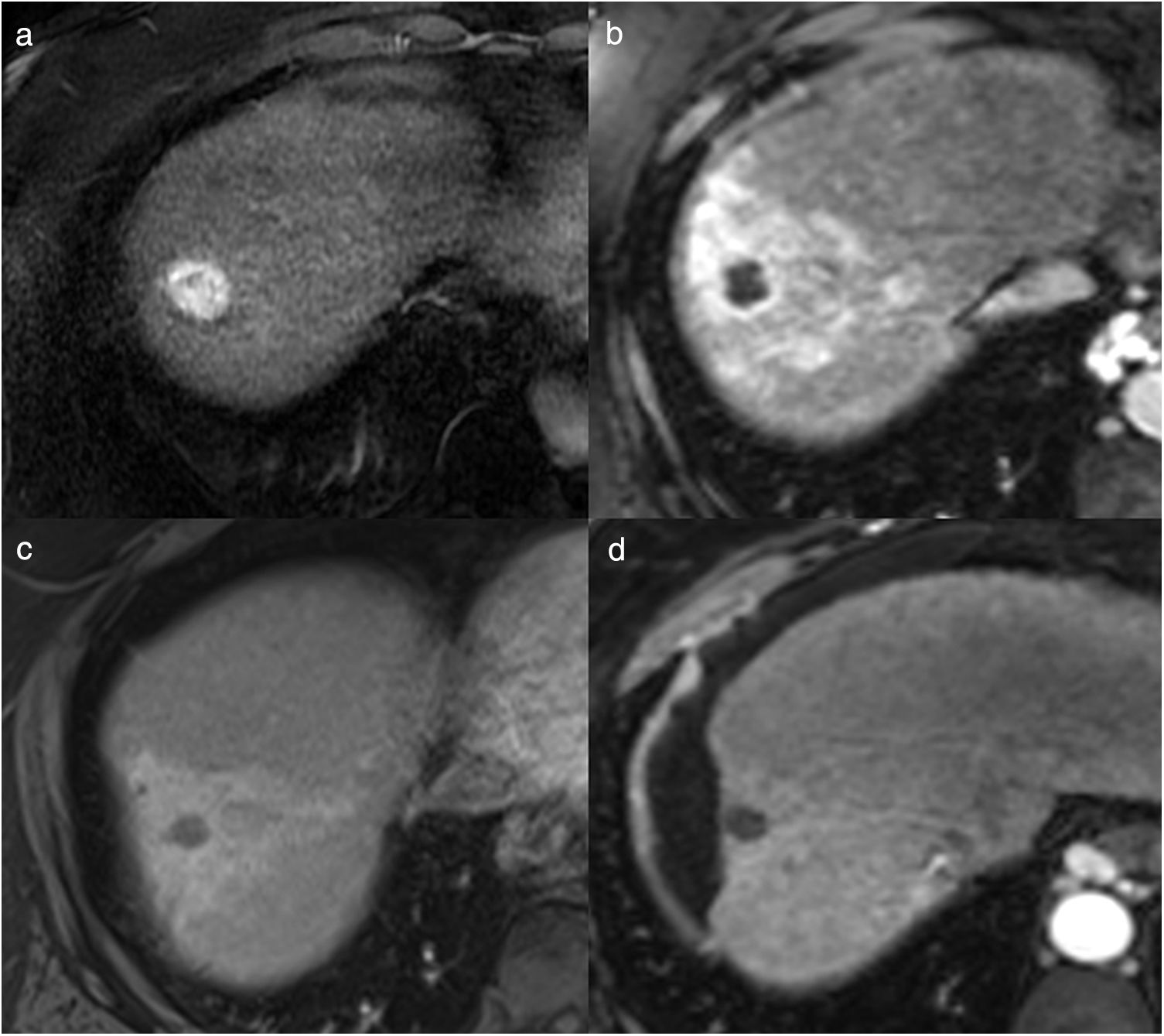
La RM tiene una elevada eficacia en la detección de pequeños focos tumorales, y se ha descrito que su precisión diagnóstica es más elevada que la de la TC por su mayor capacidad para diferenciar los diferentes tejidos. En los estudios de RM, las lesiones tratadas se ven como áreas hipointensas en secuencias potenciadas en T2 (deshidratación y necrosis coagulativa) e hiperintensas en secuencias potenciadas en T1 (hemorragia y material proteináceo), aunque en ocasiones se identifican zonas heterogéneas de diferente intensidad en T1 y T224,26–29 (fig. 4). La coincidencia de zonas hiperintensas en T2 que presentan hipercaptación de contraste en la fase arterial es característica de tumor residual viable. La hiperintensidad de las lesiones en las secuencias potenciadas en T1 puede limitar la evaluación del realce, por lo que la substracción de la imagen (fase arterial-fase precontraste) es de gran utilidad30 (fig. 5).
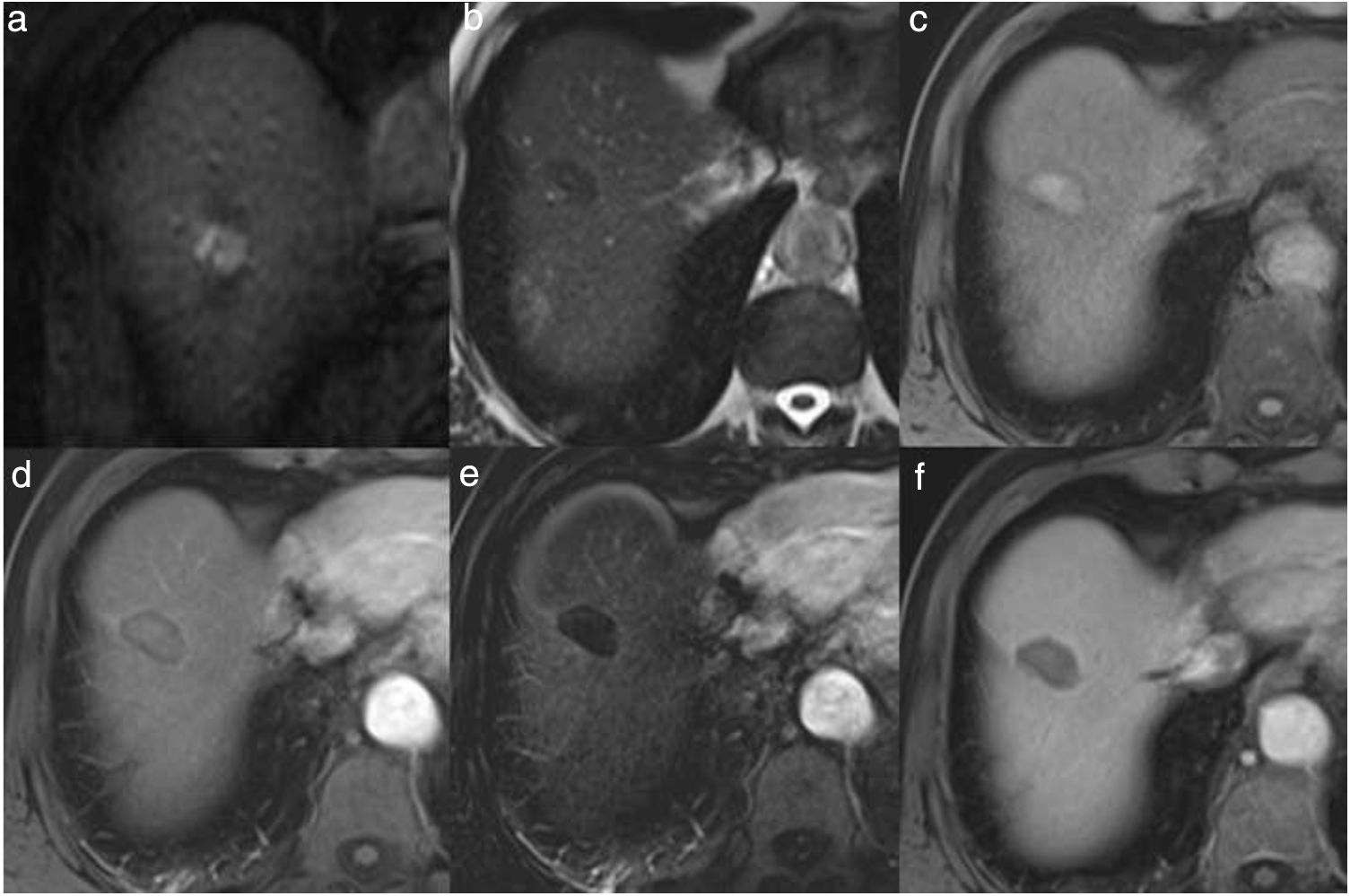
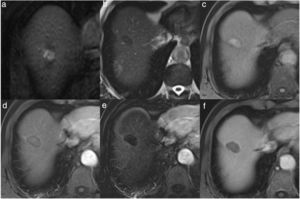
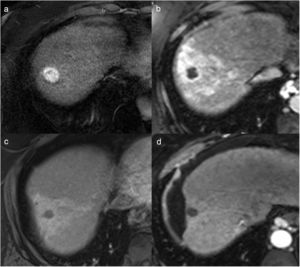
Imágenes de resonancia magnética (RM) del paciente de la Figura 1 antes (a) y después del tratamiento con radiofrecuencia (b-f). En la RM pretratamiento, en la secuencia potenciada en T1 con contraste endovenoso en fase arterial se identifica un nódulo hipercaptante, correspondiente a carcinoma hepatocelular. En la RM postratamiento a los 6 meses, el nódulo tratado se ve hipointenso en la secuencia potenciada en T2 (b), hiperintenso en la secuencia potenciada en T1 sin contraste (c), debido a la necrosis coagulativa, lo que puede dificultar la valoración del comportamiento del nódulo en la fase arterial del estudio dinámico (d). La imagen de sustracción (fase arterial-fase precontraste) no muestra realce patológico (e), y en la fase portal (f) la lesión se ve hipointensa, indicativo de respuesta completa.
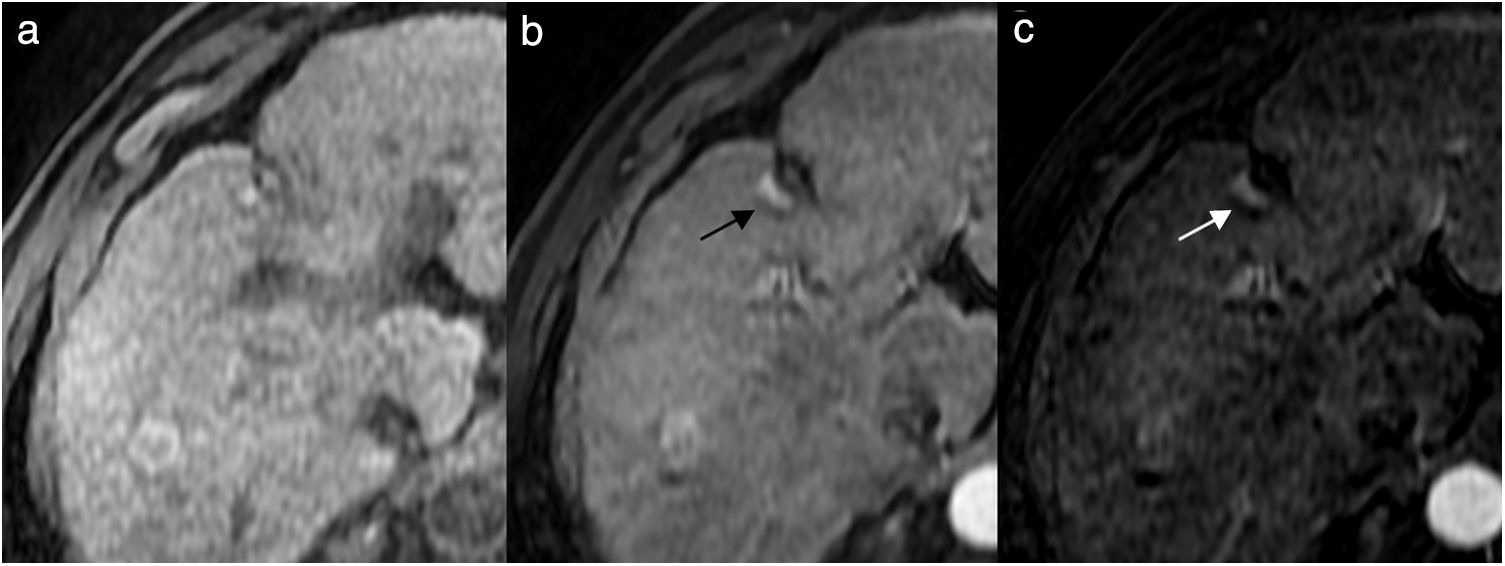
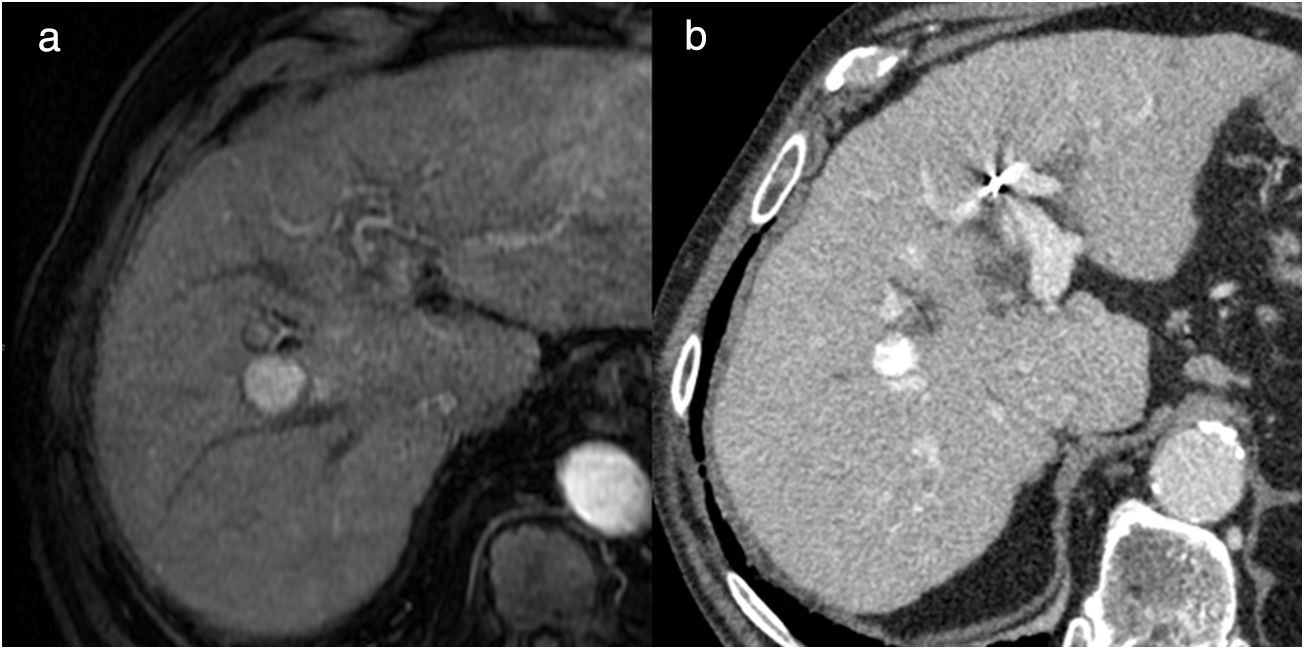
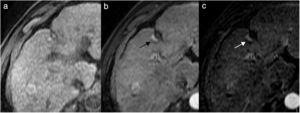
Hombre de 63 años que presenta cirrosis hepática por virus de la hepatitis C y alcohol, con carcinoma hepatocelular tratado con radiofrecuencia en el segmento IV con respuesta inicial completa. En el control con resonancia magnética al año, imágenes potenciadas en T1 pre (a) y poscontraste en fase arterial (b) e imagen de sustracción (c), presenta un área de hipercaptación en forma de semiluna en el margen posterior de la lesión tratada, indicativo de recidiva (flechas en b y c).
Después de una respuesta inicial completa en los controles de seguimiento puede aparecer una recidiva local en aproximadamente el 20% de las lesiones tratadas, que se identifica en cualquiera de las técnicas de imagen empleadas como una captación arterial nodular irregular o en forma de medialuna en la periferia tumoral o inmediatamente adyacente al tumor7,24,29. Si las lesiones tratadas incluyen tumores de más de 3cm, la recidiva es más frecuente.
En caso de conseguirse respuesta completa mantenida a lo largo del tiempo es frecuente ver un cambio en las características de las lesiones, así como una disminución paulatina del diámetro de la zona de necrosis, lo que hace que a veces las lesiones tratadas puedan pasar desapercibidas. En los controles al cabo de meses del tratamiento puede observarse retracción capsular y calcificación de la zona necrosada.
A partir de los 6 meses es más frecuente la aparición de nuevas lesiones intrahepáticas o extrahepáticas, y por ello se aconseja realizar el control de la lesión tratada, del resto del hígado y de todo el abdomen mediante TC o RM, cuya capacidad para identificar nuevas lesiones es mayor que la de la CEUS17. En estos casos hablaremos de recidiva de la enfermedad, aunque la lesión inicial esté en respuesta completa.
Pasados 2 años del tratamiento, y en caso de respuesta completa mantenida, los controles pueden espaciarse en el tiempo, e incluso realizar únicamente un control mediante ecografía cada 6 meses para detectar la aparición de nuevos nódulos. Estos nuevos nódulos, que aparecerán en más del 50% de los pacientes a los 5 años, conllevarán nuevos tratamientos y controles.
Quimioembolización transarterialEl mecanismo de acción de la quimioembolización transarterial es la infusión intraarterial de un fármaco quimioterápico seguido de la embolización de las arterias nutricias tumorales con el objetivo de conseguir una necrosis tumoral mediante el efecto citotóxico del agente quimioterápico más el efecto isquémico derivado de la oclusión vascular de las arterias nutricias tumorales.
Al igual que tras la ablación percutánea, la valoración de la respuesta a la quimioembolización mediante las técnicas de imagen irá inicialmente dirigida a determinar el área de necrosis tumoral, definida como la zona sin captación de contraste, y posteriormente a valorar la disminución del tamaño de las lesiones. Igualmente, el control posquimioembolización inmediato solo está indicado en pacientes sintomáticos para descartar complicaciones.
Se recomienda realizar el primer control para valorar la respuesta a la quimioembolización transarterial pasadas 4 semanas, y las principales técnicas de imagen empleadas son la TC y la RM con contraste27,31,32. Las imágenes obtenidas con estas técnicas son superponibles a las descritas para la ablación percutánea. La necrosis se visualiza generalmente como una zona hipodensa en la TC, y en la RM como una zona hiperintensa en secuencias potenciadas en T1 e hipointensa en las potenciadas en T2, sin captaciones de contraste en el estudio dinámico con contraste. No es infrecuente identificar un fino halo hipercaptante alrededor de la lesión tratada, de origen inflamatorio/fibroso, que no debe interpretarse como persistencia tumoral (fig. 6).
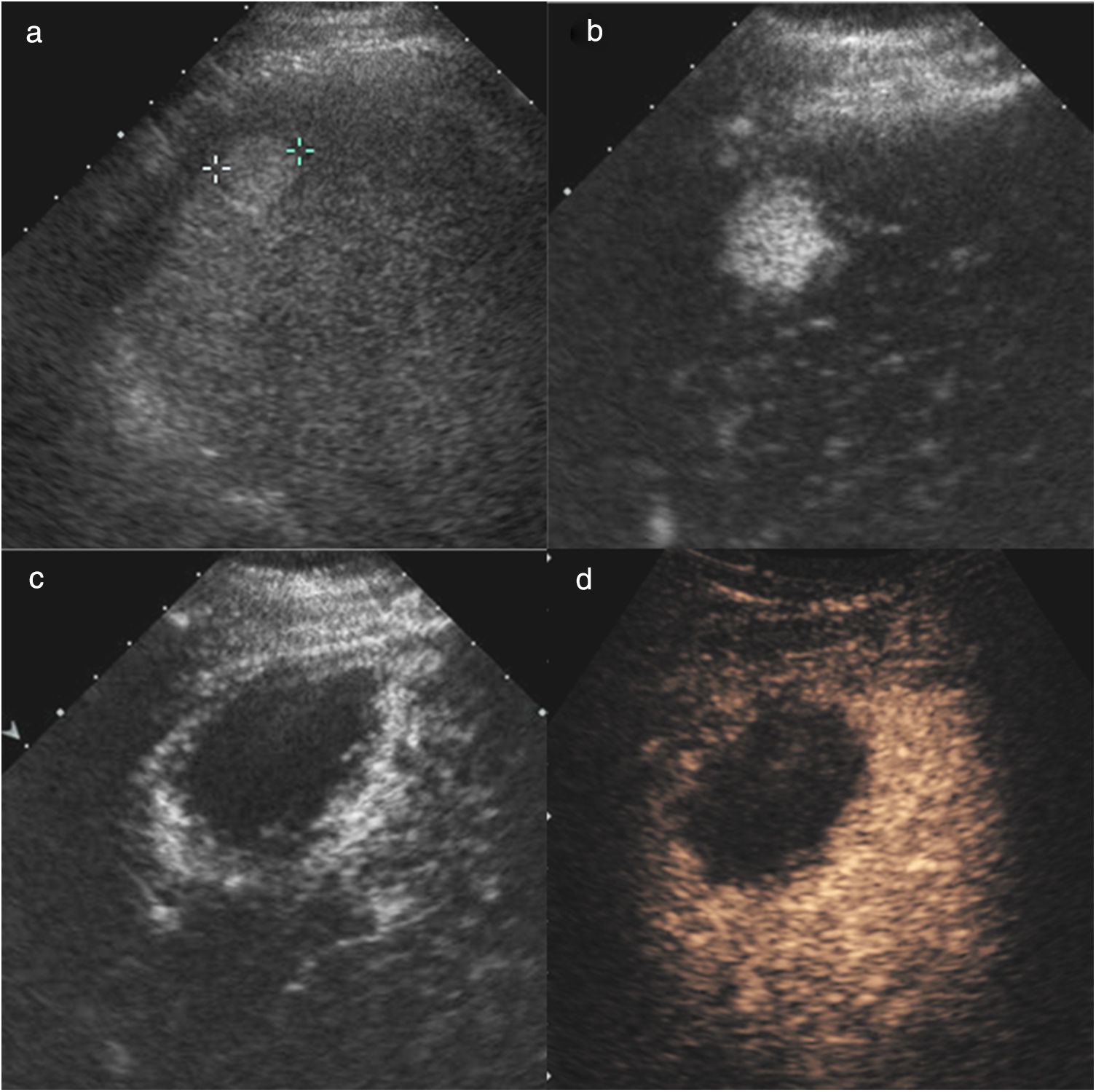
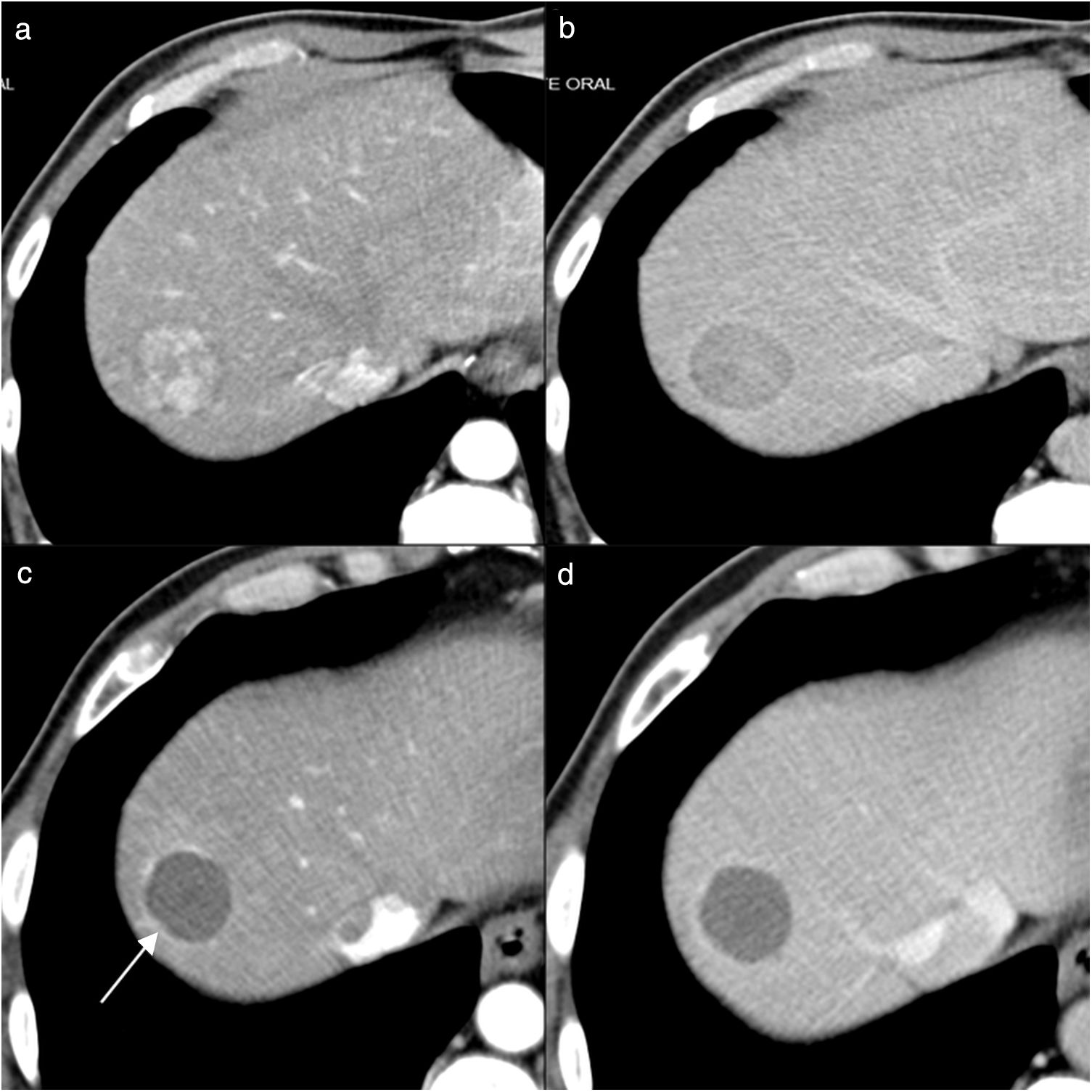
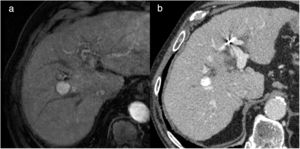
Hombre de 60 años, con cirrosis hepática por virus de la hepatitis C y carcinoma hepatocelular bifocal (34mm en segmento VIII y 30mm en segmento VI), incluido en lista de trasplante, al que se le realiza quimioembolización con partículas cargadas como tratamiento puente. En las imágenes de tomografía computarizada (TC) pretratamiento se visualiza el nódulo del segmento VIII con captación en fase arterial (a) y lavado en fase portal (b). En el control por TC al mes de la primera sesión de quimioembolización se identifica la lesión tratada del mismo tamaño, pero sin captación de contraste en fase arterial (c) ni portal (d), indicativo de respuesta completa. En las imágenes postratamiento se ve un fino halo de captación alrededor de la lesión (flecha en c) que corresponde a cambios inflamatorios postratamiento. La lesión del segmento VI presentaba el mismo comportamiento, y en la pieza del explante se evidenció necrosis completa de las dos lesiones.
La identificación de áreas de captación de contraste nodulares, gruesas e irregulares en el interior de las lesiones tratadas indica tumor viable27,31,32 (fig. 7).
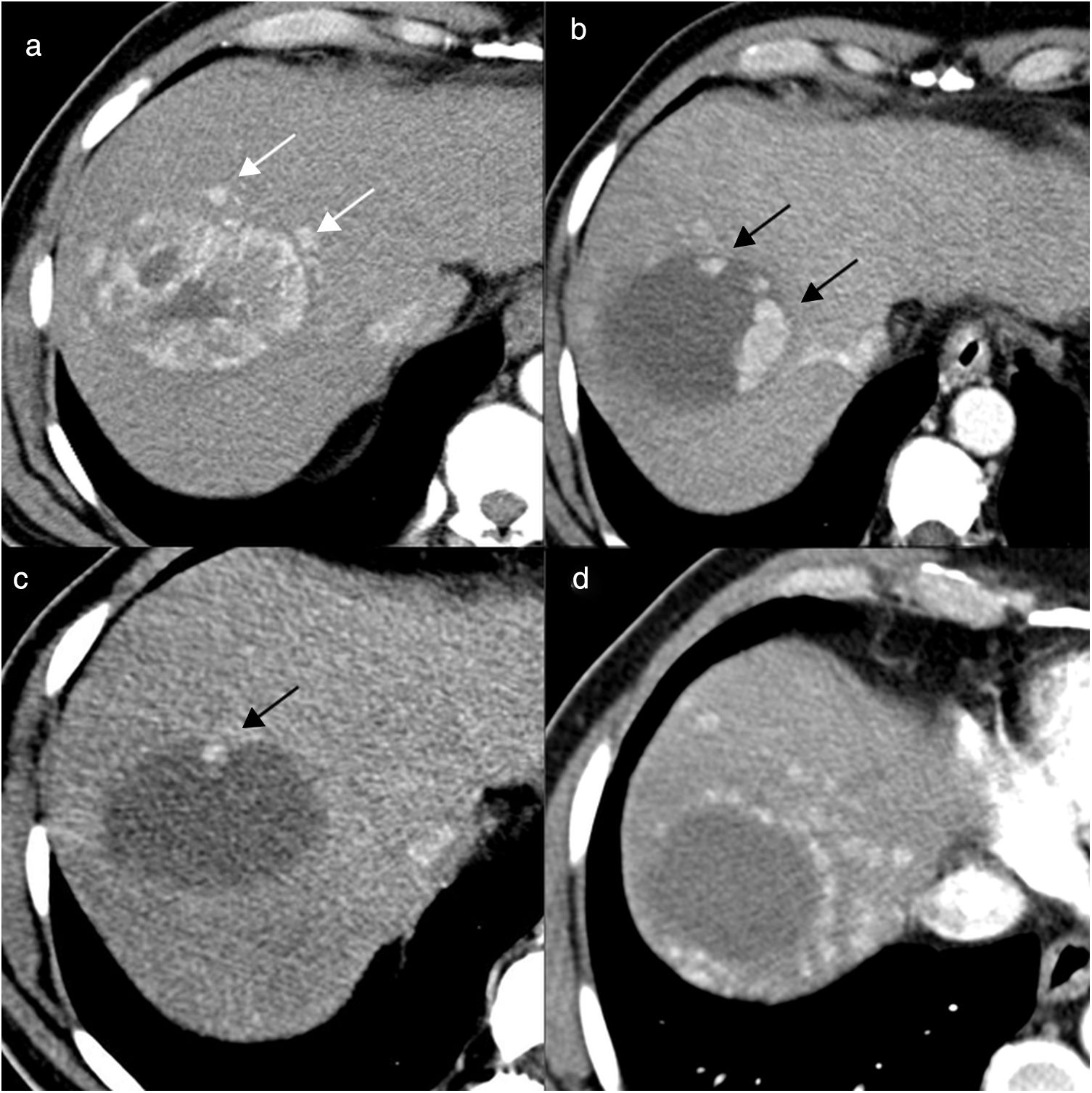
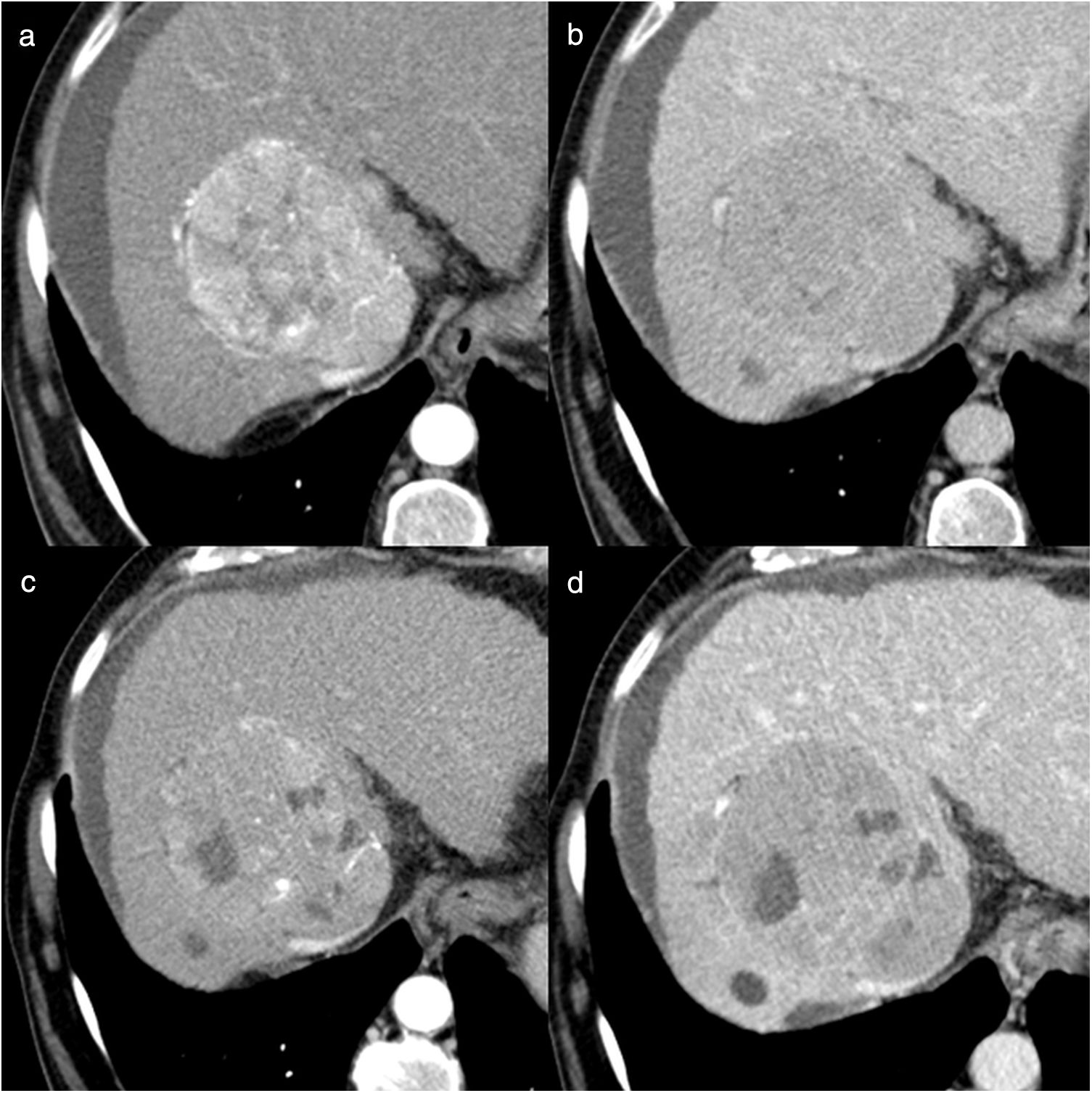
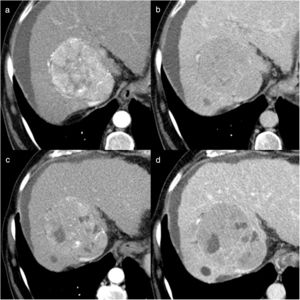
Hombre de 63 años, con cirrosis hepática por virus de la hepatitis C y carcinoma hepatocelular de 7cm en la cúpula del lóbulo hepático derecho, al que se realiza quimioembolización con partículas cargadas. a) Imágenes de tomografía computarizada (TC) con contraste en fase arterial antes del tratamiento donde se identifica una lesión de 7cm con captación heterogénea de contraste endovenoso y algunos nódulos satélites (flechas blancas). b) Control al mes de la primera sesión de quimioembolización; la lesión tratada presenta respuesta parcial, se ve mayoritariamente hipodensa y se identifican algunas áreas de realce nodular en la periferia (flechas negras), indicativas de tumor viable. c) Control 2 meses después de la segunda sesión de quimioembolización, en el que se observa que persiste una pequeña área de realce nodular en la periferia de la lesión (flecha negra). Control a los 3 meses (d) de la tercera sesión de quimioembolización; la lesión tratada no presenta áreas de realce patológico, pero se identifican múltiples nódulos hipervasculares de nueva aparición en todo el hígado, por lo que se considera al paciente en progresión y no es candidato a nuevas sesiones de quimioembolización (progresión intratable).
En el caso de la quimioembolización convencional, se ha descrito que el patrón de acumulación de Lipiodol observado en la TC puede ser útil para evaluar el efecto de la quimioembolización, de forma que una mayor acumulación de Lipiodol dentro del tumor indica una mayor área de necrosis32. Pero la elevada densidad del Lipiodol interfiere en la correcta valoración de posibles focos tumorales hipercaptantes mediante TC y es preferible la utilización de la RM33 (fig. 8). También se ha descrito la utilidad de la CEUS para la valoración de la respuesta después de quimioembolización con Lipiodol, ya que no se ve afectada por la densidad de este contraste22. A diferencia de cuando se utiliza Lipiodol, la quimioembolización con partículas cargadas no produce interferencias en la valoración postratamiento mediante TC.
Hombre de 65 años, con carcinoma hepatocelular tratado con quimioembolización convencional con Lipiodol. a) Imagen de resonancia magnética, secuencia potenciada en T1 tras la administración de contraste endovenoso en fase arterial en el momento del diagnóstico, en la que vemos un nódulo hipercaptante de 18mm en el segmento VIII. b) Control con tomografía computarizada con contraste endovenoso al año del tratamiento. Vemos el Lipiodol hiperdenso acumulado de forma homogénea en el interior del nódulo, que ha disminuido de tamaño, lo que sugiere necrosis completa, pero no permite valorar la existencia de áreas de realce en su interior.
Como en el caso de la ablación, debe tenerse en cuenta la posible aparición de complicaciones, que deben conocerse para ser interpretadas correctamente y no confundirse con persistencia tumoral o recidivas.
A pesar de que con la quimioembolización transarterial se consiguen respuestas radiológicas en más de la mitad de los casos, al ser un tratamiento que se aplica fundamentalmente en pacientes con CHC multinodular, la probabilidad de respuesta completa mantenida es muy baja, y es necesario realizar varias sesiones de tratamiento en muchos casos. Actualmente, no está definido el mejor esquema terapéutico (pauta fija o tratar en caso de detección de actividad tumoral). Por ello, la valoración objetiva de la respuesta es esencial de cara a determinar si es necesario realizar más sesiones de tratamiento y, en ese caso, cuál es el momento óptimo.
En los pacientes que presentan respuesta parcial después de la quimioembolización, si no existe contraindicación, se recomienda realizar una nueva sesión. Mientras que, si un paciente no presenta respuesta radiológica tras dos sesiones de quimioembolización, se considera que el tratamiento ha fracasado y se recomienda considerar al paciente para la siguiente opción terapéutica, que sería terapia sistémica con sorafenib34. Por otro lado, si un paciente que recibió quimioembolización y permaneció en respuesta por periodos prolongados desarrolla una progresión tratable, se considera la opción de realizar una nueva tanda de quimioembolización. En este sentido es de ayuda el concepto de progresión intratable35. Este concepto hace referencia a aquella situación en la que no se recomienda continuar realizando quimioembolización debido a que se ha producido una progresión con una excesiva carga tumoral intrahepática que conlleva una disminución significativa de las probabilidades de respuesta (fig. 7), o bien existe extensión vascular o extrahepática de la enfermedad y/o disfunción hepática y/o síntomas relacionados con el tumor o una contraindicación técnica para realizar el tratamiento.
RadioembolizaciónLa radioembolización se basa en la inyección intraarterial de microesferas cargadas con Itrio-90 (Y90), sin realizar una embolización de las arterias nutricias, lo que conlleva una menor isquemia, minimiza el riesgo de síndrome postembolización y se puede aplicar en situaciones de alteración del flujo portal. El Y90 es un radioisótopo con emisión β pura con una vida media corta, de 2,67 días y una capacidad limitada de penetración en los tejidos, lo que permite dirigir la radiación de forma muy localizada en la zona tumoral y peritumoral preservando el parénquima hepático no tumoral.
Este tratamiento produce una lesión hepática radioinducida que dificulta la valoración de la respuesta. Por un lado, se producen fenómenos de necrosis, hemorragia y edema que pueden aumentar transitoriamente el tamaño del tumor a la vez que aparecen áreas mal definidas de hipercaptación en anillo alrededor del tumor tratado que pueden persistir durante meses, por lo que no se debe confundir con persistencia o progresión tumoral36. También pueden observarse otros cambios por el efecto de la radiación, como la existencia de áreas hipodensas periportales, debido a edema perivascular, o líquido perihepático por el efecto de la radiación sobre la capsula de Glison36. A largo plazo, las lesiones tumorales disminuyen de tamaño a la vez que se observa atrofia del lóbulo tratado e hipertrofia del lóbulo contralateral. El efecto antitumoral es lento, por lo que se debe esperar varios meses para su correcta valoración7 (fig. 9).
Hombre de 52 años, con cirrosis hepática por alcohol y carcinoma hepatocelular multifocal al que se realiza tratamiento con radioembolización. a-d) Imágenes de resonancia magnética (RM), secuencias potenciadas en T1 tras la administración de contraste endovenoso en fase arterial. a) Antes del tratamiento, se identifica un nódulo hipercaptante en el segmento VIII de 23mm. b) Control a los 4 meses del tratamiento; vemos el nódulo tratado sin captación de contraste de tamaño similar, presenta un halo hipercaptante y una gran área triangular de hipercaptación mal definida en el parénquima hepático adyacente. En los controles a los 9 meses (c) y a los 18 meses (d) vemos cómo el nódulo persiste sin captación de contraste y disminuye de tamaño, a la vez que va despareciendo la zona de hipercaptación hepática, y se produce atrofia parenquimatosa y retracción capsular.
Se ha sugerido que la evaluación de la efectividad de este tratamiento debería realizarse combinando criterios basados en la vascularización tumoral, el tamaño del tumor y la actividad metabólica del tumor.
Valoración de la respuesta al tratamiento sistémicoSorafenib es el tratamiento sistémico de primera línea para los pacientes con CHC en estadio avanzado. Es un inhibidor multicinasa que inhibe la proliferación de las células tumorales y la angiogénesis, y causa un enlentecimiento en la progresión tumoral que se refleja en un mayor tiempo a la progresión, pero se desconoce cuál es el mecanismo de acción exacto que determina dicho efecto y el aumento de la supervivencia global de los pacientes37.
Una de las mayores dificultades en estos pacientes es cómo valorar de forma objetiva la eficacia terapéutica y cuándo decidir discontinuar el tratamiento por falta de respuesta.
El impacto del tratamiento sobre la supervivencia es heterogéneo entre los pacientes y pueden verse diferentes patrones de respuesta radiológica entre diferentes lesiones en un mismo paciente, lo que dificulta la valoración radiológica de la respuesta.
No existe un esquema definido para realizar la valoración radiológica de los tratamientos sistémicos, pero habitualmente los pacientes son evaluados cada 2-3 meses mediante TC o RM.
El beneficio clínico del tratamiento con sorafenib es frecuentemente infravalorado porque la tasa de respuesta objetiva según los criterios convencionales es baja. Tanto en el estudio SHARP como en el estudio Asia-Pacífico, que demostraron el beneficio de sorafenib, solo se observó respuesta objetiva según criterios RECIST en un 2-3,3% de los pacientes37,38.
Se ha propuesto la utilización de los criterios basados en la imagen dinámica con contraste endovenoso, como los criterios EASL o mRECIST, pero no está claro que los efectos del sorafenib sobre las lesiones sean recogidos por estos criterios dinámicos. Pueden observarse cambios en la vascularización de las lesiones, y por tanto cambios en el patrón de captación, e incluso la aparición de áreas hipocaptantes o avasculares que sugieren respuesta al tratamiento, pero que no deben confundirse con necrosis (fig. 10). Por ello, no se pueden extrapolar los resultados obtenidos al aplicar estos criterios después de tratamientos locorregionales que sí producen necrosis.
Hombre de 70 años, con cirrosis hepática por esteatohepatitis no alcohólica con carcinoma hepatocelular multifocal en estadio BCLC C en tratamiento con sorafenib. Imágenes de tomografía computarizada (TC) con contraste endovenoso, fase arterial (a) y portal (b), antes de iniciar el tratamiento. Se ve una lesión de 7cm en el lóbulo hepático derecho que presenta captación heterogénea del contraste endovenoso en fase arterial y lavado en fase portal. En el control por TC a los 4 meses, fase arterial (c) y portal (d), vemos una disminución global de la captación de contraste endovenoso en fase arterial y aparición de áreas pseudonodulares más hipodensas en el interior de la lesión, que mantiene un tamaño similar.
Algunos trabajos que comparan los criterios dinámicos con contraste endovenoso con los criterios RECIST observan un aumento de la respuesta objetiva de hasta el 23-51%, pero la mayoría de los trabajos que han valorado el impacto de mRECIST en pacientes con CHC avanzado tratados con sorafenib son retrospectivos o tienen limitaciones metodológicas39,40. Recientemente, el estudio RESORCE analizó la respuesta por RECIST1.1 y mRECIST y no observó diferencias en cuanto a la capacidad de objetivar la respuesta radiológica en estos pacientes41. Las guías europeas recomiendan realizar la valoración objetiva de la respuesta al tratamiento sistémico de acuerdo con los criterios mRECIST y RECIST 1,12. De igual forma, los criterios RECICL, propuestos por el Liver Cancer Study Group of Japan, cuantifican la necrosis tumoral para determinar el efecto del tratamiento, pero también están pendientes de ser validados.
Las técnicas de imagen volumétrica o funcional que tienen en cuenta la perfusión tumoral (TC perfusión42 o CEUS con análisis de perfusión43) podrían tener un papel en la valoración objetiva de la respuesta al tratamiento sistémico, pero la inconsistencia de los resultados y su falta de validación hace que deban considerarse aún técnicas experimentales y no se recomiendan en la práctica clínica para la toma de decisiones7,44.
Como hemos comentado, el impacto del tratamiento sistémico se debe al retraso en la progresión tumoral, aun en ausencia de una reducción en la carga tumoral. Respecto a la valoración de la progresión en pacientes con CHC hay que tener en cuenta algunas peculiaridades. A diferencia de otras neoplasias, el CHC afecta a pacientes cirróticos en los que la aparición de ascitis, trombosis portal o la existencia de adenopatías en el hilio hepático es frecuente. En estos pacientes solo deben considerarse patológicos los ganglios en el hilio hepático de diámetro mayor de 2cm o hipercaptantes35. La trombosis portal maligna debida al CHC suele ser expansiva e hipercaptante, y en casos dudosos debe biopsiarse antes de considerarse maligna, al igual que en los casos con aparición de ascitis debe confirmarse que es tumoral mediante anatomía patológica.
La valoración de la progresión intrahepática es aún más compleja. Sabemos que en pacientes con CHC en estadio intermedio y avanzado la probabilidad de extensión intrahepática de la enfermedad es superior que en pacientes en estados iniciales, y esto significa que la posibilidad de respuesta completa real es inferior. Por un lado, se ha demostrado que las técnicas de imagen infraestiman la enfermedad tumoral hepática si se comparan con los explantes45. Por otro lado, la presencia de fístulas arterioportales produce hipercaptaciones arteriales que simulan persistencia tumoral o nuevas lesiones.
Los criterios de diagnóstico no invasivo de CHC, definidos como hipercaptación en la fase arterial seguido de hipodensidad en la fase portal o venosa, han sido validados en pacientes cirróticos sin tratamiento previo. Este enfoque puede ser problemático en pacientes que han sufrido una o varias terapias transarteriales que alteran el suministro de sangre a los segmentos de hígado tratados7. En el contexto de pacientes con CHC avanzado, la aparición de un nódulo hepático hipercaptante de más de 10mm es altamente probable de CHC46, pero según los criterios mRECIST estos nódulos no pueden valorarse como CHC si no presentan el patrón típico de hipercaptación en fase arterial y lavado en fases venosas o presentan un crecimiento de cómo mínimo 1cm. En estos casos, la progresión debe adjudicarse al momento en que se ve la lesión por primera vez. Esta definición de progresión según los criterios mRECIST es su mayor limitación, y en la práctica clínica la aplicación estricta de estos criterios retrasaría la identificación de progresión. Los criterios BCLC-Refined RECIST consideran progresión a la aparición de un nódulo hepático hipercaptante de más de 10mm pese a la ausencia de lavado en las fases venosas5.
Otro factor que debe tenerse en cuenta es que, si bien el beneficio del tratamiento con sorafenib se relaciona con un retraso en la progresión tumoral, en algunos casos esta progresión puede no impactar negativamente en la supervivencia posprogresión. Recientemente se ha demostrado que el patrón de progresión determina la supervivencia posprogresión47. El aumento de tamaño de las lesiones conocidas o la aparición de nuevas lesiones intrahepáticas no son factores independientes predictores de supervivencia, mientras que la aparición de nuevas lesiones extrahepáticas o de invasión vascular se asocia con una disminución de la supervivencia y, por ende, son pacientes con progresiones asociadas a peor pronóstico. Recientemente, se ha demostrado el beneficio de nuevos fármacos para el tratamiento sistémico de pacientes con CHC avanzado en primera y segunda línea; por tal motivo, la valoración de los patrones de progresión es determinante en el momento de definir la continuidad o no del tratamiento con sorafenib.
ConclusiónActualmente, los pacientes con CHC pueden recibir diferentes tratamientos a lo largo de su enfermedad con la intención de prolongar su supervivencia. Una buena respuesta terapéutica se basa en la correcta selección de los pacientes, y para ello las técnicas de imagen son de gran utilidad, ya que permiten identificar a aquellos pacientes en quienes el tratamiento utilizado ya no es efectivo y pueden beneficiarse de otro tratamiento. Para evaluar correctamente la eficacia terapéutica es esencial conocer el mecanismo de acción de cada tratamiento y el espectro de imagen que estos producen en las distintas técnicas empleadas en su valoración.
Autoría- 1.
Responsable de la integridad del estudio: AD y CB.
- 2.
Concepción del estudio: AD y EB.
- 3.
Diseño del estudio: AD y EB.
- 4.
Obtención de los datos: no procede.
- 5.
Análisis e interpretación de los datos: no procede.
- 6.
Tratamiento estadístico: no procede. 7. Búsqueda bibliográfica: AD y EB.
- 7.
Redacción del trabajo: AD y EB.
- 8.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MR y CB.
- 9.
Aprobación de la versión final: AD, EB, MR y CB.
La doctora María Reig forma parte del consejo asesor de AstraZenca, y realiza habitualmente conferencias promovidas por Bayer, BMS, BTG, Gilead y Lilly.
Los doctores Anna Darnell, Ernest Belmonte y Conxita Bru declaran no tener ningún conflicto de intereses relacionado con este artículo.