Los tumores de células de Sertoli-Leydig (TCSL) son infrecuentes y constituyen el 1% de los tumores de los cordones sexuales-estroma y el 0,1-0,5% de las neoplasias ováricas primarias1-3. Aproximadamente un 75% se presenta en mujeres menores de 40 años, con una edad media de 25 años, aunque pueden ocurrir en cualquier grupo de edad.
CASO CLÍNICOLa paciente, de 62 años de edad, no presentaba antecedentes familiares ni personales de relevancia clínica, con ausencia de antecedentes previos de hipertensión arterial. Fue ingresada por presentar una tumoración abdominal de probable origen ginecológico, insuficiencia renal, anemia y síndrome general, con disminución del peso y astenia. En la exploración general destacaba un hirsutismo generalizado intenso y, a nivel sistémico, destacaba una hipertensión arterial severa con cifras de hasta 230/100 mmHg; su peso era de 60,0 kg. En la exploración ginecológica se apreciaba una tumoración pélvica grande, móvil y desviada a la izquierda, y el resto de la exploración ginecológica era aparentemente normal.
La ecografía abdominal fue informada de probable neoplasia ginecológica y nefropatía cortical crónica, y la tomografía computarizada (TC) de neoplasia ovárica sin adenopatías y sin líquido libre peritoneal; la radiografía de tórax fue normal, sin derrame pleural. En la ecografía ginecológica se identificaba una tumoración sólido-quística de 14 cm, un útero normal con endometrio menor de 3 mm y ausencia de líquido libre peritoneal.
La analítica evidenció anemia importante (hemoglobina de 8,1 g/dl con volúmenes corpusculares normales), elevación de la velocidad de sedimentación glomerular (VSG: 83 mm) y del fibrinógeno (749 mg/dl); el resto de las series y la coagulación eran normales. En la bioquímica destacaba elevación de la urea (227 mg/dl) y de la creatinina (9,1 mg/dl), disminución del hierro (42 µg%) y de la transferrina (163 ml%), elevación de la ferritina (209,3 ng/ml), disminución de las proteínas totales (5,7 g/dl) y elevación del cloro (117 mEq/l), con valores normales de sodio, potasio, calcio, fósforo, albúmina, glucosa, liproproteínas de alta densidad y creatincinasa. En la gasometría arterial se objetivaba una acidosis metabólica (pH de 7,28) con un exceso de base de –10,4 mmol/l. Las serologías de hepatitis B y C y del virus de la inmunodeficiencia humana (VIH) eran negativas. El estudio de inmunidad mostraba ANA, ANCA, anti-ADN, anticuerpos anti-Ro (SS-A), anti-La, anti Sm y anti RNP negativos, y c-3, c-4 y CH-50 normales. Los marcadores tumorales mostraban elevación de antígeno carcinoembrionario (5,2 µg/l) y AFP (12,4 UI/l), y eran normales Ca 12,5 (31,7 U/ml), Ca 19,9 (12,0 U/ml), Ca 15,3 (10,1 U/ml) y beta-HCG (1,6 mU/ml). En la función hormonal se objetivaba unos valores premenopáusicos de FSH (< 0,1 mU/ml), LH (3,35 mU/ml) y 17-beta-estradiol (87,4 pg/ml) y una elevación importante de delta-4-an-drostendiona (7,99 ng/ml) y testosterona (2,13 ng/ml), y eran normales la TSH (2,08 µU/ml), HGH (0,7 ng/ml), progesterona (0,95 ng/ml), tiroxina libre (1,28 ng%) S-DHEA (0,15 µg/ml) y el cortisol (22,4 µg%). El perfil óseo reveló una gran elevación de los marcadores de resorción ósea, con una gran elevación de PTH (1.163 pg/ml), beta-crosslaps (4.210 ng/ml) y osteocalcina (884,8 ng/ml). En el análisis sistemático de orina presentaba proteinuria (500 mg/dl) y glucosuria (100 mg/dl) y en el sedimento, hematíes aislados.
Se inició tratamiento antihipertensivo, hemotransfusión y hemodiálisis, con mejoría leve de la presión arterial, pero sin llegar a la normalización. Se realizó una histerectomía abdominal total con anexectomía bilateral y la biopsia intraoperatoria del ovario izquierdo fue informada de tumor de los cordones sexuales benigno, por lo que se concluyó la intervención.
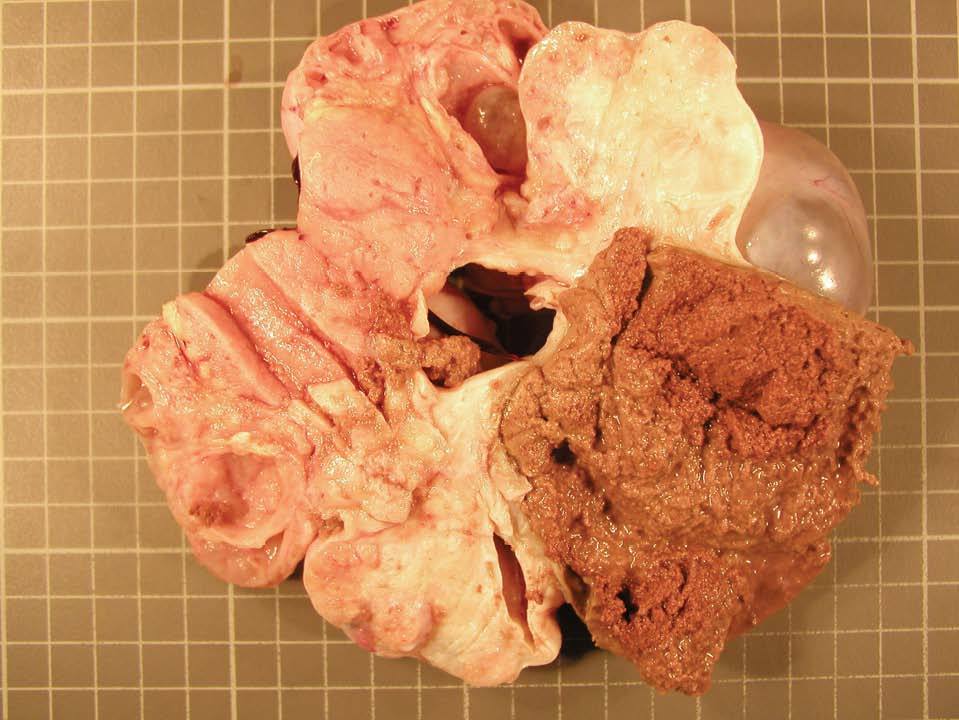
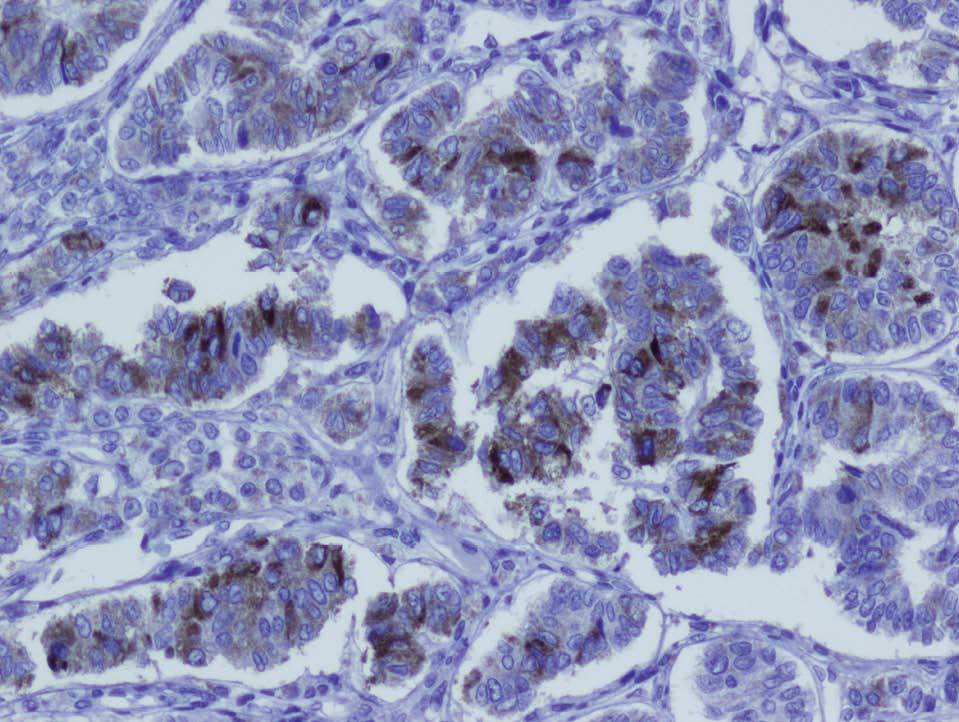
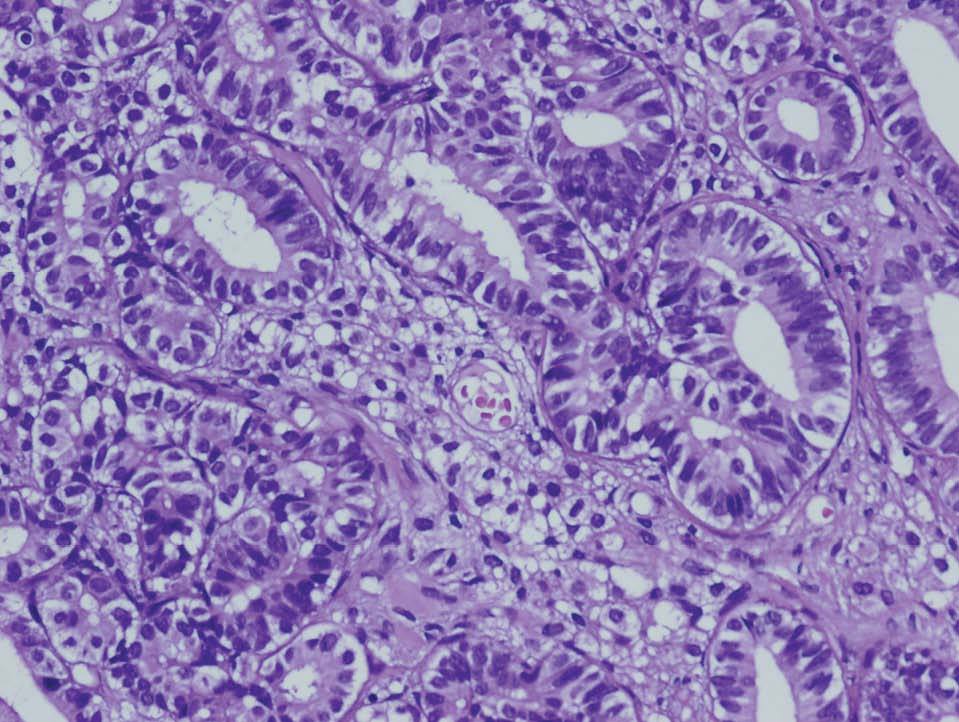
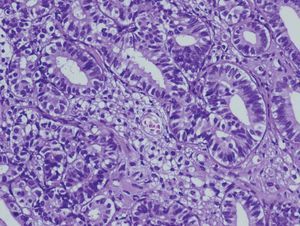
En la histopatología definitiva se describió una tumoración irregular del ovario izquierdo, parcialmente quística, con áreas blanco-amarillentas alternando con zonas hemorrágicas (fig. 1). Microscópicamente, esa tumoración mostraba áreas tubulares clásicas de tipo Sertoli-Leydig (fig. 2), y había de forma focal áreas de diferenciación a células de la granulosa con algunos cuerpos de Call-Exner reconocibles. En las múltiples secciones estudiadas no se identificaron áreas de adenocarcinoma endometrioide. El estudio inmunohistoquímico, realizado en varias áreas de la tumoración, fue positivo para inhibina (fig. 3) y queratinas de bajo peso, y fue negativo para el antígeno epitelial de membrana (EMA) y la queratina 7.
El postoperatorio evolucionó favorablemente, con normalización de los valores de la presión arterial, y fue dada de alta con inclusión en el programa extra-hospitalario de hemodiálisis. Doce días después de la intervención, la analítica hormonal mostró rangos posmenopáusicos normales, con aumento de FSH (40,4 mU/ml) y LH (26,7 mU/ml) y descenso de 17-beta-estradiol (< 20,0 pg/ml) y normalización de los valores plasmáticos de testosterona total (< 20 ng/ml) y delta-4-androstendiona (2,89 ng/ml).
Figura 1. Tumoración seccionada mostrando áreas quísticas alternando con zonas densas blanco-amarillentas.
Figura 2. Zona de tumor de Sertoli-Leydig bien diferenciada con patrón tubular (HE ×20).
Figura 3. Expresión positiva para inhibina en zonas tubulares y estromales de la tumoración (tinción inmunohistoquímica para inhibina ×40).
DISCUSIÓNDentro los tumores de células de Sertoli-estroma se incluyen los tumores de células de Sertoli, los de células de Leydig y los mixtos de células de Sertoli-Leydig. Estas neoplasias se caracterizan por la presencia de estructuras testiculares que producen andrógenos que causan virilización, aunque no todos son funcionalmente activos. Los tumores de células de Sertoli son también estrogénicos y, además, pueden secretar renina, originando hipertensión refractaria e hipocaliemia. Los tumores de células de Leydig son secretores de andrógenos.
Macroscópicamente, como en nuestro caso, los TCSL se presentan como masas sólidas polilobuladas, con una superficie externa lisa y, generalmente, son unilaterales, confinados al ovario y grandes, con diámetros de hasta 16 cm4. Microscópicamente, se identifican cinco subtipos de TCSL: bien diferenciados, moderadamente diferenciados, pobremente diferenciados, reticulares y mixtos. El patrón reticular se asocia con diferenciación hepatocelular y elevación de los valores séricos de alfafetoproteína5. En los tumores moderada y pobremente diferenciados se observan áreas celulares densas con un número aumentado de mitosis. Algunos TCSL contienen otros tejidos heterólogos, como gastrointestinal, cartilaginoso y muscular. La mayoría de los casos publicados son TCSL mixtos moderada o pobremente diferenciados6.
La edad de 62 años de nuestra paciente resultó inusual, ya que la mayoría de los TCSL se presenta durante la segunda y tercera décadas de la vida, aunque pueden ocurrir en cualquier grupo de edad. A menudo, secretan andrógenos (testosterona, 17-hi-droxi-progesterona o androstendiona) que producen virilización (oligomenorrea, amenorrea, atrofia mamaria, hirsutismo, voz profunda, patrón masculino de calvicie, acné e hipertrofia de clítoris) en más de un tercio de los casos7. Frecuentemente, existe dolor abdominal e incremento del perímetro abdominal. La mayoría de las pacientes sintomáticas tienen una masa anexial palpable.
Nuestra paciente presentaba hirsutismo severo, con valores plasmáticos elevados de andrógenos (delta-4-androstendiona: 7,99 ng/ml; testosterona: 2,13 ng/ml), valores plasmáticos elevados premenopáusicos de estrógenos (17-beta-estradiol: 87,4 pg/ml) y valores plasmáticos suprimidos también premenopáusicos de gonadotropinas (FSH: < 0,1 mU/ml; LH: 3,35 mU/ml). Se constató una hipertensión arterial severa (presión arterial: 230/100 mmHg), no conocida previamente, insuficiencia renal también severa (urea: 227 mg/dl; creatinina: 9,1 mg/dl), que precisó de hemodiálisis, y anemia moderada-severa (hemoglobina: 8,1 g/dl), que precisó hemotransfusión preoperatoria. Asimismo, presentaba hiperparatiroidismo (PTH: 1.163 pg/ml; beta-crosslaps: 4.210 ng/ml; osteocalcina: 884,8 ng/ml), ya descrito como cuadro paraneoplásico en ciertos tumores ováricos8, como carcinomas de células claras, coriocarcinomas y teratocarcinomas. Asimismo, mostraba hiperfibrinogenemia (fibrinógeno: 749 mg/dl) y acidosis metabólica (pH: 7,28; exceso de base: –10,4 mmos/l). En los exámenes tomográfico y ecográfico se constató la existencia de una tumoración unilateral de unos 14 cm a nivel anexial izquierdo, lo que motivó la sospecha diagnóstica de un tumor ovárico de los cordonesestroma.
A pesar de su gran tamaño medio, sólo el 2-3% de los TCSL muestran progresión extraovárica en el momento del diagnóstico y menos del 20% presenta un comportamiento maligno, con metástasis o recurrencia7. Las recurrencias son más frecuentes en los tumores pobremente diferenciados o que presentan elementos heterólogos1. Las recurrencias precoces son típicas de los TCSL y sólo el 6-7% se desarrollará después de los 5 años, en contraposición con las de los tumores de células de la granulosa que tienen una historia natural más larga6.
En las mujeres con TCSL que han completado su maternidad se recomienda realizar una histerectomía abdominal con salpingooforectomía bilateral. Cuando se desea preservar la fertilidad o evitar la terapia hormonal sustitutiva, el tratamiento de elección es la ooforectomía unilateral9. La cirugía como actitud terapéutica única es aceptable para las pacientes con TCSL, excepto para las que tienen un tumor metastásico o no metastásico pero pobremente diferenciado o con elementos heterólogos no epiteliales10. La combinación de quimioterápicos basada en platino es efectiva generalmente para estas últimas pacientes, aunque no existen muchos datos publicados6.
Como en los tumores de las células de la granulosa avanzados, el régimen óptimo de tratamiento de los TCSL es desconocido, aunque el más recomendado a menudo es el que incluye bleomicina, etopósido y cisplatino (BEP). Como terapias de segunda línea, otros regímenes alternativos basados en platino incluyen ciclofosfamida, doxorrubicina y cisplatino (CAP); carboplatino, epirrubicina y etopósido; y cisplatino, vinblastina y bleomicina11-15.
Nuestra paciente fue tratada únicamente con histerectomía abdominal total con anexectomía bilateral, ya que la biopsia intraoperatoria del ovario izquierdo fue informada de tumor de los cordones sexuales benigno y la histopatología definitiva de TCSL.
Desde el punto de vista histológico, se planteó el diagnóstico diferencial entre un TCSL y otros tumores que pueden adoptar un patrón sertoliforme. Entre estos tumores, y teniendo en cuenta la edad de la paciente, debemos contemplar el carcinoma endometrioide ovárico, que en ocasiones puede adoptar un patrón sertoliforme16,17 y confundirse con un TCSL, sobre todo si existe una luteinización de células estromales que pueden semejar las células de Leydig. En estos casos, se debe realizar un muestreo adecuado para buscar áreas de carcinoma endometrioide clásico o zonas de componente escamoso asociado a éste que nos orienten hacia este diagnóstico. En nuestro caso, no se encontró componente endometrioide y tampoco transformación escamosa.
El estudio inmunohistoquímico apoyó el diagnóstico de TCSL por ser positivo para inhibina en ambos componentes celulares, ya que se ha descrito en las células luteinizadas del carcinoma endometrioide con patrón sertoliforme, lo que puede llevar a error si se observa únicamente en las células estroma-les16,18. Las queratinas de bajo peso se han descrito como positivas en el TCSL; en nuestro caso mostraron un grado variable, con predominio del patrón paranuclear. La queratina 7 y el EMA fueron negativos en nuestro caso; en este diagnostico diferencial, fueron 2 anticuerpos importantes ya que son marcadamente positivos en el carcinoma endometrioide y sólo se ha descrito positividad para queratina 7 en las áreas retiformes del TCSL18,19.
La supervivencia de las pacientes con TCSL a los 5 años es del 70-90% y depende, sobre todo, del estadio y del grado histológico de diferenciación6. Young et al7, en una gran serie de 207 pacientes con TCSL, encontraron que el grado de diferenciación fue bueno, intermedio y pobre en el 11, el 54 y el 13%, respectivamente, y que el 22% contenía elementos heterólogos. Tras un seguimiento prolongado, el comportamiento maligno de recurrencia o metástasis se observó en el 18% del total de los TCSL, en el 0, el 11 y el 59% de los bien, moderada y pobremente diferenciados, respectivamente, y en el 19% de aquellos que contienen elementos heterólogos.
El seguimiento de las pacientes con TCSL se realiza mediante el examen físico y la determinación de los valores de testosterona cada 3 o 4 meses en los 2 primeros años y cada 6 meses en los 3 años siguientes. El estudio tomográfico se reserva para la evaluación de la sospecha de recidiva clínica o analítica, por elevación de los valores de testosterona. En nuestro caso, el tratamiento antihipertensivo mejoró levemente las cifras de la presión arterial pero fue la simple extracción tumoral la que normalizó completamente sus valores. El postoperatorio fue favorable y se incluyó a la paciente en un programa extrahospitalario de hemodiálisis. La evolución de los valores hormonales fue también favorable y a los 12 días tras la intervención mostró rangos posmenopáusicos normales, con aumento de FSH (40,4 mU/ml) y LH (26,7 mU/ml), y descenso de 17-beta-estradiol (< 20,0 pg/ml) y normalización de los valores plasmáticos de testosterona total (< 20 ng/ml) y delta-4-androstendiona (2,89 ng/ml).
CONCLUSIÓNEl diagnóstico de TCSL se debe sospechar en pacientes que presentan síntomas o signos de exceso de andrógenos, como hirsutismo o virilización, sobre todo si está presente una masa anexial. La cirugía de exéresis es el tratamiento primario, con el fin de obtener tejido para el diagnóstico definitivo, descartar malignidad y realizar el tratamiento oportuno. Puede plantearse el diagnóstico diferencial con los carcinomas endometrioides sertoliformes.
Correspondencia:Dr. A. Fernández Corona. República Argentina, 30, 7.o B. 24004. León. España. Correo electrónico: alfonsofernandezcorona@yahoo.es
Fecha de recepción: 6/9/2006. Aceptado para su publicación: 16/1/2007.