La detección de la sobreexpresión de la proteína p16 mediante técnicas inmunohistoquímicas e inmunocitoquímicas es un valor seguro en la identificación de lesiones epiteliales cervicales de alto grado, sirviendo al mismo tiempo para detectar aquellas lesiones de bajo grado cito o histológico con integración viral, firmes candidatas a la progresión a lesión de alto grado.
Material y métodosHemos evaluado la eficacia de la detección inmunohistoquímica e inmunocitoquímica de la sobreexpresión de la proteína p16 sobre muestras de cérvix uterino. Para ello hemos recurrido a 58 casos de biopsias de cérvix y 53 citologías con diagnóstico de positividad para la infección por el virus del papiloma humano.
ResultadosHemos observado cómo el 100% de las lesiones de alto grado eran teñidas mientras que sólo un porcentaje de las de bajo grado hacían lo propio. Los resultados obtenidos en citología fueron extrapolados a las citologías (correspondientes a las mismas pacientes que las biopsias) obteniendo similares resultados.
ConclusionesLa identificación de la sobreexpresión de la proteína p16 por métodos inmunocitoquímicos sobre citologías cervicovaginales convencionales muestra resultados superponibles a los obtenidos sobre muestras histológicas.
Detection of p16 expression by immunohistochemistry and immunocytochemistry is a good standard for the identification of high-grade cervical epithelial lesions and low-grade lesions with DNA HPV viral integration (with a tendency for progression).
Material and methodsWe evaluated p16 expression in 58 HPV-positive cervical biopsies and 53 conventional cytological samples that tested HPV-positive with immunohistochemical and immunocytochemical techniques.
ResultsAll high-grade lesions were positive for p16 while only some of the low-grade lesions were positive. The results obtained in histological samples could be extrapolated to cytological samples from the same patients.
Conclusionsp16 expression in conventional cytology provides similar results to those in histological samples.
Comenzaremos este trabajo definiendo qué es p16 para, a continuación, valorar sus utilidades prácticas en el algoritmo del diagnóstico y tratamiento del cáncer de cérvix .
La p16 es una proteína codificada por el gen supresor tumoral CDKN2A, localizado en el cromosoma 9, y actúa como inhibidor de las cinasas dependientes de ciclinas que desaceleran el ciclo celular actuando en el punto de control fase G1-fase S mediante la inactivación de la proteína codificada por el gen del retinoblastoma (pRb). Existe, por tanto, una relación recíproca entre pRb y p16. Se ha demostrado asimismo que en la patogenia del cáncer de cérvix, la integración del material genético viral en el genoma de la células huésped y la consiguiente expresión de los productos de los genes virales E6 y E7 determinan una inactivación tanto de p53 como de pRb. Esta inactivación se corresponde con una sobreexpresión de p16 que puede ser detectada mediante técnicas inmunohistoquímicas (e inmunohistoquímicas), poniendo de manifiesto la integración del genoma viral en el genoma de las células del huésped.
No podemos ni debemos sorprendernos de que p16 sea una realidad en el quehacer diario de la mayoría de los laboratorios de Anatomía Patológica de nuestros hospitales. Introducida paulatinamente en los largos paneles de anticuerpos debido al desconocimiento de sus funciones y posibilidades, la experiencia y la extensa literatura en torno a la misma parecen abrir las puertas para su uso no sólo en el ámbito de las lesiones ginecológicas asociadas con la infección por el virus del papiloma humano (VPH) sino que sus posibilidades parecen crecer a diario (melanoma, cáncer oral, vías respiratorias altas, laringe, etc.).
Es por ello por lo que hemos querido dar un paso adelante en nuestros pequeños centros, en un intento de no quedarnos atrás en el uso de armas diagnósticas de gran utilidad para el ejercicio de nuestra profesión, que al mismo tiempo sirven como un importante factor pronóstico en el manejo de lesiones preinvasivas e invasivas de cuello uterino, su aplicación fundamental a día de hoy.
Si bien la citología líquida está comenzando a florecer en aquellos centros con volumen y voluntades directivas receptivas al cambio, son muchos los centros que aún disponen únicamente de la eficaz citología ginecológica convencional para realizar el cribado poblacional del cáncer de cérvix, con lo cual sería de agradecer una adaptación de la técnica inmunocitoquímica a tal medio. La mayoría de estudios de p16 hacen referencia a su aplicación sobre muestras histológicas o citológicas (citología líquida) siendo escasas las referencias a los resultados obtenidos tras la aplicación de la técnica a extendidos citológicos convencionales. Es por ello por lo que hemos llevado a cabo el presente estudio, para valorar la eficacia de la técnica sobre extendidos citológicos convencionales y comparar los resultados con los obtenidos tras realizar la biopsia de confirmación, siendo esta última estudiada mediante tinción de rutina con HE y con la aplicación de la técnica inmunohistoquímica de p16 (determinación de la sobreexpresión de p16).
Material y métodosHemos tomado como referencia una muestra constituida por 58 biopsias y 53 citologías ginecológicas convencionales. De las 58 biopsias, 28 fueron diagnosticadas de CIN I, 7 de CIN II, 11 de CIN III, una de adenocarcinoma y una negativa para lesión intraepitelial o invasiva, que nos sirvió de control de la técnica. En cuanto a las citologías, 14 fueron diagnosticadas de HSIL, 8 de ASC, 29 de LSIL, una de AGUS y una de atrofia. La edades de las pacientes a las que corresponden las muestras analizadas son las siguientes: 6 pacientes con edades comprendidas entre 10 y 20 años, 20 pacientes con edades comprendidas entre 21 y 30 años, 17 pacientes con edades comprendidas entre 31 y 40 años, 11 pacientes con edades comprendidas entre 41 y 50 años y 4 pacientes con edades comprendidas entre 51 y 60 años. A todas las muestras se les ha aplicado una tinción inmunohistoquímica o inmunocitoquímica para detectar la sobreexpresión de p16 (CINtec® Histology y CINtec® Cytology). Las tinciones se han llevado a cabo con un inmunoteñidor VENTANA BENCHMARKT XT® utilizando el siguiente programa:
- 1.
Para las muestras histológicas:
- a)
Desparafinado: EZ prep®: 30min a 76°C.
- b)
Acondicionamiento celular: CC1, suave 30min.
- c)
Incubación del anticuerpo a 37°C.
- d)
Titulación p16: 32min.
- e)
Contratinción con hematoxilina: 4min.
- f)
Postcontratinción: Bluing Reagent®: 4min
- a)
- 2.
Para las muestras citológicas, la única variante consiste en el lavado con Reaction Buffer (ultrawash) tras la titulación del anticuerpo.
Para procesar las citologías, se procedió a su desmontado y destinción utilizando el siguiente protocolo:
- 1.
Incubación en xilol de los portaobjetos teñidos con Papanicolaou, el tiempo suficiente para que el cubreobjeto se desprenda (2 o 3 días como media, dependiendo de la antigüedad de la muestra). En todos los casos se dejó que el cubreobjetos se desprendiera espontáneamente, sin forzar en ningún caso el despegamiento, circunstancia que podría favorecer la pérdida de material celular.
- 2.
15min en xilol fresco con el objeto de eliminar el medio de montaje residual.
- 3.
5min en alcohol etílico al 99% de concentración.
- 4.
5min en alcohol etílico al 96% de concentración.
- 5.
5min en alcohol etílico al 70% de concentración.
- 6.
5min en alcohol etílico al 50% de concentración (equivalente al primer paso del protocolo de CINtec Cytology).
- 7.
5min en agua desionizada.
- 8.
Transferencia de los portaobjetos a la solución de recuperación antigénica precalentada (95°C) e incubación durante 10min a 95°C.
- 9.
Reposo, dejando enfriar las muestras a temperatura ambiente durante 20min después de proceder a la tinción con CINtec Cytology.
Posteriormente, tras la lectura y recopilación de resultados, tomamos una muestra de portaobjetos teñidos con p16 y realizamos una contratinción con Papanicolaou con el fin de evaluar el contraste de tinciones y su validez a la hora de la lectura.
La lectura de resultados fue llevada a cabo por 2 patólogos de manera alternativa. Los resultados obtenidos tras la lectura de los extendidos citológicos fueron posteriormente contrastados con los obtenidos en las biopsias correspondientes a dichas pacientes.
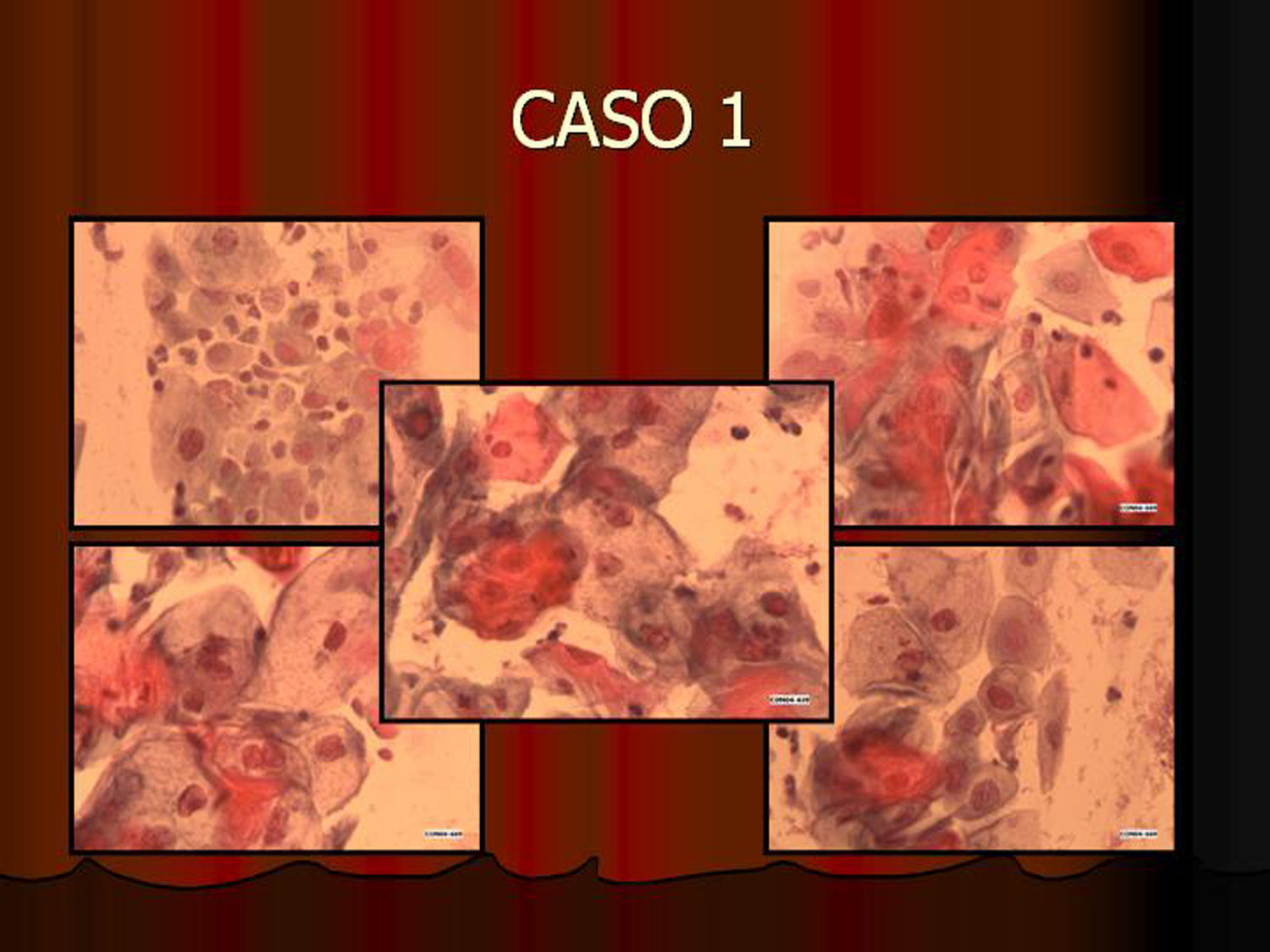
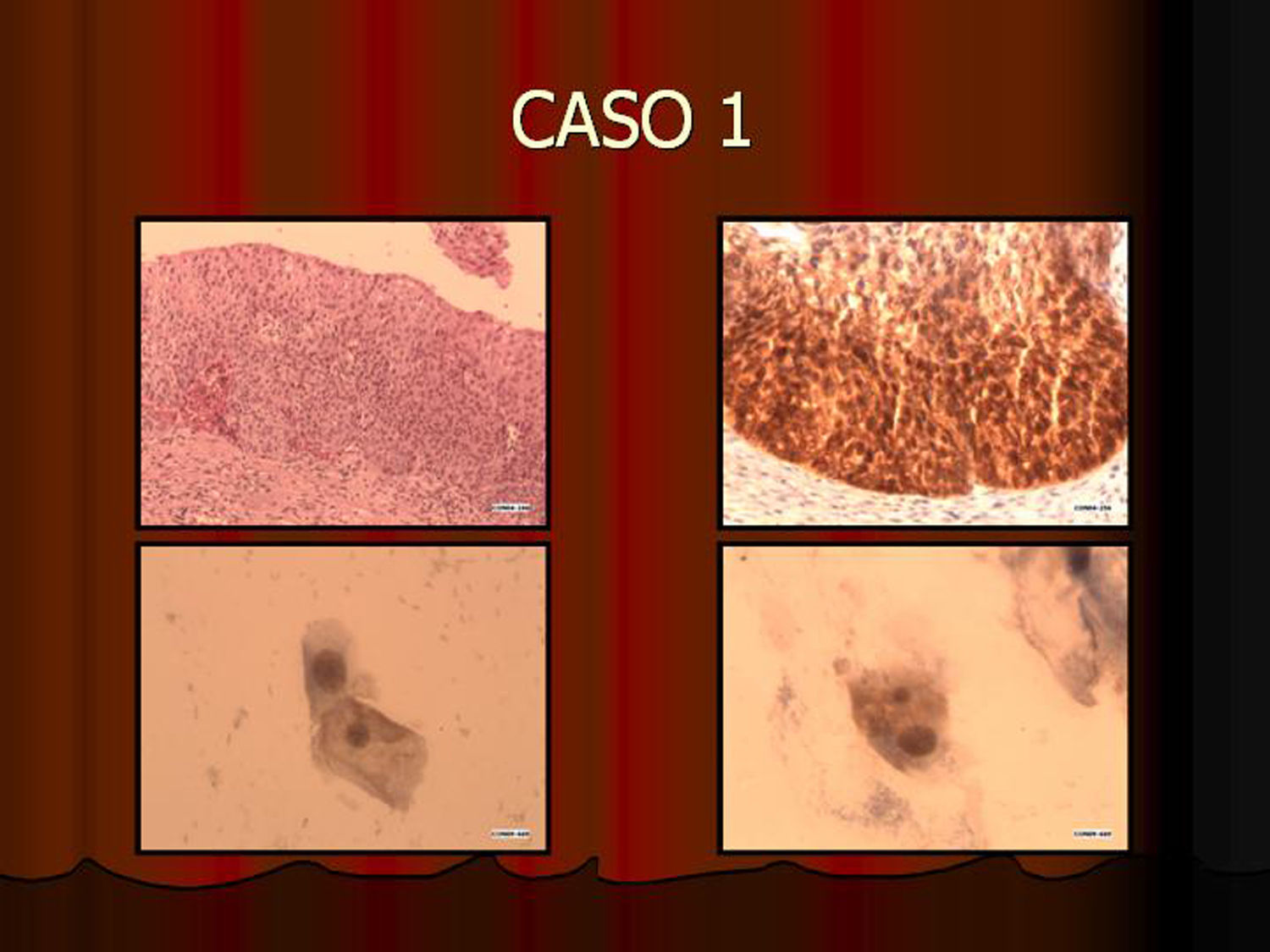
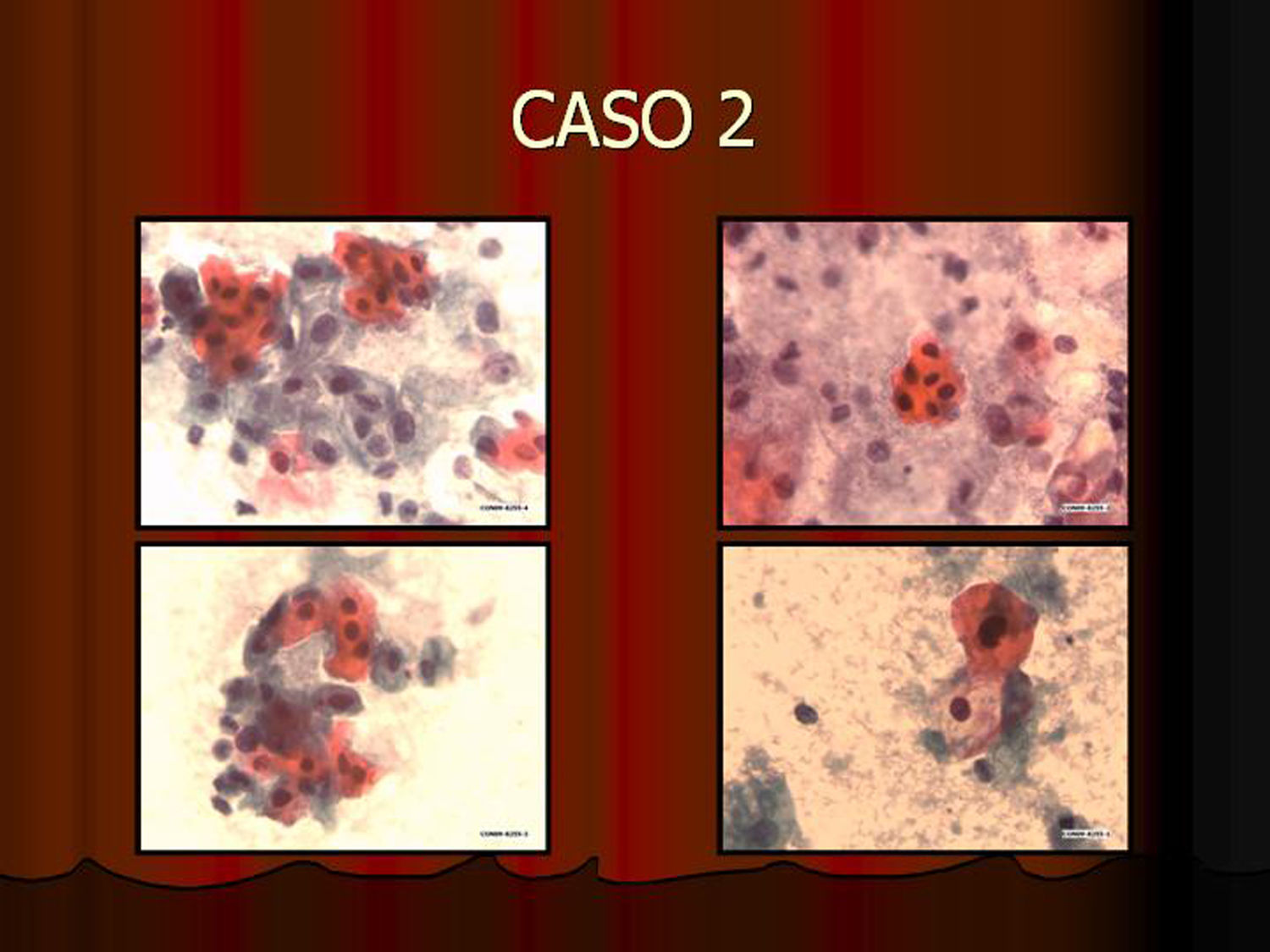
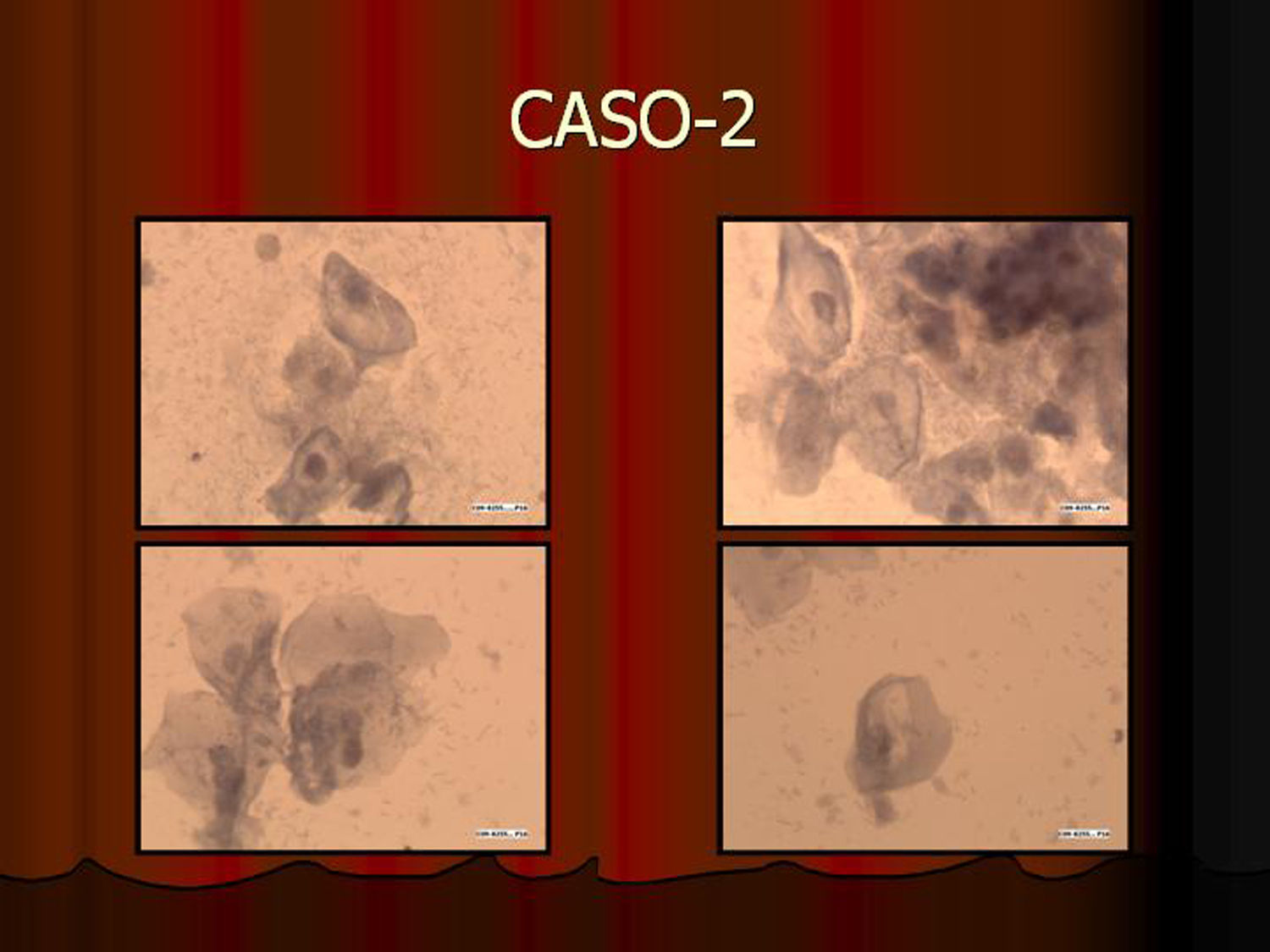
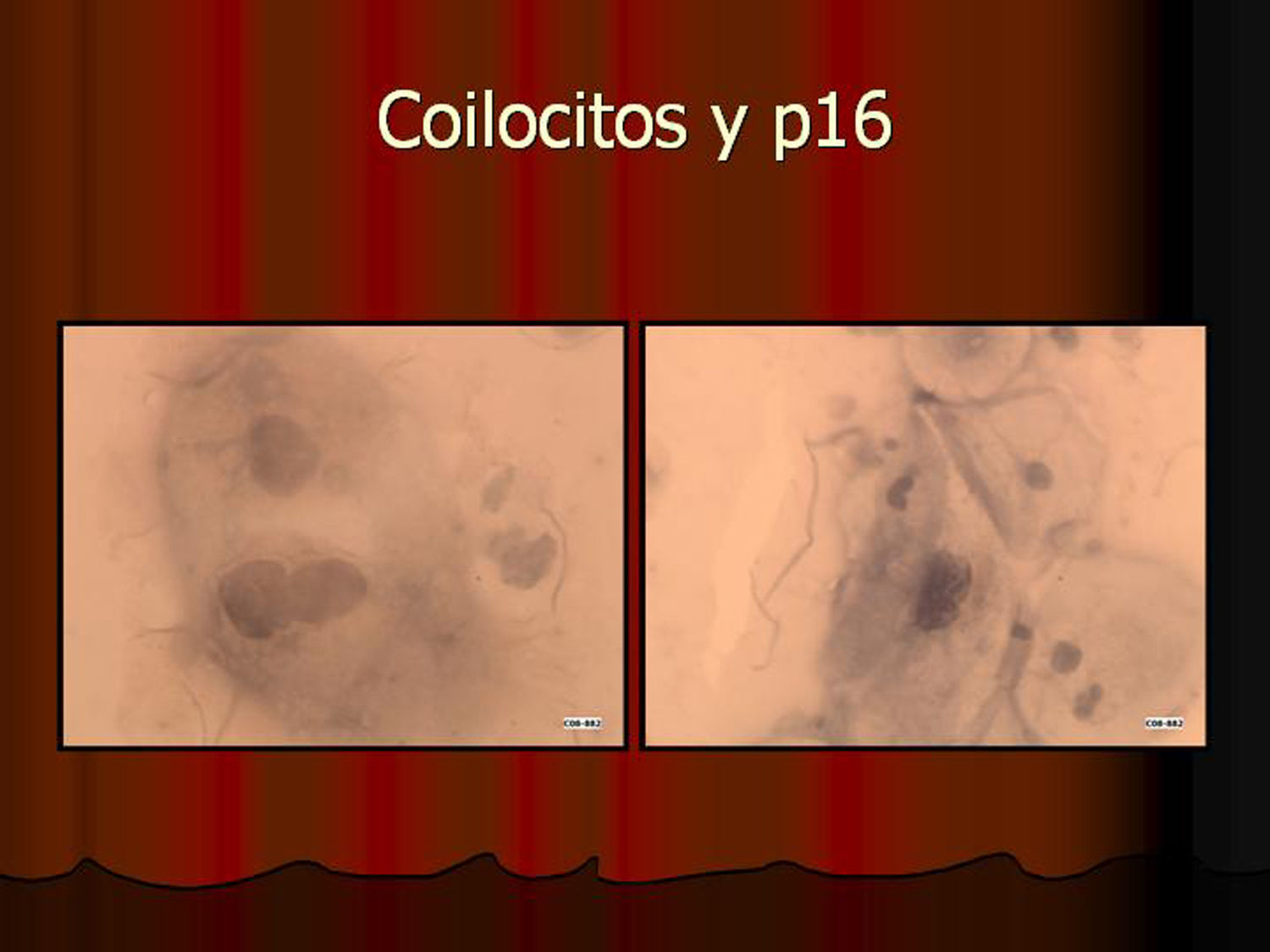
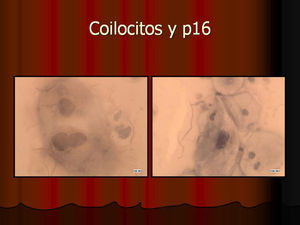
ResultadosEn contra de las reticencias surgidas en un primer momento, pudimos comprobar que existía muy buena correlación entre los hallazgos citológicos y los histológicos. La lectura de los extendidos citológicos se llevó a cabo tal como se refiere en la literatura especializada (tal como nos la comunicó la propia empresa comercial), es decir, considerando positiva la tinción del núcleo y/o del citoplasma. Lógicamente, la lectura tintorial fue interpretada en todo momento junto a la morfología exhibida por las células, de modo que se pudieron constatar positividades en células no displásicas. Este hecho parece lógico si tenemos en cuenta que la vía celular que condiciona la sobreexpresión de p16 puede ser activada por otros mecanismos distintos a la propia infección-integración del genoma del VPH. Así, existe positividad focal en algunos casos de metaplasia escamosa madura, en placas atróficas y en escasas células benignas inespecíficas. En un principio, nos llamó la atención la negatividad de la inmunotinción en células con claros cambios coilocíticos. Sin embargo, este hecho no debe sorprendernos pues, aun cuando el coilocito muestre clara atipia nuclear, estaremos ante un cambio morfológico que expresa infección viral pero no integración genómica. Es por ello por lo que la prueba no es válida para detectar simples infecciones virales en las que el genoma del virus del papiloma humano no está integrado en el de la célula huésped.
Infección viral no es lo mismo que integración viralTodas las muestras (100%) previamente diagnosticadas como lesión de alto grado (las 7 lesiones diagnosticadas como CIN II, las 11 diagnosticadas como CIN III [carcinoma in situ y la lesión diagnosticada como adenocarcinoma]) mostraron positividad inmunohistoquímica para p16. Asimismo, todas las lesiones diagnosticadas como HSIL con la tinción de Papanicolaou y 2 de las 8 lesiones diagnosticadas como ASC mostraron positividad con la tinción inmunocitoquímica para p16. Esta positividad en lesiones previamente diagnosticadas de ASC refleja una de las principales aplicaciones de la técnica al destacar e identificar lesiones que o bien son realmente de alto grado o al menos muestran integración viral que predispondrá a progresión. Las muestras usadas como control negativo no mostraron positividad. En cuanto a las lesiones de bajo grado, 5 de ellas mostraron positividad, hecho que demuestra integración viral y capacidad de progresión lesional.
DiscusiónComo bien sabemos, muchas de las lesiones intraepiteliales de bajo grado, «regresan» o se «aclaran». En cambio, existe un pequeño porcentaje de las mismas que progresa a lesiones de alto grado. Para que esto ocurra debe de existir un cambio celular y sabemos que es precisamente la integración del genoma del virus del papiloma humano el que activa esta secuencia de modo que podemos considerar a dicho virus como una causa necesaria aunque no suficiente para la progresión de la enfermedad. Considerando este escenario, es lógico suponer que al realizar tinciones con el fin de identificar sobreexpresión de p16 (integración viral) podemos observar tanto positividades como negatividades si nos referimos a las lesiones de bajo grado: aquellas positivas seguramente progresen y las negativas pueden o no regresar. Por tanto, estamos introduciendo un nuevo factor pronóstico en la identificación de lesiones tempranas con capacidad de progresión.
Por regla general, los protocolos más utilizados para el manejo de lesiones de bajo grado abogan por una postura expectante, repitiendo estudios citológicos a cortos intervalos de modo que la sucesiva positividad para lesión intraepitelial condicionará la realización de una biopsia que confirme el diagnóstico. La identificación de células morfológicamente diagnósticas de lesión de bajo grado, positivas para la determinación de sobreexpresión de p16 debería cambiar esta actitud expectante y orientar el algoritmo diagnóstico a la realización de una biopsia, evitando la consecuente demora en lesiones que seguramente progresarán a alto grado. Por supuesto, las lesiones de alto grado muestran tanto citológicamente como histológicamente, intensa positividad para p16 y serán candidatas para biopsia.
Centrémonos en la aplicación de p16 al estudio de extendidos de citología ginecológica convencional, campo menos estudiado que el de la aplicación de la técnica a la citología líquida o a la histología. Debemos reconocer que no se trata de una técnica sencilla pues ésta va a depender en gran medida de la calidad de los propios extendidos a estudiar, de su conservación y de su manejo. Obviamente, estamos ante un material que a priori mostrará resultados de peor calidad pero que, sin embargo, nos puede sorprender si atendemos a los protocolos antes expuestos. Cuando estamos ante un extendido con una lesión de alto grado, las células neoplásicas destacarán rápidamente del fondo, su tinción será intensa y homogénea y su delimitación de las células adyacentes podrá realizarse sin dificultad. Asimismo, la propia tinción nos puede servir como medio de selección celular, es decir, podemos dirigir el objetivo directamente a las células teñidas, despreciando aquellas que no se tiñan (si bien ésta es una afirmación recogida en distintos trabajos, creemos que es una práctica arriesgada, que no debería sustituir al clásico «barrido» o «muestreo»). El estudio morfológico será decisivo en la clasificación lesional. El mismo esquema podemos utilizarlo al referirnos a lesiones de bajo grado con la salvedad de que muchas células con lesión de bajo grado serán negativas para la tinción por las razones previamente expuestas. No obstante, en aquellos clásicos casos, difíciles, en los que el citólogo no se define entre lesión de bajo o alto grado, la técnica puede ser de gran utilidad para asignar la lesión a uno u otro grupo.
Las precauciones que debemos tener presentes en todo momento son, en definitiva, similares a las que se deben tener presentes a la hora de evaluar un frotis teñido con Papanicolaou: atender a la morfología y realizar los diagnósticos diferenciales pertinentes.
ConclusionesCreemos que la determinación de la sobreexpresión de la proteína p16 en muestras de citología ginecológica convencional es una técnica útil a la hora de manejar lesiones intraepiteliales de cérvix y a la de planificar las acciones diagnósticas y terapéuticas pertinentes. Remitámonos al algoritmo diagnóstico del cáncer de cuello uterino. Aquellas pacientes con resultados negativos volverán al programa de cribado siguiendo las directrices ajustadas a su edad y antecedentes. A las pacientes con lesiones de alto grado se les realizará el estudio histológico pertinente que determine o no la conización u otras vías terapéuticas. No obstante, podemos aplicar una tinción con p16 de modo que un resultado positivo nos confirme nuestro diagnóstico, tanto citológico como histológico. En cualquier caso, es en el paso intermedio donde más utilidad cobrará la determinación de la sobreexpresión de p16. Hasta ahora, aquellas pacientes con diagnóstico de ASCUS o LSIL eran vigiladas mediante citologías realizadas en intervalos más cortos y sólo en caso de persistencia se realizaba una biopsia. Teniendo en cuenta que infección e integración viral no son sinónimos, la demostración de positividad para p16 puede seleccionar a un grupo de pacientes cuyas lesiones, caracterizadas dentro del grupo de ASCUS, AGUS o LSIL, seguramente progresarán a lesiones de alto grado; por el contrario, aquellas pacientes en las que p16 sea negativo seguramente asistirán a un aclaración de sus lesiones (están infectadas pero no hay integración viral)1–4.
Por todo lo dicho, p16 se presenta como una alternativa a la determinación del genoma vírico (del VPH) mediante técnicas de (reacción en cadena de la polimerasa (PCR) o hibridación in situ. Dichas determinaciones demostraban la presencia o ausencia de infección y al mismo tiempo aportaban cierto valor pronóstico al poder agrupar el genotipo vírico aislado con grupos de alto y bajo riesgo. No obstante, se ha demostrado que genotipos de bajo riesgo pueden dar lugar a lesiones de alto grado y viceversa. En este sentido, p16 demuestra una ventaja en el momento en que una integración del genoma vírico significa irreversibilidad lesional. No es de extrañar, pues, que la actitud más prudente es realizar el estudio histológico pertinente al obtener positividad en la determinación de la sobreexpresión de p165–9.
Son muchos los trabajos que colman la literatura médica acerca la aplicación de la técnica a lesiones intraepiteliales o invasivas de cuello uterino, muchos de ellos de rabiosa actualidad. Todos ellos coinciden en afirmar las virtudes pronósticas de su aplicación10–19. Queremos destacar en este punto los que quizás sean los estudios más importantes, por su magnitud y rigurosidad, en cuanto a la valoración de la aplicación de la técnica a muestras de cérvix: estudio PALMS (Primary ASC-US, LSIL Marker Study: estudio diagnóstico multinacional, multicéntrico y prospectivo un una muestra poblacional de más de 27.000 pacientes), estudio EEMAPS (European Equivocal or Mildly Abnormal Pap Cytology Study: 200 casos de CIN II con confirmación histológica procedentes de 776 casos diagnosticados citológicamente de ASCUS y LSIL) y el estudio Wolfsburg Pap/HPV co-testing Study: 4.400 mujeres mayores de 30 años, comparando la prueba de p16 con la propia determinación del VPH). Se trata de estudios que coinciden en resultados con los obtenidos con nuestra humilde valoración.
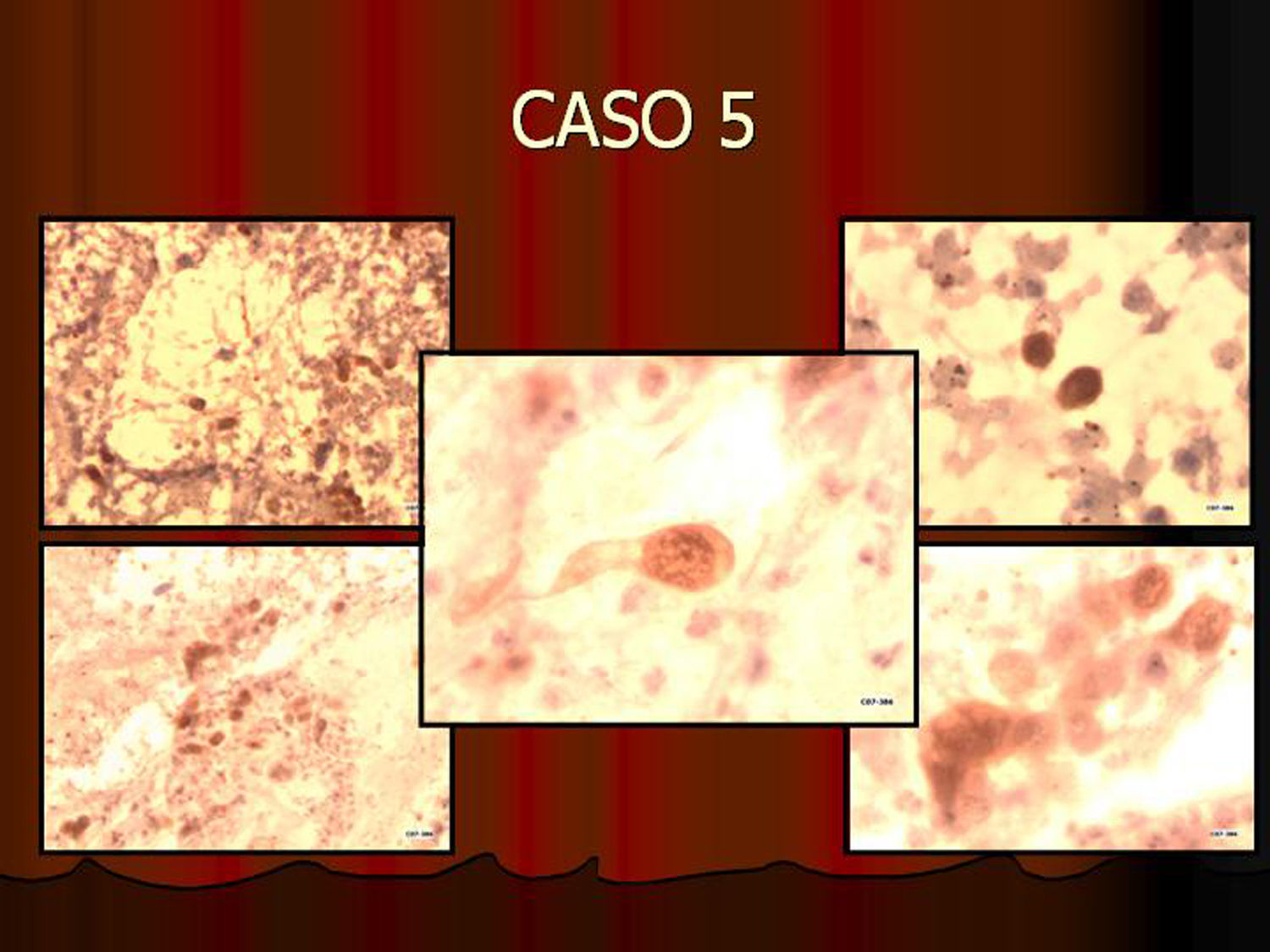
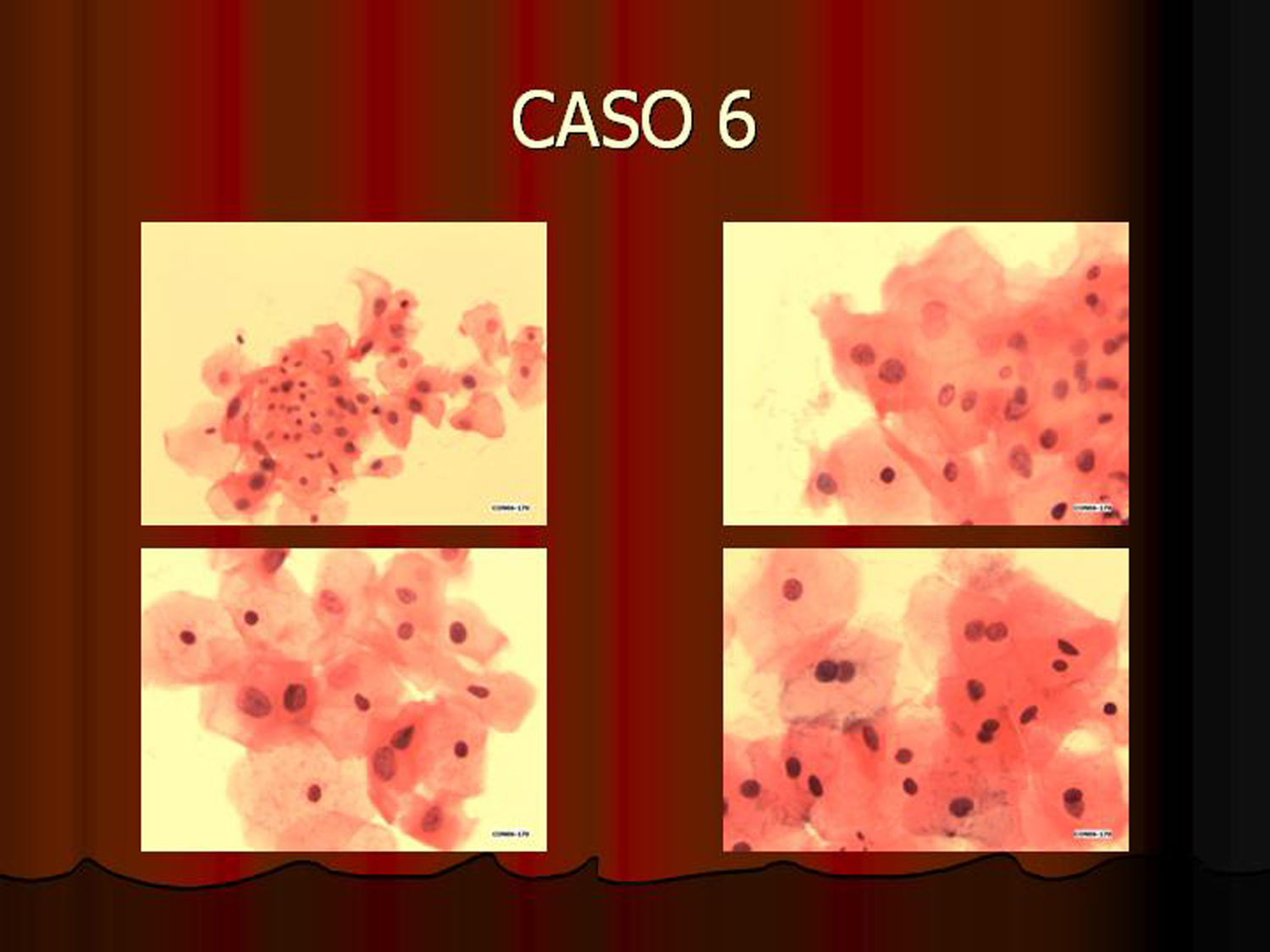
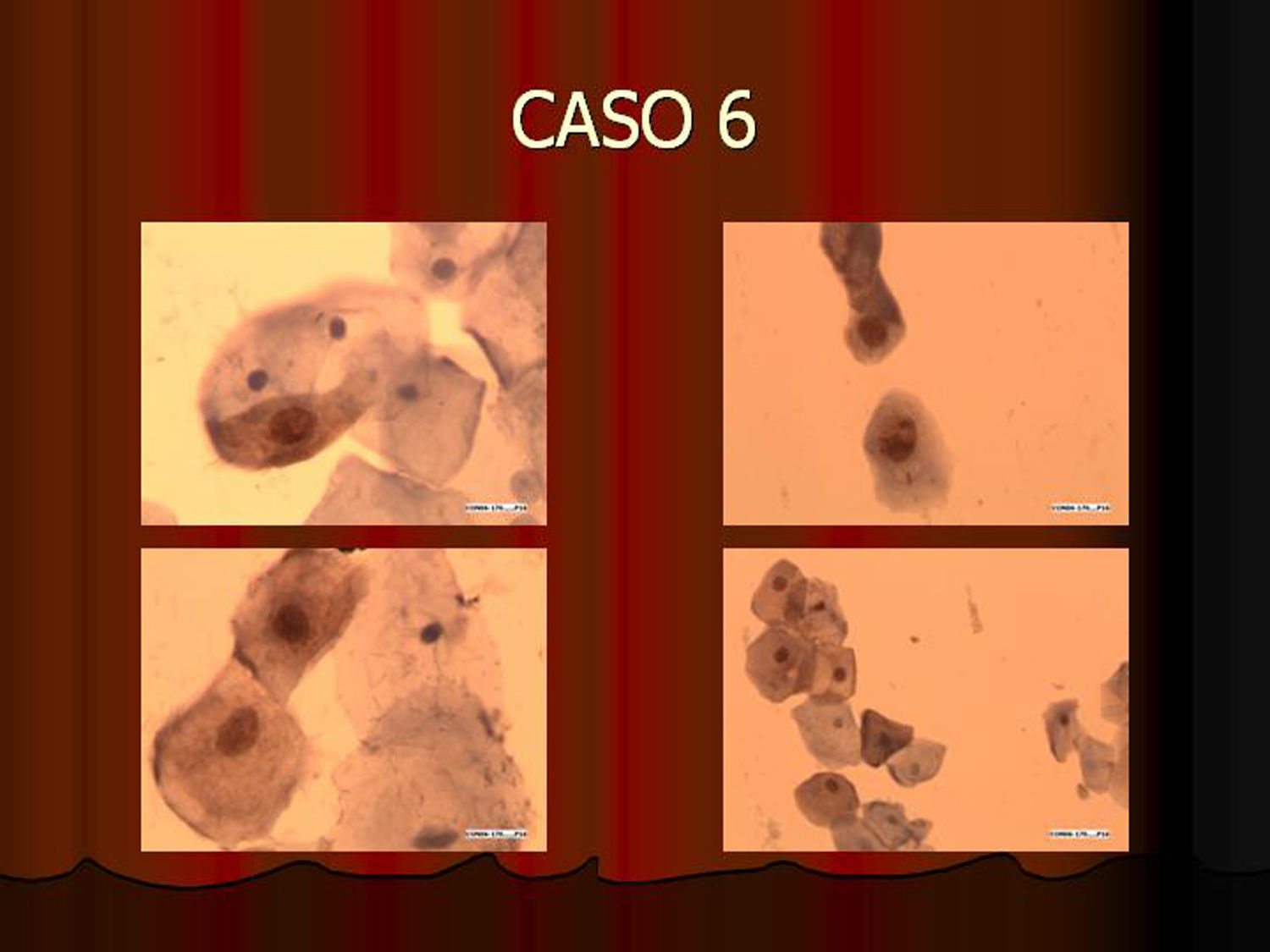
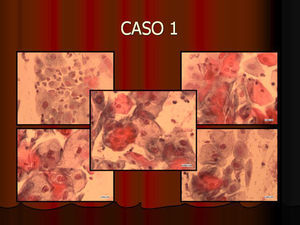
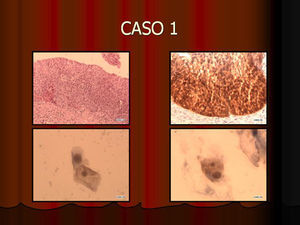
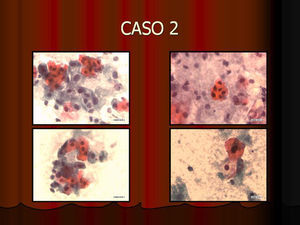
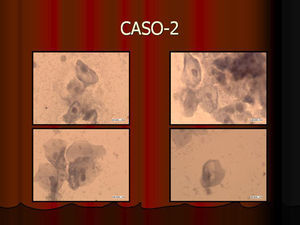
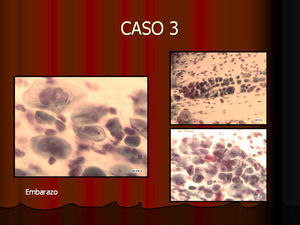
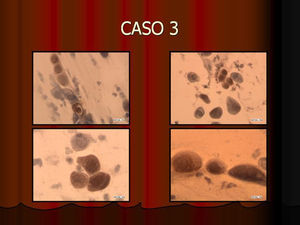
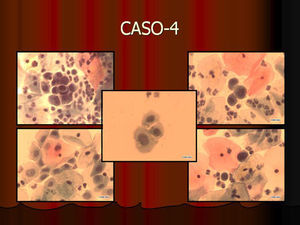
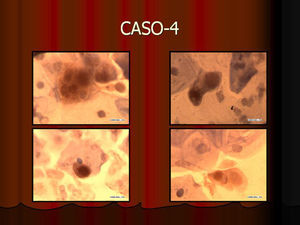
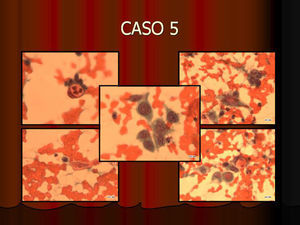
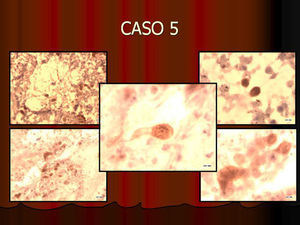
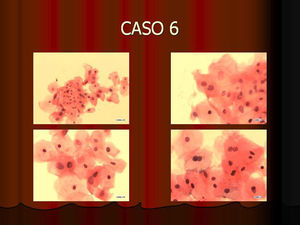
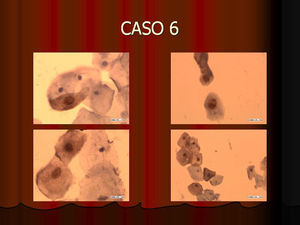
En vez de presentar las imágenes ilustrativas de los resultados de la técnica, hemos preferido elaborar un pequeño atlas fotográfico que nos sirva para este propósito. Esperamos sinceramente que sea de ayuda a todo aquel interesado en el tema (figs. 1–13).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.