La tromboflebitis superficial migratoria o tromboflebitis migrans se caracteriza por episodios recurrentes de trombosis segmentaria que afecta a las venas superficiales de las extremidades inferiores, tronco o abdomen. Se ha asociado con diversas enfermedades inflamatorias, alteraciones de la coagulación y cáncer. En este último caso constituye la manifestación clínica del síndrome paraneoplásico descrito por Trousseau y que lleva su nombre.
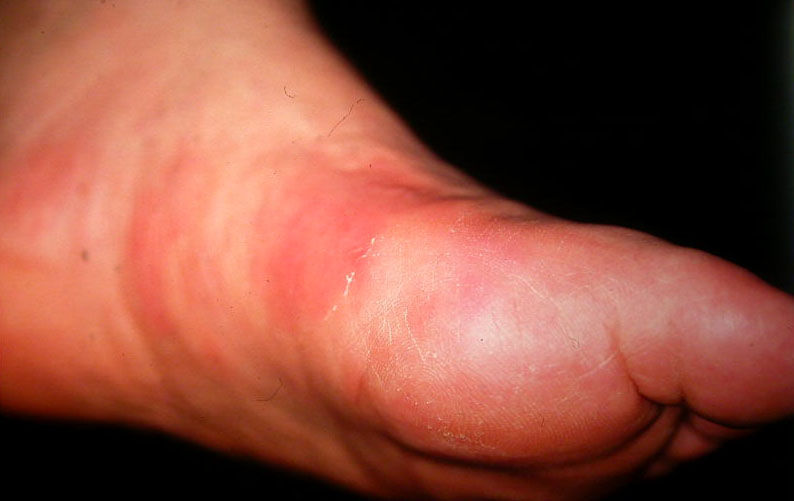
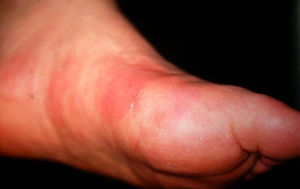
Manifestaciones clínicasLa tromboflebitis superficial migratoria afecta con mayor frecuencia a las venas del tejido celular subcutáneo superficial de extremidades inferiores. Se caracteriza por la aparición de nódulos que se distribuyen de forma lineal a lo largo de la extremidad y que con la evolución dan lugar a un cordón indurado palpable (fig. 1). Además de las venas superficiales de los miembros inferiores pueden afectarse las venas epigástricas, toracoepigástrica o torácica lateral dando lugar a cordones visibles o palpables en la pared torácica. A esta variedad se conoce como enfermedad de Mordor y también se ha descrito en axila, región inguinal y pene1.
El diagnóstico diferencial clínico se realiza con el eritema nudoso, vasculitis nodular, panarteritis nudosa (PAN), celulitis o linfangitis2,3.
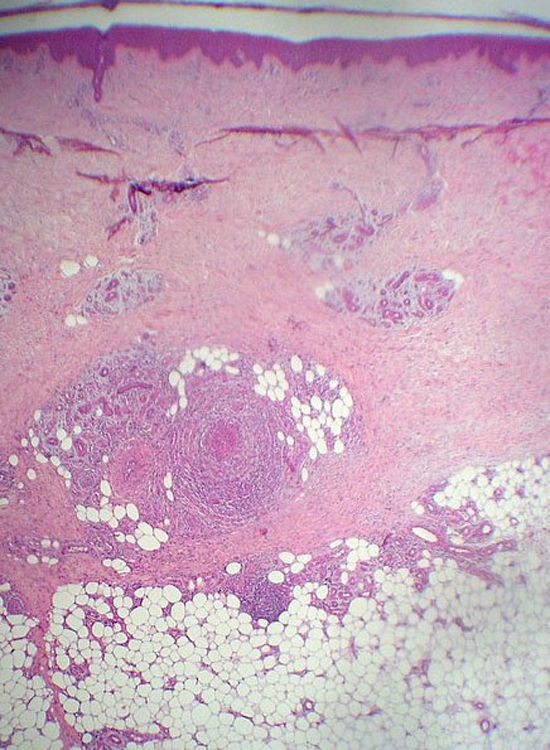
Anatomía patológicaLa tromboflebitis migratoria es un proceso trombosante que afecta a las venas localizadas en el tejido celular subcutáneo superficial. Las lesiones recientes presentan un infiltrado inflamatorio de predominio polimorfonuclear que afecta a todo el espesor de la pared de la vena y a medida que la lesión evoluciona los polimorfonucleares son reemplazados por linfocitos, histiocitos y ocasionalmente por células gigantes multinucleadas (fig. 2). Durante la evolución, el trombo que inicialmente ocluye la luz vascular es sustituido por recanalización y fibrosis. La trombosis de estas venas no altera de modo sustancial la oxigenación del lobulillo, por lo que no encontramos una paniculitis acompañante significativa4.
El diagnóstico diferencial histológico se realiza fundamentalmente con la PAN, que afecta a las arterias y no a las venas como en la tromboflebitis. Las características histológicas distintivas entre una arteria y una vena son la presencia de la lámina elástica interna y de una gruesa capa muscular compacta y concéntrica en el caso de las arterias y de un mayor diámetro de la luz vascular, una capa muscular más fina y ausencia de lámina elástica interna en el caso de las venas. Esto es así en caso de pequeñas arterias o venas o en el caso de vasos localizados en tronco u otras localizaciones. Sin embargo, esta distinción no es tan sencilla cuando nos referimos a los vasos de mediano calibre localizados en las extremidades inferiores, sobre todo en el dorso de los pies o plantas. En estas zonas las venas pueden mostrar características de las arterias, como son la presencia de una gruesa capa muscular para favorecer el retorno venoso y una proliferación concéntrica de fibras elásticas en la íntima, que simulan la lámina elástica interna de las arterias. Por este motivo, se han publicado casos de PAN que en realidad correspondían a casos de tromboflebitis, ya que tanto clínica como histológicamente estas 2 entidades pueden ser muy difíciles de distinguir, y que se han tratado erróneamente con corticoides e inmunosupresores5. Todo ello ha sido objeto de estudio por Chen5, que en un trabajo reciente destaca 3 puntos para el diagnóstico diferencial. El primer punto es el patrón que adopta la capa muscular: en las arterias, la capa muscular adopta un patrón en corona compacta y continua, mientras que en la tromboflebitis el infiltrado inflamatorio de la pared vascular hace que las fibras musculares se separen y que la capa muscular adopte un patrón en corona discontinua. El segundo punto es la diferencia entre la verdadera lámina elástica interna y la pseudolámina elástica de las venas: la lámina elástica interna de las arterias siempre es adyacente al lado luminal de la capa muscular y tiene una morfología y un grosor regular. En cambio la pseudolámina elástica de las venas tiene una morfología y un grosor irregular y suele ser más fina que la verdadera lámina elástica de las arterias. Sin embargo, a pesar de las 2 diferencias antes descritas, sigue siendo en ocasiones difícil el diagnóstico diferencial, por lo que Chen finalmente propone como clave fundamental para el diagnóstico diferencial un tercer punto: el recuento y la distribución de las fibras elásticas de la pared vascular. De esta forma, las tinciones para fibras elásticas (Van Gieson u orceína) permiten demostrar como éstas se distribuyen de forma abundante y concéntrica en la pared de las venas, mientras que en las arterias éstas son escasas. Finalmente, cabe destacar que en la PAN cutánea es clásica la imagen en escarapela con necrosis fibrinoide de la íntima. Se puede decir que en la tromboflebitis superficial migratoria lo que predomina es la trombosis y que la PAN es un proceso fundamentalmente necrosante.
Enfermedades relacionadasLa tromboflebitis migratoria se ha descrito asociada a diversas enfermedades inflamatorias, como la enfermedad de Behçet o la enfermedad inflamatoria intestinal6 o defectos en la coagulación que inducen a estados de hipercoagulabilidad, como las deficiencias de la proteína C y S, anticoagulante lúpico7 o deficiencias del factor XII de Hageman8. En otros casos se descubre una trombosis venosa profunda subyacente, enfermedad de Buerguer9 o solamente signos de insuficiencia venosa, una hipertensión arterial mal controlada10 o consumo de cocaína. En el caso de la enfermedad de Mordor, ésta se ha relacionado con traumatismos, ejercicio físico intenso, infecciones mamarias o procedimientos quirúrgicos sobre la mama e incluso se ha descrito una neoplasia de mama asociada hasta en un 12% de los pacientes1.
Además de lo descrito anteriormente, la tromboflebitis superficial migratoria puede asociarse a neoplasias ocultas, especialmente con tumores productores de mucina, como los de páncreas, estómago y pulmón.
Síndrome de TrousseauEn 1865, Armand Trousseau relacionó la tromboflebitis superficial migratoria con la presencia de una neoplasia visceral oculta. Dos años después, fue el mismo Trousseau quien experimentó el síndrome que lleva su nombre y murió al poco tiempo a causa de un cáncer gástrico.
Hoy en día el término de síndrome de Trousseau se ha ampliado e incluye todos aquellos estados de hipercoagulabilidad inesperada no explicados por otras causas, como cirugía, inmovilización, embarazo o traumatismos que precedan o sea concomitantes al diagnóstico de una neoplasia. Se incluye, por tanto, la trombosis arterial, embolia arterial, endocarditis trombótica no bacteriana y el tromboembolia venosa11–13. Sin embargo, parece que un episodio aislado de tromboflebitis no se ha relacionado con un mayor riesgo de neoplasia14.
La generación de trombina y la formación de fibrina están constantemente presentes en pacientes con enfermedades malignas, lo que determina el desarrollo de un estado de hipercoagulabilidad, aún sin manifestaciones clínicas de trombosis. Además, la formación de fibrina también participa en la progresión y metástasis tumoral.
Se han desarrollado múltiples teorías que tratan de explicar la relación entre los estados de hipercoagulabilidad y el cáncer. En primer lugar y dada la mayor frecuencia de asociación con carcinomas mucinosos, se pensaba que la mucina era el factor precipitante fundamental15. La mucina es capaz de interactuar con las selectinas de los leucocitos y las plaquetas, induciendo la formación de microtrombos ricos en plaquetas.
Sin embargo, también se ha descrito el síndrome de Trousseau en el contexto de otros carcinomas no mucinosos, por lo que se han implicado otros factores, como citocinas, el llamado factor procoagulante del cáncer13, la hipoxia tisular16 o las expresión de oncogenes17.
Las neoplasias que con mayor frecuencia se han relacionado con el síndrome de Trousseau han sido las de páncreas (50% de todos los casos), pulmón, próstata, estómago y colon. También se han publicado casos en el contexto de discrasias hematológicas18.
El riesgo de una neoplasia oculta tras un episodio de trombosis inesperada no explicable por otras causas varía ampliamente en diversos estudios retrospectivos13. Con el objetivo de valorar este riesgo, Piccioli et al19 realizaron un estudio prospectivo en el que se incluyeron pacientes aparentemente sanos que habían sufrido un episodio de tromboembolia venosa idiopática. Se aleatorizaron los pacientes en 2 grupos: en uno hacían una batería extensa de pruebas complementarias para el cribado de cáncer y en el otro no. En el primer grupo la incidencia de neoplasias fue del 13% y en el segundo de 9,8% tras un período de seguimiento de 2 años. A pesar de que la neoplasia se detectaba en un estadio más precoz en el primer grupo, la diferencia respecto a la mortalidad en ambos grupos no fue marcadamente significativa. Esto se explica porque las neoplasias que se presentan en contexto del síndrome de Trousseau se encuentran habitualmente en un estadio avanzado. Sin embargo, recientemente Thumurthy et al publicaron un caso de síndrome de Trousseau asociado a un cáncer gástrico en estadio precoz20. Se trataba de un varón de 41 años que ingresó por tromboflebitis del miembro inferior derecho, la cual se complicó con una trombosis venosa profunda con extensión a la vena cava inferior. Durante el ingreso, una analítica reveló anemia microcítica. En el estudio de dicha anemia la gastroscopia mostró un adenoma gástrico. Las exploraciones complementarias no encontraron metástasis y el tumor fue tratado con éxito tras cirugía y quimioterapia adyuvante.
TratamientoEl primer punto es la detección de enfermedades sistémicas asociadas con la tromboflebitis migratoria. Además de una anamnesis y una exploración clínica completa, incluyendo la exploración por un cirujano vascular, debe realizarse una analítica completa con hemograma, bioquímica, autoinmunidad, estudio de coagulación y trombosis. Respecto al cribado de enfermedad tumoral oculta no existen protocolos establecidos. Oktar et al21 proponen un cribado basado en una analítica, radiografía de tórax y ecografía abdominal, reservando un estudio más exhaustivo en casos de sospecha según la sintomatología del paciente o en casos de tromboembolia recurrente, tromboembolia venosa bilateral o presencia de trombosis en sitios inusuales. En segundo lugar, el tratamiento puede ser decepcionante dada la recurrencia de los brotes. El reposo relativo y las medias de compresión elástica pueden ser de utilidad, además hay pacientes que presentan a su vez insuficiencia venosa periférica y se benefician de estas medidas. La anticoagulación se reserva a los casos con trombosis venosa profunda asociada. En el caso de la enfermedad de Mordor, las lesiones suelen resolverse en pocos días con una baja tasa de recurrencias. En el caso de una neoplasia asociada se tratará el tumor, si es posible. En estos casos la heparina también produce mejoría en muchos de los casos de síndrome de Trousseau. La heparina es capaz de inhibir la interacción entre la mucina secretada por las células tumorales y las selectinas de plaquetas y leucocitos22. Esto explica por qué la heparina es eficaz en el síndrome de Trousseau, mientras que los anticoagulantes orales antagonistas de la vitamina K son inefectivos.
- 1.
Hemos de incluir la tromboflebitis migratoria en el diagnóstico diferencial de lesiones de distribución lineal.
- 2.
La anatomía patológica es fundamental en el diagnóstico diferencial con otras entidades.
- 3.
En ocasiones es muy difícil distinguir entre la tromboflebitis y la panarteritis nudosa, ya que clínica e histológicamente pueden tener características muy similares. En estos casos el dato histológico clave para el diagnóstico consiste en el recuento y la distribución de las fibras elásticas de la pared muscular del vaso.
- 4.
La tromboflebitis migratoria puede ser el primer signo de otros procesos sistémicos, incluida enfermedad vascular o inflamatoria, estados de hipercoagulabilidad y cáncer.
- 5.
No hay un protocolo definitivo para descartar enfermedad subyacente y existe controversia sobre el estudio de extensión que se debe realizar para detectar neoplasia oculta.
- 6.
Con gran frecuencia el síndrome de Trousseau se relaciona con neoplasias avanzadas. Sin embargo, hay casos en que puede ser la manifestación inicial de una neoplasia en estadio precoz y una actuación temprana puede suponer la curación de la misma.