A pesar de los importantes avances conseguidos en los últimos años en el tratamiento del síndrome de inmunodeficiencia adquirida (sida), éste continúa suponiendo un gran problema en todo el mundo. Según datos del informe anual conjunto de Naciones Unidas y la Organización Mundial de la Salud sobre la epidemia de sida, hay 39,5 millones de infectados con el virus de la inmunodeficiencia humana (VIH). En el año 2006 se produjeron 4,3 millones de nuevas infecciones y 2,9 millones de personas fallecieron a causa del sida1.
Los pacientes infectados por el VIH pueden presentar múltiples manifestaciones cutáneas, ya sea una manifestación de una infección asintomática, expresión de una inumunodeficiencia avanzada o resultado de infecciones o neoplasias oportunistas2,3.
Las toxicodermias o reacciones adversas cutáneas en pacientes con sida son un problema importante para estos pacientes debido a su frecuencia de aparición y a las dificultades diagnósticas o terapéuticas que pueden presentarse en su manejo. La siguiente revisión se ocupa de estos aspectos.
EPIDEMIOLOGÍALa incidencia de toxicodermias se encuentra aumentada 100 veces con respecto a la población general. Aumenta según avanza el grado de inmunodeficiencia y puede complicar del 3 al 20% de las prescripciones que se hagan a estos pacientes4. La elevada incidencia se debe a una mayor susceptibilidad de estos pacientes y al elevado número de fármacos que pueden llegar a necesitar a lo largo de su enfermedad5-7.
CLASIFICACIÓNSe puede clasificar las toxicodermias en inespecíficas, en relación con fármacos que también se administran en otro tipo de pacientes (sulfonamidas, betalactámicos, anticonvulsivos, tuberculostáticos, etc.) y específicas, debido a fármacos utilizados exclusivamente en los pacientes con la infección por el VIH (antirretrovirales)7.
También se puede establecer subtipos clínicos de toxicodermias. De ellos, el más frecuente es el exantema morbiliforme, que supone un 95% de los casos. Pero también se han descrito urticaria, eritema multiforme, síndrome de Stevens-Jonhson (SSJ), necrólisis epidérmica tóxica (NET), erupciones liquenoides, exantema fijo medicamentoso, vasculitis, reacciones de fotosensibilidad, ginecomastia, lipodistrofia y reacciones a la ra-dioterapia8-17.
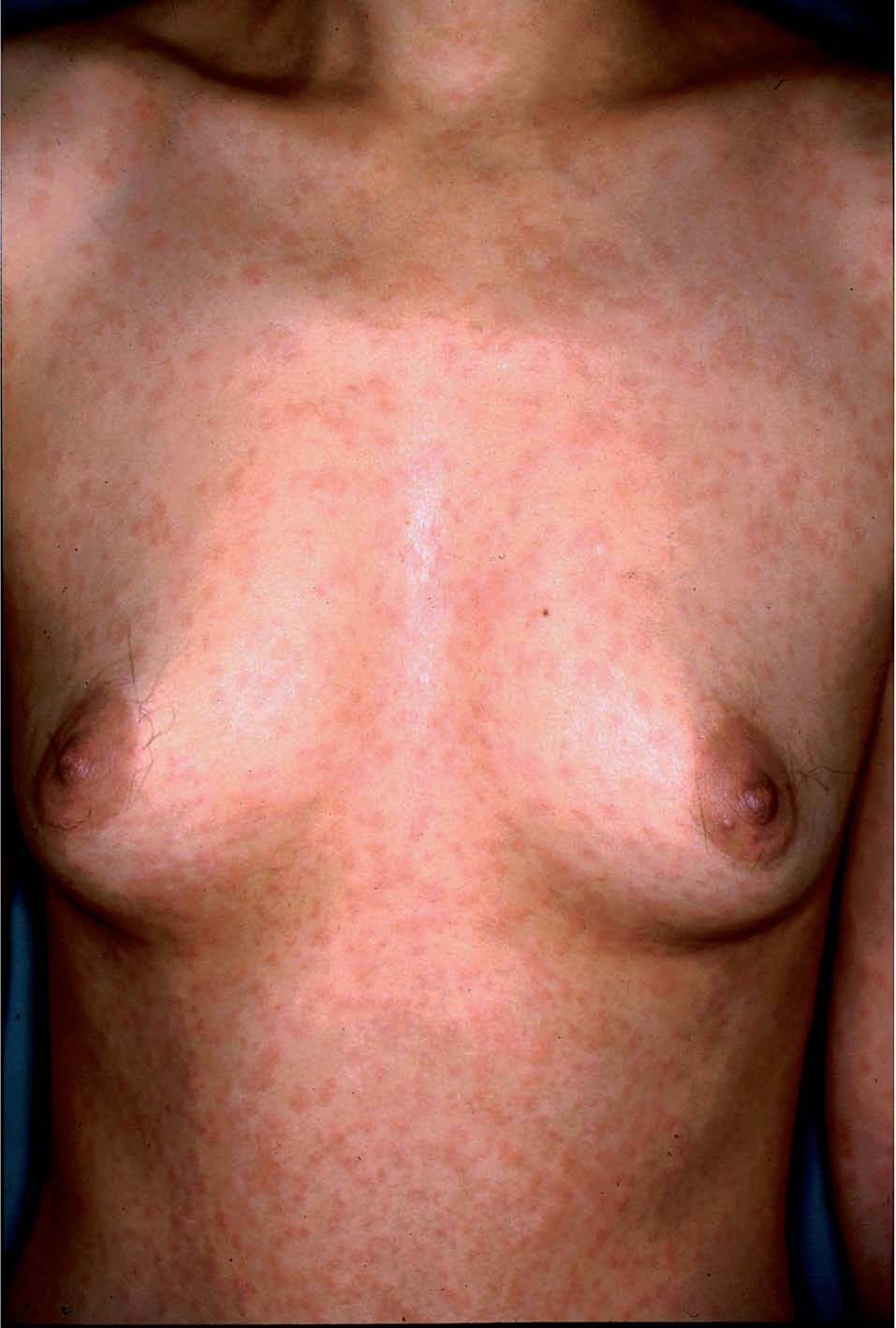
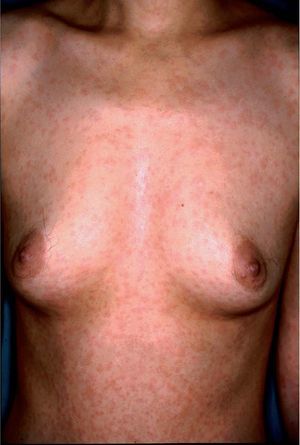
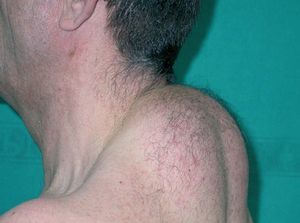
Toxicodermias inespecíficasEl 75% de las toxicodermias en pacientes con sida se puede atribuir a 3 grupos de fármacos: trimetoprima-sul-fametoxazol, otras sulfonamidas y betalactámicos. El exantema por trimetoprima-sulfametoxazol se presenta en un 50-60% de los pacientes (fig. 1). Su incidencia es 10 veces superior que en la población general6. Característicamente, aparece 1-2 semanas después del comienzo del tratamiento. La edad menor de 36 años y mayores cifras de CD8+ han sido identificados como factores de riesgo de toxicodermias por sulfamidas18. En los últimos años se han publicado numerosos casos de desensibilización con éxito19,20. La administración de corticoides concomitante reduce la incidencia de reacciones cutáneas hasta en un 13%21,22.
Figura 1. Exantema maculopapuloso en el tronco tras la administración de trimetoprima-sulfametoxazol.
Amoxicilina-ácido clavulánico puede causar exantema en la mitad de los pacientes con VIH tratados23. En el 20% de los casos, las manifestaciones cutáneas se acompañan de síntomas sistémicos, como fiebre, cefalea, mialgia y artralgia24.
Toxicodermias específicasDesde el año 1996, se han ido introduciendo de manera progresiva nuevos fármacos antirretrovirales en pautas de tratamiento antirretroviral de gran actividad (TARGA). Los fármacos comercializados se recogen en la tabla I. Gracias al TARGA, son posibles la supresión de la replicación viral y la reconstitución inmunitaria, incluso en fases avanzadas de la infección por el VIH. De este modo, se ha conseguido en los últimos años un importante descenso de la morbilidad y la mortalidad asociadas al sida25,26.
TABLA I. Fármacos antirretrovirales utilizados en pacientes con sida
En cada paciente se precisa de una elección individualizada del TARGA, en función del grado de inmunodeficiencia, el cumplimiento terapéutico, la complejidad posológica, los efectos secundarios a corto y largo plazo, las interacciones farmacocinéticas y la reserva de opciones terapéuticas en caso de fracaso clínico/virológico25,26.
El TARGA conlleva una gran incidencia de reacciones adversas cutáneas, como reacciones de hipersensibilidad, síndrome de lipodistrofia e interacciones medica-mentosas27-29.
Las reacciones de hipersensibilidad ocurren con más frecuencia con los inhibidores no nucleosídicos de la transcriptasa inversa (INNTI) nevirapina, delavirdina y efavirenz, con el inhibidor nucleosídico de la transcriptasa inversa (INTI) abacavir y con el inhibidor de la proteasa (IP) amprenavir. Se caracterizan por la aparición de un exantema maculopapuloso, eritematoso y pruriginoso, con o sin fiebre. Sobre todo afecta al tronco y las extremidades superiores y aparece en las primeras 3 semanas de iniciado el tratamiento. Puede tener pródromos en forma de mialgias, artralgias y fiebre24.
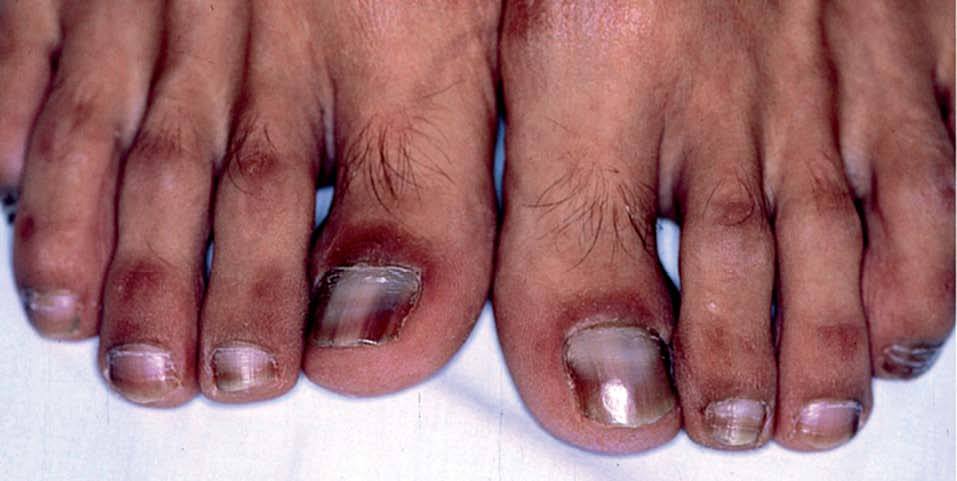
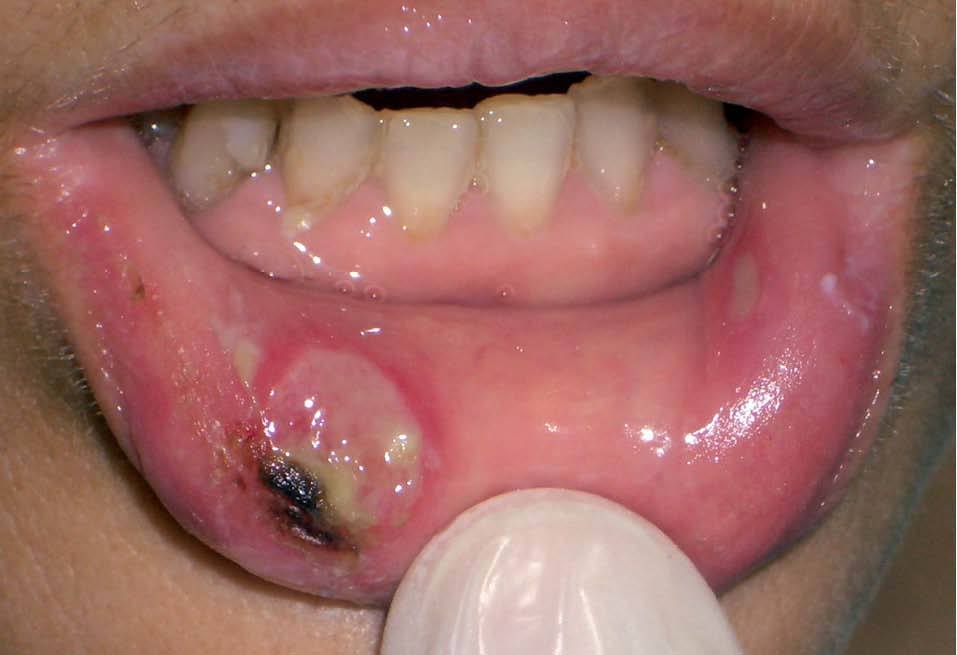
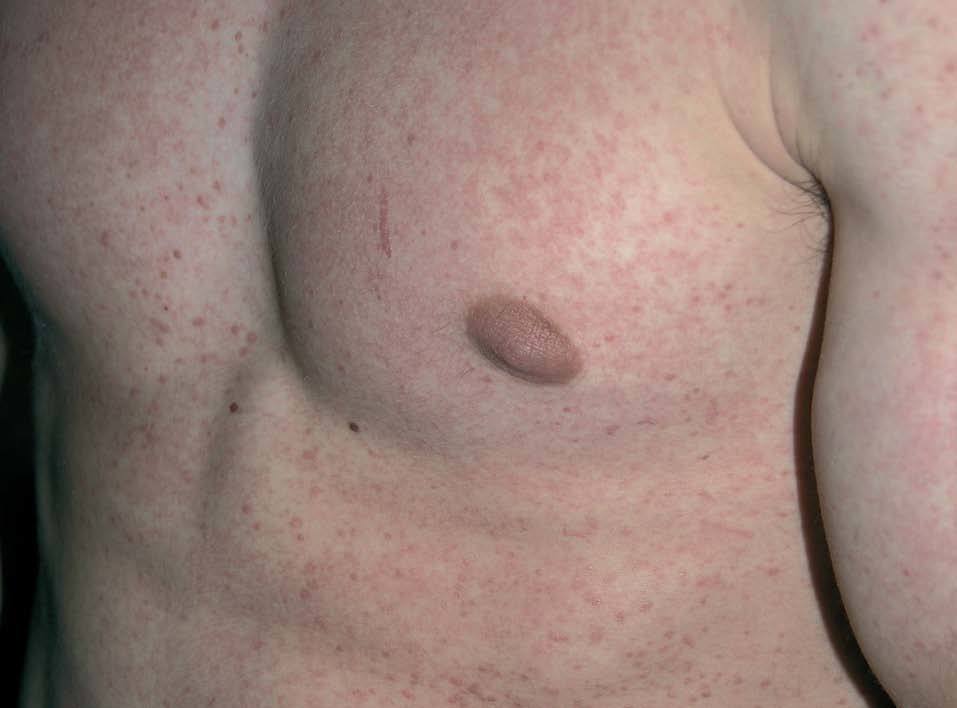
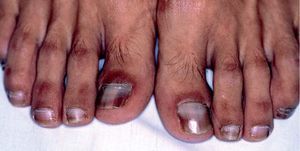
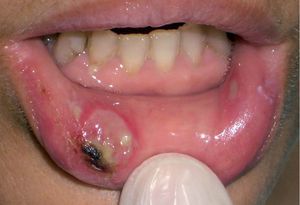
Los INTI se asocian a escasa toxicidad dermatológica. La zidovudina (AZT; Retrovir®) produce de forma característica una melanoniquia en forma de pigmentación longitudinal ungueal marronácea o negruzca (fig. 2), que aparece hasta en el 40% de los tratados. Puede aparecer tanto en los dedos de las manos como en los de los pies desde la cuarta semana hasta 1 año después de iniciado el tratamiento. También son frecuentes la aparición de máculas hiperpigmentadas en las membranas mu-cosas30,31. Otras reacciones descritas con zidovudina son hipertricosis32, vasculitis leucocitoclástica33 y paroniquia34. La didanosina (ddI; Videx®) origina escasas reacciones cutáneas y se han descrito casos aislados de vasculitis leucocitoclástica13 y síndrome de StevensJohnson14. La zalcitabina (ddC; Hivid®) puede ser causa de aftas en la orofaringe y el esófago (fig. 3)35 y reacciones de hipersensibilidad36. El abacavir (Ziagen®) puede causar exantema maculopapuloso generalizado (fig. 4)37 y en un 3-4% de los casos, hipersensibilidad severa con afección multiorgánica en forma de fiebre, mialgias, síntomas respiratorios y gastrointestinales e hipotensión29,38. Algunos estudios han encontrado la presencia de HLA-B 57 aumentada con respecto a controles en los pacientes afectados por el síndrome de hipersensibilidad a abacavir39. Se han descrito numerosos casos de fallecimiento al intentar reintroducirlo tras reacciones adversas, de modo que nunca se debe reiniciar abacavir si no se puede descartar su implicación en la reacción cutánea40. Las reacciones adversas a lamivudina (Epivir®) y estavudina (Zerit®) son muy infrecuentes29.
Figura 2. Melanoniquia en paciente en tratamiento con zidovudina.
Figura 3. Lesión ulcerosa en la mucosa labial de un paciente en tratamiento con zalcitabina.
Figura 4. Exantema maculopapuloso en el tronco tras la administración de abacavir.
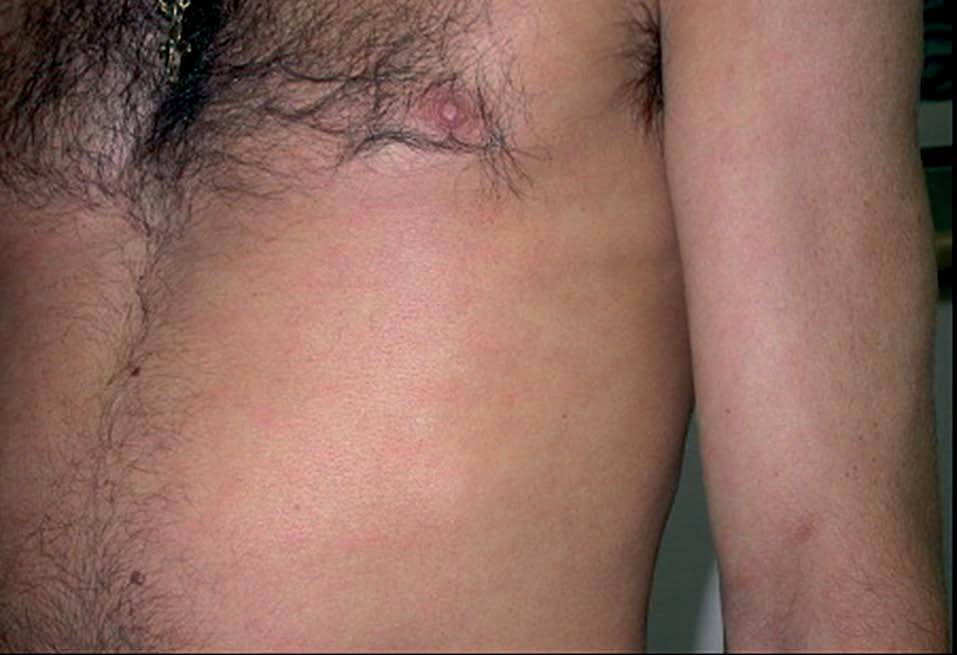
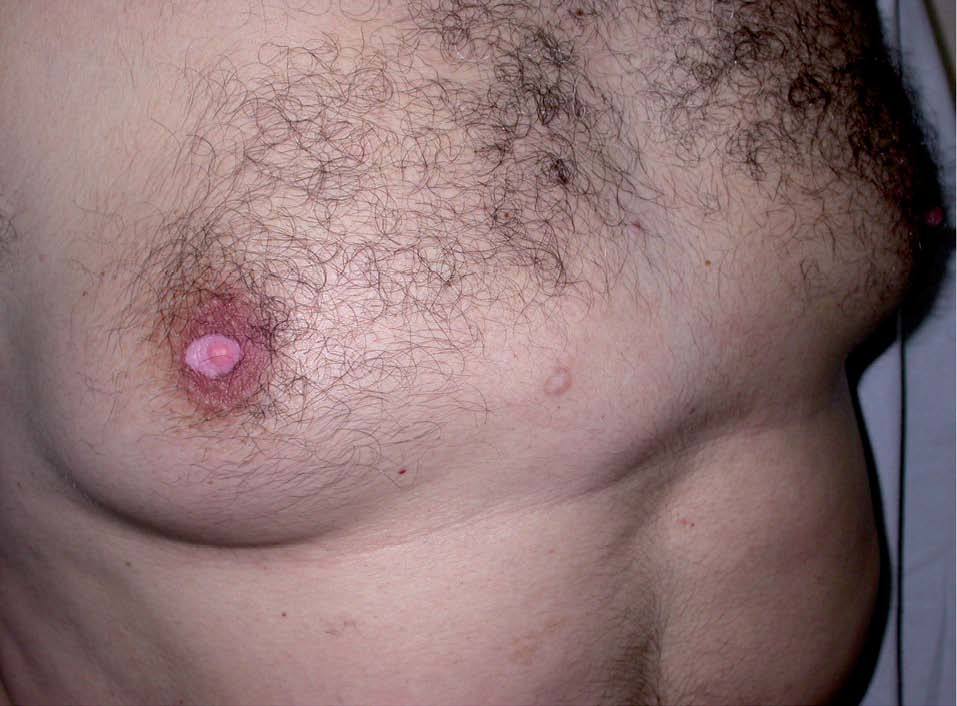
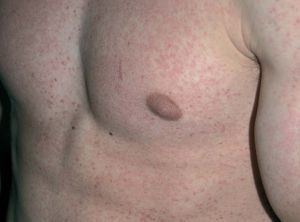
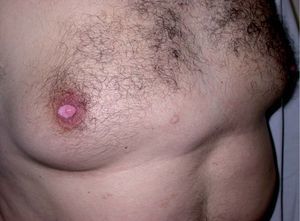
Los INNTI se encuentran relacionados con gran cantidad de reacciones adversas cutáneas. La nevirapina (Viramune®) produce exantema morbiliforme hasta en un 20% de los tratados y aparece en las primeras 4-6 semanas (fig. 5)24. Puede aparecer síndrome de Stevens-John-son hasta en un 1% de los tratados41. También ha sido descrita la aparición de síndrome de hipersensibilidad42,43. Recientemente se ha publicado un caso que fue tratado con éxito con inmunoglobulina intravenosa44. El efavirenz (Sustiva®) se asocia con exantema en un 1034% de los tratados, aparece en las primeras 2 semanas de tratamiento y en un 1% de los tratados puede causar reacciones de hipersensibilidad graves29. Además, es inductor de ginecomastia (fig. 6)17 y causa de casos aislados de vasculitis leucocitoclástica45. La delavirdina (Rescriptor®) puede causar un exantema difuso en un 18-50% de los tratados. Hasta en un 3,6% pueden ser casos graves, aunque en general es menos intenso que nevirapina29.
Figura 5. Discreto exantema en el tronco tras la administración de nevirapina.
Figura 6. Ginecomastia en un paciente en tratamiento con efavirenz.
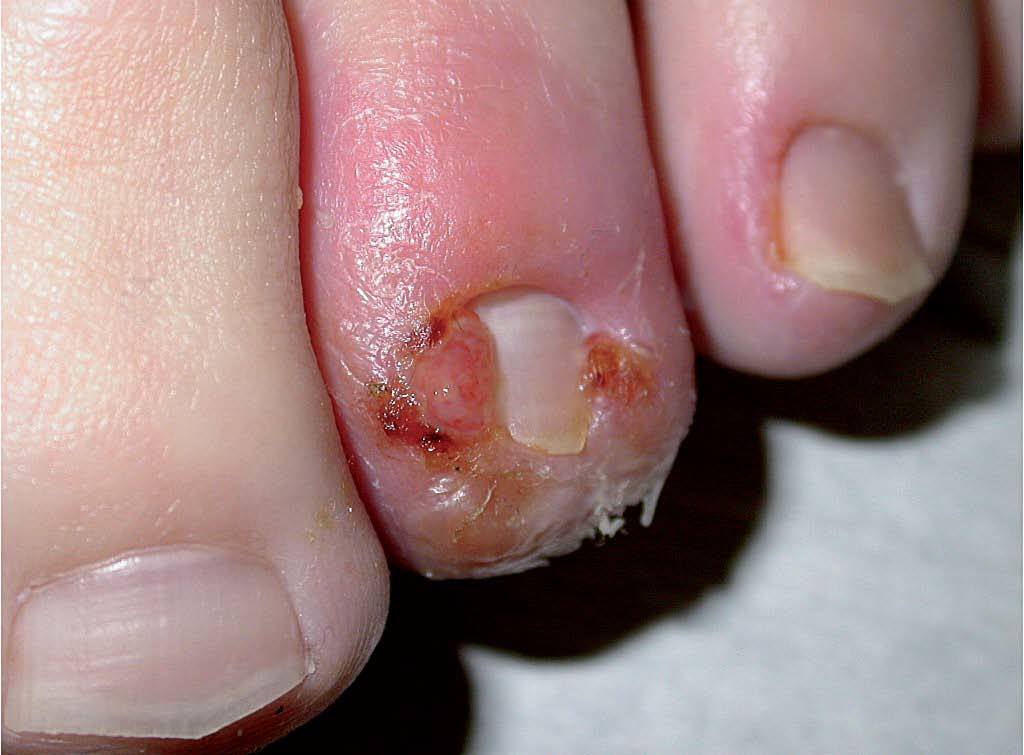
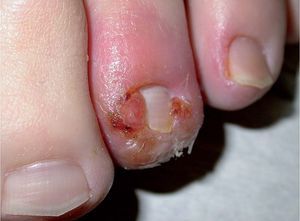
Los IP causan un gran número de efectos adversos cutáneos, en forma de reacciones de hipersensibilidad, pustulosis aguda exantemática y lipodistrofia. El indinavir (Crixivan®) origina gran número de manifestaciones cutáneas por su «efecto retinoide»46. En los pacientes tratados con indinavir es frecuente encontrar queilitis descamativa47, xerosis difusa48, paroniquia recurrente (fig. 7)49,50 o efluvio51 debido a ese «efecto retinoide» que se atribuye a la presencia de homologías estructurales entre la proteasa del VIH y proteínas humanas como CRABP-1 (cytoplasmic retinoic acid binding protein). El amprenavir (Agenerase®) causa exantemas en un 20% de los tratados (muy infrecuentes con el resto de los IP). Pueden ser severos hasta en el 5% de los casos y se caracterizan por la ausencia de pródromos. Se ha descrito la aparición de síndrome de Stevens-Johnson en el 1% de los tratados con fosamprenavir (Telzir®)29. El nelfinavir (Viracept®) puede causar exantema morbiliforme en un 3-28% de los tratados y, menos frecuentemente, urticaria52.
Figura 7. Paroniquia tras la administración de indinavir.
La enfuvirtida (Fuzeon®) es el único inhibidor de fusión (IF) aprobado por el momento. Se administra mediante inyección subcutánea y el efecto adverso más frecuente es las reacciones en el punto de inyección, que se han descrito hasta en el 98% de los casos29.
La identificación del fármaco que origina la reacción cutánea puede ser difícil, dado que se trata de pacientes polimedicados y que, por lo tanto, están recibiendo más de un fármaco potencialmente causal. La clave del diagnóstico puede ser la relación temporal del cuadro con el inicio de la terapia. La mitad de los casos de reacciones cutáneas adversas a antirretrovirales se resuelven espontáneamente a pesar del mantenimiento del fármaco. Debe interrumpirse si aparecen alteración de las mucosas, ampollas, exfoliación, disfunción hepática clínica-mente significativa, fiebre > 39 °C o prurito intolerable24.
El tratamiento con ciclos cortos de corticoides puede ser motivo de controversia en estos pacientes, debido al riesgo de aumentar la inmunosupresión, con la posibilidad de exacerbar infecciones o neoplasias oportunistas. McComsey et al53 publicaron un estudio en el que afirman que los ciclos cortos de corticoides son seguros y bien tolerados por estos pacientes53.
Tras la resolución de cualquier reacción cutánea adversa en relación con un fármaco antirretroviral, se debe valorar el riesgo de mantener o reiniciar el TARGA. Se trata de un tema complejo cuya decisión debe individualizarse en cada caso. No debería reiniciarse nunca el abacavir, ya que se ha asociado con numerosos casos de muerte tras la reintroducción24.
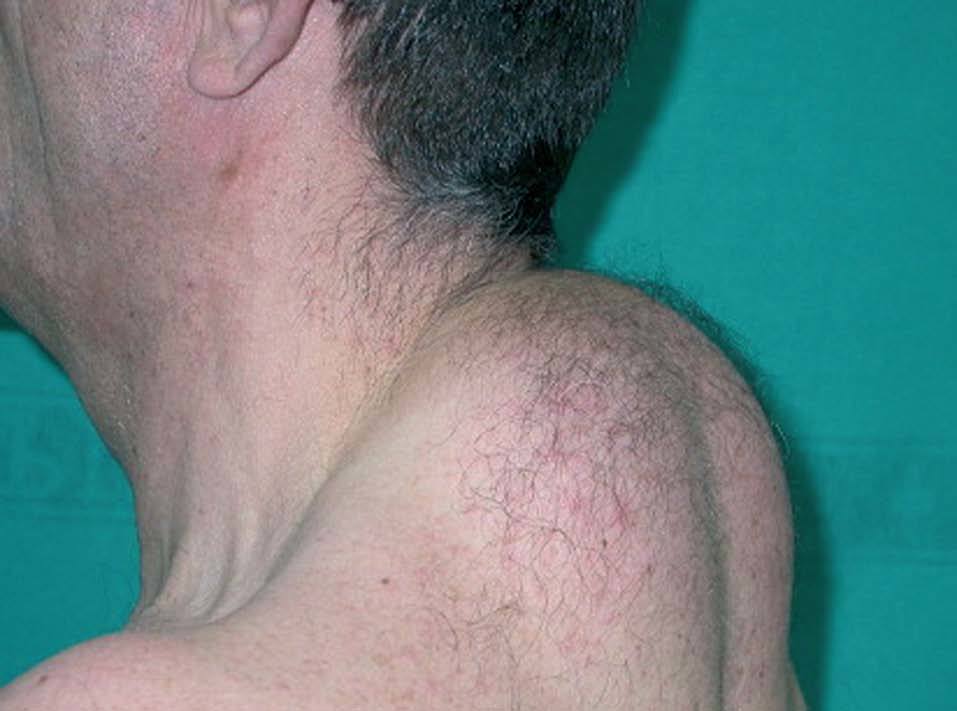
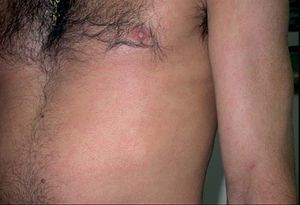
El síndrome de lipodistrofia posiblemente sea la reacción cutánea más común asociada a los antirretrovirales y causa a estos pacientes una importante morbilidad, disminución de la autoestima, alteración de la imagen corporal y estigmatización54. Consiste en alteraciones del hábito corporal en forma de lipoatrofia periférica junto con importante adiposidad central. Pero además tiene repercusión sistémica, con aparición de dislipemias, resistencia a la insulina o pérdida de masa ósea, que complican el tratamiento en estos pacientes. La lipoatrofia periférica afecta a la cara, sobre todo a nivel malar y nasolabial, y a las extremidades, sobre todo a los glúteos. La adiposidad central da lugar a un aumento del perímetro abdominal y un acúmulo dorsocervical (joroba de búfalo) (fig. 8) y supraclavicular y axilar («lipomatosis simétrica bilateral»), además de ginecomastia y aparición de lipomas múltiples29. El incremento de la grasa visceral produce un aumento del riesgo cardiovas-cular55,56. Clásicamente, se ha asociado a los IP57,58; sin embargo, recientemente se ha descrito asociado a los INTI. El mayor factor de riesgo es la duración de la terapia con estos fármacos, y la estavudina se asocia a mayor riesgo que otros INTI. En este momento hay controversia sobre la implicación de los IP, y algunos estudios lo relacionan más con las alteraciones metabólicas y no con la lipoatrofia59-63. Tenofovir y abacavir se consideran INTI seguros en cuanto a lipoatrofia59. En la patogenia de la lipodistrofia se ha involucrado la presencia de homologías estructurales entre la proteasa del VIH y proteínas humanas como CRABP-1 o proteínas relacionadas con el receptor de lipoproteínas de baja densidad (LDL). También se ha puesto en relación con la toxicidad mitocondrial de los INTI24,29. Las consecuencias estéticas del síndrome de lipodistrofia pueden ser motivo de relajación en la adherencia al tratamiento. Con el fin de tratar la lipoatrofia facial se han empleados distintas técnicas de relleno, como la utilización de grasa del paciente, ácido poliláctico, gel de poliacrilamida o silicona64,65. Existen numerosas publicaciones acerca de su eficacia y seguridad en estos pacientes66,67. Para la corrección de la «joroba de búfalo», se han utilizado técnicas quirúrgicas o liposucción, con buenos resultados68,69, aunque también se ha descrito la posibilidad de recurrencias70.
Figura 8. Lipodistrofia en forma de «joroba de búfalo».
AGRADECIMIENTOSDeseamos expresar nuestro agradecimiento al Dr. Pedro Herranz Pinto, por la aportación de algunas de las figuras de esta revisión.
Correspondencia: Dra. R. Goiriz. Servicio de Dermatología. Hospital Universitario de La Princesa. Diego de León, 62. 28006 Madrid. España. Correo electrónico: rgoiriz@yahoo.es