El metotrexato es un fármaco que puede ser muy útil para tratar diferentes procesos cutáneos inflamatorios y neoplásicos. Se ha descrito su eficacia en psoriasis, pitiriasis aguda liquenoide y variceliforme, pénfigo, penfigoide, dermatomiositis, lupus eritematoso (lupus eritematoso sistémico y cutáneo subagudo), esclerodermia, vasculitis (de pequeño vaso, poliarteritis nudosa cutánea), pioderma gangrenoso, dermatitis atópica, sarcoidosis y procesos linfoproliferativos (papulosis linfomatoide, micosis fungoide, síndrome de Sézary).
El metotrexato se utiliza en el tratamiento de la psoriasis desde finales de 1950, y sigue siendo uno de los tratamientos más utilizado a largo plazo en la psoriasis de moderada a grave, especialmente si existe una artritis psoriásica acompañante. Su efectividad en el tratamiento de la psoriasis se descubrió por casualidad en un paciente que estaba siendo tratado con metotrexato por su artritis reumatoide, y en el que se observó que también mejoraban sus lesiones de psoriasis1.
Desde la aparición del metotrexato se han ido desarrollando nuevos fármacos y sistemas para el tratamiento de la psoriasis, como PUVA, UVB, retinoides, ciclosporina y las nuevas terapias biológicas. Existen pocos estudios que comparen la eficacia entre todos estos tratamientos. Un estudio reciente publicado en New England Journal of Medicine no encontró diferencias estadísticamente significativas entre el metotrexato y la ciclosporina en el tratamiento de la psoriasis de moderada a grave2. Otro estudio en JAMA muestra que el porcentaje de pacientes con psoriasis de moderada a grave que alcanza una mejoría del Psoriasis Area and Severity Index (PASI) superior o igual al 75% es mayor en los pacientes que reciben metotrexato (60%) en comparación con otros tratamientos como la ciclosporina (2,5-3 mg/kg/día), efalizumab (1-2 mg/kg/semana), alefacept y etanercept (25-50 mg/kg/2 veces a la semana)3. Por ello, y a pesar del desarrollo y la aparición de nuevos tratamientos biológicos para la psoriasis, el metotrexato sigue teniendo un papel central en el tratamiento de los pacientes con psoriasis grave en Europa4.
MECANISMO DE ACCIÓN
El mecanismo de acción del metotrexato en la psoriasis es la inhibición competitiva de la enzima intracelular dihidrofolato reductasa y, por tanto, la inhibición de la división celular. Inicialmente se pensó que actuaba inhibiendo el ciclo celular de los queratinocitos, pero en la actualidad se cree que probablemente está más relacionado con los efectos en las células T que en los queratinocitos5,6. Es poco probable que, a las dosis bajas en las que se utiliza en la psoriasis, tenga un efecto antiproliferativo significativo en los queratinocitos. También tiene una variedad de efectos antiinflamatorios sobre los linfocitos y los neutrófilos que, probablemente, tienen mayor relevancia en su papel terapéutico en la psoriasis.
SEGURIDAD
Los efectos secundarios más importantes del metotrexato son la mielosupresión, la hepatotoxicidad y la fibrosis pulmonar. De las 164 muertes por metotrexato comunicadas al Comité on the Safety of Medicines en el Reino Unido, entre 1969 y 2004, 67 fueron por mielosupresión, 30 por complicaciones pulmonares y sólo 8 por complicaciones hepáticas. Es posible que estos datos no sean del todo fiables, ya que en una encuesta realizada a 278 dermatólogos del Reino Unido, en 1992, que trataban aproximadamente a 10.000 pacientes con metotrexato durante una media de 12 años, se informó de 23 muertes por fallo hepático y 5 por complicaciones de la biopsia hepática7.
Entre los dermatólogos existe una preocupación especial sobre el potencial hepatotóxico del metotrexato a largo plazo, algo que curiosamente no preocupa tanto a otros especialistas, como los reumatólogos8. Parece que el riesgo de hepatotoxicidad varía entre las diferentes enfermedades9. Por ejemplo, los pacientes con artritis reumatoide toman corticoides con más frecuencia que los pacientes con psoriasis, lo que reduce la inflamación hepática. Además, los pacientes con psoriasis tienen una mayor tendencia a beber alcohol en exceso. Estos factores podrían favorecer una mayor hepatotoxicidad del fármaco en los pacientes con psoriasis.
Además, el metotrexato puede ser un factor de riesgo independiente para el desarrollo de esteatohepatitis no alcohólica10, la causa más frecuente de enfermedad hepática en los países desarrollados. Se ha observado que los suplementos de folato reducen la frecuencia de elevación de las enzimas hepáticas sin alterar la eficacia del metotrexato11.
Se desconoce la causa de inducción de fibrosis por el metotrexato, pero en los últimos años se han hecho importantes avances en la comprensión de los procesos de fibrosis hepática y cirrosis; por ejemplo:
Se sabe que las células hepáticas estrelladas son el paso final común en la producción de colágeno, y la gliotoxina que estimula la apoptosis de estas células promueve la reversión de la fibrosis hepática en modelos animales12.
La comprensión del papel de las metaloproteinasas, que degradan el colágeno, también puede proporcionar dianas terapéuticas para revertir la fibrosis13.
Estudios farmacogenéticos han demostrado que el polimorfismo A1298C en el gen de la metilenotetrahidrofolato reductasa puede proteger contra los efectos adversos asociados al metotraxato14, mientras que el polimorfismo C667T en el mismo gen se correlaciona con la hepatotoxicidad el metotrexato15. Es posible que, en el futuro, el descubrimiento de nuevos polimorfismos en la vía metabólica del folato y la existencia de polimorfismos responsables de la variabilidad fenotípica en la actividad enzimática ayuden a optimizar la respuesta de cada paciente al metotrexato16.
Factores ambientales que predisponen a la hepatotoxicidad por metotrexato incluyen la exposición a otras hepatotoxinas, como el alcohol, y también varios factores asociados con la esteatohepatitis no alcohólica, como la obesidad y la diabetes17.
El método recomendado hasta hace poco para detectar la hepatotoxicidad inducida por el metotrexato es la biopsia hepática. Las recomendaciones para realizar una biopsia hepática en los pacientes en tratamiento con metotrexato durante largos períodos, según la Academia Americana de Dermatología, se muestran en la tabla I.
Hay que tener en cuenta, no obstante, que al realizar una biopsia hepática se extrae una pequeña muestra del hígado que no siempre es representativa. Esto es conceptualmente similar a realizar una biopsia cutánea a ciegas en un paciente con una erupción cutánea generalizada, donde la posibilidad de obtener una muestra adecuada sería de un 30%18. Además:
La información obtenida es estática y morfológica, en lugar de dinámica y funcional.
Los resultados obtenidos sólo influirían en el tratamiento de los pacientes en una minoría de los casos19,20.
Las biopsias hepáticas son impopulares entre los pacientes.
Las biopsias hepáticas se asocian con una morbilidad significativa y una mortalidad ocasional.
Por todos estos motivos, en los últimos años se están investigando métodos no invasivos para monitorizar la fibrosis hepática, y se está cuestionando la necesidad de realizar siempre la biopsia hepática21. Entre estos métodos destaca la determinación sérica de los valores del péptido aminoterminal del colágeno tipo III (PIIINP) que se produce durante la síntesis del colágeno tipo III. Los valores de PIIINP se correlacionan directamente con la actividad hepática fibrogénica en curso, pero no con el daño hepático previo22-24.
En estudios recientes se ha demostrado que la determinación de los valores de PIIINP reduce la necesidad de realizar biopsias hepáticas25,26. Estos estudios, junto con los datos publicados previamente sugieren que las determinaciones seriadas de PIIINP son sensibles, pero no específicas, para detectar la fibrosis hepática. El PIIINP no es órgano-específico, y puede estar elevado en niños y en varias enfermedades, como la artritis, la esclerodermia y el hipertiroidismo. Aunque es necesario estandarizar los valores de PIIINP en los que es necesario realizar una biopsia hepática, parece razonable sugerir que si los valores de PIIINP séricos no están elevados, el riesgo de fibrosis hepática significativa es muy bajo, y no sería necesario realizar biopsias de forma sistemática, a diferencia de lo que aconseja la Academia Americana de Dermatología27.
Los dermatólogos europeos realizan cada vez menos biopsias hepáticas de rutina a sus pacientes en tratamiento con metotrexato y utilizan cada vez más métodos no invasivos para determinar la fibrosis hepática, como los valores de PIIINP4, aunque de manera desigual en los diferentes países europeos28. Por ejemplo, en una encuesta realizada a dermatólogos daneses y suizos, el 52% de los daneses y el 0% de los suizos utilizaban los valores de PIIINP para determinar la fibrosis hepática.
A pesar de estos avances, probablemente serán necesarios otros marcadores no invasivos más específicos para los pacientes con valores elevados de PIIINP que no tienen fibrosis hepática. Otros marcadores directos de fibrosis son: el procolágeno I, el colágeno tipo IV, la laminina, el ácido hialurónico, las metaloproteinasas tisulares y sus inhibidores. La sensibilidad y la especificidad de estos marcadores varían dependiendo de la causa de la fibrosis. Por ejemplo, el ácido hialurónico ha mostrado tener una mayor precisión diagnóstica que el PIIINP en la hepatitis viral y alcohólica, y en la cirrosis biliar primaria.
Donde más se está investigando para determinar el grado de fibrosis hepática mediante técnicas no invasivas es en los pacientes con hepatitis C, y aunque hay varios estudios que intentan determinar la utilidad de diferentes marcadores séricos para predecir los grados de fibrosis en estos pacientes, actualmente la biopsia hepática sigue siendo el gold standard29-40.
A continuación, se exponen unas recomendaciones para el uso de metotrexato en los pacientes con psoriasis basadas principalmente en la guía del St John's Institute of Dermatology, Guy's and St Thomas and Lewiaham Hospital (amablemente proporcionadas por el profesor Jonathan Barker).
INDICACIONES DEL METOTREXATO EN LA PSORIASIS
1. Placas extensas (> 10% de la superficie corporal) que no se controlan con tratamientos tópicos.
2. Artritis psoriásica que requiere una segunda línea de tratamiento.
3. Psoriasis pustulosa aguda.
4. Eritrodermia psoriásica.
CONTRAINDICACIONES ABSOLUTAS
1. Alteraciones hematológicas importantes.
2. Enfermedad hepática importante (fibrosis severa o cirrosis).
3. Embarazo o lactancia.
CONTRAINDICACIONES RELATIVAS
1. Insuficiencia renal (filtrado glomerular < 50 ml/min). El metotrexato se excreta fundamentalmente por el riñón. Por ello, en pacientes con insuficiencia renal se pueden acumular valores tóxicos rápidamente, y así producir un riesgo de mielosupresión. Esto es especialmente frecuente en ancianos durante períodos de deshidratación o como resultado de la administración concomitante de fármacos como los antiinflamatorios no esteroideos (AINE).
2. Enfermedad hepática (hepatitis crónica por virus de la hepatitis B o C).
3. Consumo excesivo de alcohol.
4. Infección por el virus de la inmunodeficiencia humana (VIH).
5. Enfermedades infecciosas, por ejemplo, tuberculosis, pielonefritis.
6. Pacientes incumplidores (aunque nosotros consideramos que para todos los tratamientos sistémicos éste debería de considerarse una contraindicación absoluta).
7. Según las recomendaciones del fabricante deberían evitarse las inmunizaciones activas con vacunas vivas.
INTERACCIONES FARMACOLÓGICAS. RECOMENDACIONES
1. Existen numerosas interacciones farmacológicas, pero se debe tener especial precaución con:
Antagonistas del folato: trimetropim, sulfonamidas, fenitoína.
Fármacos que reducen su eliminación: AINE, probenecid, ciclosporina.
Acitretino, con el cual se han descrito raros casos de hepatitis fulminante. De todos modos, algunos autores recomiendan esta asociación en la psoriasis.
2. Si es necesario prescribir también AINE se deberían seguir las siguientes indicaciones:
Reducir la dosis de metotrexato en unos 2,5 mg antes de iniciar el tratamiento.
Comprobar el hemograma y la función renal al cabo de una semana de haber iniciado el tratamiento con los AINE.
Repetir la analítica si se incrementa la dosis de los AINE.
Intentar que los AINE no se tomen de forma erratica, ya que sus efectos sobre los valores de metotrexato son difíciles de predecir.
3. Los pacientes deberían siempre comprobar que no existen interacciones con otros fármacos o medicaciones que tomen que no requieren prescripción médica.
4. Se debería suprimir completamente el consumo de alcohol, o al menos mantener un consumo mínimo durante todo el tratamiento.
ESTUDIOS QUE SE DEBEN REALIZAR ANTES DE INICIAR EL TRATAMIENTO CON METOTREXATO
Cribado de enfermedad hepática
1. El metotrexato puede causar mayor hepatotoxicidad si:
Hay antecedentes de ingesta excesiva de alcohol presente o pasada.
Alteraciones persistentes de la biología hepática.
Antecedentes de hepatopatía presente o pasada.
Antecedentes familiares de enfermedades hepáticas hereditarias.
Diabetes, obesidad.
Exposición a fármacos hepatotóxicos.
2. La analítica hepática pretratamiento debería incluir:
Transaminasas, gammaglutamil transpeptidasa (GGT), albúmina, fosfatasa alcalina, bilirrubina.
Serologías para los virus de la hepatitis B y C.
Ferritina.
Anticuerpos antimitocondriales.
Valores séricos de PIIINP.
3. Biopsia hepática pretratamiento:
Si el paciente no tiene factores de riesgo de hepatotoxicidad por metotrexato, y los análisis son normales, incluyendo los valores de PIIINP, no es necesario realizar una biopsia basal.
La biopsia estará indicada en aquellos pacientes cuyos valores de PIIINP sean superiores a 8,0 µg/l, o bien si existen factores de elevado riesgo de hepatotoxicidad.
En caso de considerarse necesaria deberá hacerse bajo control ecográfico y deben de considerarse los riesgos con el paciente (consentimiento informado).
Cribado de enfermedad hematológica
Antecedentes de enfermedad hematológica.
Solicitar analítica que incluya hemograma y valores de folato intraeritrocitario.
Cribado de enfermedad renal
Solicitar analítica que incluya creatinina, urea, electrólitos y sedimento de orina.
Calcular el aclaramiento de creatinina o filtrado glomerular en los pacientes de más de 60 años, los valores de creatinina séricos elevados o los antecedentes que sugieran un daño renal potencial.
Cribado de enfermedad pulmonar
Se han descrito casos de neumonitis y fibrosis pulmonar en asociación con el metotrexato. De todos modos, se trata de un fenómeno infrecuente en los pacientes con psoriasis en tratamiento con dosis bajas de metotrexato. Se debería realizar una radiografía de tórax antes de iniciar el tratamiento porque puede ser útil en caso de que posteriormente aparezcan síntomas respiratorios, y también para descubrir focos de tuberculosis antigua que podría reactivarse como consecuencia del efecto inmunosupresor del metotrexato.
En pacientes fértiles en edad de concebir
El metotrexato es un fármaco teratógeno, por lo que todos los pacientes (varones y mujeres) deberían evitar la concepción durante y hasta 6 meses después de haber finalizado el tratamiento.
En mujeres en edad fértil se deberían realizar tests de embarazo antes de iniciar el tratamiento.
RECOMENDACIONES DURANTE EL TRATAMIENTO CON METOTREXATO Y SEGUIMIENTO
La supervisión del tratamiento debería hacerla siempre un dermatólogo.
Se debe administrar una única dosis semanal, dando al paciente instrucciones claras y por escrito. Un error de dosificación (p. ej., tomar la dosis cada día, en vez de semanalmente) puede ser mortal debido a la mielosupresión que puede provocar.
La pauta en 3 tomas repartidas cada 12 h es poco útil, porque complica la realización del tratamiento, y existe un mayor riesgo de hepatotoxicidad y error en la administración por parte de los pacientes, si son mayores. Además, está basada en la premisa de que, así, se interfería más el ciclo celular del queratinocito. Sólo estaría justificada en caso de náuseas o malabsorción del fármaco.
La dosis inicial de metotrexato es de 5 mg en adultos sanos, y se incrementará en intervalos de 2,5 a 5 mg hasta un máximo de 25-30 mg semanales.
En ancianos o pacientes con afección renal, la dosis inicial debería ser de 2,5 mg semanales.
La dosis de mantenimiento dependerá del control de la enfermedad. No hay que pretender que el paciente esté completamente libre de lesiones.
Los pacientes que reciben una dosis semanal no superior a los 15 mg parecen tener un riesgo muy bajo de hepatotoxicidad.
Todos los pacientes deben tomar concomitantemente 5 mg al día de ácido fólico. A pesar de que hay pautas intermitentes se ha visto que el tomar el ácido fólico a diario no interfiere con la acción del metotrexato, es más cómodo de administrar, y previene los efectos secundarios.
Las primeras 2 semanas, y después de cada aumento de dosis, se debe realizar un control analítico que incluya un hemograma, urea, creatinina, electrolitos y enzimas hepáticas.
El metotrexato es un fármaco de acción lenta y hay que avisar a los pacientes que la respuesta clínica completa para cada aumento de dosis puede tardar varias semanas en alcanzarse.
MONITORIZACIÓN DE LOS PACIENTES EN TRATAMIENTO CON METOTREXATO
Una vez llegado a la dosis de mantenimiento, se debería realizar un análisis de sangre que incluya un hemograma, urea, creatinina, electrólitos y enzimas hepáticas cada 8-12 semanas.
En caso de incrementos del volumen corpuscular medio (VCM) eritrocitario se deberían determinar los valores de folato intraeritrocitario.
Cada 3 meses se deberían determinar los valores de PIIINP.
La biopsia hepática sólo debería realizarse en los pacientes con valores persistentemente elevados de PIIINP (p. ej., superiores a 4,2 ng/ml en varias determinaciones).
PROBLEMAS Y EFECTOS SECUNDARIOS DURANTE EL TRATAMIENTO
Náuseas y vómitos. Pueden ocurrir hasta en un 25% de los pacientes. Aparecen, generalmente, al cabo de 12 h de la ingesta y persisten hasta 3 días después. Para evitarlos, se puede intentar: reducir la dosis, tomar el metotrexato con la comida, administrar el metotrexato por vía intramuscular o subcutánea, o bien fraccionar la dosis en 3 partes y administrar cada parte a intervalos de 12 h. En caso de que el tratamiento antiemético estándar no sea eficaz, se puede administrar ondansetrón 1 h antes y 11 h después de la administración del metotrexato41.
Suplementos de ácido fólico. Un VCM alto en pacientes que toman metotrexato, generalmente, indica una deficiencia relativa de ácido fólico, y se debe tratar con suplementos de ácido fólico (5 mg/día) mientras se continúe el tratamiento con metotrexato. Si, a pesar de los suplementos de ácido fólico y haber excluido otras causas (valores de vitamina B12, alcohol...) el VCM es > 106 fl, se debe suspender el tratamiento con metotrexato.
Tal como se ha indicado previamente, se aconseja prescribir ácido fólico (5 mg/día) de forma sistemática a todos los pacientes en tratamiento con metotrexato, ya que se ha demostrado que el ácido fólico no reduce la eficacia del metotrexato y la mielotoxicidad casi siempre se produce en el contexto de un déficit relativo de ácido fólico.
Mielosupresión. El riesgo de mielosupresión en los pacientes con metotrexato incrementa rápidamente en las siguientes situaciones:
Insuficiencia renal, especialmente en los ancianos.
Administración conjunta de fármacos que reducen su eliminación renal (p. ej., AINE, probenecid) o aumentan la actividad antifolato (p. ej., trimetoprim, sulfonamidas, fenitoína).
Déficit de folato.
Hepatotoxicidad. Hay que tener en cuenta que:
Si las cifras de transaminasa glutámico oxalacética (GOT) y transaminasa glutámico pirúvica (GPT) son superiores a 3 veces el límite superior de la normalidad, se deberá suspender el tratamiento con metotrexato o disminuir su dosis.
Se debe considerar realizar una biopsia hepática si los valores de las enzimas hepáticas o del PIIINP en suero están persistentemente elevadas.
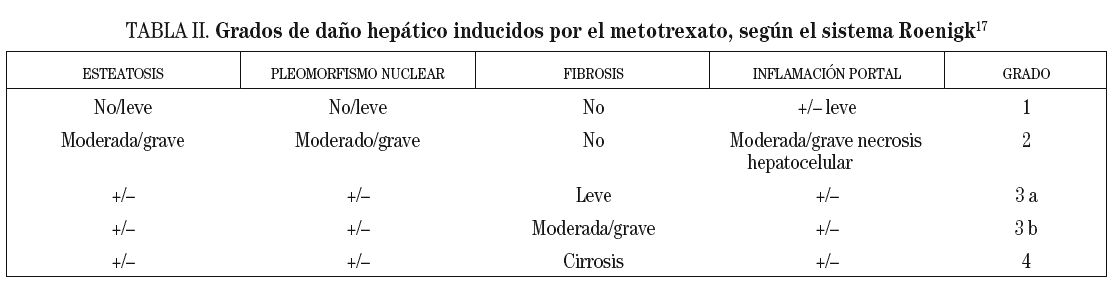
Si la histología hepática muestra una fibrosis severa o cirrosis (grados 3b o 4 de Roenigk17; tabla II) se deberá suspender la administración de metotrexato, a no ser que la enfermedad del paciente sea lo suficientemente grave y no existan alternativas terapéuticas.
Si la histología hepática muestra una fibrosis leve a moderada (grados 2 o 3a de Roenigk) se puede seguir administrando el metotrexato, siempre y cuando se evite estrictamente el consumo de alcohol y se monitorice estrechamente al paciente.
Si la histología hepática indica presencia de fibrosis, se deberá considerar repetir una nueva biopsia hepática después de que se hayan administrado 3 g más de metotrexato.
Toxicidad pulmonar. Esta complicación parece ser más frecuente en los pacientes con artritis reumatoide que toman metotrexato que en la psoriasis. Si aparecen síntomas pulmonares (tos seca, persistente) se debe suspender el metotrexato hasta que se excluya la existencia de toxicidad pulmonar.
Carcinogénesis. El riesgo carcinogénesis del metotrexato parece ser relativamente bajo en comparación con otros tratamientos sistémicos comúnmente utilizados en la psoriasis. De todos modos, existen algunas evidencias de que el metotrexato en combinación con PUVA puede conferir un mayor riesgo de desarrollar cáncer cutáneo, por lo que esta combinación se debería evitar.
Sobredosis. Las manifestaciones de la toxicidad aguda incluyen la mielosupresión, la ulceración de mucosas (sobre todo la oral) y raramente la necrólisis cutánea. Esta última complicación también se observa ocasionalmente en pacientes con psoriasis activa muy extensa cuando se incrementa demasiado rápido la dosis de metotrexato. La sobredosis relativa generalmente está precipitada por factores que interfieren en la excreción renal del metotrexato por interacciones farmacológicas. En estos casos de sobredosis de metotrexato, el antídoto que se debe administrar es el ácido folínico.
Falta de respuesta. La biodisponibilidad del metotraxato oral es muy variable y significativamente baja comparada con la administración parenteral, por lo que en pacientes que presenten una respuesta inadecuada al tratamiento deberíamos plantearnos la posibilidad de la administración subcutánea o intramuscular43-48.
CONCLUSIÓN
El metotrexato es un fármaco muy útil en el tratamiento de la psoriasis. En algunos estudios se ha visto que tiene una eficacia similar a la ciclosporina y que se puede alcanzar una mejoría superior o igual al 75% del PASI en el 60% de los pacientes con psoriasis moderada a grave3. Se trata, además, de un fármaco económico comparado con otras opciones terapéuticas, y que podría administrarse durante períodos prolongados si se siguen correctamente las guías planteadas. Además, la posibilidad de monitorizar la hepatotoxicidad con determinaciones seriadas de PIIINP, evitando las biopsias hepáticas que lo hacen impopular entre dermatólogos y pacientes, pueden ayudar a «redescubrir» este fármaco que en ocasiones queda olvidado en el fondo de saco del arsenal terapéutico dermatológico.