A pesar de que las complicaciones cutáneas en el paciente oncológico secundarias a los agentes quimioterápicos son frecuentes1-3, éstas no siempre son bien conocidas y muchas veces son minusvaloradas por los médicos que habitualmente tratan a estos pacientes, más preocupados por la eficacia antitumoral del tratamiento y otros efectos adversos extracutáneos considerados más graves. Sin embargo, el paciente, probablemente por un mecanismo de defensa y negación de las complicaciones más graves de la enfermedad, muchas veces se preocupa más por problemas secundarios leves, muchos de ellos cutáneos, que empeoran su calidad de vida4.
Hemos dividido esta revisión en dos partes; en la primera abordaremos las complicaciones cutáneas de la quimioterapia estándar, ampliamente conocidas, pero desde un punto de vista práctico recopilando las acciones que podemos recomendar para tratarlas y/o prevenirlas. También hemos incluido los efectos cutáneos, menos conocidos, de la hormonoterapia, que en ocasiones se utilizan como terapia adyuvante en algunos tumores. En la segunda parte profundizaremos en los efectos de los nuevos agentes biológicos.
TOXICIDAD CUTÁNEA DE LA QUIMIOTERAPIA ESTÁNDAR Y LA HORMONOTERAPIALos tratamientos citostáticos, cada vez más agresivos, han permitido que los pacientes con neoplasias puedan sobrevivir largo tiempo libres de enfermedad. La actividad de estos fármacos se centra en las células con un elevado índice mitótico, como sucede con las células tumorales, pero la falta de selectividad hace que puedan afectar a otras células sanas de tejidos con un elevado índice de proliferación. Por ello, esta toxicidad puede afectar a cualquier célula de nuestro organismo; la médula ósea, el tubo digestivo y la piel, junto con sus anejos, son los órganos que se afectan con una mayor frecuencia.
Los efectos colaterales cutáneos de los citostáticos tienen un amplio espectro de manifestaciones y un grado de intensidad muy variado. En ocasiones comportan una modificación de la imagen corporal que puede preocupar al paciente hasta el punto de originar un rechazo al tratamiento4; en otras, produce un deterioro tan importante en la calidad de vida que puede impedir la continuidad de la quimioterapia o al menos obligar a disminuir la dosis1,2.
Básicamente, el efecto de los citostáticos en la piel se produce mediante dos mecanismos patogénicos: a) citotoxicidad directa, que puede dañar cualquier estructura cutánea afectando especialmente a las que tienen un elevado índice mitótico, como ocurre en el estrato basal de la epidermis y el folículo piloso, fenómeno que se produce en mayor o menor grado en todos los pacientes que reciben quimioterapia y su intensidad también depende del tipo de citostático, y b) hipersensibilidad al medicamento, como puede ocurrir con cualquier fármaco, mecanismo que requiere una sensibilización previa y es mucho menos frecuente.
Las complicaciones cutáneas más frecuentes son las secundarias a la toxicidad directa del fármaco en determinadas estructuras celulares de la piel. Las manifestaciones clínicas serán distintas en función de cuáles sean las células lesionadas (tabla I). Aunque algunos cuadros clínicos son comunes a varios fármacos, otros se pueden considerar específicos de alguno de ellos (tabla II).
TABLA I. Entidades clínico-patológicas inducidas por la quimioterapia según la estructura cutánea que se afecta
TABLA II. Fármacos implicados con mayor frecuencia en los distintos cuadros clínicos cutáneos secundarios a la quimioterapia
No obstante, la aparición de lesiones cutáneas en un paciente en tratamiento citostático merece un diagnóstico diferencial amplio, ya que el contexto clínico del paciente obliga a que se deba descartar complicaciones infecciosas, algunos síndromes paraneoplásicos, la posible extensión metastásica del tumor y los déficit nutricionales. Una vez descartados estos procesos, cuando decidimos que el cuadro cutáneo es secundario a los citostáticos, nos encontramos con que el uso frecuente de poliquimioterapia hace que sea difícil saber cuál de los agentes es la causa. Lo que se complica todavía más si tenemos en cuenta que varios agentes pueden tener efectos secundarios similares (tabla II). Ante estas dudas diagnósticas, es responsabilidad del médico determinar cuál o cuáles pueden ser los fármacos causales y, según la gravedad del cuadro, intentar paliar la dermatosis o buscar otras alternativas terapéuticas.
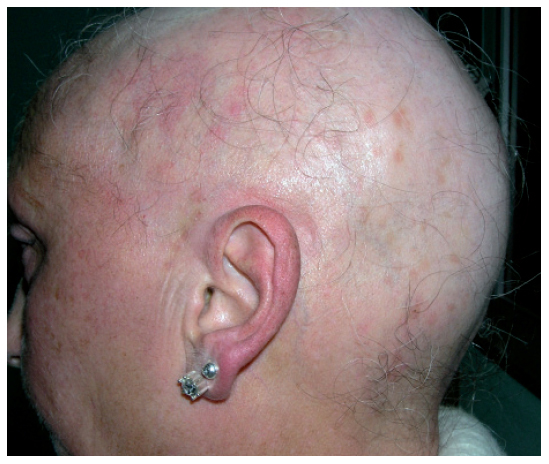
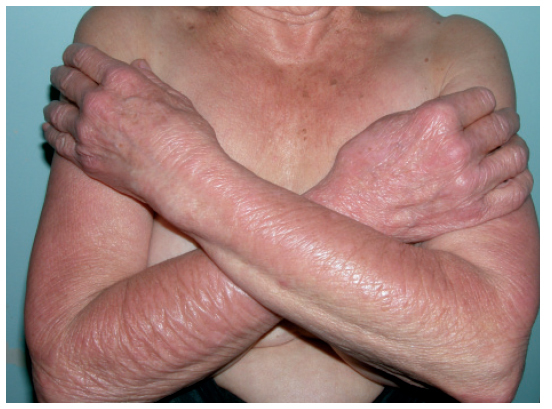
COMPLICACIONES CUTÁNEAS RELACIONADAS CON LA QUIMIOTERAPIA ESTÁNDAR AlopeciaLa caída del cabello tras la administración de citostáticos es uno de los efectos secundarios más frecuentes1,5 (fig. 1) y tiene gran impacto psicológico en el paciente, especialmente en las mujeres y los niños. Este impacto se debe al deterioro de la imagen corporal y puede llegar a ocasionar el rechazo del tratamiento4.
Figura 1. Alopecia difusa casi total aparecida tras varios ciclos de poliquimioterapia.
El mecanismo habitual es el efluvio anagénico secundario al cese brusco de la actividad mitótica de las células de la matriz del folículo piloso. Como consecuencia, el cabello se desprende de la raíz y cae y puede producirse la pérdida total del cabello en pocos días. En ocasiones, este efluvio anagénico se acompaña de un efluvio telogénico secundario a otros factores del estado del enfermo, como pueden ser la desnutrición, otros fármacos, la fiebre o el estrés psicológico. En el efluvio telogénico se produce una pérdida de cabello mayor de lo habitual, pero la alopecia resultante es difusa. Los citostáticos que con mayor frecuencia producen alopecia se resumen en la tabla II.
La alopecia secundaria a la quimioterapia es reversible, pero a menudo el cabello reaparece con cambios en el color y la textura, más seco y fino1. El mecanismo exacto de estos cambios en la calidad del cabello es desconocido3. La intensidad de la alopecia se relaciona con el tipo de agente, la dosis, la duración del tratamiento y la forma de administración, y es más grave en los pacientes sometidos a dosis altas y a poliquimioterapia6.
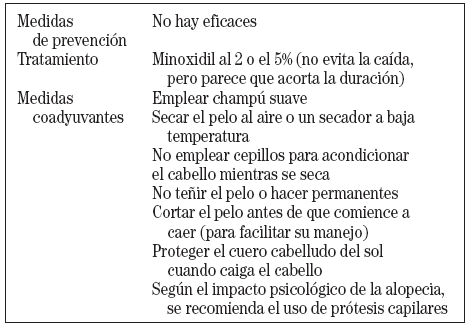
Aunque en los últimos años se han hecho progresos significativos en el conocimiento de la patogenia de la alopecia inducida por quimioterapia, no se ha conseguido un tratamiento específico para ello (tabla III). Como hemos comentado, el problema fundamental para los pacientes se debe a la alteración de su imagen, que con frecuencia produce estrés psicológico. En estos casos, se puede recomendar la utilización de prótesis capilares o pelucas. Años atrás se había recomendado algunas estrategias para evitar este efecto secundario, como el enfriamiento del cuero cabelludo a 24 °C mediante un dispositivo refrigerante que, utilizado durante la quimioterapia, produciría una vasoconstricción cutánea, o la utilización de unas bandas con efecto de torniquete. Actualmente estas medidas no se recomiendan por su escasa efectividad y la posibilidad de que al evitar el efecto de la quimioterapia en la piel del cuero cabelludo puedan desarrollarse metástasis en dicha localización7.
TABLA III. Recomendaciones para el manejo de la alopecia inducida por la quimioterapia8,12
En los últimos años se han publicado numerosos estudios, aún en fase experimental, sobre fármacos orientados a prevenir la alopecia inducida por quimioterapia, aunque de momento no están disponibles para su utilización clínica8. Entre los agentes farmacológicos en estudio se incluyen anticuerpos específicos de fármaco9, modificadores del ciclo del crecimiento del pelo10, citocinas, factores del crecimiento11, antioxidantes, modificadores del ciclo celular o de la proliferación e inhibidores de la apoptosis8. En los modelos animales se ha observado que la mayor parte de estos agentes protectores tienen actividad limitada a un solo agente quimioterapéutico8. En principio, el único agente del que se dispone de experiencia clínica es el minoxidil tópico al 2 o al 5% que, aunque no previene la alopecia, podría reducir su intensidad o acortar su duración12,13.
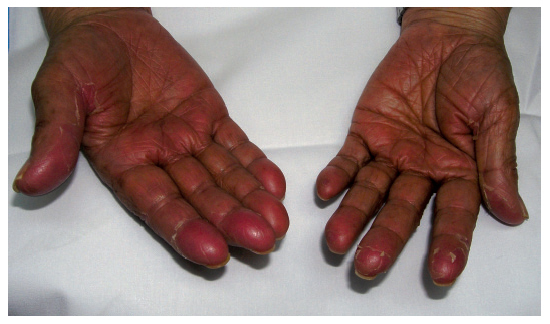
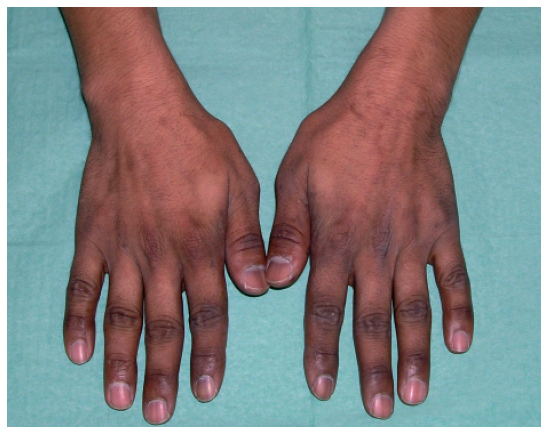
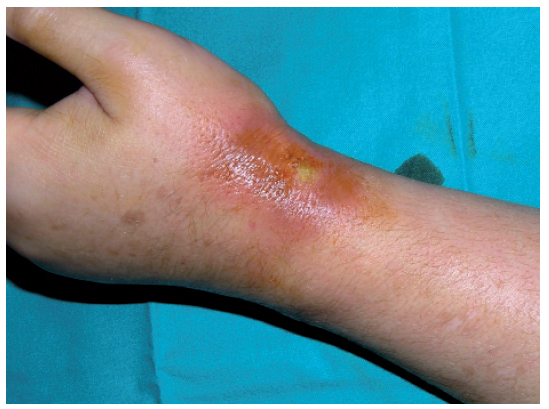
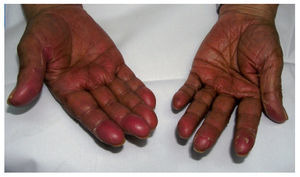
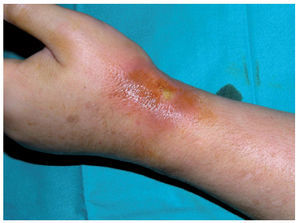
Eritema acral inducido por quimioterapiaLa clínica característica del eritema acral inducido por quimioterapia también se denomina eritrodisestesia y se inicia con la aparición de disestesias en las palmas y las plantas, en las que después aparecen pequeñas placas eritematosas. Suelen localizarse en la cara lateral externa de los dedos y las eminencias tenar e hipotecar de las manos, pero pueden progresar hasta afectar a toda la superficie1,14. En las zonas más inflamatorias pueden aparecer lesiones ampollares15,16. Aunque se afectan con más frecuencia las manos (fig. 2), los pies pueden afectarse como única localización. La clínica cutánea se acompaña de dolor e impotencia funcional que dificulta las actividades diarias1. Tras la retirada de la medicación que lo causa, se produce exfoliación y posterior reepitelización, y reaparece en caso de que se reintroduzca la medicación. Existen varias clasificaciones (tabla IV) en las que los diferentes estadios se estratifican según la intensidad del cuadro. Se ha descrito formas atípicas con una aparición conjunta de un rash morbiliforme en la nuca, el pecho y las extremidades17,18.
Figura 2. Eritema acral secundario a quimioterapia (5-fluorouracilo)
TABLA IV. Clasificación clínica del eritema acral inducido por quimioterapia19
La incidencia del eritema acral es difícil de estimar, ya que dependiendo de las series publicadas oscila en un 260%1,2,19, y la mayoría de los casos son de intensidad leve a moderada19. Su intensidad es proporcional a la dosis administrada y la duración de la infusión. Los fármacos que lo producen con más frecuencia son la citarabina, la doxorubicina y el 5-fluorouracilo, aunque también se ha asociado a otros muchos fármacos (tabla II).
El eritema acral es un efecto colateral importante, ya que es una complicación que limita la dosis de la quimioterapia. Según la serie de 44 casos publicada recientemente por Hueso et al19, fue la causa de reducción de dosis o retirada del tratamiento citostástico en el 29,5% de los pacientes.
Los hallazgos histológicos son inespecíficos y varían según la intensidad clínica de las lesiones; los más habituales son una dermatitis de interfase con espongiosis y necrosis de los queratinocitos y dilataciones del plexo vascular superficial acompañadas de un escaso infiltrado inflamatorio19,20.
No se conoce con exactitud el mecanismo patogénico del eritema acral inducido por quimioterapia. En la actualidad, la hipótesis más probable y aceptada es que la eritrodisestesia palmoplantar es una reacción adversa directa del agente citostático en las células epidérmicas. Esta teoría se basa en la relación directa entre las dosis y la intensidad de las lesiones y los hallazgos histopatológicos comunes a otras entidades producidas por citotoxicidad directa en la epidermis19,21.
La reducción de la dosis, la prolongación del intervalo de administración del fármaco y, en última instancia, la retirada son las únicas medidas terapéuticas que se han demostrado eficaces (tabla V)1,19. Como estrategias preventivas, se ha recomendado el enfriamiento de las manos y los pies durante la administración de la quimioterapia. Esta medida ha obtenido un éxito parcial en la prevención o la disminución de la intensidad del eritema acral asociado a docetaxel o doxorubicina22,23. Además se recomienda no realizar trabajos manuales intensos ni caminar en exceso y evitar el calor local durante el tratamiento.
TABLA V. Recomendaciones en el manejo del eritema acral inducido por la quimioterapia19
Una vez se inicia la clínica, la mayoría de autores coinciden —aunque no existen estudios prospectivos y aleatorizados— en la importancia del cuidado de las heridas para prevenir infecciones, la elevación de las extremidades para reducir el edema, los fomentos fríos seguidos de emolientes y antibióticos tópicos acompañados de pautas analgésicas para aliviar el dolor1,18,24. Los corticoides tópicos potentes se han utilizado con diferente éxito, y obtiene mejores resultados si se administran conjuntamente con el frío local y los emolientes19.
Dentro de los tratamientos sistémicos, la piridoxina (vitamina B6) parece ser el tratamiento más útil. En una reciente serie se ha utilizado a dosis de 300-500 mg/día y ha permitido la continuidad del tratamiento en muchos de los casos19. Se desconoce su mecanismo de acción y se ha propuesto que podría regenerar las fibras nerviosas lesionadas. La prednisona por vía oral puede ser útil en dosis de 1 mg/kg/día, iniciando el tratamiento un día antes y continuando hasta 4 días después de la administración del citostático. Otros tratamientos propuestos son el dimetilsulfóxido tópico al 99%25 y la vitamina E26.
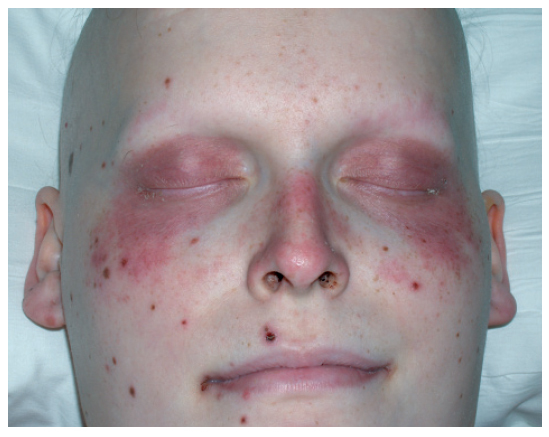
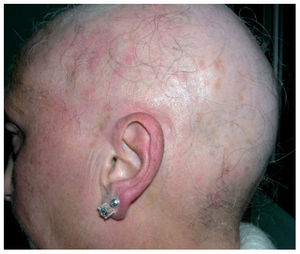
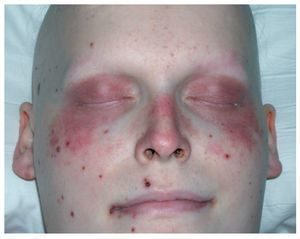
Hidradenitis ecrina neutrofílicaLa hidradenitis neutrofílica ecrina se manifiesta como una erupción muy polimorfa en forma de pápulas, placas o vesículas, que en ocasiones son dolorosas y típicamente se distribuyen en el tronco, las extremidades, la cabeza y la nuca1,2,27. En algunos casos puede presentar una afección periorbital grave (fig. 3) parecida a la celulitis periorbitaria28,29. En ocasiones el cuadro cutáneo se acompaña de un síndrome febril. La erupción suele aparecer entre 3 días y 2-3 semanas tras iniciar la quimioterapia e involuciona sin tratamiento en unas 4 semanas. En un 60% de los casos reaparece al reintroducir la quimioterapia1.
Figura 3. Hidradenitis ecrina neutrofílica de localización periocular.
El 90% de los casos descritos son pacientes con enfermedades oncológicas, fundamentalmente leucemia mieloide aguda o crónica, aunque también se ha descrito en pacientes con cáncer de pulmón, cáncer testicular y cáncer de mama. El fármaco que la produce con mayor frecuencia es la citarabina (tabla II).
Dada la poca especificidad de las manifestaciones clínicas en el contexto del paciente oncológico, para establecer el diagnóstico de hidradenitis ecrina neutrofílica es esencial una biopsia para el estudio histológico y de cultivos microbiológicos. El diagnóstico diferencial clínico es amplio e incluye complicaciones infecciosas (sepsis con émbolos sépticos), vasculitis, leucemia cutánea, hipersensibilidad por drogas, urticaria, eritema multiforme y dermatosis neutrofílicas como el síndrome de Sweet o un pioderma gangrenoso atípico2,30.
Sin embargo, la histología es bastante característica27,31, ya que la diana principal es el ovillo glandular ecrino. La epidermis, por lo general, no está afectada, y si hay alguna anormalidad, suele ser una discreta espongiosis, vacuolización de las células basales, paraqueratosis o necrosis focal de queratinocitos. La clave es el infiltrado de polimorfonucleares alrededor de las glándulas ecrinas desde el glomérulo al acrosiringo. Hay degeneración vacuolar de las células epiteliales de las glándulas ecrinas, que puede llegar a la necrosis. Además puede observarse metaplasia escamosa ecrina. Otros hallazgos son edema dérmico difuso, a veces hemorrágico, e infiltrado difuso de linfocitos, macrófagos y eosinófilos. La erupción también se ha detectado en pacientes con neutropenia grave; en estos casos el infiltrado está compuesto fundamentalmente por linfocitos32,33.
La patogenia de esta reacción no está clara, y se ha planteado la posibilidad de un efecto tóxico directo en las glándulas ecrinas debido a la secreción del quimioterápico a través de ellas34,35.
Sigue un curso autolimitado y no tiene un tratamiento específico. La utilización de corticoides es controvertida, ya que pueden disminuir el componente inflamatorio, pero su uso está limitado por la inmunosupresión del paciente36. En algunos casos recurrentes se ha recomendado tratamiento con dapsona, aunque la utilidad de este fármaco no está bien establecida37.
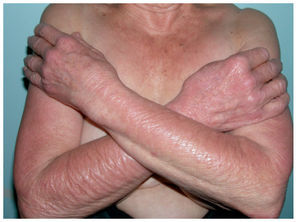
HiperpigmentaciónEs un efecto secundario común que puede producirse por un elevado número de quimioterápicos y afectar a la piel (fig. 4), las mucosas, las uñas y el cabello. Según los fármacos implicados, se han descrito varias formas de presentación (tabla II). Un ejemplo es la bleomicina, que puede dar una hiperpigmentación difusa, pero el patrón más frecuente y característico es una hiperpigmentación lineal de aspecto flagelado, que marca las zonas donde se habían producido pequeños traumatismos, como el roce de la ropa, aunque también puede dar hiperpigmentación difusa2,38,39. Otros fármacos como el busulfán y la ciclofosfamida se asocian a hiperpigmentaciones más difusas. El docetaxel se ha asociado a una hiperpigmentación de la piel supravenosa tras la infusión intravenosa40. En algunos casos se puede observar hiperpigmentación en las uñas y las mucosas.
Figura 4. Hiperpigmentación difusa por doxorubicina.
Los mecanismos de la hiperpigmentación son desconocidos; por un lado, se ha atribuido a un efecto tóxico en los melanocitos que induce un aumento en la producción de la melanina1,3. Otras teorías postulan mecanismos más complejos como un flujo creciente de la sangre a ciertas áreas, lo que produciría un depósito del fármaco en la piel, con el consiguiente aumento en la pigmentación, o la toxicidad directa en la piel causada por la secreción del fármaco en el sudor1. Otras especulaciones apuntan a anomalías endocrinas con alteraciones en las corticotropinas, los inhibidores de la tirosinasa y la hormona estimuladora de los melanocitos, que dan como resultado la pigmentación de la piel1.
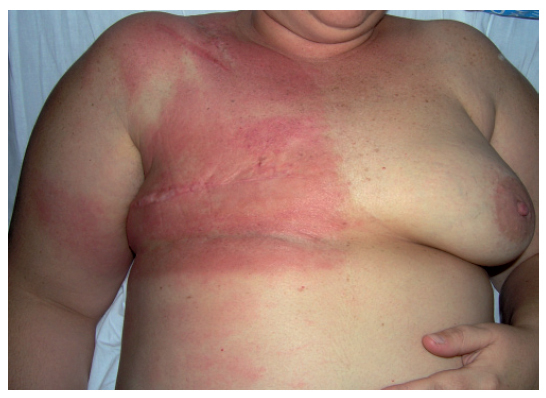
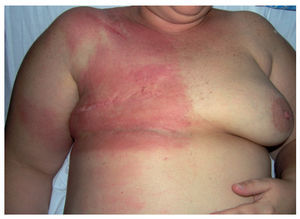
Erupciones por efecto recuerdo o fenómeno de recallLa dermatitis por efecto recuerdo o fenómeno de recall se define por la aparición de una reacción inflamatoria cutánea de diferente intensidad que aparece tras la administración de un fármaco, generalmente quimioterápico, y se circunscribe al área previamente irradiada1,41,42. El inicio de los síntomas suele ocurrir pasados días o varias semanas después de la exposición al fármaco precipitante, aunque no se ha establecido un lapso fijo 43,44. Las manifestaciones cutáneas suelen comenzar como dolor o eritema doloroso, que puede acompañarse de vesiculación, descamación, prurito e hinchazón (fig. 5), y en casos graves, hasta necrosis o ulceración41.
Figura 5. Erupción recall, en paciente con neoplasia de mama y antecedentes de irradiación previa, aparecida a la semana de tratamiento citostático con docetaxel.
La intensidad de las reacciones recall depende del periodo entre la radioterapia y la quimioterapia, así como de la dosis de la radiación recibida inicialmente por el paciente. Está bien documentado que las reacciones más graves tienden a ocurrir cuando el intervalo entre ambos tratamientos es corto45. Aunque se ha descrito preferentemente en la piel, puede afectarse cualquier órgano que se haya sometido a radioterapia46,47.
Este fenómeno se ha relacionado con una gran variedad de fármacos, sobre todo las antraciclinas y los taxanos (tabla II). Se ha descrito un caso de reacción de recuerdo en forma de nódulos que aparecieron en las zonas de venopunción de infusiones antiguas del citostático48.
Hay pocos casos publicados con estudio histológico, y los hallazgos varían según la intensidad clínica49. Los hallazgos más frecuentes son una hiperqueratosis folicular, en ocasiones con formación de pústulas y cambios psoriasiformes en la epidermis. En la dermis suelen producirse cambios de radiodermatitis crónica, con áreas de esclerosis dérmica, dilatación vascular con atipia en las células endoteliales y grados variables de atipia en otras células estromales41.
La patogenia de esta reacción actualmente es desconocida, pero se teoriza que puede ser causada por un defecto de la reparación del ADN causado por la radioterapia previa que puede favorecer que se genere una reacción inflamatoria tras la quimioterapia1. También se ha planteado un mecanismo de acción no basado en la citotoxicidad inducida, sino en una reacción de hipersensibilidad a fármacos idiosincrásica, que no tendría una base inmunitaria41,50.
Entre los fenómenos de recall se han incluido dos variedades41 que, aunque tienen unas características diferenciales, cuentan con unos hallazgos comunes al cuadro clínico clásico: la dermatitis de incremento de la radiación y la dermatitis de recuerdo inducida por radiación ultravioleta.
Dermatitis de incremento de la radiación. La dermatitis de incremento de la radiación se debe a un efecto aditivo y a veces sinérgico producido por aumento de la toxicidad de la radiación cuando se administran quimioterápicos de forma conjunta o pocos días después51,52. Clínicamente es similar a una dermatitis de recall y también se manifiesta con lesiones cutáneas inflamatorias que pueden ser desde un leve eritema a una necrosis cutánea en la zona irradiada (fig. 6)3. Los agentes que la producen con mayor frecuencia son la bleomicina, la actinomicina, la doxorubicina, el fluorouracilo, la hidroxiurea, la 6-mercaptopurina y el metotrexato. Se han buscado posibles explicaciones para estos efectos sinérgicos, entre los que se encuentran un incremento del flujo sanguíneo y, por lo tanto, una reoxigenación celular, el aumento del porcentaje de células en la fase sensitiva del ciclo, la interferencia de la reparación de la lesión inducida por la radiación, con descenso de la capacidad de las células para recuperarse del daño subletal, y la competición por las enzimas de reparación o bloqueo de los procesos de reparación, que podrían permitir una mayor apoptosis celular por el segundo agente41.
Figura 6. Erupción por incremento de la radiación en paciente con radioterapia y quimioterapia concomitantes.
Dermatitis de recuerdo inducida por radiación ultravioleta. Este cuadro se ha descrito fundamentalmente por metotrexato, aunque se han publicado casos por otros fármacos53. Desde el punto de vista clínico, se caracteriza por la aparición tras la administración del fármaco de una dermatosis que se limita a una zona que previamente ha sido expuesta a la radiación ultravioleta. Normalmente estas lesiones se resuelven de forma espontánea en horas a semanas tras suspender el fármaco que las ha desencadenado, de manera que el tratamiento habitualmente es sintomático. Se suelen pautar corticoides tópicos o sistémicos, según la intensidad de la reacción, especialmente en los pacientes que necesiten seguir con la quimioterapia. Dado que la intensidad de este cuadro disminuye al aumentar el intervalo entre ambos factores, parece ser que en nuevas administraciones del fármaco la gravedad de la erupción es cada vez menor, aunque no hay datos concluyentes en la bibliografía41.
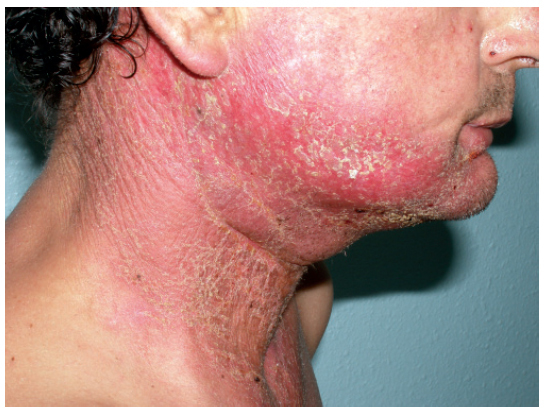
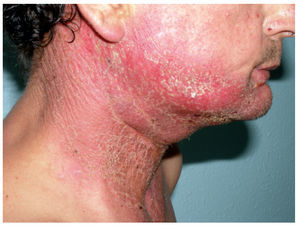
FotosensibilidadEl aumento en la sensibilidad a la radiación ultravioleta puede suceder tras la exposición a múltiples quimioterápicos (tabla II). Ésta se puede manifestar de distintas formas, como una tendencia al eritema, quemaduras, hiperpigmentación y erupción tras la exposición solar54-56. En algunos casos, tras la fase eritematosa la erupción puede desaparecer o dejar una hiperpigmentación residual3,57. En casos graves se produce una reacción fototóxica que puede inducir necrosis epidérmica subtotal. Esta respuesta se observa sobre todo en áreas expuestas al sol, como la cara, la zona del escote, la nuca, el dorso de las manos y los antebrazos (fig. 7). El diagnóstico se basa en la observación de la localización de las lesiones y el antecedente de la administración del fármaco y la exposición a la radiación ultravioleta, generalmente por exposición solar.
Figura 7. Erupción fotosensible en paciente en tratamiento con 5-fluorouracilo.
Los fármacos implicados con mayor frecuencia son la dacarbacina, el fluorouracilo (tópico y sistémico), el tegafur y la vinblastina (tabla II).
El mecanismo de la sensibilización al sol es desconocido, aunque se han propuesto mecanismos secundarios al daño causado en el ADN por los quimioterápicos que alterarían la respuesta celular a la radiación ultravioleta58.
En algunos pacientes tratados con mercaptopurina se ha observado fotoonicólisis. Este cuadro aparece a partir de las 2 semanas de exposición al fármaco y se manifiesta con onicólisis del tercio distal de la uña junto con eritema y dolor a la palpación1.
Evitar la exposición solar y usar fotoprotectores previene la aparición de la fototoxicidad por citostáticos59. Una vez establecida, se recomienda tratamiento con corticoides tópicos, aunque en casos graves puede ser necesaria la administración de corticoides sistémicos.
ExtravasaciónUna de las complicaciones más graves de la administración intravenosa de citostáticos es su extravasación. Se considera extravasación la salida del líquido de perfusión que contiene el o los citostáticos hacia los tejidos circundantes, bien debido a factores intrínsecos del vaso, bien por desplazamiento de la cánula fuera de la vena. Su incidencia se ha valorado entre el 0,1 y el 6% según las series60, aunque probablemente la incidencia real sea más alta, ya que no se suele registrar extravasaciones leves. La gravedad del cuadro está relacionada con el tipo de quimioterápico y la cantidad y la concentración administradas61-63.
Los agentes citostáticos pueden clasificarse en función de su capacidad de agresión tisular en vesicantes (originan necrosis una vez extravasados), irritantes (originan irritación y escasa necrosis) y no agresivos (no originan daño e incluso pueden administrarse por vía intramuscular sin peligro) (tabla VI). El agente más vesicante es la doxorubicina (fig. 8) y el segundo lugar en frecuencia lo ocupan el resto de las antraciclinas y los alcaloides de la vinca.
TABLA VI. Clasificación de los citostáticos según su potencial para producir daño local64
Figura 8. Placa infiltrada que apareció tras la extravasación de doxorubicina (vesicante). Después de 2 meses, la lesión mostraba escasa tendencia a la curación.
Los agentes irritantes causan reacción inflamatoria local, que puede curar con cicatrización e hiperpigmentación pero difícilmente originan necrosis cutánea. Los vesicantes pueden producir necrosis cutánea; los síntomas son muy sutiles al inicio y pueden aparecer, muchas veces días o semanas después de la extravasación. En los casos en que la cantidad extravasada es abundante, se forma una escara necrótica amarillenta que llega a ulcerarse y persiste mucho tiempo, incluso meses. La úlcera no suele mostrar tendencia a la granulación ni a la reepitelización. En los casos más graves pueden afectarse estructuras profundas como tendones, vasos o nervios, y si no son tratados adecuadamente, pueden dejar secuelas cicatrizales graves como síndromes de compresión nerviosa, contractura de articulaciones, daño neurológico irreversible, distrofias simpáticas reflejas, etc.64. Su evolución puede afectar a la funcionalidad de la extremidad donde se ha producido y, en los casos más graves, puede ser necesaria su amputación.
Una extravasación no siempre se manifiesta de una forma clara. El paciente puede presentar alguno o varios síntomas en la zona de administración, como dolor, picor o quemazón, eritema o palidez, hinchazón y/o piel fría o caliente.
La adopción de medidas preventivas es muy importante. Es muy recomendable el uso de vías centrales para la administración de agentes irritantes y vesicantes, pues permite evitar los riesgos de una extravasación periférica65 (tabla VII), aunque excepcionalmente se ha producido extravasación de la vía central con consecuencias muy graves en forma de pleuritis, neumonitis, celulitis64.
TABLA VII. Recomendaciones en el manejo de la extravasación de quimioterápicos64,65
En caso de detectarse una extravasación, se recomienda suspender inmediatamente la infusión del fármaco sin retirar la vía, y a través de ésta debe aspirarse tanto citostático como sea posible64. En la tabla VII se resumen la recomendaciones habituales para esta complicación. Se ha comprobado que sólo un tercio de las extravasaciones de agentes vesicantes evoluciona a la ulceración, por lo que en general el desbridamiento quirúrgico del tejido necrótico se reserva hoy en día para los casos en que haya dolor intratable o úlceras sin tendencia a la epitelización64.
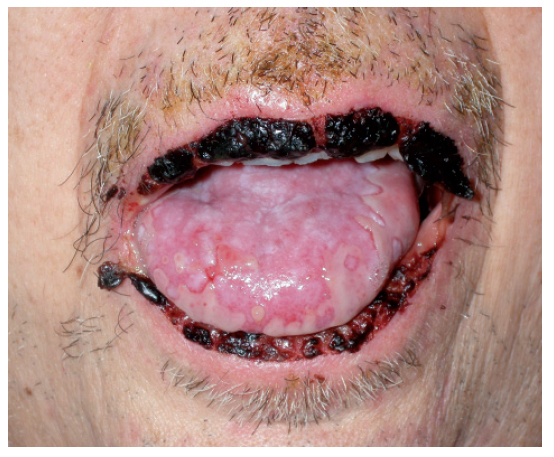
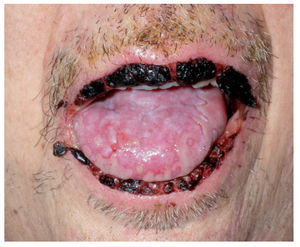
MucositisLas complicaciones orales son uno de los principales problemas de la terapia de los pacientes con cáncer. Un 40% de los pacientes que reciben quimioterapia y hasta un 76% de los pacientes trasplantados de médula ósea tienen problemas bucales, de los que la mucositis es la más frecuente1,2,66. La clínica se inicia con sequedad de boca, dificultad en la deglución, quemazón, hormigueo en los labios y dolor. Se pueden presentar diferentes grados de afección, desde un mínimo eritema, edema o sensación de quemazón hasta grandes y dolorosas úlceras que impiden la alimentación por vía oral (fig. 9) y requieren la administración de analgésicos potentes (tabla VIII). La localización habitual de las lesiones es el epitelio no queratinizado: paladar blando, mucosa vestibular, cara interna de labios, cara ventral de la lengua y suelo de la boca66. En ocasiones la clínica se complica con infecciones por cándidas o herpes simple, dada la inmunosupresión inducida por la quimioterapia.
Figura 9. Mucositis secundaria a poliquimioterapia.
TABLA VIII. Clasificación de la mucosistis producida por quimioterápicos según la OMS
Los mecanismos etiopatogénicos de la mucositis son mixtos, en principio debidos a una toxicidad directa del fármaco que causa un ataque indiscriminado a todas las células con un índice rápido de proliferación, acompañado por mecanismos indirectos secundarios a la inhibición de la médula ósea que favorecerían la sobreinfección y las hemorragias66,67. Los síntomas derivados de la toxicidad directa se observan precozmente, a los 4-7 días, mientras que los derivados de la mielosupresión aparecen más tarde. Dadas la frecuencia y la importancia clínica de esta complicación, se han diseñado numerosas guías terapéuticas68-70 y se han publicado numerosos artículos, muchos de ellos con pocos pacientes, que recomiendan la utilización de diferentes productos. A continuación se resumen las principales recomendaciones estableciendo una división entre las medidas preventivas y las recomendadas en caso de mucositis ya instaurada (tabla IX).
TABLA IX. Recomendaciones en el manejo de la mucositis inducida por quimioterapia68-71
Las medidas preventivas incluyen la limpieza con un cepillo de cerdas suave y el enjuague con productos que no contengan alcohol68; se puede utilizar agua, suero salino, agua con bicarbonato o con agua oxigenada1. Estos dos últimos con moderación, ya que algunos estudios apuntan que se debe evitar el uso de bicarbonato porque aumenta la alcalinidad de la mucosa oral y disminuye las propiedades bactericidas de la saliva71. Por otro lado, el agua oxigenada empleada en exceso podría interferir con la cicatrización de lesiones de la mucosa. La importancia de los enjuagues radica en su utilidad para eliminar las partículas de alimentos que se pueden acumular y ocasionar crecimiento bacteriano.
Los labios deben conservarse perfectamente hidratados con cremas hidratantes labiales o soluciones de metilcelulosa.
La crioterapia, que consiste en masticar suavemente trocitos de hielo, se ha demostrado eficaz para la prevención de la mucositis inducida por quimioterapia. Esta técnica produce vasoconstricción local, con lo que se disminuye el flujo sanguíneo de la mucosa oral y con ello la exposición al citostático. Diversos estudios realizados en pacientes tratados con 5-fluorouracilo y melfalán han demostrado su utilidad72,73.
La aplicación de algunos protectores de la mucosa para disminuir el dolor bucal por la mucositis, como el sucralfato y el hidróxido de magnesio, han mostrado resultados dispares66,74. El sucralfato es un fármaco antiulceroso protector de la mucosa digestiva que actúa formando una barrera protectora, además de incrementar la producción local de prostaglandina E2. Sin embargo, los estudios concluyen que el sucralfato parece ser más efectivo en la prevención de la mucositis inducida por quimioterapia que en su tratamiento una vez instaurada70.
En pacientes con neoplasias hematológicas, se ha recomendado la palifermina, también conocida como factor de crecimiento 1 del queratinocito, que actúa a través del receptor KGF. Este fármaco ha sido aprobado para disminuir la prevalencia y la duración de la mucositis oral grave75. En un ensayo aleatorizado y controlado con placebo, la palifermina también redujo la incidencia de mucositis oral en los pacientes con cáncer colorrectal metastásico tratado con quimioterapia basada en fluorouracilo76. De momento no se recomienda en otros tumores, dado que algunos de ellos podrían expresar receptores de KGF y, teóricamente, ser estimulados por ligandos de receptores de KGF.
Entre las estrategias terapéuticas, recientemente algunos autores77 han ensayado un protector de la mucosa oral constituido por polivinilpirrolidona y ácido hialurónico, que se mostraría eficaz tanto en la disminución del dolor bucal como en la reducción del grado de mucositis. Su mecanismo de acción local es formando una barrera protectora que evitaría la estimulación de las terminaciones nerviosas expuestas. Su administración se recomendaría en fases precoces de mucositis (grados III de la OMS) tres veces/día, 1 h antes de las comidas (tabla IX).
Para controlar el intenso dolor que acompaña a la mucositis, se han recomendado agentes anestésicos tópicos como el elixir de difenhidramina, la benzocaína y la lidocaína viscosa. De éstos, el más utilizado es la lidocaína, un anestésico local de tipo amida que se puede administrar tópicamente en forma de gel o solución a concentraciones del 1-5%66,70.
Las guías más recientes70 no hallan evidencias que recomienden el uso de pentoxifilina como prevención de la mucositis ni el uso del factor estimulador de colonias de granulocitos, ya que no se ha demostrado que ofrezca resultados positivos en la duración o la intensidad de la mucositis.
OnicopatíasLas uñas son una parte del organismo especialmente vulnerable a la quimioterapia, ya que estos fármacos se incorporan a ellas mediante un doble mecanismo. Por un lado se depositan en la matriz ungueal a través del flujo sanguíneo y se incorporan a través del lecho ungueal durante el crecimiento desde la lúnula hasta el inicio del margen libre. Las anormalidades ungueales son el resultado de toxicidad en los distintos constituyentes de las uñas, como la matriz ungueal, el lecho ungueal, los tejidos periungueales y los vasos sanguíneos78.
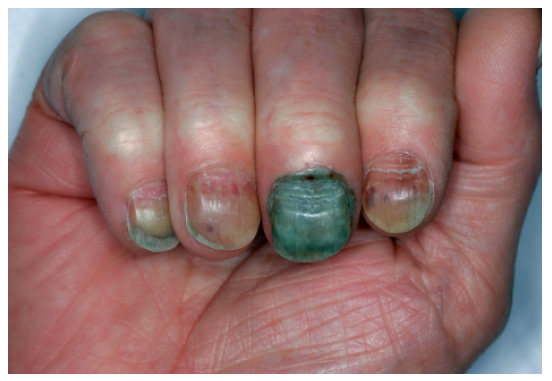
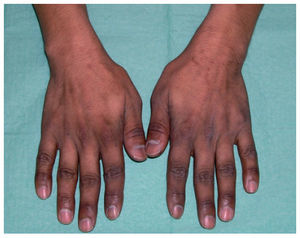
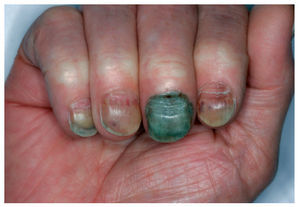
Las alteraciones ungueales derivadas de la administración de los agentes antineoplásicos son múltiples y se resumen en la tabla X. La fisiopatología exacta de la toxicidad ungueal se desconoce. Aun así, se cree que la pigmentación ungueal es el resultado de los efectos tóxicos en la matriz ungueal que inducen la activación de melanocitos. La aparición de hemorragias en astilla y hematomas subungueales podría explicarse por la trombocitopenia y las anormalidades vasculares inducidas por los citostáticos. Las líneas de Beau son secundarias a la disminución transitoria de la actividad mitótica de la matriz ungueal (fig. 10), cuyo resultado es un adelgazamiento focal de la lámina ungueal. Clínicamente aparecen a las 4-8 semanas de administración del quimioterápico y afecta a todas las uñas79. La noxa aguda al repliegue ungueal dorsal produce la paroniquia, mientras que el daño al lecho y la lámina ungueales causa la onicólisis79.
TABLA X. Alteraciones ungueales asociadas a quimioterapia78
Figura 10. Líneas de Beau aparecidas a los 2 meses de iniciar tratamiento citostático. Además se observa sobreinfección secundaria por Pseudomonas en la uña del tercer dedo.
Muchas veces es complejo evaluar si las alteraciones ungueales aparecidas en el paciente oncológico se deben al tratamiento cistostático o son una combinación de más factores. Es decir, debido al estado de inmunosupresión del paciente, es frecuente la sobreinfección de las uñas ya alteradas por bacterias (fig. 10) u hongos, por lo que es recomendable el control por el dermatólogo y la realización de exploraciones complementarias, especialmente cultivos microbiológicos.
No existe un tratamiento específico para la toxicidad ungueal inducida por quimioterapia, y en la mayoría de los casos es transitoria y desaparece progresivamente una vez se retira el fármaco. En caso de que se demuestre sobreinfección bacteriana o fúngica, se ha de tratar con los fármacos específicos para ello. Actualmente se está estudiando la eficacia de usar durante la aplicación del fármaco guantes congelados, que causarían una vasoconstricción inducida por frío y reducirían la cantidad de fármaco que llega a los componentes ungueales80.
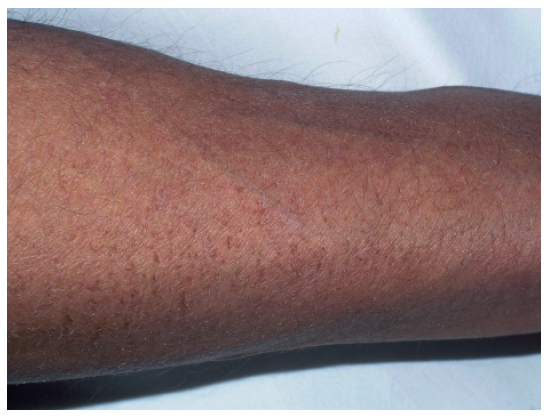
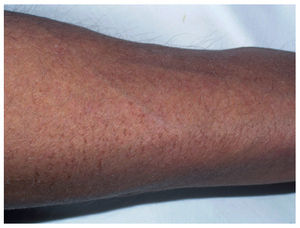
XerosisLa xerosis probablemente sea uno de los efectos secundarios observados con más frecuencia en los pacientes oncológicos, aunque muchas veces esté minusvalorado porque el paciente tiene otras complicaciones más graves.
Desde el punto de vista patogénico, la xerosis y la atrofia cutánea que observamos en estos pacientes pueden relacionarse con la acción antiproliferativa y citostática de los fármacos en la epidermis, particularmente en la capa basal81, la lámina basal y las microfibrillas de la dermis papilar82. Además de este efecto relacionado con los fármacos, otros factores del contexto del paciente oncológico como la inmunosupresión, la desnutrición y las frecuentes anemia e hipoproteinemia también influyen en la aparición de la xerosis.
La clínica característica es de xerosis (fig. 11) y descamación que a veces se acompaña de prurito. El tratamiento es la hidratación adecuada con emolientes y la utilización de jabones suaves. En un estudio realizado en pacientes sometidos a quimioterapia, tras 3 semanas de tratamiento con una solución de lavado y un emoliente de pH 5,5, se ha observado un incremento significativo del grosor del estrato córneo y una disminución de la pérdida transdérmica de agua, lo cual indica una restauración de la función de barrera de la epidermis; también aumentó la cantidad de sebo y mejoraron los síntomas83. En las escamas y la hiperqueratosis resultan efectivas las preparaciones con lactato de amonio y urea, aunque deben usarse con precaución en pieles sensibles84.
Figura 11. Xerosis intensa, casi ictiosiforme, en paciente en tratamiento con citostáticos.
COMPLICACIONES CUTÁNEAS DE LA HORMONOTERAPIA PARA EL CÁNCEREn algunos tumores cuyo crecimiento es hormonodependiente, el bloqueo de estos estímulos hormonales constituye una parte importante del tratamiento. El efecto fundamental de la hormonoterapia es alterar la producción o impedir la acción de hormonas como estrógenos o testosterona en los órganos diana. La indicación fundamental de este tratamiento son los antiestrógenos en el cáncer de mama y los antiandrógenos en el cáncer de próstata.
Los antiestrógenos compiten con los estrógenos por los receptores, e impiden que los segundos ejerzan su acción en los distintos órganos. Como consecuencia de la anulación del efecto de los estrógenos, en las mujeres produce una situación de menopausia inducida. En la piel los efectos de los estrógenos son variados y beneficiosos85, y su defecto se traduce en una piel más seca, más sensible a las agresiones, con aparición temprana de arrugas por pérdida de la densidad de la dermis (aspecto envejecido) y con problemas para la cicatrización. Para contrarrestar estos efectos se aconseja el uso de emolientes o cremas faciales antiedad.
En el caso del tamoxifeno, uno de los principales fármacos antiestrógenos, se han descrito además casos de fenómenos de recall y vasculitis86,87.
Los efectos de los fármacos antiandrógenos en la piel son similares a los descritos por los fármacos antiestrogénicos, con un aumento de la sequedad y disminución de la elasticidad. También se han descrito varios casos de fotosensibilidad inducida por flutamida88.
Correspondencia: Dra. M.J. Fuente.
Servicio de Dermatología. Hospital Universitari
Germans Trias i Pujol.
Ctra. del Canyet, s/n. 08916 Badalona. Barcelona. España.
Correo electrónico: mjosefuente@hotmail.com