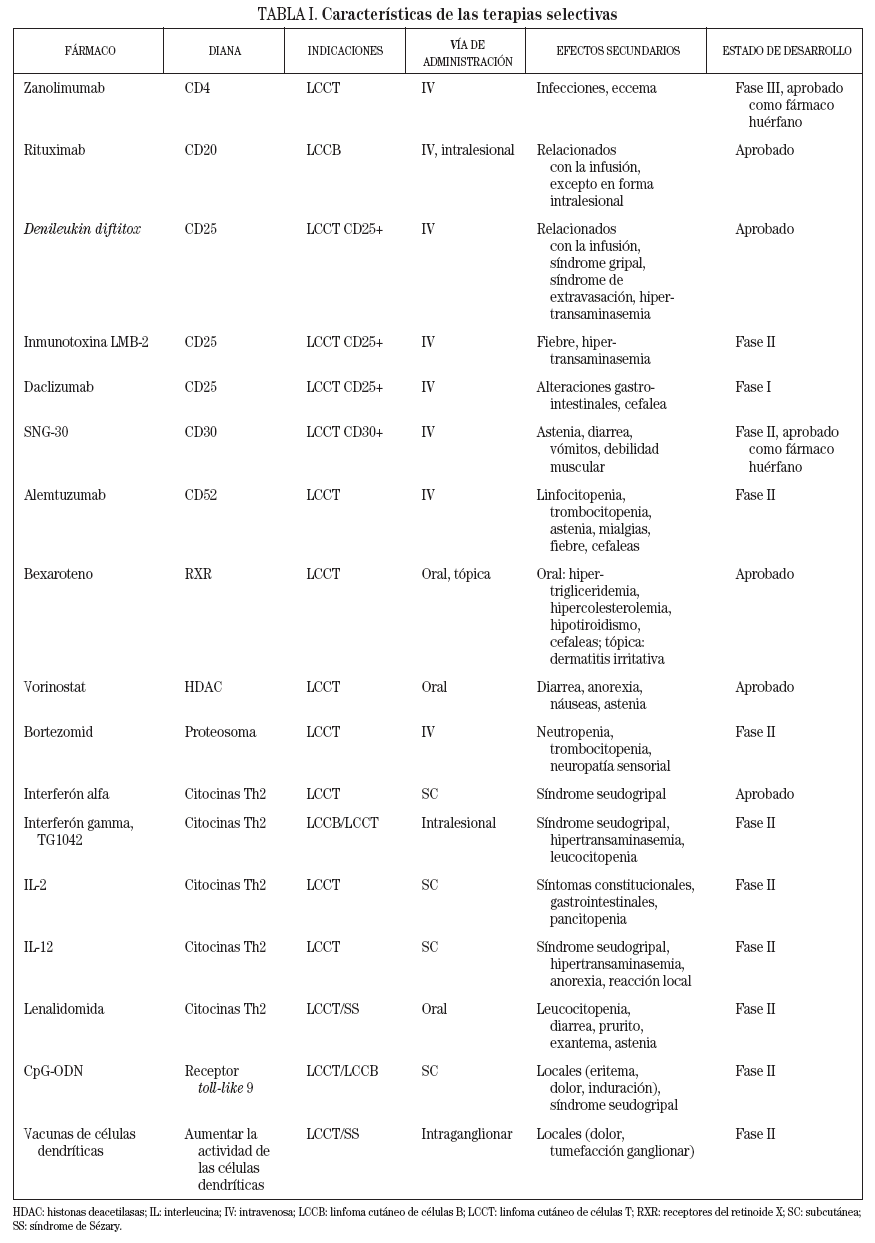
- Zanolimumab es un anticuerpo monoclonal contra el antígeno CD4 y está aprobado como fármaco huérfano para el tratamiento de la micosis fungoide rebelde al tratamiento.
- Rituximab es un anticuerpo monoclonal contra el antígeno CD20 que está indicado para el tratamiento de linfomas no hodgkinianos de células B de bajo grado y se ha empleado con éxito de forma intralesional en linfomas cutáneos.
- Denileukin diftitox es una proteína de fusión que combina toxina diftérica e interleucina (IL) 2 y está indicada para el tratamiento de pacientes con linfoma cutáneo de células T persistente o recurrente que expresa el receptor CD25.
- SNG-30 es un anticuerpo monoclonal contra el antígeno CD30 que ha sido aprobado como fármaco huérfano para el tratamiento del linfoma cutáneo de células T CD30 positivo.
- La enzastaurina y la lenalidomida son fármacos con actividad contra el LCCT que tienen biodisponibilidad oral y actualmente se encuentran en ensayos de fase II.
- El bexaroteno es un retinoide con elevada afinidad por los receptores del retinoide X con biodisponibilidad oral y tópica que está aprobado para el tratamiento del linfoma cutáneo de células T.
- El vorinostat es el primer inhibidor de las histonas deacetilasas aprobado para el tratamiento del linfoma cutáneo de células T y tiene biodisponibilidad oral.
- La progresión de la micosis fungoide se caracteriza por una respuesta inmunitaria Th2 con aumento en la producción de las citocinas Th2 (IL-4, IL-5, IL-10) y disminución de las citocinas Th1 (interferón alfa y gamma e IL-12).
- Las novedades en el tratamiento con citocinas incluyen la utilización de interferón gamma pegilado, vectores adenovirales para aumentar la vida media (TG1042) y la combinación de citocinas con actividad sinérgica (IL-2 e IL-12).
- Los agonistas de receptores toll-like, entre los que se encuentra el imiquimod, incrementan la producción de citocinas Th1 (interferón alfa, IL-12).
Los linfomas cutáneos constituyen un grupo de linfomas no hodgkinianos (LNH) poco frecuentes. De los linfomas cutáneos primarios, la gran mayoría, cerca del 80%, corresponde a linfomas de células T y el 20% restante, a linfomas de células B. Esta proporción es justamente la inversa en los LNH ganglionares.
Los avances terapéuticos se han visto comprometidos por la escasa incidencia de estas neoplasias y la naturaleza indolente de la mayor parte de los casos. No obstante, el mayor conocimiento de la patogenia a escala molecular en el sistema inmunitario, sobre todo de la micosis fungoide (MF) y los linfomas B ganglionares, ha permitido el desarrollo de terapias selectivas.
DIANAS TERAPÉUTICASLas terapias selectivas se pueden clasificar en las que tienen diana en las células tumorales (receptores de superficie, receptores intranucleares y complejos enzimáticos) y las que la tienen en el microambiente tumoral (citocinas, células dendríticas). En esta revisión se excluyen los fármacos de reciente desarrollo pertenecientes al grupo de quimioterápicos citotóxicos, como los análogos de los nucleósidos (sapacitabina) y los inhibidores de la purina nucleósido fosforilasa (forodesina). En la tabla I se resumen las principales características de los fármacos desarrollados.
TABLA I. Características de las terapias selectivas
DIANAS EN LAS CÉLULAS TUMORALESReceptores de superficieAntígeno CD4. El antígeno CD4 se expresa en las células T cooperadoras, monocitos y macrófagos. Es el correceptor del complejo mayor de histocompatibilidad (CMH) II, está implicado en la activación y la diferenciación de los linfocitos T y constituye el fenotipo del infiltrado tumoral en la mayoría de los pacientes con micosis fungoide. Contra este receptor, se ha desarrollado un anticuerpo monoclonal humano de alta afinidad, zanolimumab, que actualmente se encuentra en ensayos de fase III (Hx-CD4-110, NCT [National Cancer Trial] 00127881) para MF y síndrome de Sézary (SS) rebeldes al tratamiento. Los ensayos de fase II han demostrado una tasa de respuestas del 56% en los pacientes con linfoma cutáneo de células T (LCCT) rebelde al tratamiento que recibieron las dosis más elevadas (560 y 980 mg en infusiones semanales)1. Tras el tratamiento de 17 semanas, se mantuvo una respuesta con una duración mediana de 81 semanas. Los efectos secundarios más frecuentes fueron infecciones leves y eccema. Ha sido designado fármaco huérfano para el tratamiento de MF resistente tanto en Estados Unidos como en Europa.
Antígeno CD20. El antígeno CD20 se expresa fundamentalmente en las células B y está implicado en su activación. Asimismo se expresa en las células tumorales de la mayoría de los linfomas de células B. Contra este receptor se ha desarrollado un anticuerpo monoclonal quimérico (humano/murino), rituximab, indicado para el tratamiento de LNH de células B, de bajo grado o folicular, CD20 positivo en casos pertinaces o por recaídas2. Se administra en infusión semanal a la dosis de 375 mg/m2 de superficie corporal hasta un total de 4-8 ciclos. La tolerancia es buena, y los efectos adversos más frecuentes son los relacionados con la infusión (fiebre, escalofríos), especialmente durante la primera dosis. El rituximab se ha utilizado en pacientes con linfoma cutáneo de células B (LCCB) como primera línea de tratamiento en los casos en que se desestimó realizar radioterapia o escisión quirúrgica. Se ha descrito remisión completa en la mayoría de los pacientes tratados, con una duración de la respuesta de 12-39 meses3,4. Se ha empleado incluso de forma intralesional a una dosis bastante menor (10-30 mg/lesión) que la utilizada en la administración intravenosa y presenta mejor tolerabili-dad5,6. Aunque la respuesta inicial es completa, la tasa de recurrencia es superior en los pacientes tratados con rituximab intralesional que en los tratados mediante infusión a mayor dosis6.
Antígeno CD25. El antígeno CD25, también conocido como Tac o p55, se expresa en las células B y T activadas y forma parte del complejo de alta afinidad del receptor de la interleucina (IL) 2. Se expresa en las células tumorales de los pacientes con MF, excepto en las fases iniciales. La detección en sangre de la forma soluble del receptor se correlaciona con el pronóstico de la enfermedad en las fases avanzadas7. Contra este antígeno se han desarrollado tres moléculas: denileukin diftitox, inmunotoxina LMB-2 y daclizumab. Denileukin diftitox es una proteína de fusión que combina toxina diftérica e IL-2 y está indicada para el tratamiento de pacientes con LCCT persistente o recurrente que expresa el receptor CD258. Se administra de forma intravenosa en dos dosis diarias (9 o 18 g/kg) durante 5 días consecutivos cada 21 días hasta un total de 8 ciclos. La duración óptima del tratamiento no está establecida, pero la mayoría de los pacientes que responden lo hacen antes del cuarto ciclo. Un estudio multicéntrico, aleatorizado y controlado con placebo en pacientes con LCCT pertinaz demostró una respuesta global del 30% (el 10% de respuestas completas y el 20% de respuestas parciales) y una duración de la respuesta de 7 meses9. Los efectos secundarios más frecuentes fueron síndrome seudogripal, efectos relacionados con la infusión (hipotensión, disnea, dolor torácico), síndrome de extravasación (hipotensión, hipoalbuminemia, edema) e hipertransaminasemia transitoria. La inmunotoxina LMB-2 está formada por un fragmento de la cadena variable del receptor CD25 y una forma truncada de la exotoxina de Pseudomonas. En un estudio de fase I se demostró su actividad en pacientes con neoplasias hemáticas CD25 positivas y el único paciente con LCCT que recibió tratamiento presentó una respuesta parcial10. Se trató a los pacientes mediante infusión intravenosa hasta una dosis máxima de 40 g/kg en 3 dosis. Los efectos adversos más frecuentes fueron hipertransaminasemia y fiebre. Únicamente 6 de los 35 pacientes tratados desarrollaron anticuerpos neutralizantes significativos. Actualmente está en curso un ensayo de fase II para LCCT pertinaz (NCT 00085085). Daclizumab es un anticuerpo quimérico monoclonal contra el receptor de la IL-2 aprobado para prevenir el rechazo agudo del trasplante renal, aunque también se ha empleado para el tratamiento de algunas enfermedades inflamatorias crónicas como asma, psoriasis y colitis ulcerosa11. Se ha completado un ensayo de fase I en el que se evaluó la respuesta de los pacientes con LCCT y leucemia de células T del adulto tras tratamiento con daclizumab conjugado con itrio radiactivo 90 Gy (10 mCi) (NCT 00001249), aunque aún no se han publicado los resultados.
Antígeno CD30. El antígeno CD30 se expresa fundamentalmente en las células T y NK y está implicado en la proliferación y apoptosis de los linfocitos. Se expresa asimismo en las células de la papulosis linfomatoide y del linfoma anaplásico de células grandes. Contra este receptor se han desarrollado dos anticuerpos, SNG-30 y HeFi-1. El anticuerpo monoclonal quimérico SNG-30 se encuentra en ensayos de fase II, pero ya ha sido aprobado como fármaco huérfano para el tratamiento del LCCT pertinaz CD30 positivo. En el caso del linfoma anaplásico de células grandes, se ha objetivado una tasa de respuesta del 50% en los pacientes tratados (3/6) con una infusión semanal de 6 mg/kg durante 6 semanas. Los efectos adversos más frecuentes fueron tos, astenia, diarrea, vómitos y debilidad muscular12. Los resultados preliminares de un ensayo de fase II para el LCCT CD30 positivo, incluyendo MF transformada CD30 positiva, han demostrado eficacia en 5/6 pacientes tratados, con mínima toxicidad13. HeFi-1 es un anticuerpo monoclonal murino que ha demostrado eficacia en modelos murinos de linfoma14.
Antígeno CD52. El antígeno CD52 se expresa en las células B y T, monocitos y macrófagos, y su función no está caracterizada. Contra este antígeno se ha desarrollado un anticuerpo monoclonal humanizado, alemtuzumab, que está indicado para el tratamiento de casos resistentes de leucemia linfática crónica15. En un ensayo de fase II se trató a 22 pacientes con MF/SS avanzado, y se observó una tasa de respuestas del 55% (el 32% de respuestas completas y el 23% de respuestas parciales) tras la administración intravenosa de 30 mg 3 veces por semana durante 12 semanas. El principal inconveniente fue el desarrollo de infecciones oportunistas16. Es necesaria una adecuada profilaxis antibiótica debido a la elevada tasa de infecciones derivadas de la linfocitopenia asociada al tratamiento. Para minimizar la inmunosupresión, se ha evaluado la administración de alemtuzumab a dosis más bajas (10 mg 3 veces por semana durante 4 semanas), pero con este esquema terapéutico sólo se observaron respuestas parciales en 3 de 4 pacientes con MF resistente17. Debido a que en la mayoría de los pacientes estudiados las respuestas suelen ser modestas, se plantea emplear alemtuzumab en terapia combinada.
Receptores intranuclearesReceptores retinoides. Los receptores retinoides constituyen una familia de factores de transcripción entre los que también se incluyen los receptores esteroideos y los receptores de la hormona tiroidea y de la vitamina D. Existen dos familias de receptores retinoides: los receptores del ácido retinoico (RAR) y los receptores del retinoide X (RXR). Los retinoides están implicados en la diferenciación celular, la apoptosis y la modulación de la respuesta inmunitaria. El bexaroteno es un retinoide con elevada afinidad por los receptores de retinoide X que está aprobado para el tratamiento del LCCT pertinaz. En los casos de LCCT pertinaz, se ha observado una tasa de respuesta del 45% (25/56) con dosis de 300 mg/m2/día y una duración mediana de la respuesta de 299 días18. Los efectos adversos más frecuentes son hipertrigliceridemia, hipercolesterolemia, hipotiroidismo y cefaleas. También se ha formulado bexaroteno en gel al 1%, y aunque actualmente no está disponible en España, en Estados Unidos está indicado para estadios iniciales de LCCT rebelde a otros tratamientos o para los casos en que el paciente presente intolerancia a ellos. Los ensayos de fase III con el LCCT pertinaz han mostrado una respuesta global en el 44% de los pacientes, con una tasa de respuestas completas del 8%19. El efecto adverso más frecuente es la irritación local. Se recomienda iniciar la aplicación cada 2-3 días e ir aumentando hasta un total de 3-4 aplicaciones al día.
Complejos enzimáticosInhibidores de las histonas deacetilasas. La regulación de la expresión génica está mediada por diversos mecanismos, entre ellos las modificaciones postraslacionales de las histonas. Se han descrito 18 tipos de histonas deacetilasas (HDAC), que se dividen en cuatro clases según la homología de la secuencia con las HDAC de las levaduras. Los inhibidores de las histonas deacetilasas inducen la hiperacetilación de las histonas que modulan la estructura de la cromatina y la expresión génica. Estos cambios inducen la diferenciación celular y la apoptosis de las células tumorales e inhiben la angiogénesis, entre otros efectos20. El primer inhibidor de las HDAC aprobado para el tratamiento de LCCT es el vorinostat. Con dosis de 400 mg al día por vía oral, se ha descrito una tasa de respuestas del 30% (22/74) en pacientes con enfermedad rebelde al tratamiento, incluidos casos de transformación en linfoma de células grandes y SS. Los efectos secundarios más frecuentes son alteraciones gastrointestinales (diarrea, anorexia, náuseas) y astenia21. Gracias a su peculiar mecanismo de acción y su buen perfil de seguridad, los inhibidores de las HDAC se han convertido en objeto de intensa investigación y actualmente hay al menos tres inhibidores en distintas fases de desarrollo clínico para su utilización en LCCT: LBH589 vía oral (CLBH589B2201, NCT 00425555 y CLBH589B2212, NCT 00490776), romidepsina [FK228] vía intravenosa (GPI-04-0001, NCT 00106431) y tópica (07-C-0133, NCT 00477698) y PDX101 intravenoso (PXD101-CLN-6, NCT 00274651).
Inhibidores del proteosoma. El proteosoma es uno de los componentes de la vía de degradación conocida como vía de la ubiquitina-proteosoma, que degrada las proteínas reguladoras implicadas en el ciclo celular. La inhibición de este sistema proteolítico provoca la apoptosis celular. El bortezomib es un inhibidor del proteosoma que ha sido aprobado para el tratamiento del mieloma múltiple recidivante22. Un ensayo de fase II evaluó la respuesta al bortezomib en pacientes con LCCT (n = 10) y linfoma de células T periférico con afección cutánea aislada (n = 2) previamente tratados23. Tras la administración intravenosa de 1,3 mg/m2 en los días 1, 4, 8 y 11 de un ciclo que se repite cada 21 días hasta un total de 6 ciclos, se observó una respuesta global del 67%, con 2 (17%) remisiones completas y 6 (50%) remisiones parciales. La duración de la respuesta fue de 7-14 meses. Los efectos secundarios más frecuentes fueron neutropenia, trombocitopenia y neuropatía sensorial. Actualmente se está llevando a cabo un ensayo de fase II en LCCT recurrente o pertinaz (UCLA-0405014-02, MI-LLENNIUM-VEL-04-103, NCT 00182637).
Inhibidores de la nicotinamida fosforibosiltransferasa. La nicotinamida fosforibosiltransferasa (NMFRT) es una enzima implicada en la síntesis del dinucleótido de nicotinamida y adenina, NAD. El NAD es un cofactor enzimático necesario, entre otras cosas, para las reacciones involucradas en la señalización celular. De esta forma, la inhibición de la NMFRT provocaría una depleción de NAD, con la consiguiente apoptosis de las células, sobre todo de las que tienen un mayor recambio de este cofactor, como las células tumorales24. Estudios preclínicos con un inhibidor de la NMFRT, APO866, han demostrado el potencial terapéutico en varios tipos de tumores, el LCCT inclusive. Actualmente se está llevando a cabo un ensayo de fase II para LCCT pertinaz o recurrente, en el que los pacientes reciben la infusión intravenosa de APO866 durante 96 h, repitiendo el tratamiento cada 4 semanas hasta un total de 3 ciclos (AP3001, NCT 00431912).
Inhibidores de la proteincinasa C. La proteincinasa C (PQC) está constituida por una familia de al menos 11 proteínas serina-treonincinasas que están implicadas en las vías de señalización que regulan los fenómenos de proliferación celular y apoptosis. Los linfocitos T expresan las isoformas clásicas alfa y beta de la PQC así como otras isoformas recientemente descritas. Contra la PQCµ se ha desarrollado un inhibidor selectivo con biodisponibilidad oral, enzastaurina, que actualmente se encuentra en ensayos de fase III para el tratamiento del glioblastoma y del linfoma B difuso de células grandes rebelde al tratamiento. Estudios in vitro han demostrado que también inhibe el crecimiento e induce la apoptosis de líneas celulares de LCCT25. Con base en estas observaciones, se está llevando a cabo un ensayo de fase II para el tratamiento de LNH, entre los que se incluyen LCCT y linfomas de células B indolentes (NCT 00542919).
DIANAS EN EL MICROAMBIENTE TUMORALLas interacciones célula tumoral-microambiente son complejas y se las ha estudiado más extensamente en la MF. La progresión de esta enfermedad se caracteriza por una respuesta inmunitaria Th2 con aumento de la producción de citocinas Th2 (IL-4, IL-5, IL-10) y disminución de las citocinas Th1 (IL-2, interferón [IFN] alfa y gamma)26. Esto conlleva una disminución de las células dendríticas y de las células efectoras de la respuesta antitumoral (CD8 y NK).
En este sentido se intenta modular la respuesta Th2 a través del aumento de citocinas Th1, la disminución de las Th2 y el aumento del número y la actividad de las células dendríticas.
Interferón alfaEl IFNµ potencia la citotoxicidad mediada por células (NK y macrófagos) y suprime la producción de citocinas Th2. En pacientes con LCCT pertinaz, la administración intramuscular de dosis elevadas (50 MU 3 veces por semana) consigue tasas de respuesta parcial cercanas al 50%27, pero la toxicidad dependiente de la dosis (síndrome seudogripal grave) es un factor limitante. La dosis máxima diaria que la mayor parte de los pacientes tolera a largo plazo es de 9 MU/día, por lo que se recomienda iniciar el tratamiento con dosis de 3 MU 3 veces por semana, y en función de la respuesta y la tolerancia, ir aumentando hasta una dosis máxima diaria de 9 MU28. Los principales incovenientes de la terapia actual son la toxicidad dependiente de la dosis y la necesidad de administración frecuente (3 veces por semana) debido a la corta vida media del IFNµ. Estos inconvenientes podrían atenuarse mediante el uso del IFNµ pegilado que presenta menor toxicidad y sólo necesita una administración semanal. También se ha descrito la utilización de IFNµ intralesional en LCCB marginal. En un estudio se trató a 8 pacientes con LCCB marginal que rechazaron el tratamiento o en los que no estaban indicados tratamientos de primera línea (cirugía o radioterapia)29. Tras una media de 2 meses de tratamiento con administración intralesional de 3 MU 3 veces por semana, todos los pacientes presentaron remisión completa. Únicamente 2 pacientes recidivaron durante el primer año de seguimiento, pero respondieron nuevamente al tratamiento.
Interferón gammaEl IFNµ potencia la actividad citolítica de los linfocitos, suprime la producción excesiva de citocinas Th2, estimula la expresión de CD40 (antígeno de superficie de las células dendríticas) y estimula la producción de IL-12 por las células dendríticas. Se han descrito respuestas parciales del 30% (5/16) en pacientes con LCCT rebelde al tratamiento con una duración mediana de la respuesta de 10 meses30. Al igual que el IFNµ los principales inconvenientes son la toxicidad dependiente de la dosis (fiebre, pérdida de peso, hipertransaminasemia, neutropenia) y la corta vida media. En el caso del IFNµ se han desarrollado vectores virales que permiten la producción de IFN hasta 2 semanas tras la administración intralesional. El TG1042 es un vector adenoviral que contiene IFNµ humano. En un ensayo de fase I se trató a 7 pacientes con LCCT avanzado y 2 pacientes con lesiones multifocales de LCCB31. Tras la administración intralesional de TG1042 (3 veces al mes durante 4 meses) se observaron respuestas en 5 de los 9 pacientes (3 respuestas completas, 2 en LCCT y 1 en LCCB; y 2 respuestas parciales, 1 en LCCT y 1 en LCCB). La duración mediana de la respuesta fue de 3 meses. Los efectos adversos más frecuentes fueron la reacción local en la zona de inyección y un síndrome seudogripal. Con base en estos resultados, se está llevando a cabo un estudio de fase II para LCCB (TG1042.06, NCT 00394693).
Interleucina 2La IL-2 se produce en las células T activadas, y entre sus múltiples funciones destacan el aumento de la proliferación de las células citotóxicas CD8 y NK, la apoptosis de las células T proliferantes y la regulación de las células T reguladoras (CD4+, CD25+), que están implicadas en la tolerancia y la supresión inmunitarias. Se han descrito respuestas duraderas en pacientes con LCCT avanzado tratados con dosis elevadas de IL-2 (20 MU/m2/día), pero la toxicidad asociada al tratamiento es un factor limitante32. Un estudio de fase II demostró una tasa de respuestas parciales del 18% (4/22) en pacientes con LCCT pertinaz que recibieron IL-2 por vía subcutánea a la dosis de 11 MU/día, 4 días por semana durante 6 semanas33. La duración mediana de la respuesta fue 5 meses. Los efectos adversos más frecuentes fueron síntomas constitucionales, alteraciones gastrointestinales y pancitopenia. Estudios in vitro han demostrado que la IL-2, en combinación con la IL-12, incrementa de forma sinérgica varios parámetros de la inmunidad mediada por células en pacientes con LCCT, como la producción de IFNµ y la actividad de las células NK34. Esta combinación sinérgica también incrementa la expresión del receptor de IL-12, que disminuye con la administración continua de esta citocina, lo cual explicaría la falta de eficacia del tratamiento con IL-12 en monoterapia. Con base en estos hallazgos, se ha completado un ensayo para MF con un primer período (fase II) de tratamiento con IL-12 y otro posterior (fase I) con dosis progresivamente más altas de IL-2, ambas administradas por vía subcutánea (NCT 00052377).
Interleucina 12La IL-12 potencia la actividad citolítica de las células T y NK e induce la liberación de IFNµ. Los pacientes con SS tienen una menor producción de IL-1235. Ensayos clínicos de fase I y II que utilizan IL-12 recombinante para LCCT han demostrado una tasa de respuestas cercana al 50%36. Un ensayo multicéntrico de fase II evaluó la respuesta de pacientes con MF rebelde al tratamiento en estadios iniciales (IA-IIA) tras la administración subcutánea de IL-12 (100 ng/kg 2 veces por semana durante 2 semanas, incrementando la dosis hasta 300 ng/kg)37. De los 22 pacientes evaluables, 10 (43%) presentaron una respuesta parcial; 7 (30%), una respuesta menor, y 5 (21%), enfermedad estable. La duración mediana de la respuesta parcial fue 94 días. Los efectos adverso más frecuentes fueron un cuadro seudogripal, reacción local en la zona de inyección e hipertransaminasemia. Debido a que la exposición continua a dosis elevadas de IL-12 causa una disminución de la expresión de sus receptores, se plantea agregar otras citocinas como la IL-2 para mejorar la eficacia del tratamiento.
LenalidomidaEs un análogo de la talidomida que incrementa la producción de IFNµ e IL-2, estimula la actividad de las células CD8 y NK y promueve la apoptosis de las células tu-morales. En Estados Unidos está aprobada para el tratamiento de síndromes mielodisplásicos38. La lenalidomida se administra por vía oral a la dosis de 25 mg diarios durante 21 días en ciclos de 28 días. Los resultados de un estudio piloto demuestran que la lenalidomida presenta actividad en pacientes con LCCT avanzado39. De los 15 pacientes evaluados, 5 presentaron una respuesta parcial, 6 tuvieron una respuesta menor y 4 presentaron progresión de la enfermedad. Los efectos adversos más frecuentes fueron anemia, astenia, prurito y edema de las piernas. Asimismo se observó un empeoramiento clínico tras la administración del fármaco seguido de una mejoría de la enfermedad. La causa de este fenómeno no está aclarada, pero podría deberse a la respuesta citotóxica al tumor. Actualmente continúa en curso un ensayo de fase II para el tratamiento de LCCT/SS pertinaz (NU-04H5, NCT 00466921).
Agonistas de los receptores toll-like(TLR)Imiquimod. Es un agonista del receptor toll-like 7 que incrementa la producción local de IFNµ. Está aprobado para el tratamiento de condilomas planos y carcinoma basocelular superficial y queratosis actínicas. En un estudio piloto se han observado respuestas en el 50% de los pacientes (3/6) con MF en estadios IA-IIB tras la aplicación tópica tres veces por semana durante 12 semanas40.
CpG-ODN. Es un agonista del receptor toll-like 9 que incrementa la producción de IL-12 e IFNµ y activa directamente las células B, NK y dendríticas. Un ensayo clínico de fase I evaluó la respuesta de CpG-ODN a diferentes dosis semanales (0,08, 0,16, 0,24 o 0,28 mg/kg) administradas por vía subcutánea a pacientes con LCCT recurrente o pertinaz41. Se observó una respuesta parcial o completa en 3 pacientes, enfermedad estable en 5 y progresión de la enfermedad en 2 de un total de 10 pacientes evaluables. Los efectos adversos más frecuentes fueron los relacionados con la zona de infiltración (eritema, induración, dolor) y un cuadro seudogripal de leve a moderado. Se continúa investigando sobre nuevas dosis para optimizar la eficacia y la tolerancia al tratamiento. También se está desarrollando un ensayo de fase II para evaluar el tratamiento combinado de CpG-ODN y radioterapia (LYMNHL0014, NCT 00185965) en pacientes con linfomas de bajo grado (linfoma de células B o MF).
Vacunas de células dendríticasLas células dendríticas (CD) tienen un papel clave en la presentación de antígenos que permite desarrollar una respuesta antitumoral eficaz. Las vacunas de células dendríticas se preparan con células dendríticas previamente activadas y lisado tumoral del paciente. En un estudio piloto se trató a 10 pacientes con LCCT rebelde al tratamiento, a los que una vez por semana se administró la vacuna de CD en ganglios accesibles42. Se observó una tasa de respuestas del 50%, 4 pacientes presentaron una respuesta parcial y 1 presentó una respuesta completa que se mantenía tras 19 meses de seguimiento. La duración de las respuestas parciales fue una media de 10 meses en 2 pacientes y persisten en los otros 2. Los pacientes respondedores necesitaron una media de 7 vacunas y tenían menos carga tumoral que los no respondedores. La tolerancia fue buena, y los efectos adversos más frecuentes fueron el dolor en la zona de infiltración y la inflamación ganglionar. Actualmente se está llevando a cabo un ensayo de fase II con vacunas de células dendríticas para pacientes con SS (FD-R-002545-01, NCT 00099593).
CONCLUSIONESEl manejo de los linfomas cutáneos continúa siendo un reto debido a la dificultad de generar terapias altamente selectivas que permitan eliminar únicamente la población clonal. En la actualidad disponemos de fármacos con dianas terapéuticas que no afectan de forma significativa a la respuesta inmunitaria, tienen biodisponibilidad oral y son eficaces en el tratamiento de los linfomas pertinaces. Es previsible que, a medida que progrese la comprensión de la patogenia de estas neoplasias, se desarrollen fármacos más selectivos. La caracterización de los mecanismos de acción de estos fármacos permite optimizar distintas pautas de tratamiento para realizar terapias de mantenimiento o combinadas con un perfil de seguridad favorable que mejoren la calidad de vida de los pacientes con enfermedad rebelde al tratamiento.
Correspondencia: Dra. I. Longo Imedio. Servicio de Dermatología. Hospital General Universitario Gregorio Marañón. Dr. Esquerdo, 46. 28007 Madrid. España. Correo electrónico: milongo@arrakis.es