El síndrome de ovario poliquístico es un trastorno endocrino-metabólico que se explica como un hiperandrogenismo femenino funcional. Asociado a ello se desencadenan diversas alteraciones sistémicas, siendo la acumulación de tejido adiposo visceral una de las más importantes. Se ha demostrado que los andrógenos y el aumento de los ácidos grasos libres, como se ve en la obesidad de tipo central, inhiben la acción hepática de insulina que resulta en el hiperinsulinismo compensatorio secundario a la resistencia a la insulina, por lo tanto, las pacientes con síndrome de ovario poliquístico presentan diversas características clínicas, hormonales y metabólicas, dependiendo de su grasa corporal y del patrón de distribución, por lo que la clasificación en subgrupos nos puede ayudar a identificar los trastornos sistémicos que puede presentar cada paciente. Uno de estos parámetros es el fenotipo otorgado por la composición corporal, el cual puede determinarse a través de impedancia por fluido eléctrico, que permite conocer las proporciones de los distintos componentes del cuerpo humano. Por esta razón, debe considerarse actualmente, como parte del seguimiento de las pacientes con síndrome de ovario poliquístico, el estudio de la composición corporal para establecer la respuesta a los tratamientos empleados en la corrección de este trastorno sistémico.
Polycystic ovary syndrome it is an endocrine-metabolic dysfunction and it is explained as a female functional hyperandrogenism. Associated to this, several systemic alterations are triggered, with one of these very important dysfunctions being the accumulation of visceral fat tissue. It has been demonstrated that the androgens and the increase of the free fatty acids, as observed in central type obesity, inhibit the hepatic action of insulin that results in compensatory hyperinsulinism secondary to insulin resistance. For this reason, patients with polycystic ovary syndrome present with diverse clinical, hormonal and metabolic characteristics, depending on their body fat and its distribution pattern. The classification into sub-groups can help to identify the systemic dysfunctions that each patient may have. One of these parameters is the phenotype associated with the body composition, which can be measured using the electrical impedance of the body fluids that helps to determine the distribution of the different components of the human body. For this reason, the study of the body composition should be now considered as part of the follow-up of patients with polycystic ovary syndrome, in order to determine the response to the treatments used in the correction of this systemic dysfunction.
EL síndrome de ovario poliquístico (SOP) es un trastorno endocrino-metabólico que afecta al 4-10% de las mujeres en edad reproductiva, se caracteriza por alteraciones hormonales y se explica como un hiperandrogenismo femenino funcional, en el cual el ovario secreta excesivamente andrógenos1.
Su etiología aún no está bien definida, por lo que se considera una entidad multifactorial, pero en los últimos 15 años se ha demostrado que la resistencia a la insulina (RI) juega un papel importante en su fisiopatología, por medio de los siguientes mecanismos:
- -
Acción sobre el hígado, lo que reduce la producción de globulina transportadora de hormonas sexuales y de la proteína ligadora del factor de crecimiento insulinoide tipo 1, por lo que los niveles de andrógenos se incrementan2.
- -
Acción directa sobre el ovario, lo que favorece la producción de andrógenos. El estado de hiperinsulinemia estimula las células de la teca sobreexpresando receptores de hormona luteinizante y de factor de crecimiento insulinoide tipo 1, por lo tanto, hay sobreestimulación de la enzima PC450-LYASA, 17α-hidroxilasa y 17β-hidroxiesteroide deshidrogenasa, que modifican la vía metabólica hacia la conversión de testosterona y su metabolito final, la dihidrotestosterona, que ejerce la acción biológica final androgénica3. Por lo tanto, el descenso en las concentraciones plasmáticas de estrógenos característico en este trastorno tiene una retroalimentación positiva sobre la secreción de hormona luteinizante que, al igual que la insulina y el factor de crecimiento insulinoide tipo 1, estimula la producción de andrógenos en el ovario y refuerza la hiperandrogenemia4.
Asociado a ello se desencadenan diversas alteraciones sistémicas, como cambios metabólicos, obesidad, diabetes mellitus tipo 2, hipertensión arterial y enfermedades cardiovasculares. Dependiendo de la gravedad del defecto esteroidogénico, los factores desencadenantes tendrán una mayor o menor influencia en la aparición del síndrome. Uno de los trastornos más importantes es la acumulación de tejido adiposo visceral, muy frecuente en pacientes con SOP, debido a que la insulina en un estado metabólico normal es un punto clave en la regulación del metabolismo lipídico, ya que inhibe la lipogénesis e induce la degradación de ApoB5.
Asociación androgénicaLos andrógenos son hormonas que se producen en los ovarios y las glándulas suprarrenales. Todas las mujeres producen una cierta cantidad de estas hormonas. Algunos estudios han demostrado que la testosterona influye en el desarrollo de la RI, ya que los andrógenos y el aumento de los ácidos grasos libres (AGL), como se ve en la obesidad de tipo central, inhiben la acción hepática de insulina que resulta en el hiperinsulinismo compensatorio secundario a la RI. La testosterona estimula la lipólisis, proporcionando una mayor concentración periférica de AGL, que inhiben tanto la acción de la insulina como la captación de glucosa en el músculo esquelético, lo que se ha confirmado de manera experimental al administrar insulina a mujeres con SOP, en quienes también se incrementan las concentraciones de andrógenos. Por lo tanto, las pacientes con SOP presentan un patrón lipídico anormal, en el cual los triglicéridos y las lipoproteínas de baja densidad se encuentran elevados6.
Se han utilizado diversos criterios para el diagnóstico del SOP; de estos, los criterios de Rotterdam son actualmente unos de los más utilizados en la práctica clínica y se determinan cuando hay presencia de al menos 2 de 3 de los siguientes hallazgos: oligoanovulación; ovario poliquístico; hiperandrogenismo bioquímico con una concentración elevada de hormona luteinizante con respecto a la de hormona foliculoestimulante, y/o hiperandrogenismo clínico, como el hirsutismo observado en el 73 al 83% de la población, seguido del acné observado en el 49 al 63% y la alopecia en el 16 al 34% de los casos; también puede presentarse piel grasa, tendencias compulsivas, cambios corporales y acantosis nigricans7,8.
El cuadro clínico del SOP es completado por alteraciones de la esfera metabólica, entre las cuales la RI y la obesidad son las más frecuentes, con prevalencias de 71 a 77% y de 52 a 80%, respectivamente. Las mujeres con SOP y trastornos metabólicos tienden a tener mayores índices de masa corporal, circunferencia de cintura, presión arterial, hiperglucemia en ayuno y concentración de insulina en comparación con las que no lo presentan. Todo esto, asociado a la RI9.
En diversos estudios se ha demostrado que las pacientes con SOP presentan diversas características clínicas, hormonales y metabólicas, dependiendo de su grasa corporal y del patrón de distribución. De igual forma, se ha valorado el impacto de la obesidad en el estado hiperandrogénico, y se ha demostrado uniformemente que las mujeres obesas con SOP presentan unos valores plasmáticos de globulina transportadora de hormonas sexuales significativamente más bajos y una hiperandrogenemia más severa en comparación con las mujeres con SOP no obesas. Además, se ha demostrado que las mujeres con obesidad androide y que presentan mayores niveles de andrógenos libres también tienen un grado significativamente mayor de RI que controles con peso normal10.
Distribución de grasa y resistencia a la insulinaLa obesidad se presenta en las pacientes con SOP en un porcentaje variable, que según los diferentes autores oscila entre el 31 y el 60%. Se sabe que el tejido adiposo subcutáneo puede tener distintas formas de distribución: andrógena, infantil y ginecoide. Las 2 primeras se encuentran en pacientes con SOP. El patrón androgénico de distribución del tejido adiposo subcutáneo se caracteriza por un aumento de este tejido en el muslo y en el tronco, y se presenta con frecuencia en las pacientes con SOP que son obesas. El patrón infantil, en cambio, se observa con mayor frecuencia en las pacientes con SOP que son delgadas, y se caracteriza por una disminución del tejido adiposo subcutáneo en el tronco y especialmente en los muslos y un aumento de este a nivel de las vísceras abdominales11,12.
Es conocido que tanto el SOP como la obesidad se asocian con la RI, que se define como una condición en la que una concentración normal de insulina produce un efecto biológico atenuado, por lo tanto, disminuye la capacidad de esta hormona para ejercer sus acciones biológicas en los tejidos típicos, como el músculo esquelético, el hígado o el tejido adiposo. Sin embargo, existen alteraciones genéticas que explican la hiperandrogenemia y la presencia simultánea de una IR, ambos factores implicados en la génesis de la obesidad13,14 (tabla 1).
Genes sobreexpresados o suprimidos diferencialmente en las pacientes con síndrome de ovario poliquístico
| CYP17 (citocromo P450; 17-hidroxilasa/17,20-demolasa) |
| CYP11A (enzima de clivaje de cadena lateral de citocromo P450) |
| CYP21 (citocromo P450: 21-hidroxilasa) |
| INS (gen codificante de la insulina) |
| IRS1 y 2 (gen codificante de las proteínas sustratos del receptor de insulina) |
| Folistatina |
| Calpaína-10 |
| TNF-R (gen del receptor del factor necrótico tumoral) |
| PPARγ2 (gen del receptor activado por proliferadores peroxisómicos γ2) |
| AR (gen codificante del receptor de andrógenos) |
La hiperandrogenemia, causa de la disfunción ovulatoria de las pacientes con SOP, aumenta la grasa abdominal (obesidad central), que tiene una alta actividad lipolítica y aumenta los AGL en la circulación. Estos compiten con la glucosa en el músculo esquelético y el tejido adiposo, lo que ocasiona un descenso en el transporte de la glucosa en dichos tejidos, con el consiguiente aumento de su concentración en el plasma. Este aumento persistente de la glucemia puede llevar secundariamente a una hiperinsulinemia14.
La adiponectina es una de las principales adipocinas secretadas en el tejido adiposo, aumenta con la reducción de la grasa (especialmente visceral) y sus efectos están asociados con un aumento de la sensibilidad a la insulina a nivel ovárico. Se ha demostrado que el nivel de adiponectina es un buen indicador de la masa grasa abdominal y su asociación con la RI. Por lo tanto, las pacientes obesas que tienen menores niveles de adiponectina presentan una mayor RI y una mayor producción de andrógenos ováricos15–17. Por consiguiente, clínicamente el diámetro de la cintura es un buen marcador del estado metabólico de la mujer y su relación con la RI. En este sentido, la dieta y la realización de ejercicio básico son pilares fundamentales en el tratamiento de la RI, pues de esta forma ayudan a normalizar el ciclo menstrual y a prevenir las complicaciones que acompañan al SOP18.
Estudios de composición corporalLa alta prevalencia de desórdenes metabólicos apoya el hecho de que se debe estudiar a estas pacientes considerando cada una de las variables implícitas en el SOP, ya que confluyen múltiples factores que están involucrados en este trastorno metabólico y, por lo tanto, se debe considerar la estratificación de subpoblaciones de pacientes de forma independiente, por lo que la clasificación en subgrupos nos puede ayudar a identificar los trastornos sistémicos que puede presentar cada paciente. Uno de estos parámetros es el fenotipo otorgado por la composición corporal, en el que el tejido graso puede modificar el estado hormonal cíclico de la paciente.
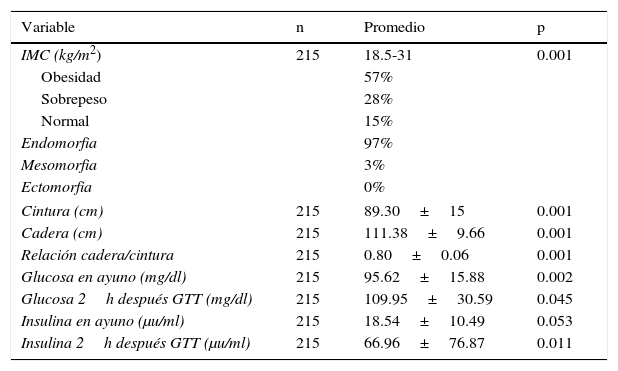
Así, las mediciones antropométricas ayudan a calcular la masa corporal, la cual se expresa por el peso, la estatura, la composición corporal y las reservas de tejido adiposo y muscular. El somatotipo es la descripción de la configuración morfológica de un individuo, el cual refleja los constituyentes del cuerpo y permite determinar su endomorfia, que es la cantidad de tejido adiposo en el cuerpo, así como la mesomorfia, que se refiere a la masa muscular, y la ectomorfia, que expresa la normalidad de la constitución física de un individuo19 (tabla 2).
Distribución corporal de pacientes con síndrome de ovario poliquístico
| Variable | n | Promedio | p |
|---|---|---|---|
| IMC (kg/m2) | 215 | 18.5-31 | 0.001 |
| Obesidad | 57% | ||
| Sobrepeso | 28% | ||
| Normal | 15% | ||
| Endomorfia | 97% | ||
| Mesomorfia | 3% | ||
| Ectomorfia | 0% | ||
| Cintura (cm) | 215 | 89.30±15 | 0.001 |
| Cadera (cm) | 215 | 111.38±9.66 | 0.001 |
| Relación cadera/cintura | 215 | 0.80±0.06 | 0.001 |
| Glucosa en ayuno (mg/dl) | 215 | 95.62±15.88 | 0.002 |
| Glucosa 2h después GTT (mg/dl) | 215 | 109.95±30.59 | 0.045 |
| Insulina en ayuno (μu/ml) | 215 | 18.54±10.49 | 0.053 |
| Insulina 2h después GTT (μu/ml) | 215 | 66.96±76.87 | 0.011 |
Se han empleado diversos métodos para determinar la composición corporal; dentro de ellos se encuentra el análisis de activación neutrónica, la resonancia magnética, la densitometría e hidrometría, la pletismografía por desplazamiento de aire, los métodos de dilución isotópica, la absorciometría dual de rayos X, la antropometría y la impedancia (bioimpedancia eléctrica), siendo este último uno de los más empleados actualmente20,21.
Por lo tanto, el análisis de la composición corporal a través de impedancia permite conocer las proporciones de los distintos componentes del cuerpo humano y sus resultados otorgan el conocimiento de la proporción de los diversos compartimentos, entre los que se encuentran la estimación del agua corporal total, de la masa grasa, de la masa muscular, de la masa mineral ósea y de las proteínas, lo cual permite la adecuada caracterización de la composición corporal, así como la asociación temprana entre el exceso de estos compartimientos y la aparición del riesgo para algunas enfermedades crónicas. La información se obtiene por segmentos, es decir, la cantidad de grasa, músculo, agua y minerales en abdomen, piernas y brazos, así como la cantidad de calorías que consume y lo que debería de consumir para evitar la acumulación corporal.
La bioimpedancia eléctrica se obtiene en los tejidos o líquidos corporales por el paso de una corriente eléctrica en forma de fluido descendente. La masa muscular contiene la mayoría de los fluidos y electrolitos corporales, siendo un buen conductor eléctrico, por lo que tiene baja impedancia u oposición, mientras que la masa grasa actúa como un aislante y se comporta con alta impedancia. El valor de la impedancia corporal (medida en ohmios) proporciona una estimación directa del agua corporal total y permite estimar indirectamente la masa muscular y la masa grasa22; de esta forma, se puede establecer la distribución de grasa corporal en una paciente con SOP, para iniciar tratamiento y otorgar el seguimiento como una herramienta que nos permita conocer si al disminuir la obesidad central también mejoran las características bioquímicas de estas mujeres.
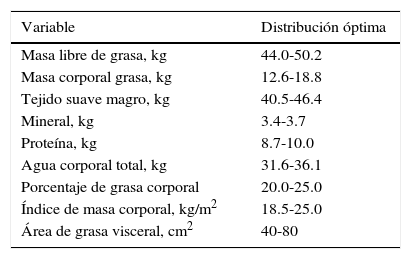
El método de estimación se basa en la aplicación de una corriente eléctrica de una intensidad muy pequeña, por debajo de los umbrales de percepción del cuerpo humano. Esta corriente produce una tensión eléctrica que es más alta cuanto mayor sea la impedancia que muestra el tejido evaluado. La impedancia eléctrica de un tejido biológico tiene 2 componentes: resistencia y reactancia. La resistencia es la oposición al flujo de la corriente a través de las soluciones electrolíticas intra y extracelulares; y la reactancia determina las propiedades dieléctricas o mal conductoras de los tejidos23,24. Con este estudio se evalúan los diferentes compartimientos del cuerpo y podemos establecer anormalidades relacionadas con los cambios metabólicos. Los valores considerados como normales para esta prueba se describen en la tabla 3.
Composición corporal normal con impedancia
| Variable | Distribución óptima |
|---|---|
| Masa libre de grasa, kg | 44.0-50.2 |
| Masa corporal grasa, kg | 12.6-18.8 |
| Tejido suave magro, kg | 40.5-46.4 |
| Mineral, kg | 3.4-3.7 |
| Proteína, kg | 8.7-10.0 |
| Agua corporal total, kg | 31.6-36.1 |
| Porcentaje de grasa corporal | 20.0-25.0 |
| Índice de masa corporal, kg/m2 | 18.5-25.0 |
| Área de grasa visceral, cm2 | 40-80 |
El SOP, así como la obesidad son trastornos poligénicos, influidos por factores ambientales, como el estilo de vida y la dieta relacionados con la vida moderna, donde prevalece un aumento de tejido adiposo, y los cambios metabólicos a los que se enfrenta la mujer en la etapa reproductiva. Estos cambios son la hiperandrogenemia, que conduce a un aumento del tejido adiposo, especialmente en el tronco; el tejido adiposo favorece la RI por un incremento de los AGL, que elevan la glucemia. En las pacientes con SOP se han encontrado alteraciones en los adipocitos, los cuales tendrían una actividad lipolítica disminuida por la RI, la cual se sabe está correlacionada con la obesidad de tipo central. Por lo tanto, resulta importante el estudio de la composición corporal en las pacientes con SOP para establecer la respuesta a los tratamientos empleados en la corrección de este trastorno.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.