El síndrome de las piernas inquietas (SPI) es un trastorno neurológico del sueño frecuente en los adultos y caracterizado por los siguientes criterios diagnósticos: necesidad de moverse habitualmente asociada con sensaciones desagradables y síntomas que empeoran en reposo, se alivian con el movimiento y son más intensos por la noche1,2. Los estudios poblacionales en adultos que utilizan estos cuatro criterios diagnósticos esenciales del SPI han encontrado una prevalencia del 5 al 10% en Estados Unidos y en Europa3-9. La prevalencia de adultos moderada o gravemente afectados, con al menos 2 o 3 días semanales con síntomas y un significativo impacto sobre la calidad de vida, fue cercana al 2,5% en dos estudios3,10. Estudios menos exhaustivos han encontrado una menor prevalencia en poblaciones asiáticas11-13 y en la India14,15. El impacto del SPI puede ser muy intenso, con importantes efectos adversos sobre el sueño16, la función cognitiva17,18, el humor19 y la calidad de 3,20 de los adultos. Sin embargo, la alteración sigue siendo significativamente infradiagnosticada10,21.
Aunque Ekbom publicó la sintomatología del SPI en la infancia ya en los años cuarenta22,23, los casos clínicos pediátricos detallados con polisomnografía aparecieron en la bibliografía a mediados de los noventa24,25. Luego han aparecido otros casos clínicos y series26-35. Los criterios de consenso del diagnóstico de SPI en los niños y los adolescentes se publicaron en 2003 tras una reunión de trabajo en los National Institutes of Health2 (NIH) y se resumen en la figura 1. Los criterios pediátricos evolucionaron de los criterios del SPI para los adultos y de dos versiones anteriores de criterios pediátricos25,36. Se incorporaron dos conceptos importantes: mayor dificultad que en los adultos para alcanzar los criterios de un diagnóstico definido en los niños y distintas categorías de investigación para los casos menos definidos. El primero fue acordado para evitar el exceso diagnóstico en los niños y el segundo para captar un espectro más amplio de SPI en la infancia a efectos de investigación. Por la experiencia clínica y el desarrollo de mejores habilidades del lenguaje en los adolescentes con respecto a los niños pequeños, el comité de los NIH decidió utilizar los criterios de los adultos para los adolescentes, aunque se dejaron abiertas las categorías de SPI probable y posible como opción para la investigación. Estos nuevos criterios pediátricos del SPI fueron posteriormente incluidos en el manual diagnóstico de la International Classification of Sleep Disorders, 2.a edición37. El trabajo en el SPI pediátrico en los 12 años anteriores ha subrayado la aparición familiar del SPI, la asociación con los movimientos periódicos de las extremidades durante el sueño (MPES) y la relación con el trastorno de hiperactividad y déficit de atención (THDA) en algunos casos38.
Los estudios han indicado que muchos adultos con SPI recuerdan retrospectivamente que sus síntomas comenzaron en la infancia o la adolescencia. Dos de estos informes observaron la aparición del SPI entre los 10 y los 20 años de edad en el 25% de los pacientes39,40. La consulta pediátrica de trastornos del sueño de la Mayo Clinic encontró una prevalencia pediátrica del SPI del 5,9%27 y otro estudio encontró una prevalencia del 1,3% en 12 consultas pediátricas41. Además, un estudio que incluyó una pregunta acerca de la “inquietud de las piernas al acostarse” tuvo una respuesta positiva en el 6,1% de los niños canadienses de 11 a 13 años de edad42. Sin embargo, ningún estudio publicado ha utilizado los criterios esenciales para el adulto o los criterios pediátricos de consenso para evaluar la prevalencia del SPI en los niños y los adolescentes en la población general.
Los objetivos del estudio Peds RLS Epidemiology, Symptoms and Treatment (Ped REST) fueron caracterizar la epidemiología del SPI pediátrico en dos poblaciones generales –en Reino Unido y en Estados Unidos– así como la recogida de datos sobre los síntomas, la gravedad, los antecedentes familiares, el impacto, las tasas de diagnóstico, los tratamientos y las comorbilidades.
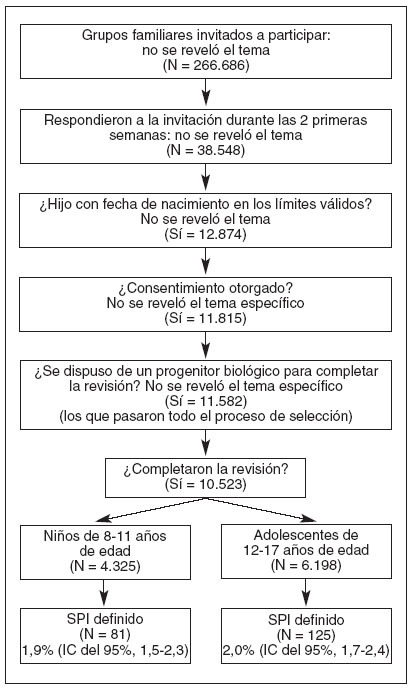
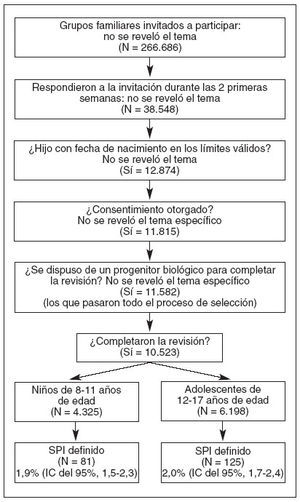
MÉTODOSPoblación de estudioUna selección aleatoria de domicilios identificados de un gran panel voluntario de investigación comercial en Reino Unido y en Estados Unidos fue invitada a participar en esta revisión. Los que respondieron desconocían el contenido de la revisión antes de aceptar la invitación y sólo se permitió una revisión por domicilio. Los incluidos en la revisión fueron domicilios con al menos un niño en los límites de edad elegibles (8-17 años, ambos inclusive), en los que el niño elegible era hijo biológico del adulto que respondía y en los que se otorgaba el consentimiento informado. Cuando en un domicilio había más de un niño elegible, el niño a supervisar se escogió al azar utilizando el método del último cumpleaños43. La figura 2 muestra el proceso de selección y de inclusión.
El panel de voluntarios para la investigación de mercado constó de unas 163.000 respuestas en Reino Unido y de 128.000 en Estados Unidos. Sus componentes fueron incluidos inicialmente en el panel mediante una invitación por internet y accedieron a participar en revisiones sobre una serie de temas como ocio, artículos de consumo y salud. Se pagó a los que respondieron una suma equivalente a unos 12 dólares o 10 A por cumplimentar cada revisión.
Fig. 1. Criterios diagnósticos del SPI en los niños del grupo de trabajo de los NIH (2003). MPES: Trastorno de movimiento periódico de las extremidades.
Diseño de la revisiónLa revisión constó de preguntas acerca de los síntomas del SPI, el impacto de los síntomas sobre el sueño y el rendimiento diurno, el comportamiento en busca de tratamiento, los diagnóticos, los tratamientos recibidos, las comorbilidades y la historia familiar de SPI (tabla 1). La revisión constó de cuatro secciones, de las que las dos últimas contenían preguntas detalladas para quienes habían dado una respuesta positiva a las anteriores preguntas indicadoras de SPI. Los dividimos por edad en dos grupos: de 8 a 11 años, inclusive, y de 12 a 17 años, inclusive. Esta división sigue los grupos de edad de la US Food and Drug Administration (FAD), que son ligeramente distintos que los grupos de edad de los NIH, con un límite de 13 en vez de 12 años de edad. En la revisión completa hubo 48 preguntas en total para los de 8 a 11 años de edad y 49 para los de 12 a 17 años de edad. Las revisiones fueron estudiadas en el campo sobre seis familias, cada una con un niño o adolescente afectado por un SPI conocido por la evaluación del experto. La mitad fue del grupo de menor edad y la otra mitad del de mayor edad. Las revisiones funcionaron bien en esta muestra. Cuando el niño elegible tenía de 8 a 11 años de edad, se pidió al progenitor que respondía que cumplimentara la sección de la revisión que contenía preguntas sobre las sensaciones en las piernas en presencia del niño. Cuando el niño elegible tenía de 12 a 17 años de edad, las secciones relativas a los síntomas padecidos, las molestias y las consecuencias fueron cumplimentadas por el adolescente. La revisión se administró por Internet y los que respondieron fueron dirigidos automáticamente a las preguntas pertinentes según sus respuestas. La investigación se realizó entre el 11 y el 25 de abril de 2005.
Fig. 2. Entrada de los participantes en el estudio. IC: intervalo de confianza.
Definición de caso de SPIUn grupo de expertos (los autores Picchietti, Allen, Walters y Ferini-Strambi) desarrolló, basándose en los criterios pediátricos de los NIH2 (fig. 1), un algoritmo de SPI definido y probable, adecuado a la edad de los dos grupos y basado en la respuesta a la revisión. El estado del caso se evaluó secuencialmente, y los que respondieron fueron valorados en primer lugar respecto al SPI definido y luego al SPI probable. Cuando se utilizaron descripciones literales en las definiciones del SPI, fueron revisados a ciegas por 3 expertos (autores Picchietti, Allen y Walters). Este trabajo se centra en el SPI definido. Aunque se recogieron muchos datos del SPI probable, sólo se incluyó en el análisis de prevalencia, y en una tabla distinta. Se prevé realizar otro trabajo para evaluar el papel del SPI probable en el esquema diagnóstico pediátrico. El SPI moderado a grave fue definido como el que tuvo una frecuencia de síntomas de al menos dos veces a la semana y con una molestia calificada al menos de moderada (en una escala de cuatro puntos: extrema, moderada, escasa o nula).
La revisión contó con preguntas específicas para impedir calificar de SPI a las molestias posturales simples, los calambres, las artralgias y las agujetas.
AnálisisEl análisis fue realizado con el programa informático Statistical Package for the Social Sciences (SPSS, Inc., Chicago, IL). Cuando fue oportuno, las diferencias entre los grupos se estudiaron mediante tests descriptivos (como los estadísticos χ2, t de Student) y los intervalos de confianza.
RESULTADOSPoblación de estudioLa figura 2 muestra la inclusión de los participantes en el estudio. De los 266.686 domicilios invitados a participar, 38.548 respondieron en el período necesario para obtener una muestra de tamaño adecuado. De ellos, 12.874 familias tenían un hijo en los límites de edad válidos, 11.815 consintieron en participar y 11.582 fueron elegibles según el requisito de que un progenitor biológico cumplimentase la revisión. Diez mil quinientos veintitrés completaron la revisión detallada. Así pues, la muestra constó del 4% del total y el 91% de los que cumplieron todos los criterios de selección cumplimentó la revisión. De los 10.523 niños y adolescentes, hubo 2.133 niñas y 2.192 niños en el grupo de 8 a 11 años de edad, y 2.981 chicas y 3.217 chicos en el grupo de 12 a 17 años de edad.
TABLA 1. Resumen de preguntas
De los 4.325 participantes en el grupo de 8 a 11 años de edad, 2.092 eran de Reino Unido y 2.233 de Estados Unidos. De los 6.198 participantes en el grupo de 12 a 17 años de edad, 2.707 eran de Reino Unido y 3.491 de Estados Unidos. Como las tasas de prevalencia no fueron significativamente distintas entre Reino Unido y Estados Unidos, se combinaron los datos de cada grupo para el análisis, excepto los datos de comorbilidad, que mostraron tasas de diagnósticos comórbidos significativamente distintas entre los países.
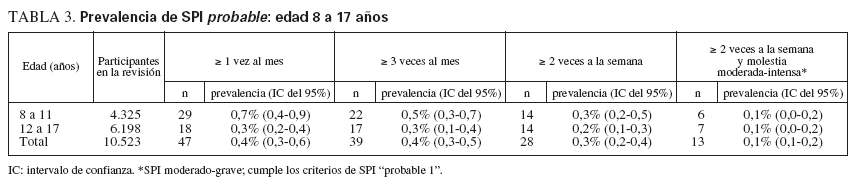
Prevalencia de los síntomas de SPIDoscientos seis niños y adolescentes cumplieron los criterios diagnósticos de SPI definido (tabla 2). Esto corresponde a una prevalencia del 1,9% en el grupo de 8 a 11 años de edad y de 2,0% en el de 12 a 17 años de edad. De ellos, el 27% (22/81) y el 52% (65/125), respectivamente, informó de SPI moderado o grave, lo que corresponde a unas estimaciones de prevalencia del 0,5% y el 1,0%. Otro 0,7% del grupo de 8 a 11 años de edad y otro 0,3% del grupo de 12 a 17 años de edad cumplió los criterios de SPI “probable 1” (tabla 3).
TABLA 2. Prevalencia de SPI definido: edad 8 a 17 años
TABLA 3. Prevalencia de SPI probable: edad 8 a 17 años
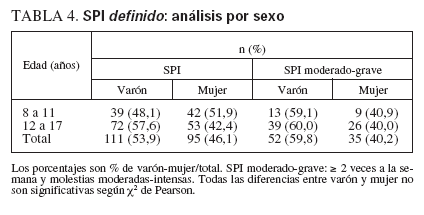
No se encontraron diferencias significativas por sexo en cualquier grupo de edad respecto al SPI definido o probable. La tabla 4 muestra un análisis detallado de los datos de sexo en los grupos de SPI definido.
Los padres de los niños de 8 a 11 años de edad informaron que la “edad a la que aparecieron por primera vez sensaciones incómodas en las piernas” fue: < 5 años de edad, 15%; 5 a 7 años de edad, 63%, y ≥ 8 años de edad, 22%.
Síntomas publicados e impacto percibido del SPIDescripciones del SPI
En los niños de 8 a 11 años de edad se tomaron descripciones detalladas de las sensaciones del SPI porque en este grupo de edad son necesarias la urgencia y una descripción, con las palabras del niño, compatible con molestias en las piernas para la categoría “definido 1” (fig. 1). La tabla 5 ofrece ejemplos de las descripciones expresadas por los participantes.
TABLA 4. SPI definido: análisis por sexo
TABLA 5. Descripciones de las dolencias sensoriales: 8 a 11 años de edad
Dolores del crecimiento
Los niños y los adolescentes con SPI definido tuvieron una probabilidad significativamente mayor de padecer “dolores de crecimiento” respecto a los que no cumplieron los criterios de SPI definido o probable (en conjunto 80,6% frente a 63,2%, p < 0,001). La tabla 6 enumera el porcentaje con antecedente de “dolores del crecimiento” por categoría de edad.
Molestias
Cuando se preguntó hasta qué punto eran molestos los síntomas del SPI (mucho, moderado, escaso, nada), el 22,2% (18/81) de las respuestas de los padres de 81 niños que cumplieron los criterios de SPI definido dijo que los síntomas eran muy molestos para sus hijos, el 32,1% (26/81) informó de molestias moderadas, el 39,5% (32/81) informó de una leve molestia y el 6,2% (5/81) indicó que los síntomas no eran molestos. Se preguntó directamente el grado de molestia a los adolescentes que cumplieron los criterios de SPI definido (n = 125) y el 23,2% (29/125) informó de mucha molestia, el 40,8% (51/125) de molestias moderadas, el 31,2% (39/125) de escasa molestia y el 4,8% (6/125) de ausencia de molestia.
TABLA 6. Historia de “dolores de crecimiento”
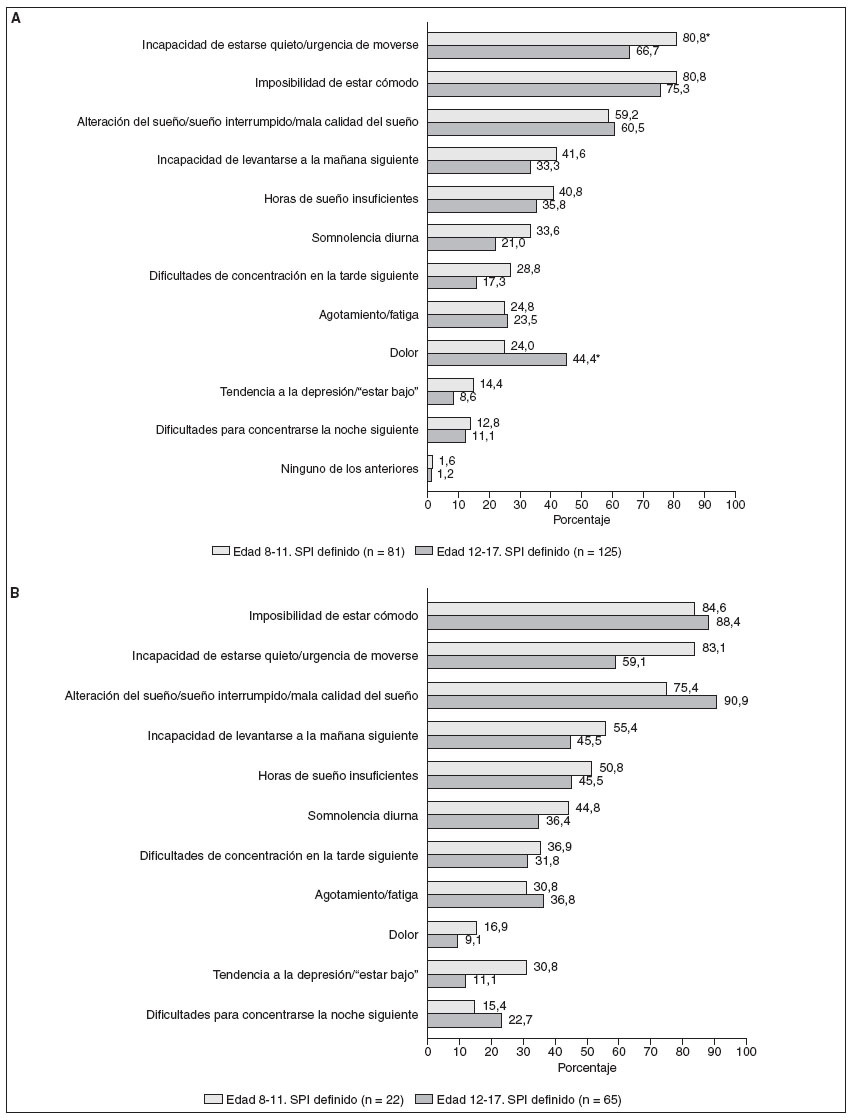
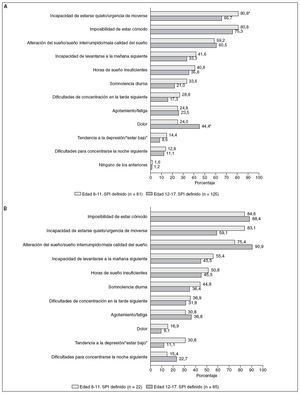
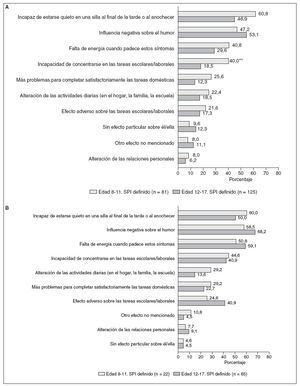
Se pidió a los que respondieron que seleccionasen de una lista los síntomas de SPI que habían padecido. La figura 3A muestra las proporciones de personas que respondieron a cada síntoma. En respuesta a una pregunta sobre qué síntomas eran los más engorrosos, los adolescentes con SPI informaron de la incapacidad de estar cómodos (32,0%) y la incapacidad de permanecer quie-to/la urgencia de moverse (29,6%) mientras que los padres de los niños con SPI informaron de la incapacidad de estar cómodos (30,9%) y el dolor (22,2%) como lo más molesto para su hijo. La figura 3B ofrece las tasas de síntomas de los niños y los adolescentes con SPI moderado a grave, que fueron típicamente mayores que las de todos los afectados por el SPI. En la mayoría de los síntomas no hubo diferencias significativas entre los niños y los adolescentes (fig. 3).
Fig. 3. A. Síntomas notificados: niños y adolescentes con SPI definido. B. Síntomas notificados: niños y adolescentes con SPI moderado grave. *Diferencia significativa 8-11 frente a 12-17 a un valor de p < 0,05.
Alteración del sueño
Los niños y adolescentes con SPI definido tuvieron una probabilidad significativamente mayor de tener antecedentes de dificultades para conciliar el sueño o de permanecer dormido de noche, comparados con los que no cumplieron los criterios de SPI definido o probable (en conjunto 69,4% frente a 39,6%, p < 0,001). La tabla 7 indica el porcentaje con dificultades para conciliar el sueño o para permanecer dormido por categoría de edad. Los adolescentes con SPI definido informaron de una media de 7,1 (mediana 7) horas de sueño en una noche de día escolar. No se dispuso de la notificación de las horas de sueño para los niños de 8 a 11 años de edad. Los padres de los niños de 8 a 11 años de edad con SPI definido informaron de una media de 2,1 (mediana 2) noches de sueño alterado por semana en sus hijos, mientras que los adolescentes con SPI definido informaron de alteración del sueño con una frecuencia media de 3,2 (mediana 3) noches por semana. Como media, esta cifra de los adolescentes es significativamente mayor (t = 4,0529, gl = 204, p < 0,001) que la de los niños. El 83,9% de los padres de los niños con SPI definido informó que su hijo, cuando padecía síntomas de SPI, tardaba más de 30 minutos en dormirse y que se despertaba, 77,6% de los adolescentes con SPI definido informó de tardar más de 30 minutos en conciliar el sueño cuando padecía síntomas de SPI y de despertarse una media de 2,5 (DE = 1,8) veces cada noche.
El 21,0% de los niños de 8 a 11 años de edad, y el 33,6% de los de 12 a 17 años de edad, con SPI definido, informó de somnolencia diurna.
Consecuencias percibidas
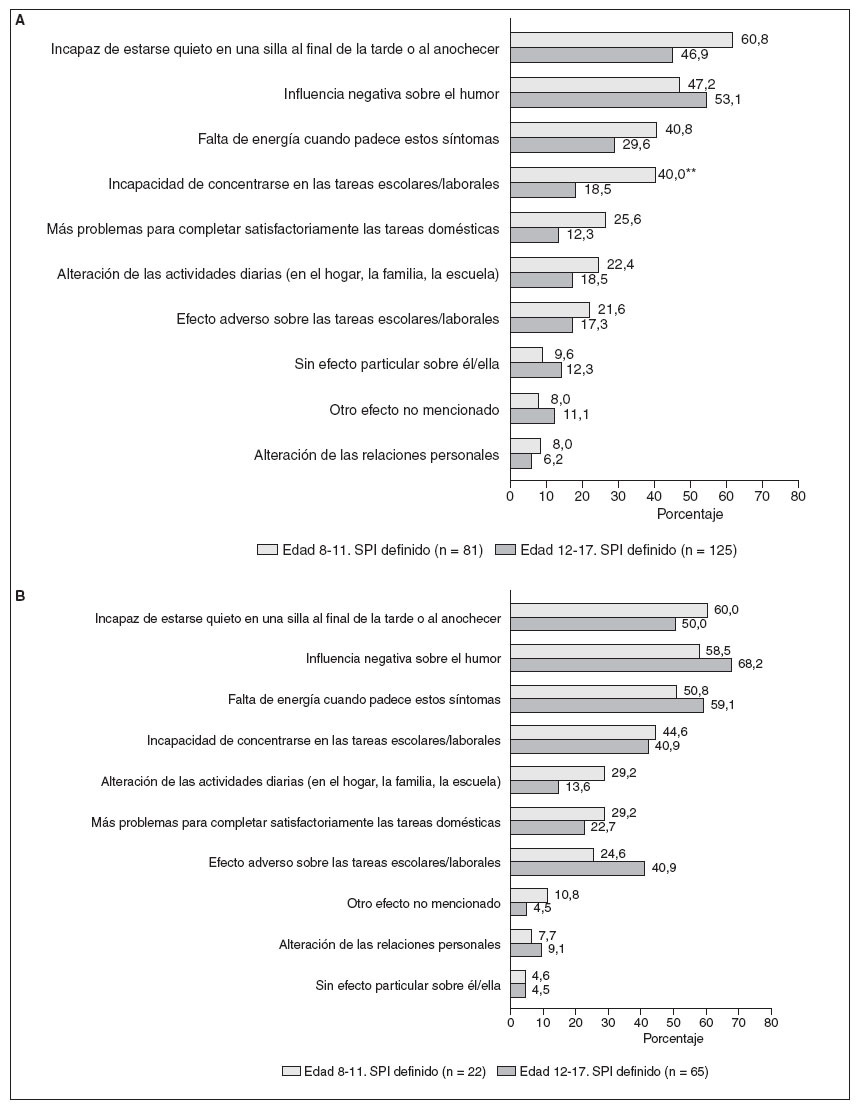
Se pidió a quienes respondieron que seleccionaran de una lista las posibles correlaciones que creyeran relacionadas con sus molestias en las piernas (fig. 4A). En los niños con SPI definido, la consecuencia de los síntomas del RSL citada con mayor frecuencia por los padres fue la influencia negativa sobre el humor del niño (53,1%), seguida de la incapacidad de sentarse tranquilamente por la tarde o al anochecer (46,9%), y de una falta de energía (29,6%). El efecto más frecuente de los síntomas del SPI enumerados por los adolescentes con SPI fue la incapacidad de sentarse tranquilamente durante la tarde o al anochecer (60,8%), seguidas de una influencia negativa sobre el humor (47,2%), una falta de energía (40,8%) y la incapacidad de concentrarse en las tareas escolares/laborales (40,0%). Muchas de las consecuencias notificadas tuvieron mayor prevalencia en los afectos de SPI moderada a grave, incluyendo la influencia negativa sobre el humor y la falta de energía (fig. 4B). Respecto a la mayoría de las consecuencias percibidas no hubo diferencias significativas entre los niños y los adolescentes (fig. 4).
Fig. 4. A. Consecuencias percibidas: niños y adolescentes con SPI definido. B. Consecuencias percibidas: niños y adolescentes con SPI moderado-grave. aDiferencia significativa 8-11 frente a 12-17 a un valor de p < 0,05; bdiferencia significativa 8-11 frente a 12- 17 a un valor de p = 0,01.
Diagnóstico del SPI, tratamiento, antecedentes familiares y alteraciones comórbidasDiagnósticos de SPI
Se investigaron los patrones de consulta de todos los niños y adolescentes con SPI definido. De los 81 niños con SPI definido, 38 (46,9%) informaron haber realizado al menos una consulta médica por los síntomas del SPI en los 12 meses anteriores a la revisión, y de los 125 adolescentes con SPI definido, 64 (51,2%) informó de una consulta. Como respuesta a la pregunta “¿Qué diagnóstico ha recibido su hijo por estos síntomas?”, la explicación médica más habitual de los síntomas del SPI fue la misma para los niños (16 de 38 que consultaron) y los adolescentes con SPI definido (29 de 64 que consultaron), que los síntomas formaban parte del desarrollo normal (44,1%). El porcentaje de los diagnosticados de SPI en una consulta médica fue del 23,7% (9/38) para los niños con SPI definido y del 21,9% (14/64) para los adolescentes con SPI definido. Las tasas globales de diagnóstico médico de SPI de todos los afectados por RSL definido fueron, por lo tanto, 11,1% (9/81) de los niños y 11,2% (14/125) de los adolescentes.
De los 22 niños que cumplieron los criterios de SPI moderado o grave, 11 (50,0%) de los padres informaron haber consultado al médico los síntomas del niño en los 12 últimos meses y, de ellos, 3 (27,3%) informaron que el niño fue diagnosticado de SPI. Del mismo modo, los padres de 41 de los 65 adolescentes (63,1%) con SPI moderado o grave informaron que había solicitado asistencia sanitaria por los síntomas del SPI durante los 12 últimos meses, y 10 de los 41 (24,4%) fueron diagnosticados de SPI. Así pues, las tasa globales de diagnóstico médico de RSL en los grupos moderado a grave fueron: 13,6% (3/22) en los niños y 15,4% (10/65) en los adolescentes.
TABLA 7. Dificultad para conciliar el sueño o para permanecer dormido de noche
Tratamiento
El tratamiento sostenido con prescripción de medicamentos para los niños y los adolescentes con SPI definido fue escaso, pero similar: 6,2% (5/81) y 6,4% (8/125), respectivamente. Sin embargo, sólo en tres casos (1,5%) las medicaciones citadas fueron las consideradas adecuadas en la bibliografía del SPI del adulto44,45: ropinirol (n = 1) y codeína (n = 2). Otros fármacos citados en el tratamiento del SPI fueron amitriptilina, celecoxib, metilfenidato, anfetamina/dextroanfetamina, atomoxetina, coproxamol y un antiinflamatorio tópico. No se mencionó la clonidina ni el clonazepam.
Antecedente familiar de SPI
El antecedente familiar de SPI fue habitual en el grupo de SPI “definido 1” de niños (n = 70) y en el grupo de “SPI definido” de adolescentes (n = 125). El grupo de SPI “definido 2” de niños (n = 11) no fue incluido en este análisis porque la presencia de un familiar en prilos progenitores con respuesta positiva a la pregunta del SPI en el 71,4% (50/70) de los niños SPI “definido 1” y en el 80,0% (100/125) de los adolescentes con SPI definido. Ambos progenitores respondieron positivamente a la pregunta del SPI en el 17,1% (12/70) y el 16,0% (20/125) de las familias, respectivamente. El análisis por sexo del SPI de los progenitores encontró a 44 madres y 18 padres positivos a SPI en el grupo SPI “definido 1” de 8 a 11 años de edad, y en 83 madres y 37 padres del grupo de SPI definido de 12 a 17 años de edad, lo que resulta en unas proporciones madre:padre de 2,4:1 y 2,2:1, respectivamente.
Comparamos a los niños y los adolescentes que cumplieron los criterios diagnósticos de SPI y tuvieron un antecedente familiar de SPI con los que cumplieron los criterios diagnósticos pero no tuvieron antecedente familiar de SPI. No hubo diferencias significativas respecto a la alteración del sueño (pregunta 3) o a ninguna de las consecuencias percibidas y enumeradas en la figura 4A (p > 0,05).
Comorbilidad
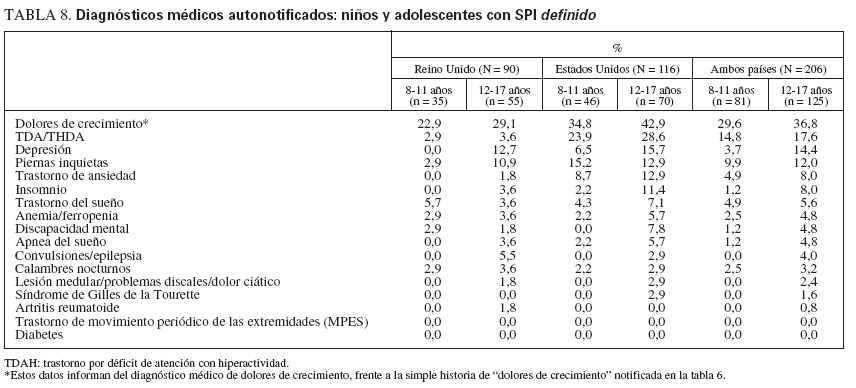
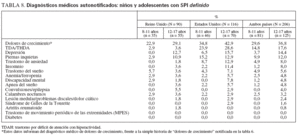
La revisión incluyó una pregunta sobre la historia médica y se pidió a los que respondieron que seleccionaran de una lista los diagnósticos que habían recibido. La lista constó de diagnósticos que pudieran confundirse, imitar o interactuar con el SPI (tabla 8). Como era de esperar, el más frecuente de los diagnósticos médicos notificados fue el de dolores de crecimiento (29,6% de los niños y 36,8% de los adolescentes con SPI). Estos datos sobre el diagnóstico médico de los dolores de crecimiento no deben confundirse con los datos de la tabla 6, que se refieren a la historia de dolores de crecimiento como respuesta a la pregunta “¿Han padecido ‘dolores de crecimiento’?”, que respondieron los padres. Otros diagnósticos médicos habituales fueron los trastornos con déficit de atención (14,8 y 17,6%, respectivamente), la depresión (3,7 y 14,4%, respectivamente) y los trastornos de ansiedad (4,9 y 8,0%, respectivamente). Los niños o los adolescentes estadounidenses con SPI tuvieron más probabilidades de haber sido diagnosticados de un trastorno con déficit de atención, una depresión o un trastorno de ansiedad que los niños o adolescentes de Reino Unido con SPI.
TABLA 8. Diagnósticos médicos autonotificados: niños y adolescentes con SPI definido
DISCUSIÓNQue sepamos, éste es el primer estudio poblacional a gran escala de la prevalencia y el impacto del SPI en los niños y los adolescentes, y es el primero que utiliza definiciones pediátricas específicas del SPI en una revisión de la población general. El hallazgo más importante de este estudio fue la gran prevalencia de SPI definido, el 1,9% de los niños de 8 a 11 años de edad y el 2,0% de los adolescentes de 12 a 17 años de edad. Además, cerca de la cuarta parte de los niños y la mitad de los adolescentes con SPI definido cumple los criterios de SPI moderado o grave. La prevalencia cercana al 2% en los pacientes de 8 a 17 años de edad supera a la de las convulsiones no febriles (∼0,5%) y a la combinada de diabetes tipo 1 y tipo 2 (< 1%) en este mismo grupo de edad, y es similar a las estimaciones de la apnea pediátrica obstructiva del sueño37,46 (∼2%). Esta prevalencia del SPI es congruente con siete grandes estudios epidemiológicos en el adulto, que encontraron una prevalencia del 5 al 10% en Estados Unidos y en Europa occidental3-9, tras ajustar respecto a que el 25% de los pacientes adultos con SPI presentados en dos estudios distintos comenzaron el SPI entre los 10 y 20 años de 39,40. Esto daría una previsión de la prevalencia entre 1,25 y 2,5%, sorprendentemente próxima a los resultados de esta revisión. El otro estudio poblacional pediátrico relacionado con el SPI que conocemos es un estudio longitudinal de niños francocanadienses que incluyó una pregunta acerca de “agitación de las piernas al acostarse” y encontró que el 6,1% de 1.353 niños de 11 a 13 años de edad han presentado constantemente esta dolencia42. Sería de esperar que la adición de los demás criterios diagnósticos del SPI disminuyera apreciablemente este número. Además, se debe indicar que la población francocanadiense tiene una de las mayores tasas de prevalencia poblacional del SPI, estimada entre el 15 y el 20%47,48.
Encontramos que la prevalencia del SPI en los niños y los adolescentes es similar a la de las niñas y las adolescentes, lo que contrasta vivamente con los estudios de SPI en los adultos, que han informado constantemente de una proporción de mujeres a varones de 2:14. Aunque nuestra supervisión hizo hincapié en los síntomas actuales, los padres del grupo de 8 a 11 años de edad informaron que recordaban el inicio del SPI < 5 años de edad en el 15% de los casos, y de 5 a 7 años de edad en el 63%, lo que indica que niños incluso de menor edad que los incluidos en nuestro estudio pueden estar afectados por el SPI.
Las descripciones de las sensaciones en el SPI notificadas por los niños de 8 a 11 años de edad (tabla 5) nos ofrecieron datos convincentes de que esta revisión midió la sintomatología de las piernas inquietas. Informes de sensaciones de hormigueo, cosquillas, electricidad, impulsividad y “energía” fueron habituales y compatibles con nuestra gran experiencia clínica en el diagnóstico del SPI en los niños y los adolescentes. La historia compatible con SPI fue mencionada por más de dos terceras partes de los padres de niños y adolescentes con SPI definido, lo que apoya en este aspecto su utilidad como criterio diagnóstico del SPI en los niños y los adolescentes49. Destaca el notable número de familias en que ambos progenitores informaron de síntomas de SPI, cerca de una de cada seis familias. Esta “carga genética” extra puede desempeñar un papel en la edad de inicio y la gravedad del SPI en la infancia. La mayor prevalencia de síntomas del SPI en las madres respecto a los padres es compatible con los estudios de prevalencia en el adulto, que han mostrado una proporción de mujeres a varones cercana a 2:14. La paridad se considera un factor importante para explicar esta diferencia por sexo4.
Es probable que nuestros datos incluyeran casos primarios y secundarios de SPI. Aunque la tabla 8 enumera los 17 diagnósticos médicos por los que preguntamos, no incluimos una pregunta acerca de todas las alteraciones médicas activas, no preguntamos acerca de todas las medicaciones actuales, y esta gran revisión no incluyó pruebas de laboratorio para la detección sistemática. Las causas conocidas de LRS secundaria son la insuficiencia renal, el embarazo, la neuropatía periférica y algunas medicaciones50,51. No obstante, es probable que gran parte de nuestros casos correspondan a un SPI primario, dada la relativamente escasa observación de estos factores a la edad estudiada y el predominio de casos de SPI primario cuando el inicio es anterior a los 45 años de edad52. Encontramos diagnósticos médicos autonotificados de anemia o de ferropenia, que agravan los factores del SPI, en el 2,5% de los niños de 8 a 11 años de edad y en el 4,8% de los de 12 a 17 años de edad.
Dolores de crecimientoDesde el trabajo de Ekbom sobre SPI entre los años cuarenta y los setenta hubo debate sobre la relación de los dolores de crecimiento con el SPI infantil23,35,53. Creemos que nuestros datos arrojaron luz sobre este tema. La historia de “dolores de crecimiento” fue habitual en los niños de 8 a 17 años de edad con SPI –más de tres cuartas partes– pero también fue habitual en los libres de SPI, casi dos terceras partes. Aun siendo estadística-mente significativa y útil para los datos del grupo, no es probable que esta diferencia sea un factor clave en la decisión de si un paciente en concreto padece un SPI. Sin embargo, hemos observado que los dolores de crecimiento son una pregunta “inicial” clínicamente útil para una discusión más específica de los síntomas del SPI. Quizá más relevante es la disparatadamente elevada tasa de diagnósticos médicos de los dolores de crecimiento en los niños con SPI comparados con los pocos diagnósticos médicos de SPI (tabla 8), lo que sugiere la omisión del mucho más específico diagnóstico de SPI y que también se perdió una oportunidad de tratamiento.
ImpactoEl impacto del SPI en los niños y los adolescentes parece ser sustancial. La frecuencia y la intensidad de las sensaciones del SPI fueron calificadas de moderadas a intensas por cerca de la cuarta parte de los niños de 8 a 11 años de edad y por cerca de la mitad de los de 12 a 17 años de edad (al menos dos veces a la semana y moderadamente o muy molesto). La alteración del sueño fue notificada muy habitualmente en los niños y adolescentes que cumplieron los criterios de SPI definido, superando las dos terceras partes, y mucho más que quienes no presentaron el SPI (tabla 7). Las consecuencias percibidas del SPI fueron comunes: la dificultad para permanecer sentado al final de la tarde o al anochecer, un efecto negativo sobre el humor, la falta de energía y la incapacidad de concentrarse se notificaron con frecuencia en los grupos de SPI definido, y fueron aún más pronunciados en los grupos de SPI moderado a grave (fig. 4). Dada la reciente bibliografía sobre el efecto de la alteración del sueño sobre la función cognitiva y afectiva de los niños y los adolescentes, estos aspectos son de notable preocupación54-60. En nuestra experiencia, el tratamiento de los casos más graves de SPI pediátrico puede ser beneficioso. Sin embargo, debemos destacar que la FDA no ha aprobado hasta ahora ningún tratamiento del SPI en los niños y los adolescentes.
Diagnóstico y tratamientoNuestros datos indican que el SPI se diagnostica con poca frecuencia en los niños y los adolescentes, incluso en los que dicen solicitar asistencia médica por los síntomas. Menos de la cuarta parte de los que solicitan asistencia médica es diagnosticada de SPI, y las tasas de diagnóstico de los moderada o gravemente afectados sólo son un poco mayores. Muy a menudo se indicó una explicación médica de desarrollo normal. Como el SPI no suele ser reconocido como un trastorno médicamente importante, puede existir una tendencia a descartar estos síntomas como carentes de importancia o a interpretarlos como la expresión de alteraciones médicas más conocidas. Cuando se prescribió medicación, sólo una de las medicaciones notificadas hubiera sido considerada un tratamiento de primera línea del SPI en la bibliografía del adulto1,45.
Al tratarse de una revisión y no de una evaluación clínica, es posible que otros diagnósticos pudieran explicar los síntomas de los niños y los adolescentes que cumplieron criterios de SPI definido en nuestro estudio. Sin embargo, los exhaustivos criterios de inclusión y de exclusión utilizados en este estudio, así como la rigurosa aplicación de los criterios de los NIH, lo hacen poco probable, según nuestra opinión. Debemos destacar que los criterios de SPI definido de los NIH en los pacientes < 12 años de edad exigen más síntomas que los necesarios para el diagnóstico en los adultos. Esto se diseñó para evitar el exceso de diagnóstico en los niños. Muy probablemente las bajas tasas de diagnóstico médico de SPI reflejan la falta de conocimiento de quienes ofrecen asistencia médica a los niños y los adolescentes. En dos grandes textos pediátricos estadounidenses, dos párrafos en total46,61, el SPI apenas se menciona. Se ha documentado el escaso conocimiento del SPI de quienes ofrecen asistencia sanitaria a los adultos, aunque hay pruebas de que el conocimiento está mejorando3,21,62.
ComorbilidadEs interesante la comorbilidad de un SPI definido con un trastorno de hiperactividad con déficit de la atención (TDA/TDAH), una depresión y trastornos de ansiedad médicamente diagnosticados en nuestro estudio. Todos se encontraron a tasas mayores que las notificadas en la población pediátrica en general63,64 pero se debe tener cuidado con estos hallazgos dado el pequeño tamaño de la muestra en alguna de las celdas. Además, las tasas de diagnóstico en Reino Unido fueron mucho menores que en Estados Unidos, lo que quizá refleje un menor número de casos, pero con mayor probabilidad se debe a las mayores tasas de diagnóstico y tratamiento de ciertas alteraciones del comportamiento en Estados Unidos con respecto a Reino Unido y Europa65,66. Se considera que existe una compleja relación entre los trastornos de déficit de atención y las alteraciones del sueño en los niños, y existe una cantidad sustancial de bibliografía38,58,67,68. En los adultos con SPI aumenta la tasa de depresión19, ansiedad69,70 y trastorno por déficit de atención71 comparado con la población general. Aunque existen varias teorías, hay cierta evidencia de que el SPI y estas alteraciones ejercen un efecto interactivo negativo entre sí, y que su asociación puede reflejar cierta patología común compartida19,67.
LimitacionesEn la interpretación de nuestros resultados se debe tener en cuenta los temas metodológicos. En primer lugar, la confirmación del estado del SPI fue mediante notificación por los padres o los adolescentes, no por una entrevista clínica. Aunque es posible que otras alteraciones pudieran ser notificadas como sintomatología de SPI, la revisión incluyó un grupo detallado de preguntas para excluir a los conocidos mimetizadores del SPI. La existencia de bajas tasas de diabetes, artritis y problemas ciáticos en los casos de SPI encontrados es tranquiliza-dora, ya que estos problemas son conocidos factores de confusión del diagnóstico en los adultos. Además, en el marco clínico, el diagnóstico de SPI se basa en la historia clínica y no necesita una exploración física para que el diagnóstico sea positivo. En segundo lugar, nuestra revisión se realizó sobre una muestra de conveniencia de usuarios de internet. Los datos del censo de Reino Unido indican que el 55% de los grupos familiares de Reino Unido tenía acceso a internet en julio de 200572. Los datos del censo de Estados Unidos de octubre de 2003, ofrecidos por el US Department of Comerce, indicaron que cerca del 55% de los grupos familiares de Estados Unidos tenía acceso a internet y que el acceso estaba claramente asociado con los ingresos económicos73. Sin embargo, en primavera de 2004, la tasa de utilización de internet en los adultos estadounidenses fue del 63%, y la diferencia de ingresos se estaba eliminando74. En la medida que la prevalencia del SPI, la observación paterna de los síntomas y la utilización de la asistencia sanitaria se asocian con los factores que influyen sobre el empleo de internet o la propensión a participar voluntariamente en revisiones de investigación, nuestros resultados, como los de los demás estudios sobre poblaciones similares, pueden estar sesgados. En tercer lugar, las 10.523 unidades familiares participantes representan un subgrupo del 4% de las unidades familiares inicialmente invitados, que a su vez es un subgrupo de las unidades familiares totales de Reino Unido y Estados Unidos. Para limitar el sesgo de inclusión, no revelamos el tema específico de la revisión hasta cumplir todos los criterios de selección y la inclusión finalizó al cabo de 2 semanas, que fue el tiempo necesario para obtener una muestra del tamaño adecuado. En cuarto lugar, aunque los criterios diagnósticos del SPI pediátrico de los NIH son un consenso de la opinión de los expertos, estos criterios no han sido validados exhaustivamente en el marco clínico. En quinto lugar, las familias con uno de los progenitores afectado por SPI pudieron ser más capaces de identificar los síntomas en sus hijos que las familias sin progenitores afectados, influyendo así en las tasas de prevalencia en los casos familiares. El que los adolescentes cumplimentaran directamente las preguntas sobre el SPI y contar con la presencia de los niños de menor edad cuando el progenitor cumplimentó las preguntas sobre los síntomas sensoriales debería haber disminuido este sesgo.
CONCLUSIONESEste gran estudio poblacional encontró una gran prevalencia de piernas inquietas en los niños y adolescentes de 8 a 17 años de edad. Muchos de ellos tuvieron síntomas moderada o intensamente molestos e indicaron que el SPI afectó negativamente tanto al sueño como al rendimiento diurno. Las tasas de diagnóstico médico del SPI fueron bajas y el tratamiento fue poco habitual.
AGRADECIMIENTOSDamos las gracias a Trevor Brown, de Premark, Inc., por su ayuda en la organización de este proyecto.
Correspondencia: Daniel Picchietti, MD, University of Illinois School of Medicine and Carle Clinic Association, Department of Pediatrics, 602 W University Ave, Urbana, IL 61801, Estados Unidos.
Correo electrónico: clpicchie@uiuc.edu