Las enfermedades diarreicas plantean un importante problema de salud pública global, y especialmente en los países en desarrollo. Se estima que cada año se producen unos 1.500 millones de episodios de diarrea y que la enfermedad diarreica es responsable del 21% de las muertes de niños menores de 5 años de edad. Esto equivale a 2,5 millones de muertes del mismo grupo de edad1,2.
Esta situación es favorable comparado con los resultados de un estudio de 1982, en el que, basándose en una revisión de los datos de farmacovigilancia de los estudios realizados en los años cincuenta, sesenta y setenta, se estimó que los niños muertos anualmente por diarrea eran 4,6 millones3. Los nuevos datos de la Organización Mundial de la Salud (OMS) demuestran que la enfermedad diarreica provoca el 18% de las 10,6 millones de muertes de niños menores de 5 años de edad4.
Uno de los principales avances de la disminución de la mortalidad por la diarrea fue la introducción de la solución de rehidratación oral de la OMS5 (SRO OMS). Sin embargo, la SRO OMS no disminuye significativa-mente el número de deposiciones ni la duración de la diarrea y, por lo tanto, se han buscado otros abordajes para añadir o mejorar la SRO disponible. Algunos de los nuevos enfoques han incluido la adición de zinc al régimen de tratamiento. Zinc es un micronutriente esencial y protege a las membranas celulares del daño oxidativo. El zinc no se almacena en el organismo, de forma que el valor del zinc se determina por el equilibrio entre la ingestión dietética, la absorción y las pérdidas. Puede existir un estado de deficiencia de zinc en los niños con diarrea aguda, debido a la pérdida intestinal. Hace poco se ha publicado una exhaustiva revisión de este tema6. Puntos de vista alternativos indican que el zinc puede actuar como agente farmacológico en la expresión génica7. Varios ensayos aleatorizados controlados (EAC), que demuestran la disminución de la duración de la diarrea, la frecuencia y la cantidad de deposiciones, apoyan la eficacia del zinc en el tratamiento de la diarrea. Se han publicado anteriormente metaanálisis de los efectos terapéuticos8 del zinc en la diarrea aguda y persistente, así como la prevención9 de la diarrea con el suplemento de zinc. Los datos publicados hasta ahora han demostrado la eficacia del zinc en el tratamiento de la diarrea aguda y crónica. Nuestro metaanálisis se realizó para incluir los nuevos estudios publicados desde el último metaanálisis y para examinar la eficacia y la seguridad del tratamiento con zinc durante la recuperación de la diarrea aguda o persistente.
MÉTODOSCriterios de inclusiónLos estudios seleccionados para la inclusión estudiaron la misma hipótesis primaria (duración media de la diarrea; presencia de diarrea los días uno, tres y cinco) en pacientes de características similares (principalmente niños de entre 1 y 60 meses de edad), con diarrea aguda o persistente, incluyendo disentería. La definición de diarrea aguda fue la que duró hasta 14 días y la de diarrea persistente la que duró más de 14 días. Para cumplir con la inclusión hubo que cumplir con la asignación aleatoria de los grupos de tratamiento y la ocultación de la asignación porque una ocultación inadecuada de la asignación, pese al empleo de la aleatorización, permite un sesgo de selección. La intervención con un suplemento oral de sal de zinc, que autorizó cualquier tipo de sal de zinc o de formulación (sulfato, gluconato o acetato) si aportaba al menos 5 mg diarios y con cualquier duración, se examinó frente a un control con empleo de placebo. Todas las comparaciones entre los grupos de tratamiento tuvieron que estar libres de confusión por agentes adicionales o cointervenciones. Los grupos de estudio que, tras la aleatorización, recibieron suplemento de zinc y rehidratación oral salina (SRO) o suplemento de zinc con vitamina A fueron excluidos.
Identificación de los ensayosLa estrategia de búsqueda utilizó búsquedas bibliográficas informatizadas en Medline (1966-2006), el Cochrane Central Register of Controlled Trials (2006), Embase (1974-2006), Lilacs (1982 a 2006); CINAHL (1982 a 2006), Current Controlled Trials (CCT; 2006) y los resúmenes publicados en Pediatric Research (1991-2006) y en el primer (Boston, 2000) y segundo (París, Francia, 2004) World Congress of Pediatric Gastroenterology, Hepatology and Nutrition. Se incluyeron los ensayos publicados y no publicados en un intento por controlar el sesgo de publicación. Las citas de los oportunos estudios fueron verificadas mediante la revisión de la bibliografía y las listas de referencias de los ensayos identificados. Se descargaron los títulos identificados de los resúmenes con posible relevancia y luego se obtuvieron los originales completos de todos los resúmenes considerados relevantes. Veintidós ensayos cumplieron los criterios de inclusión: dieciséis estudios relativos a la definición de la diarrea aguda y seis a la de la diarrea persistente.
Resultados principal y secundarioSe tomaron los datos de ocho resultados clínicamente relevantes. La duración media de la diarrea y la presencia de episodios de diarrea los días uno, tres y cinco fueron nuestros resultados principales. Los datos sobre la frecuencia del vómito; la frecuencia del vómito por tipo de tratamiento; la disminución de la frecuencia de deposiciones, y la probabilidad de continuación de la diarrea fueron los resultados secundarios. Tres revisores (ML, RLT y JVA) tomaron los datos de forma independiente de los mismos artículos mediante una hoja de recogida de datos, y luego compararon la concordancia de los resultados. Los datos así obtenidos fueron controlados respecto a la constancia entre los revisores, la integridad de la aleatorización y la ocultación de la asignación. Las dudas acerca de la interpretación de determinados valores de datos fueron resueltas por los mismos tres revisores. El estadístico (RLT) verificó las entradas en la base de datos definitiva. Pocos estudios satisficieron los criterios de inclusión de todas las variables. Cuando fue necesario nos comunicamos con los autores de determinados estudios para verificar los valores de los datos recogidos derivados de los gráficos, para conseguir más información de forma que pudiera combinarse con otros estudios, o con ambos objetivos. Las tablas 8 y 9 reflejan estos casos.
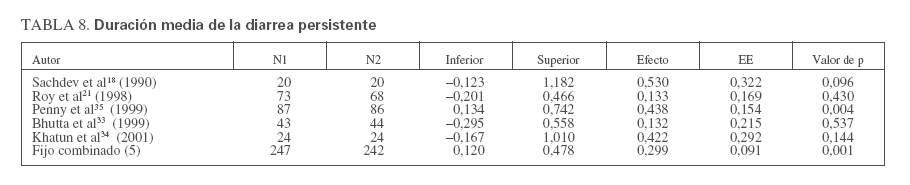
TABLA 8. Duración media de la diarrea persistente
TABLA 9. Efectos del tratamiento con zinc de la diarrea persistente
DefinicionesLas definiciones de diarrea variaron un tanto en todos los estudios incluidos. Por lo general, en los ensayos agudos, las definiciones de diarrea fueron la emisión de tres o más deposiciones desligadas acuosas, o una deposición desligada acuosa con sangre, cada 24 h con una duración de entre 3 y 7 días. En los ensayos de diarrea persistente las definiciones fueron similares, excepto en que persistieron hasta una duración de 14 días.
La definición de la duración de la diarrea también varió pero, en general, fue el intervalo entre la inclusión en el estudio y la primera deposición consistente. La duración se midió en días u horas. Para este metaanálisis se convirtieron en días. Tras la in-clusión/aleatorización se asignó el tratamiento con zinc o el placebo antes de transcurridas 24 h.
Análisis estadísticosSe utilizó Comprehensive Meta-Analysis10, un programa singular, para sintetizar los datos obtenidos de los veintidós ensayos identificados para la inclusión, de los que dieciséis fueron ensayos sobre diarrea agua y seis sobre diarrea persistente. En resumen, el programa informático de análisis produce un diagrama de Forrest como descripción esquemática de los resultados del metaanálisis. El programa se potencia mediante algoritmos informáticos aceptados. Cuando fue oportuno, los resultados se informaron mediante el riesgo relativo (RR) agrupado. En los resultados continuos se calculó la diferencia media ponderada (DMP). Se presentaron los intervalos de confianza (IC) del 95% alrededor del tamaño ponderado del efecto.
HeterogeneidadComo los estudios seleccionados para su inclusión en un metaanálisis serán distintos, se debe investigar el tipo de variabilidad (clínica, metodológica, estadística, o una combinación de ellos) que puede aparecer entre los estudios. Estos tipos de variabilidad se denominan heterogeneidad. El metaanálisis sólo se debe considerar cuando un grupo de ensayos es suficientemente homogéneo (como se indican en los criterios de inclusión) respecto a los participantes, las intervenciones y los resultados para ofrecer un resumen sensato. El estricto cumplimiento de los criterios de inclusión citados, como la ocultación de la asignación, ayuda a controlar la heterogeneidad clínica/metodológica. Con todo, la heterogeneidad estadística también puede producirse cuando existe variabilidad de los efectos de tratamiento evaluados en los distintos ensayos. Se produce cuando los efectos del tratamiento observados difieren más entre sí que lo esperado por un error aleatorio (azar) aislado. Por convención, la heterogeneidad estadística en los resultados de este metaanálisis se denominará sencillamente como heterogeneidad.
Por lo tanto, se realizaron distintos abordajes para la identificación y la medición de la heterogeneidad para examinar hasta qué punto fueron consistentes los resultados de los estudios incluidos. Los intervalos de confianza de los resultados de los estudios individuales (representados gráficamente mediante líneas horizontales) se examinaron respecto al solapamiento, una indicación general de la presencia de heterogeneidad estadística. Más formalmente, la variabilidad (heterogeneidad) entre los tamaños de efecto obtenidos se convirtió formalmente en operativa mediante un test de χ2 de la significación. La fórmula de la heterogeneidad valora la dispersión de los resultados individuales, junto con el efecto combinado, y denota su valor mediante un estadístico Q11. Un valor bajo de p (o un gran estadístico χ2 en relación con sus grados de libertad) ofrece la prueba de la heterogeneidad de los efectos del tratamiento (variación de las estimaciones del efecto superior al azar).
Como siempre se produce cierto grado de diversidad clínica y metodológica en un metaanálisis, es inevitable cierto grado de heterogeneidad estadística. Así, la prueba de heterogeneidad es irrelevante para la elección del análisis; siempre existirá la heterogeneidad, pueda o no detectarse mediante un test estadístico.
Con todo, se han desarrollado métodos para cuantificar la inconstancia en los estudios que ponen su atención lejos de comprobar la existencia de heterogeneidad y valorar su impacto en el metaanálisis. Un estadístico útil para cuantificar la inconsistencia es I2, el porcentaje de variabilidad de las estimaciones del tamaño del efecto que se debe a la heterogeneidad en lugar de al error de muestreo12 (azar). Un valor superior al 50% puede considerarse como una heterogeneidad sustancial, y este porcentaje límite fue el adoptado y examinado también en nuestros análisis.
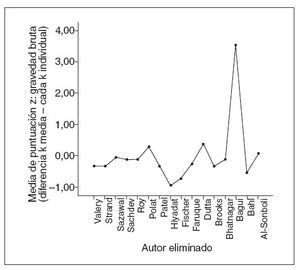
GravedadOtro abordaje más reciente13 ha propuesto la repetición del muestreo en navaja para medir un concepto denominado “gravedad”. En cualquier metaanálisis, los argumentos se han centrado en la inclusión o exclusión de algunos estudios, con debate sobre los que se debe incluir o excluir porque los estudios suelen ponderarse según su tamaño de muestra, su variabilidad interna, o ambas características. Gee propuso que se podría utilizar la repetición del muestreo en navaja para examinar la influencia del estudio y detectar a estudios fuera de límites. La técnica recalcula el metaanálisis una vez cada k estudios, donde cada estudio se excluye de forma individual. Luego se obtienen los resultados de K. La diferencia entre la media de estos resultados k y el resultado individual de cada estudio (cuando se omite) se toma como índice de “gravedad bruta”. Esta diferencia, dividida por la desviación estándar de las diferencias k, se toma como puntuación Z, o “gravedad normalizada” que se puede utilizar para establecer qué estudios podrían tener una influencia fuera de lo común. Para calcular los valores de gravedad normalizada se utilizó SPSS versión 15.014.
Modelo de efectos fijos o aleatoriosLa elección de interpretar un modelo de efectos fijos o uno de efectos aleatorios se consideró detenidamente. Los metaanálisis de efecto fijo ignoran la heterogeneidad. La estimación de efecto fijo y su intervalo de confianza responden a la pregunta “¿cuál es la mejor estimación del efecto del tratamiento?”, mientras que la estimación de los efectos aleatorios y su intervalo de confianza responde a la pregunta “¿cuál es el efecto medio del tratamiento?”. Las respuestas a estas preguntas son análogas cuando no existe heterogeneidad, o cuando la distribución de los efectos del tratamiento es, más o menos, simétrica. En caso contrario, la estimación de efectos aleatorios puede no reflejar el efecto real en cualquier población a estudiar. En un metaanálisis de efecto fijo, la estimación del efecto conjunto se denomina, en general, la mejor estimación del efecto del tratamiento. Por estas razones optamos por un modelo de efectos fijos en nuestro metaanálisis, además de los distintos abordajes indicados para examinar la heterogeneidad, si se encontraba.
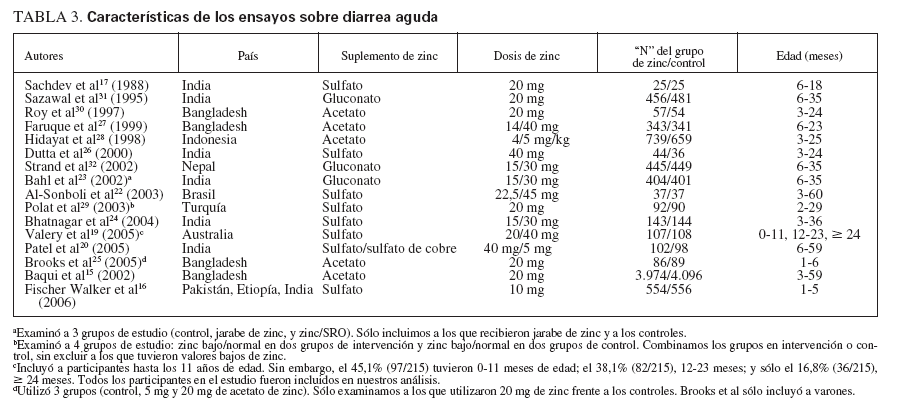
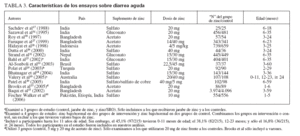
RESULTADOSLas tablas 1 (diarrea aguda) y 2 (diarrea persistente) muestran el autor, el año, el país, la cantidad y el tipo de suplemento de zinc, el tamaño de la muestra y la edad en cada uno de los veintidós estudios seleccionados para la inclusión en el metaanálisis. Aunque los veintidós estudios fueron ensayos aleatorizados controlados, pareció que cinco15-19 no eran de doble ocultación. Dieciséis de estos estudios publicados cumplieron la definición de diarrea aguda y seis la de diarrea persistente.
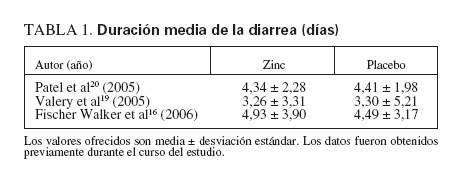
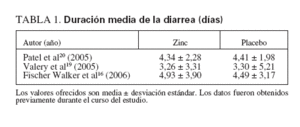
TABLA 1.Duración media de la diarrea (días)
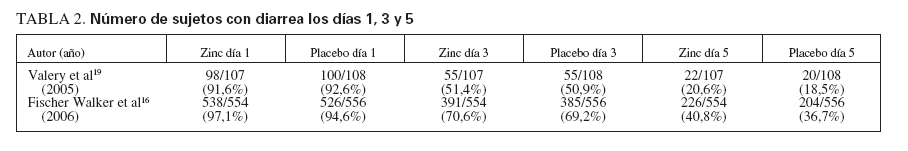
TABLA 2.Número de sujetos con diarrea los días 1, 3 y 5
En conjunto, el 56,3% (9/16) de los ensayos sobre diarrea aguda fue realizado en un marco intrahospitalario y el 43,7% (7/16) en el domicilio y en la comunidad. De los seis ensayos sobre diarrea persistente, el 66,7% (4/6) fue realizado intrahospitalariamente y el 33,3% (2/6) de forma ambulatoria.
MortalidadAl principio, la mortalidad fue un resultado principal en este metaanálisis. Sin embargo, sólo tres15,20,21 de los ensayos, tanto de diarrea aguda como persistente, informaron del resultado de la mortalidad, lo que dificultó la comparación con los ensayos incluidos. Dos de ellos fueron ensayos sobre diarrea aguda15,20 y uno sobre diarrea persistente21. En el ensayo ambulatorio de mayor tamaño sobre diarrea aguda15 (n = 8.070) murieron treinta y tres niños (0,008%; 33/3.974) en el grupo tratado con zinc y treinta y siete (0,009%; 37/4.096) en el grupo placebo. Treinta muertes fueron debidas a ahogamiento y el resto no tuvo relación con una lesión (es decir, no se debieron a la intervención con zinc). Si nos limitamos a las muertes sin lesión, hubo trece en el grupo tratado con zinc y veintisiete en el grupo de placebo. Los investigadores atribuyeron la menor tasa de muerte sin lesión en el grupo de intervención debida casi por completo al menor número de muertes por diarrea e infección aguda de las vías respiratorias bajas. Estas dos causas provocaron, en conjunto, diez muertes en el grupo de intervención con zinc y veinte en el grupo de placebo. En el otro ensayo sobre diarrea aguda20 murieron dos niños de septicemia en el grupo de placebo. En el ensayo sobre diarrea persistente21 las causas de muerte fueron septicemia con diarrea en tres niños, septicemia en un niño, bronco-neumonía en un niño y diarrea sostenida en un niño.
Como la diarrea aguda y la persistente son, muy probablemente, entidades nosológicas distintas, el resultado obtenido se presenta inicialmente para la diarrea aguda (hasta 14 días de duración) y luego para la persistente (más de 14 días de duración).
Resultados de los ensayos de la diarrea agudaDuración de la diarrea aguda
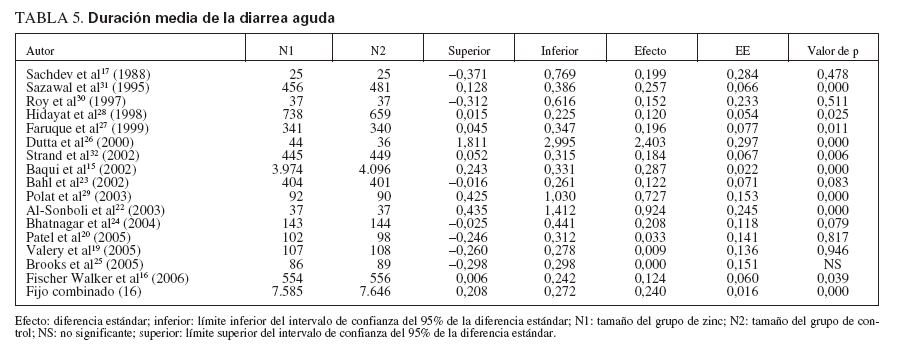
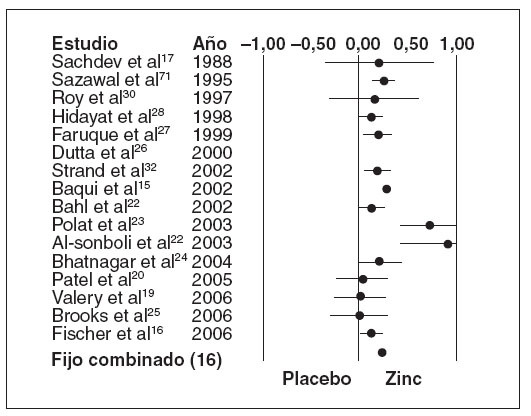
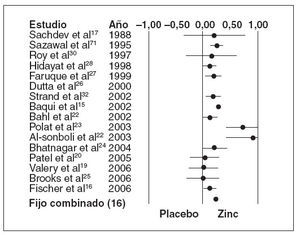
En los dieciséis ensayos que examinaron como resultado principal la duración media de la diarrea aguda15,17,19,20,22-32 (n = 15.231), los que recibieron zinc experimentaron una duración media de la diarrea significativamente menor que los que recibieron un placebo (tabla 3) (fig. 1; DMP, 0,24, EE, 0,02, IC, 0,21-0,27, p < 0,001), aunque también hubo una heterogeneidad estadísticamente significativa (Q = 95,58, gl (Q) = 15, p < 0,001, I2 = 84,3%). La figura 1 muestra un diagrama de Forrest de estos resultados, en los que cada estudio se muestra como una estimación singular con intervalos de confianza.
TABLA 3.Características de los ensayos sobre diarrea aguda
Fig. 1. Diferencia media de la duración de la diarrea aguda. El índice del tamaño del efecto en este diagrama es la diferenciamedia estándar, de forma que un valor de 0,0 indica la ausen-cia de efecto. Los valores inferiores a 0,0 indican mejor resul-tado en el grupo de placebo, y los superiores a 0,0, en el grupode zinc. Si la estimación individual y su intervalo de confianzaestán por encima de 0,0, el estudio cumple el criterio de signifi-cación estadística (para un valor de alfa de 0,05). Si el interva-lo de confianza incluye 0,0, el valor de p superaría 0,05 y el es-tudio no sería estadísticamente significativo.
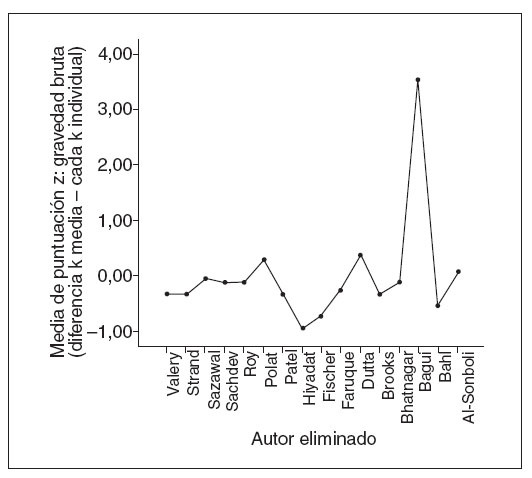
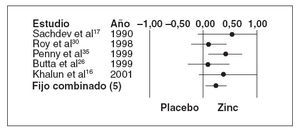
Fig. 2. Resultados de gravedad normalizada.
El examen de una heterogeneidad significativa en los ensayos sobre diarrea aguda encontró cinco ensavos17,19,20,25,30 con diferencias no significativas entre los grupos de zinc y placebo respecto a la duración media de la diarrea. Los valores de p oscilaron entre 0,478 y 1,00 en tamaños de muestra que oscilaron entre 50 y215. Aunque los que recibieron zinc tuvieron una me-nor duración media de la diarrea, la diferencia en cuatro ensayos17,19,20,30fue muy pequeña, con una diferen-cia media de 0,18 ±0,18 días, con límites de 0,04 a 0,40 días. Un ensayo25no encontró diferencias entre losgrupos de tratamiento. Los participantes en los cincoensayos habían estado ingresados por deshidratación se-cundaria a la diarrea, aunque la gravedad de la des-hidratación fue variable. Cuatro de los ensayos17,20,25,30 administraron una solución de rehidratación oral antes de la asignación al tratamiento. Tres ensayos recibieron sulfato de zinc y dos recibieron acetato. Por el contrario, todos los ensayos agudos23,31,32 que ofrecieron gluconato de zinc, y no sulfato de zinc, tuvieron una duración de la diarrea más breve que con placebo (p µ 0,08). Dos ensayos17,20 se realizaron en India, dos25,30 en Bangladesh y uno19 en Australia. Un ensayo15, cuya duración media con el empleo de zinc fue significativa-mente menor (1,2 días menos), mostró también un tamaño de muestra tremendamente mayor (n = 8.070) que todos los demás.
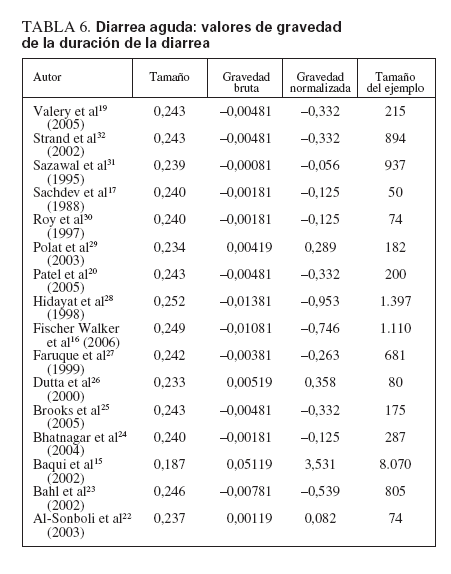
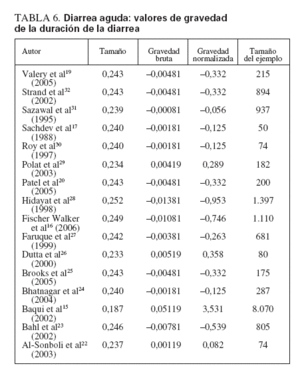
La tabla 5 muestra los tamaños del efecto, los valores calculados de la gravedad bruta, los valores de la gravedad normalizada y los tamaños de la muestra de cada estudio cuando se eliminaron. Está claro que un estudio15 ejerció mucho impacto sobre la potencia y la dirección del valor del tamaño estimado del efecto encontrado para la duración media de la diarrea aguda entre todos los estudios. Cuando se eliminaron, el nuevo promedio del tamaño del efecto obtenido (0,187) y el valor representado de la gravedad normalizada (3,531; fig. 3) se consideraron valores fuera de límites en comparación con todos los demás. Esto se atribuyó en gran medida al enorme tamaño de la muestra (n = 8.070) utilizado en el ensayo, ya que incluso diferencias muy pequeñas de la duración media de la diarrea resultarían estadísticamente significativas.
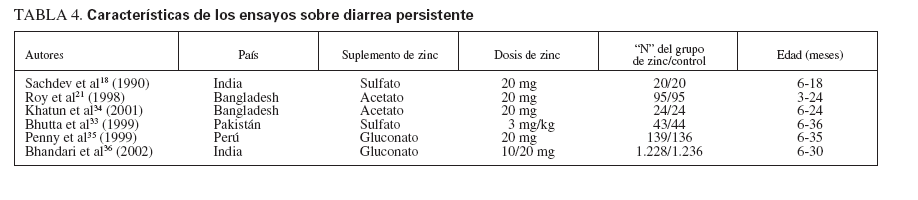
TABLA 4.Características de los ensayos sobre diarrea persistente
TABLA 5. Duración media de la diarrea aguda
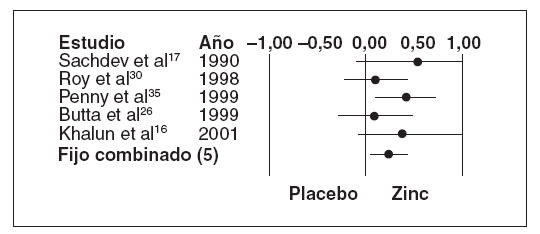
Fig. 3. Diferencia media de la duración de la diarrea persis-tente. El índice del tamaño del efecto en este diagrama es la di-ferencia media estándar, de forma que un valor de 0,0 indica la ausencia de efecto. Los valores inferiores a 0,0 indican mejor resultado en el grupo de placebo, y los superiores a 0,0, en elgrupo de zinc. Si la estimación individual y su intervalo de con-fianza están por encima de 0,0, el estudio cumple el criterio designificación estadística (para un valor de alfa de 0,05). Si el intervalo de confianza incluye 0,0, el valor de p superaría 0,05 y el estudio no sería estadísticamente significativo.
Aparición de la diarrea en el día 1
Cinco ensayos sobre diarrea aguda16,19,20,27,32 informaron de la aparición de diarrea el día 1 (n = 3.100). No hubo diferencia estadísticamente significativa en la aparición de diarrea aguda el día 1 (RR 1,01, IC 0,99-1,03, p = 0,30). Y, aunque la variabilidad en los tamaños del efecto osciló entre un mínimo de 0,968 y 1,965, se produjo una heterogeneidad significativa; Q = 10,60, gl (Q) = 4, p = 0,03, I2 = 62,3%.
Aparición de diarrea el día 3
Seis ensayos sobre diarrea aguda16,19,20,23,27,32 recogieron datos de la aparición de diarrea el día 3. No hubo diferencias estadísticamente significativas entre los grupos de tratamiento respecto a la aparición de diarrea el día 3 (RR 0,97, IC 0,91-1,03, p = 0,36). Sin embargo, se determinó la existencia de heterogeneidad significativa (Q = 10,880, gl (Q) = 5, p = 0,05), I2 = 54,0%. Sólo un ensayo30 encontró una aparición de diarrea el día 3 significativamente (p = 0,01) menor con zinc (27,4%) que placebo (35,4%), tamaño de efecto 0,774. Sin embargo, se encontró la existencia de heterogeneidad estadísticamente significativa (Q = 10,880, gl (Q) = 5, p = 0,05), I2 = 54,0%.
Aparición de diarrea el día 5
De forma similar, en los mismos seis ensayos sobre diarrea aguda16,19,20,23,27,32 no hubo diferencias estadísticamente significativas entre los grupos de tratamiento respecto a la aparición de diarrea el día 5 (RR, 0,94, IC 0,84-1,05, p = 0,26). Del mismo modo que los resultados a los 3 días, se encontró una heterogeneidad estadísticamente significativa (Q = 18,957, gl (Q) = 5, p = 0,002), I2 = 73,6%.
Vómitos
La proporción de participantes que vomitaron tras la dosis inicial en once ensayos sobre diarrea aguda16,17,19,22-25,29-32 (n = 4.438) fue significativamente mayor con el empleo de zinc (278/2.196; 12,7%) que con placebo (171/2.242; 7,6%) (RR 1,55, IC 1,30-1,84; µ 0,001%; Q = 25,54, p = 0,004).
Vómitos tras la administración de sulfato o de gluconato de zinc
En tres ensayos sobre diarrea aguda hubo una proporción significativamente mayor de pacientes que vomitaron tras recibir gluconato de zinc23,31,32 (160/1.095; 14,6%) que tras tratamiento con sulfato/acetato de zinc16,17,19,22,24,25,29,30 (118/1.101; 10,7%) (RR 1,18, IC 1,05-1,31, p = 0,006).
Acortamiento de la duración de la diarrea
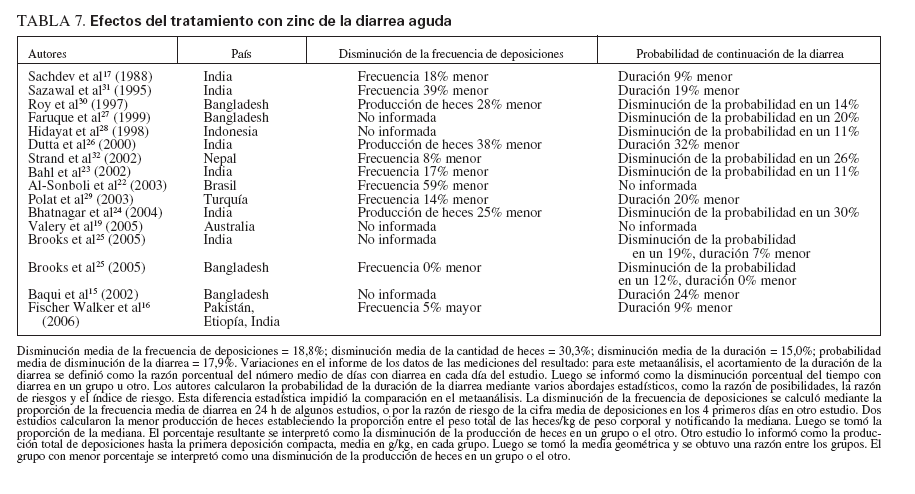
Ocho ensayos sobre diarrea aguda15-17,20,25,26,29,31 encontraron un acortamiento medio de la duración de la diarrea del 15,0% para los que recibieron zinc en comparación con placebo (tabla 6).
TABLA 6. Diarrea aguda: valores de gravedad de la duración de la diarrea
Disminución de la frecuencia de deposiciones
Siete ensayos sobre diarrea aguda17,22,23,25,29,31,32 encontraron una disminución media de la frecuencia de las deposiciones del 22,1% con el tratamiento con zinc, comparado con placebo. Un solo ensayo16 encontró una frecuencia de deposiciones un 5,0% mayor utilizando zinc que placebo.
Cantidad de heces
Tres ensayos de diarrea aguda24,26,30 encontraron una disminución media de la cantidad de heces del 30,3%.
Probabilidad de disminución de la diarrea
Ocho ensayos agudos20,23-25,27,28,30,32 midieron la probabilidad de disminución de la diarrea y encontraron una disminución del 17,9% utilizando zinc en comparación con placebo.
Resultados de los ensayos sobre diarrea persistenteDuración de la diarrea persistente
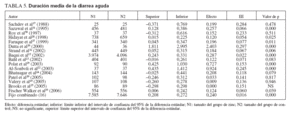
En cinco ensayos sobre diarrea persistente18,21,33-35 (n = 489) los que recibieron placebo también experimentaron una duración media de la diarrea significativamente menor que el grupo placebo (tabla 4; DMP 0,30, EE 0,09, IC 0,12-0,48, p < 0,001) pero sin una heterogeneidad significativa (Q = 3,08, gl (Q) = 4, p = 0,544), I2 = 29,9%). La figura 2 muestra el diagrama de Forrest de estos resultados.
Aparición de diarrea el día 1
En dos ensayos sobre diarrea persistente34,35 (n = 221) no hubo diferencias estadísticamente significativas entre los grupos de tratamiento respecto a la aparición de diarrea el día 1 (RR 1,00, IC 0,93-1,08, p = 0,98) y no hubo una variabilidad estadísticamente significativa entre los tamaños del efecto (Q = 0,01, gl (Q) = 1, p = 0,93).
Aparición de diarrea el día 3
En dos ensayos sobre diarrea persistente34,35 (n = 221) los tratados con zinc tuvieron una incidencia de diarrea el día 3 significativamente menor que los del grupo placebo (RR 0,70, IC 0,51-0,94, p = 0,02). No hubo una variabilidad estadísticamente significativa entre los tamaños del efecto (Q = 0,33, gl (Q) = 1, p = 0,56).
Aparición de diarrea el día 5
No examinada. La notificaron menos de 2 estudios.
Vómitos
En cuatro ensayos sobre diarrea persistente18,21,35,36 (n = 2.969) vomitó una proporción de los que recibieron zinc (41/1.482; 2,8%) significativamente mayor que con placebo (2/1.487; 0,001%) (RR 3,64, IC 1,02-13,02, p = 0,047; Q = 5,91, p = 0,116).
Vómitos tras sulfato o gluconato de zinc
En cuatro ensayos sobre diarrea persistente18,21,35,36, los que recibieron gluconato de zinc35,36 vomitaron con mayor frecuencia (41/1.367; 3%) que los que recibieron sulfato/acetato de zinc (0/115; 0%) (RR 1,09, IC 0,94-1,09, p = 0,07).
Acortamiento de la duración de la diarrea
En cuatro ensayos sobre diarrea persistente18,21,34,35, los que recibieron zinc experimentaron un acortamiento medio de la duración de la diarrea del 15,5% con respecto a los que recibieron placebo (tabla 7).
TABLA 7. Efectos del tratamiento con zinc de la diarrea aguda
Disminución de la frecuencia de deposiciones
Cuatro ensayos sobre diarrea persistente observaron que quienes recibieron zinc también experimentaron una media de disminución de la frecuencia del 9,8%.
Cantidad de heces
La cantidad de heces no se midió en los ensayos persistentes.
Probabilidad de disminución de la diarrea
Dos ensayos persistentes33,36 que midieron la probabilidad de una disminución de la diarrea encontraron una disminución del 18,0% con el empleo de zinc, respecto a placebo.
ANÁLISISSegún estos hallazgos, que ahora aumentan la gran cantidad de datos clínicos previamente publicados y actualizan los metaanálisis y las revisiones sistemáticas anteriores8,37, el tratamiento con zinc es útil para tratar la diarrea tanto aguda como persistente y su profilaxis. Con todo, como se estudió exhaustivamente en una revisión sistemática muy reciente6, falta mucha información acerca de los mecanismos por los que el zinc ejerce fisiológicamente su efecto antidiarreico. En este metaanalisis cinco17,19,20,25,30 de dieciséis estudios sobre la diarrea aguda (31,3%) no encontraron diferencias estadísticamente significativas entre el zinc y el placebo respecto a la duración media de la diarrea (al menos a una p µ 0,48). De forma similar, dos21,33 de cinco estudios sobre diarrea persistente (40,0%) tampoco encontraron diferencias significativas en la duración media de la diarrea entre los tratamientos (al menos a una p µ 0,43). Aún así, la media de las disminuciones de la frecuencia de deposiciones, el acortamiento de la duración de la diarrea y las probabilidades de un acortamiento de la duración notificada de la diarrea fueron mayores en los estudios con tratamiento con zinc en comparación con placebo.
Para la mayoría de los individuos, la diarrea significa un aumento de la frecuencia o una disminución de la consistencia de los movimientos intestinales. En muchos países desarrollados, la media de movimientos intestinales es de tres al día. Sin embargo, la diarrea se asocia con un aumento del peso de las heces, debido principalmente al exceso de agua, que normalmente constituye un gran porcentaje de la materia fecal. Por ello, la diarrea se distingue de las enfermedades que causan sólo un aumento del número de movimientos intestinales, o incontinencia fecal.
Puede ser difícil determinar las causas exactas de la diarrea porque son muchos los agentes diarreicos distintos, con variedad de agentes infecciosos, como bacterias, parásitos y virus. La identificación de los agentes diarreicos específicos está complicada por la falta de acceso a las pruebas de laboratorio en muchos países en desarrollo. La gastroenteritis viral causada por rotavirus es la causa principal de diarrea entre los lactantes de todo el mundo. Otros agentes etiológicos son los patógenos bacterianos, como Vibrio cholerae, Shigella y Salmonella. Los protozoos como Cryptosporidium parvum y Giardia lamblia son dos de los agentes diarreicos protozoarios más frecuentes. Los síntomas principales de la infección por rotavirus son fiebre y vómitos de varios días de evolución, seguidos de diarrea no sanguino-lenta. Aunque normalmente no es fatal, la diarrea causada por el virus puede ser bastante intensa, conduciendo a una deshidratación que puede llegar a amenazar la vida. Aunque su tratamiento con líquidos intravenosos es sencillo en los países desarrollados, estos suministros no suelen estar disponibles en el mundo en desarrollo, y la deshidratación causada por el rotavirus es una importante causa de muerte.
En realidad, las conclusiones de estos ensayos aleatorizados respecto a la eficacia del tratamiento con zinc sobre la duración de la diarrea incluyeron un aumento de la absorción de agua y electrolitos por el intestino y una regeneración más rápida del epitelio intestinal38. También se ha descrito el aumento de los valores de las enzimas del ribete en cepillo (apical), que indica un transportador del zinc en los enterocitos39, y una respuesta inmunitaria más potente con aumento de la eliminación de los patógenos del intestino40.
La eficacia del tratamiento de rehidratación oral para corregir la deshidratación y disminuir la mortalidad condujo a modificar la solución de rehidratación oral con zinc. El éxito del tratamiento con zinc ha sido atribuido, en general, a una disminución del volumen de la absorción de líquido y sodio (Na) en el intestino delgado desencadenada por el suministro de zinc. Con todo, aún no se han aclarado por completo los mecanismos por los que el zinc mejora el transporte de líquidos y electrolitos. Esto incluye el efecto del zinc sobre el transporte intestinal de iones, tanto si el zinc provoca o incrementa la absorción de cationes, suprime la secreción de aniones, o ambas cosas, como si su deficiencia aumenta la probabilidad de una diarrea secretora.
La localización del efecto del zinc es, muy probablemente, en el intestino delgado, dada su inhibición de la secreción de líquido dependiente del cloro (Cl) inducida por la adenosina 3’,5’ monofosfato cíclica (cAMP). El tratamiento con solución de rehidratación oral debería ejercer su máximo efecto en la disminución de la pérdida de líquido mediante el aumento de la absorción en el intestino delgado. Así pues, el tratamiento con zinc tras el realizado con la solución de rehidratación oral puede no haber mostrado un efecto beneficioso (disminución de la duración media de la diarrea) respecto al placebo en cinco ensayos17,19,20,25,30 de este metaanálisis sencillamente porque el tratamiento previo con una solución de rehidratación oral ya ha llevado al máximo la tasa de absorción en el intestino delgado.
El zinc inhibe la secreción de Cl inducida por cAMP mediante la inhibición específica de los canales basolaterales de potasio (K) sin efecto de bloqueo sobre los canales de K mediados por calcio (Ca) en los estudios in vitro en el íleon de rata41. El zinc también inhibe la secreción de iones inducida por la toxina del cólera, pero no la inducida por la enterotoxina termoestable de Escherichia coli, en el cultivo de células Caco-2. Un estudio42 ha demostrado que cAMP actúa como efector intracelular de la secreción de líquido inducida por la enterotoxina termolábil. La guanosina 3’,5’ monofosfato cíclica (cGMP) media la secreción de líquido inducida por enterotoxina termoestable. De sustanciarse, la eficacia del zinc se limitaría a la diarrea inducida por enterotoxina termolábil o a la diarrea mediada por cAMP pero no por cGMP ni Ca intracelular. También se ha notificado43 que un receptor sensor del zinc desencadena la liberación de Ca2+ intracelular y regula el transporte de iones. La concentración micromolar de zinc extracelular provoca la liberación masiva de calcio de los depósitos intracelulares en la línea celular de colonocitaria. El aumento sostenido de la concentración intracelular de Ca puede aumentar el eflujo de K y una hiperpolarización del potencial de la membrana celular, lo que conduce a un gradiente eléctrico ventajoso para la secreción de Cl.
Aunque es más accesible el tratamiento alternativo de rehidratación oral, todavía hay problemas importantes en la distribución del tratamiento. Una vacuna antisecretora podría ser una solución mucho más rentable. La vacuna antisecretora podría inducir inmunidad sin que los niños necesitaran sufrir numerosas infecciones, y los riesgos asociados con ellas. Al evitar que los niños contrajesen infecciones, la vacuna podría disminuir en gran medida el número de muertes debidas a enfermedades diarreicas, así como la carga sobre el sistema sanitario.
El modelo de un fármaco antisecretor debería actuar inhibiendo la secreción intestinal6 de Cl y HCO3, en vez de centrarse en disminuir la motilidad gastrointestinal, la regeneración, restauración, o ambas cosas, del epitelio intestinal. Es necesario acelerar la investigación dirigida a conseguir una mayor comprensión de la biología, la química y la biopatología del zinc en el sistema gastrointestinal. ¿Mantiene el zinc los sistemas de defensa intestinal? ¿Cuál es la relación entre el zinc y el equilibrio hídrico intestinal? ¿Cuáles son, definitivamente, las relaciones de los transportadores intestinales de zinc con el estado corporal de zinc? ¿Existe un transportador de zinc en la membrana (apical) del ribete en cepillo de los enterocitos? Es de esperar que las respuestas a estas y otras preguntas impulsen la creación de un tratamiento farmacológico que induzca colectivamente la absorción de cationes, inhiba la secreción de aniones, reduzca la frecuencia de deposiciones y la cantidad de heces, disminuya la duración de la diarrea y sea seguro, tolerable y barato.
AGRADECIMIENTOQueremos dar las gracias al Dr. William D. Lyman, PhD, por su ayuda y sugerencias para redactar el manuscrito.
Correspondencia: Marek Lukacik, MD, Children’s Medical Center Department of Pediatrics, Medical College of Georgia, 1120 15th St, Augusta, GA 30912, Estados Unidos.
Correo electrónico: mlukacik@mcg.edu