El virus del papiloma humano (VPH) está formado por moléculas de ADN circular de 8.000 pares de bases de longitud y envueltas por una cubierta proteica compuesta por 2 moléculas. Hay más de 120 tipos descritos, de los cuales sólo 15 se consideran de alto riesgo para el desarrollo de cáncer de cuello de útero.
El ciclo se inicia cuando las partículas infecciosas alcanzan la capa basal del epitelio a través de pequeñas roturas. Allí se unen a las células y penetran en ellas. Se ha sugerido que, para mantener la infección, el virus debe infectar una célula madre epitelial.
La infección por VPH es asintomática y la mayoría de los casos se resuelven de forma espontánea: un 70% en el transcurso del primer año y un 90% en los 2 primeros años, ofreciendo una protección posterior frente a reinfecciones. El porcentaje restante evoluciona a cambios neoplásicos epiteliales que dan lugar a lesiones precancerosas de bajo grado que también remiten espontáneamente en un 60% de los casos. El resto de los casos progresan a lesiones precancerosas de alto grado que pueden conducir, si no se tratan, a un cáncer de cerviz cuya evolución requiere entre 30 y 40 años.
El VPH se transmite casi exclusivamente por vía sexual. Su prevalencia entre la población femenina se sitúa en un 10-15% a partir de los 30-35 años en todo el mundo, aunque con importantes diferencias territoriales. En España, la tasa media, en el segmento bajo, se sitúa alrededor del 3%. En edades más jóvenes, las tasas son más elevadas, pero la mayoría de estas presencias virales desaparecen de forma espontánea, sin dejar secuelas, a lo largo del primer o segundo año.
Vacuna contra el VPHLa vacuna tetravalente está indicada en la prevención de la displasia cervical de alto grado (CIN 2/3), carcinoma cervical, lesiones displásicas vulvares de alto grado (VIN 2/3) y verrugas genitales externas (condiloma acuminata) relacionadas causalmente con los tipos 6, 11, 16 y 18 del VPH.
El objetivo final a largo plazo de la vacuna frente al VPH es la prevención del cáncer invasor de cuello de útero. Otros objetivos asociados son la prevención de los otros cánceres relacionados con el VPH: vulva, vagina, ano y pene y, probablemente, orofaringe. A corto y medio plazo se pretende prevenir las lesiones precursoras del cáncer de cuello de útero, neoplasia intraepitelial de cuello de útero y CIN, especialmente la considerada lesión precursora necesaria, CIN 3. Además, la vacuna tetravalente plantea la posibilidad a corto plazo de prevenir las verrugas/condilomas genitales y la papilomatosis respiratoria recurrente, causadas por los tipos 6 y 11 del VPH.
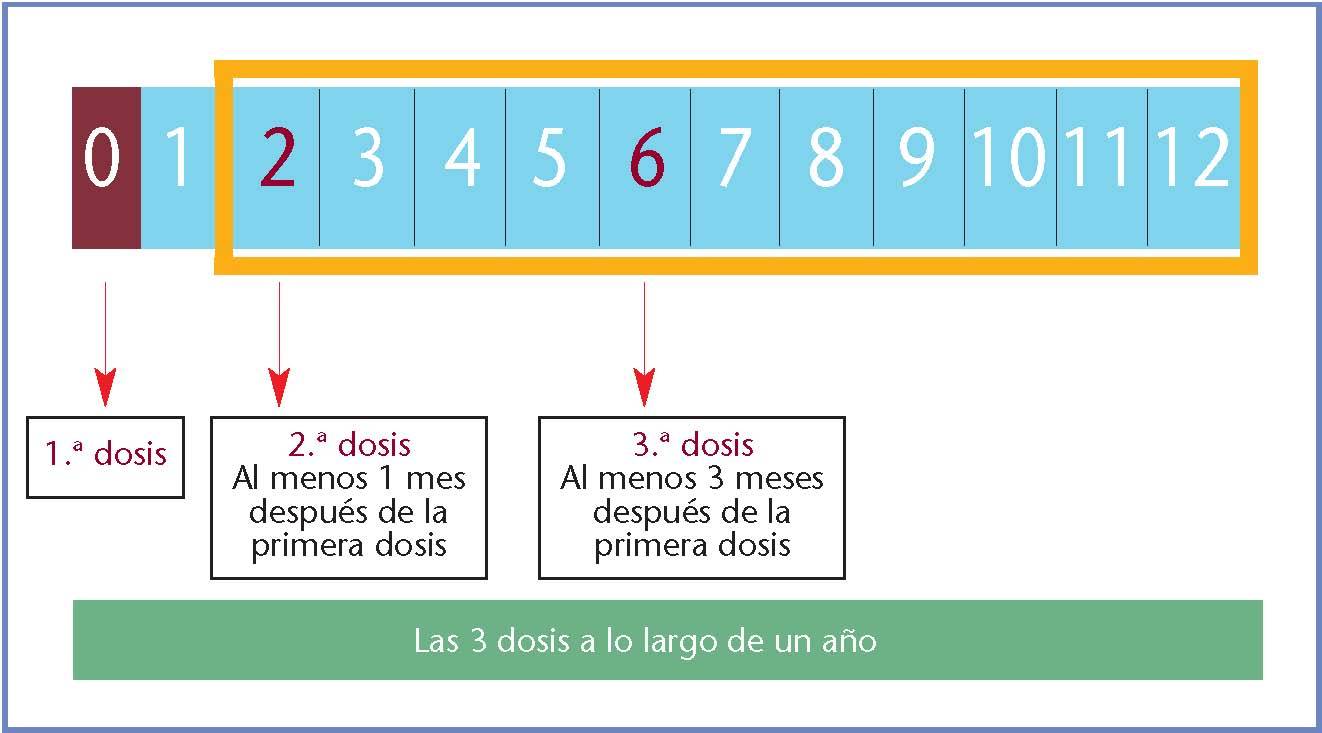
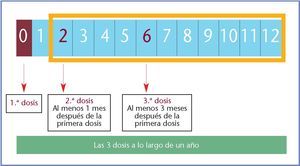
La vacuna tetravalente incluye partículas similares al virus (VLP) de los tipos 6, 11, 16 y 18, y utiliza una sal de aluminio como adyuvante. El esquema de vacunación recomendado tras el desarrollo clínico está compuesto por 3 dosis intramusculares de 0,5 ml. La segunda dosis se administra a los 2 meses de la primera y la tercera a los 6 meses. No es necesario administrar dosis de recuerdo (fig. 1).
Fig. 1. Dosificación de la vacuna tetravalente contra los VPH
La vacuna está indicada para mujeres de 16-26 años de edad y niñas y niños de 9 a 15 años. Su eficacia no ha sido evaluada en varones.
Mecanismo de acciónLa vacuna induce la formación de anticuerpos específicos que interfieren en el proceso de transmisión viral uniéndose al VPH y neutralizándolo para evitar que penetre en las células diana epiteliales.
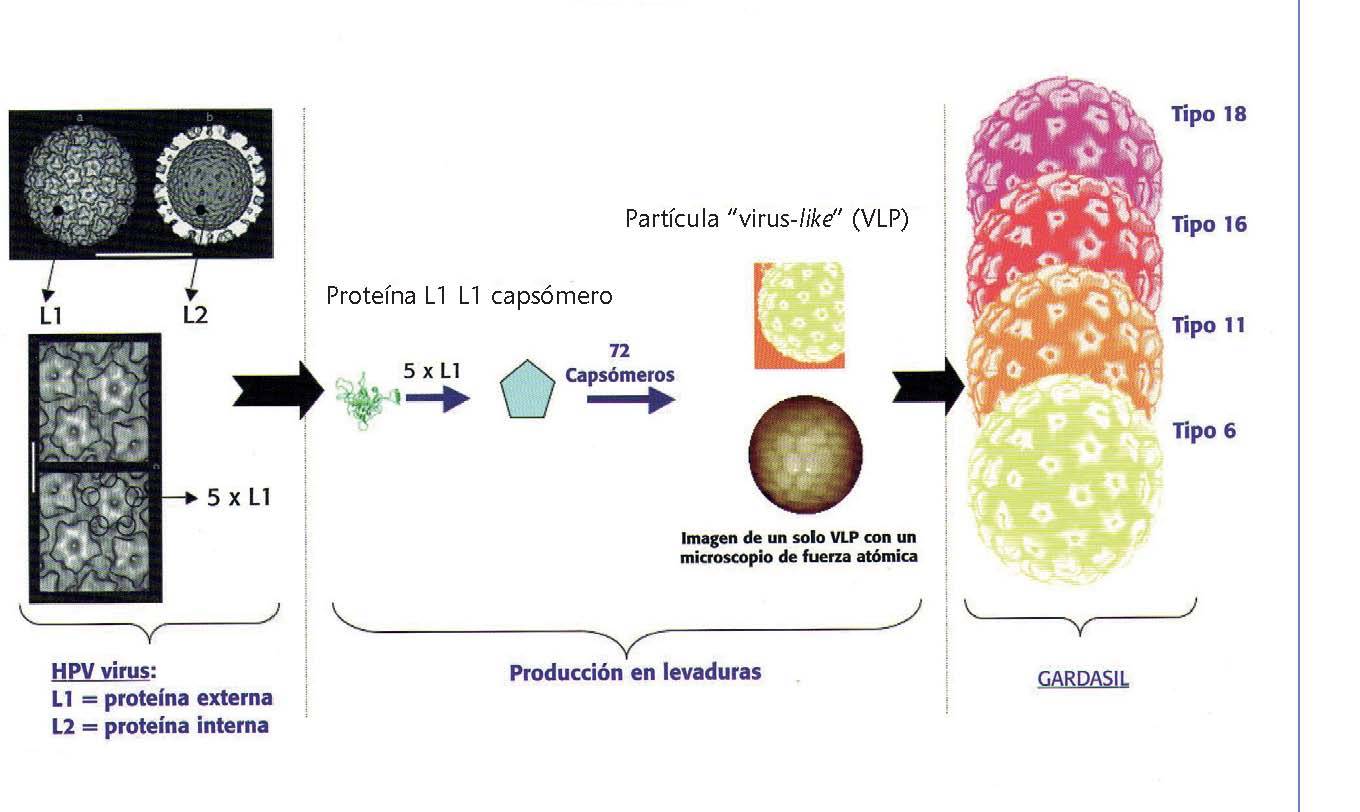
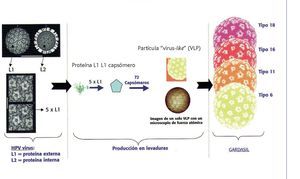
La vacuna tetravalente recombinante no infecciosa se prepara a partir de VLP altamente purificadas de la proteína L1 de la cápside mayor de los tipos 6, 11, 16 y 18 del VPH. Las VLP no contienen ADN viral, no pueden infectar células, reproducirse ni causar la enfermedad. El VPH sólo infecta a los seres humanos, pero los estudios en animales con análogos del virus del papiloma sugieren que la eficacia de las vacunas de VLP L1 está mediada por el desarrollo de una respuesta inmune humoral (fig. 2).
Fig. 2. La vacuna simula la cápside viral
De los tipos de VPH presentes en la vacuna:
- VPH 16 y 18 son responsables de aproximadamente el 70% de los casos de displasia cervical de alto grado (CIN 2/3) y adenocarcinoma in situ (AIS) y aproximadamente del 70% de los casos de displasia vulvar de alto grado (VIN 2/3) en mujeres jóvenes premenopáusicas. VPH 16 y 18 son también responsables de la mayoría de las lesiones vaginales escamosas de alto grado (VaIN 2/3). Otros tipos del VPH no contenidos en la vacuna son responsables del 20-30% de los restantes casos de CIN 2/3, VIN 2/3 y VaIN 2/3. CIN 3 es un precursor inmediato aceptado del cáncer cervical invasivo. VIN 3 es un factor de riesgo importante para el desarrollo del cáncer vulvar en mujeres jóvenes premenopáusicas infectadas con los tipos carcinogénicos del VPH.
- VPH 6 y 11 son responsables de aproximadamente el 90% de los casos de verrugas genitales.
- VPH 6, 11, 16 y 18 son responsables del 35 al 50% de CIN 1 o displasia cervical de bajo grado.
La eficacia de la vacuna fue evaluada en 4 estudios clínicos de fase II y III aleatorizados, a doble ciego y controlados con placebo entre un total de 20.541 mujeres de 16-26 años de edad, reclutadas y vacunadas sin cribado previo de presencia de infección por VPH.
Las variables primarias de eficacia incluyeron lesiones vulvares y vaginales relacionadas con VPH 6, 11, 16 o 18 (verrugas genitales, VIN, VaIN) y CIN de cualquier grado (Protocolo 013, FUTURE I), CIN 2/3 y AIS relacionados con HPV 16 o 18 (Protocolo 015, FUTURE II), infección persistente relacionada con VPH 6, 11, 16 o 18 (Protocolo 007) e infección persistente relacionada con VPH 16 (Protocolo 005).
CIN 2/3, una displasia de grado moderado a alto, fue utilizada en los ensayos clínicos como un marcador clínico subrogado del cáncer cervical.
Reacciones adversasEn los ensayos clínicos, solo un 0,2% de los sujetos abandonó el estudio debido a efectos adversos. Las reacciones adversas que se observaron con más frecuencia fueron las siguientes:
- Muy frecuentes:
- Pirexia.
- En el lugar de inyección: eritema, dolor, hinchazón. - Frecuentes:
En el lugar de inyección: hemorragia, prurito. - Con una frecuencia inferior al 1% se observaron:
Trastornos respiratorios, torácicos y mediastínicos: - Muy raras:
Broncoespasmo. - Trastornos de la piel y del tejido subcutáneo:
- Urticaria.