La triquinosis es una parasitosis que tiene su origen en Asia, desplazándose posteriormente al continente Europeo con las invasiones mongólicas del siglo xiii y con las importaciones de cerdos desde China en el siglo xviii. Los primeros brotes, de la enfermedad como tal, fueron observados a finales del siglo xix, ya que en tiempos pasados se confundían con toxiinfecciones alimentarias.
El sacrificio de animales para consumo humano fuera del matadero y de sus controles pertinentes es una actividad frecuente, por ello la triquinosis es un riesgo sanitario asociado al consumo de su carne o de los productos elaborados a partir de ella, como pueden ser chorizos, salchichas, etc. Para controlar sanitariamente a estos animales se realiza cada temporada, desde el servicio de Sanidad Ambiental, la campaña sobre la matanza domiciliaria de cerdos. Esta parasitosis es de declaración obligatoria, y por lo tanto cualquier caso detectado debe ser puesto en conocimiento de la Dirección General de Salud Pública. Trichinella spiralis parasita mayoritariamente al cerdo y a otros animales como pueden ser la rata, el perro, el caballo, el jabalí y en general cualquier otro mamífero depredador o carroñero.
Este parásito produce una zoonosis endémica en España, por lo que las autoridades sanitarias han dictado normas, recogidas en la Orden de 17 de enero de 1996 sobre la detección de triquina en las carnes frescas procedentes de animales domésticos de las especies porcina y equina, para asegurar la inocuidad de los alimentos cárnicos.
Etiología
Como hemos dicho anteriormente, el agente etiológico o causal de esta parasitosis es el nematodo Trichinella spiralis, que infesta al hombre cuando este ingiere carne contaminada con quistes que contienen larvas viables del parásito.
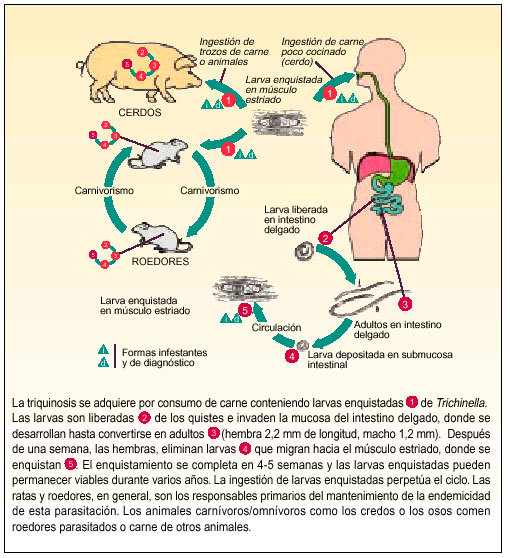
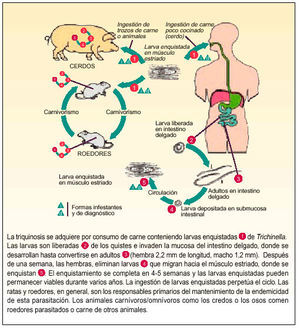
Al ciclo biológico, que es directo, se le conoce como autoheteroxeno, ya que todas las fases suceden dentro de un mismo hospedador (fig. 1).
Fig. 1. Ciclo biológico de Trichinella spiralis.
Tanto el ciclo como la vida de este parásito son fundamentalmente endocelulares, y se produce en las microvellosidades intestinales y en el tejido muscular.
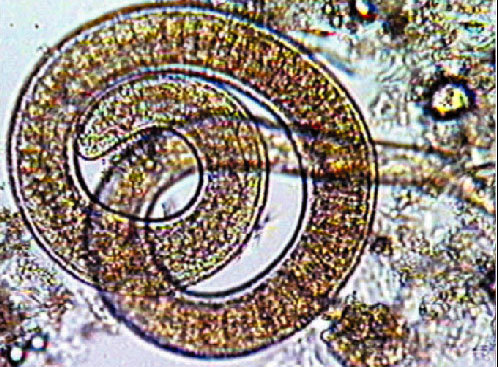
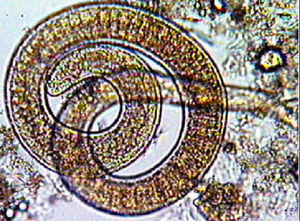
Los quistes musculares con las larvas, al llegar al estómago, por medio de la acción de enzimas proteolíticas, dejan en libertad las larvas (fig. 2), que pasan a la mucosa intestinal donde evolucionan hasta convertirse en adultos; una vez fecundadas las hembras, y después de aproximadamente 5 días, empiezan a eliminar larvas vivas.
Fig. 2. Liberación de las larvas en el estómago.
La producción de larvas por parte de la hembra depende del grado de infestación, del estado inmunológico del huésped, de la especie de Trichinella parásita y de la especie a la que pertenece el hospedador. Transcurridas unas 6 semanas, la hembra es arrastrada con el bolo alimenticio y es eliminada con las heces.
Las larvas pasan a la circulación general, dirigiéndose posteriormente al músculo estriado. A pesar de tener preferencia por los músculos con alta actividad y bajas tasas de glucógeno, como el diafragma, bíceps, lengua y maseteros, también pueden invadir cualquier otro tipo de tejido.
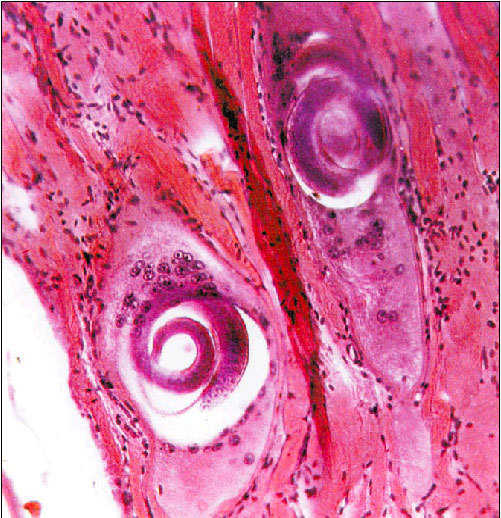
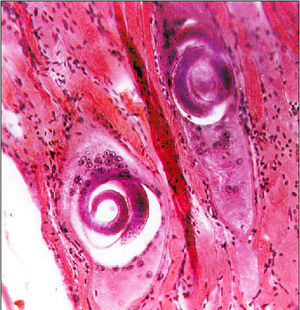
Transcurridas 6-8 semanas, la larva se enquista (fig. 3), pudiendo permanecer viable 2 años, período durante el cual puede volver a iniciarse el ciclo si el animal que las alberga es ingerido por otro carnívoro. La forma del quiste depende de la actividad del músculo, ya que es más esférico en músculos muy activos y más oval en los poco activos. Cada quiste alberga generalmente una larva, aunque puede llegar a presentar tres.
Fig. 3. Enquistamiento de la larva.
El cuadro clínico en humanos es muy variable ya que, a pesar de que se trata generalmente de una infestación benigna, puede llegar a ser un proceso mortal si no se diagnostica ni trata rápidamente
En resumen, dentro del ciclo biológico de T. spiralis, podemos distinguir la presencia de distintas formas de vida de este parásito:
Larvas musculares. Se liberan vivas tras la digestión péptica del quiste muscular.
Adultos. La larva, tras varias mudas, se transforma en adulto, diferenciándose en machos y hembras. Las hembras, con el doble de tamaño que los machos, son vivíparas.
Embriones. Son las larvas recién nacidas. Migran por los capilares sanguíneos buscando su alojamiento en el tejido muscular estriado.
Quiste muscular. Los embriones, al llegar al músculo estriado, penetran mecánicamente en las células musculares y se enquistan en él.
Epidemiología
La triquinosis es una parasitosis de distribución cosmopolita, más frecuente en países donde se consume la carne de cerdo cruda o insuficientemente cocinada. Es una parasitosis casi inexistente en países de Oriente Próximo y Medio, donde las prácticas religiosas prohíben la ingesta de carne de cerdo. Las salchichas caseras, embutidos y la carne de jabalí también constituyen una fuente común de triquina.
Esta parasitosis es endémica, apareciendo como un brote que afecta a pocas personas generalmente relacionadas, ya que suelen proceder de la misma familia o comparten la matanza de un mismo animal.
En la Península Ibérica hay una prevalencia constante de triquinosis, aunque la incidencia sea variable. Los focos de triquinosis humana, tanto en España como en Portugal, son poco frecuentes, aunque el notable incremento, durante los últimos años, del consumo de carne de jabalí representa un peligro potencial, siendo altamente peligrosa la carne de este animal que no haya pasado la inspección veterinaria1.
La rata de los basureros es un reservorio importante para mantener la parasitosis, aunque el cerdo es determinante para que ésta se presente en el hombre si se alimenta de desperdicios de animales parasitados2. Los cerdos criados por la industria cárnica no suelen padecer esta parasitosis, ni cualquier otro proceso viral o bacteriano, ya que se crían con alimentación controlada y en situación de aislamiento con una cuidada inspección que evita que el parásito llegue al hombre. Si bien, en el centro y sureste de España, donde existen explotaciones montañesas donde los cerdos van al campo y conviven con la fauna silvestre, es posible que puedan infestarse por carroñerismo, ya que los animales silvestres pueden estar infestados. Los focos de triquinosis sufridos en España en los últimos 30 años se localizan en las cordilleras del país, y se deben mayoritariamente al consumo de cerdos no inspeccionados o de jabalíes cazados furtivamente.
En Francia, en 1998, surgió un brote de triquinosis producido por la ingesta de carne de caballo3.
Los cánidos son los animales que alcanzan tasas más altas de prevalencia, mayoritariamente lobos4 y zorros5,6, sobre todo cuando viven alejados de las poblaciones humanas y de los vertederos. Además, se han encontrado casos de parasitación de animales árticos7 como el oso polar8, mapache, erizo, morsa y mofeta. En estas zonas árticas se baraja la posibilidad de que sea la ingestión de carne de oso la que propaga la infestación, aunque también podría producirla la carne de cualquier otro tipo de animal salvaje9.
Signos y síntomas
El cuadro clínico en humanos es muy variable ya que, a pesar de que se trata generalmente de una infestación benigna, puede llegar a ser un proceso mortal si no se diagnostica ni trata rápidamente.
Las alteraciones sintomatológicas se dividen en tres etapas sucesivas cuya severidad dependerá del número de parásitos ingeridos: fase intestinal, de migración y de estado.
Fase intestinal
Aparece después de un período de incubación que oscila de 2 a 10 días. Se origina dolor abdominal tipo cólico acompañado de náuseas, vómitos, diarreas y malestar general.
La sintomatología suele confundirse con una intoxicación alimentaria tanto por la similitud de los síntomas como porque afecta simultáneamente a un grupo de personas relacionadas. Durante esta fase no es normal que se produzca la muerte del individuo parasitado. Este cuadro dura de 10 a 12 días.
Fase de migración o invasión muscular
Aparece aproximadamente 5 días más tarde. Se caracteriza por la presencia de fiebre, edema palpebral crónico bilateral, dolor e hinchazón de los músculos afectados, conjuntivitis, cefalea, insomnio, irritabilidad, decaimiento generalizado y pérdida de peso. Es característico a partir de la segunda semana de infestación la presencia de eosinofilia por encima del 10%. La manifestación más grave en esta fase es la miocarditis, que puede llegar a producir la muerte.
Aunque las larvas pueden penetrar en multitud de células, las que lesionan con más gravedad son las del músculo cardíaco, cerebro y retina, a pesar de que su objetivo principal son las fibras del tejido muscular estriado.
Si el músculo afectado es el diafragma se produce hipo y dolor al respirar.
Fase de estado
Las larvas ya se han establecido y el síntoma predominante es el dolor muscular que se exacerba con el ejercicio.
Con el tiempo los síntomas desaparecen y la pared quística se calcifica, pudiendo llegar a verse los quistes calcificados en las fibras musculares expuestas. Algunas infestaciones se descubren casualmente en las autopsias.
Diagnóstico
Para un diagnóstico certero de la triquinosis se debe tener en cuenta el antecedente de haber ingerido carne de cerdo, productos cárnicos derivados o músculo de animales como el jabalí poco cocinados.
Para la realización del diagnóstico la búsqueda de adultos que puedan aparecer en las heces no es certera ni se utiliza. Los métodos de laboratorio que se utilizan directos, indirectos, ELISA y hemaglutinación.
Métodos directos
Se basan en la observación al microscopio de una biopsia de alguno de los músculos donde el paciente presente más dolor, y será positivo si se observan quistes con larvas. También se pueden realizar cortes histológicos (con pequeños fragmentos de músculo) que se tiñen con hematoxilinaeosina (histopatología).
Métodos indirectos
Dentro de este tipo de métodos podemos destacar varios como la reacción de floculación con bentonita, que es muy específica pero muy laboriosa, por lo que no se utiliza.
ELISA
Detecta anticuerpos específicos a partir de la segunda semana de parasitación. Éste es un método muy utilizado10.
Hemaglutinación indirecta
Se usa con frecuencia. Cabe destacar que, aparte de cualquier prueba de diagnóstico realizada, se debe tener en cuenta la presencia de eosinofilia por encima del 10%.
En los animales, salvo el diagnóstico post mortem, sólo tienen utilidad los métodos inmunológicos, entre ellos destacamos los siguientes:
Exploración de anticuerpos circulantes (IgM) que aparecen tempranamente y se mantienen durante un largo período de tiempo si el animal está parasitado.
Técnicas de precipitación del suero problema11.
ELISA es la técnica de elección si no existe la posibilidad del examen después de muerto, ya que es una técnica útil y segura.
Tratamiento
El tratamiento depende de la fase del ciclo en la que se encuentre la infección. Cuando se diagnostica la triquinosis en la fase intestinal el tratamiento se realiza con piperazina, mebendazol o albendazol, mejor tolerado que los anteriores12. Es importante el uso de corticosteroides para disminuir la inflamación13 y de analgésicos para controlar el dolor. El reposo durante el tratamiento farmacológico es importante. Para las formas larvarias se recomienda el uso de albendazol durante 6 días.
En veterinaria, el tratamiento, al igual que en humanos, depende de la fase de desarrollo en la que se encuentra el parásito.
Contra los preadultos muestra una eficacia del 100% el flubendazol; contra adultos el pirantel y contra larvas enquistadas, el carbamato de bencimidazol o el flubendazol, acompañados de prednisona inyectada.
Medidas profilácticas
Dentro de las medidas profilácticas que se deben llevar a cabo para evitar esta parasitosis destacamos las siguientes:
Evitar la ingestión de carne de cerdo o productos cárnicos derivados si la matanza del cerdo es clandestina.
Se debe consumir la carne previa cocción o cualquier otro tratamiento térmico, evitando comerla cruda o poco cocinada.
En caso de duda sobre la procedencia de la carne, ésta debe ser congelada a 29 ºC durante 5 días para que se destruyan, en caso de existir, los quistes.
Las piezas de caza deben ser llevadas a un matadero autorizado para que se realice la inspección post mortem por parte de un veterinario oficial, aunque sea para consumo propio.
La salazón no es un método que garantice la total inocuidad del producto sino se ha completado el tiempo pertinente.
No alimentar a los cerdos con desperdicios crudos, y llevar a cabo en las instalaciones donde viven programas de desratización.
Realizar inspecciones veterinarias en cualquier establecimiento dedicado a la cría de cerdos. *