En las últimas décadas se ha producido el desarrollo de una de las ramas más fascinantes de la biología: la tecnología del ADN recombinante, que permite la manipulación del genoma de un individuo, con aplicaciones tanto desde el punto de vista terapéutico como comercial, al ofrecernos no sólo el desarrollo de nuevos métodos de diagnóstico, sino también la transferencia de información genética.
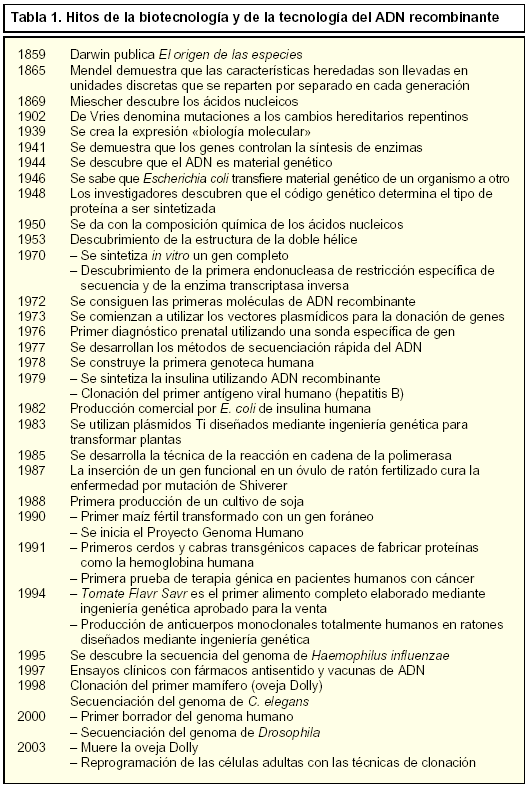
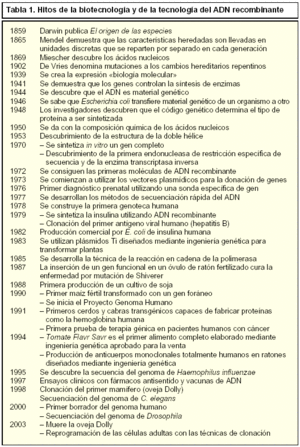
Aunque la mayor parte de los avances que ha hecho posible el desarrollo de la tecnología del ADN recombinante son resultado de investigaciones realizadas en las cuatro o cinco últimas décadas (tabla 1), la historia realmente se inició cuando los babilinios y egipcios produjeron frutos por fecundación artificial y aunque Sócrates (420 a.C.) hipotetizó que los padres no se parecían a los hijos, «los hijos de grandes hombres de estado generalmente son perezosos o buenos para nada», ya Hipócrates (400 a.C.) afirmó que el hombre transmite las características hereditarias en el semen (semilla) y que debe haber otro fluido en la mujer, siendo el aporte aproximadamente igual. Más tarde, los hindúes observaron que ciertas enfermedades aparecían en las familias y Manú (100-300 d.C.) nos dijo que «el hombre no puede escapar a sus orígenes». Aunque no fue hasta mediados del siglo xix, con las investigaciones independientes de Charles Darwin y Gregor Mendel, cuando realmente comenzó el concepto actual de genética.
Charles Darwin (1809-1882), conocido como padre de la biología moderna, fue el primero en describir que las especies no eran fijas e inalterables, sino capaces de evolucionar durante el tiempo, y que sólo los individuos cuyos rasgos favorecieran la supervivencia y la reproducción se mantendrían y se propagarían. De forma casi simultánea, Gregor Mendel (1823-1884) estableció los fundamentos de la genética moderna, realizando experimentos con plantas y estudiando las leyes básicas que controlan la herencia, llegando a la conclusión de que los rasgos o características hereditarias son transportados y transmitidos a los descendientes como unidades discretas, originando el concepto de gen, aunque el término propiamente dicho no se utilizara hasta comienzos del siglo xx.
Quizás, debido a que Mendel sólo describió el comportamiento esencial de los genes sin revelar su naturaleza química, ni identificar el material genético, el punto de inflexión de la sucesión imparable de descubrimientos fue la descripción de la estructura del ADN por Watson y Crick (1953). De esta forma, comenzó el conocimiento y la comprensión de la estructura y funciones del ADN hacia la segunda mitad del siglo xx, desarrollándose el concepto de ácido nucleico como macromolécula básica que contiene la información genética o interviene en su descodificación y describiéndose dos clases, el ácido desoxirribonucleico (ADN) y el ácido ribonucleico (ARN). Estos avances permitieron a los científicos, en la década de los setenta, el desarrollo de técnicas capaces de combinar segmentos y transferir porciones de ADN de un organismo a otro, dando lugar a la aparición de la Genética Molecular. Esta ciencia abarca desde la replicación del ADN, pasando por la trascripción, o copia del ADN a ARN, hasta la traducción o síntesis de proteínas que son en realidad las efectoras de la función codificada en el ADN. El perfeccionamiento de estas técnicas ha permitido conocer que el origen de numerosas enfermedades es el resultado de alteraciones en la expresión y funcionalidad de proteínas, por lo que hoy día se utilizan para el diagnóstico de enfermedades que presentan desórdenes genéticos.
La transducción de genes foráneos en organismos vivos comenzó con la observación de que el ADN aislado podía ser introducido en células en cultivo y éste se integraba al genoma y sintetizaba la proteína correspondiente en la célula receptora.
Durante este trabajo revisaremos los avances que han tenido lugar en las técnicas y vectores utilizados en la aplicación terapéutica, dejando para un segundo artículo las aplicaciones que se están llevando a cabo en este campo.
La terapia génica presenta tres componentes indisociables y necesarios: el primero, un gen de interés del cual se espera que la expresión en una célula normal se acompañe de un efecto terapéutico. El segundo lo constituye la célula blanco, sobre la cual hay que realizar la modificación y el tercero es el vector, vehículo que transporta el material genético y permite su introducción en la célula blanco.
Entendemos por vectores a los sistemas que utilizamos como ayuda en el proceso de transferencia de un gen exógeno al interior de la célula
Los diferentes modelos experimentales sobre los que se lleva a cabo la manipulación genética se clasifican, en in vivo, ex vivo e in situ, dependiendo del tipo de muestra y del método utilizado. En el procedimiento in vivo se inocula al paciente directamente con el vector y los genes a transducir alcanzan las células diana a través del torrente circulatorio, utilizándose este método para el tratamiento de enfermedades tales como la fibrosis quística y algunas neoplasias. En el proceso ex vivo se realiza la corrección del defecto genético en células extraídas del propio paciente que son cultivadas y modificadas genéticamente en el laboratorio y que, al dividirse, transmiten el transgén a sus células hijas, devolviéndose al paciente sólo aquellas poblaciones celulares en las que se ha comprobado la integración y funcionamiento correcto del transgén. Este procedimiento se utiliza cuando las células diana son células o tejidos que presentan la capacidad de renovarse a partir de células precursoras, como es el caso de la piel, los endotelios, el hígado o los mioblastos musculares. Ejemplos de esta estrategia están representados por la modificación de linfocitos T en el tratamiento de la deficiencia en adenosina desaminasa de hepatocitos en la hipercolesterolemia familiar y de linfocitos infiltradores de tumores en algunas enfermedades neoplásicas. La tercera y última estrategia la constituye la terapia génica in situ o somática que consiste en la introducción de las modificaciones genéticas en las células somáticas de un organismo sin modificar las células germinales.
Vectores
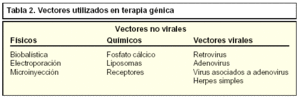
Entendemos por vectores a los sistemas que utilizamos como ayuda en el proceso de transferencia de un gen exógeno al interior de la célula. Ellos facilitan la entrada y biodisponibilidad intracelular del material genético a transducir y, por consiguiente, su funcionamiento correcto. Se ha utilizado una gran variedad de vectores con fines experimentales y de forma genérica los podemos clasificar en: vectores no virales y vectores virales (tabla 2).
Vectores no virales
Los vectores no virales engloban aquellas técnicas de transducción donde el material genético es introducido utilizando tanto métodos químicos (fosfato cálcico, liposomas) como físicos (biobalística, electroporación, microinyección).
Los vectores químicos fueron los primeros en utilizarse, alguno de ellos, como el fosfato de calcio y los liposomas, en la década de los sesenta y setenta del siglo pasado aunque no se lograron buenas eficiencias en la transducción hasta mediados de los ochenta. La utilización del fosfato de calcio se basa en la capacidad que presentan los iones calcio para precipitar el ADN provocando que la célula, mediante endocitosis, introduzca el ADN en su interior. No es una técnica que provoque toxicidad en las células, pero la expresión del transgén es transitoria y con una eficacia de transfección cercana al 10%. Su utilización se ve reducida a cultivos celulares en aplicaciones ex vivo. Los liposomas constituyen bolsas rodeadas de una membrana lipídica, a semejanza de una célula eucariota animal, capaces de introducir ADN en la célula diana. Los liposomas catiónicos interaccionan tanto con el material genético a transferir como con las membranas celulares que deben atravesar, debido a la presencia de cargas netas negativas originadas por los grupos fosfato en el ADN y por residuos del ácido siálico de la superficie celular. Así, los lípidos catiónicos condensan el ADN y, ya en forma de complejos transfectantes, se unen a las proteínas azucaradas de la membrana plasmática mediante enlaces electrostáticos.
Los complejos transfectantes con carga neta positiva utilizan las proteínas azucaradas de la membrana plasmática para fijarse en la célula. Los lípidos catiónicos interaccionan con las cargas negativas del ADN condensándolo, mientras que los transportadores catiónicos interaccionan con las cargas negativas que presenta la membrana celular gracias al exceso de cargas positivas, mediante enlaces electrostáticos.
Una condensación controlada del ADN permite la formación de partículas, con un diámetro de 50-150 nanómetros, que contienen una sola molécula de ADN, hecho que facilita notablemente la penetración en las células y posteriormente en el núcleo. Se produce la captura del 100% de los complejos estables de polinucleótidos por atracción de cargas y los lípidos se absorben a la membrana celular debido a propiedades de fusión, liberando el ácido nucleico directamente dentro del citoplasma. De esta manera se evita la degradación lisosomal. Este vector no plantea problemas en modelos in vitro, sin embargo, in vivo su eficacia se encuentra disminuida, llegando incluso en algunas ocasiones a una eficacia nula. Entre ellos destacan el DMRIE (dimiristiloxi-propil-3- dimetil-hidroxietilamonio/DOPE), o las combinaciones DMRIE/DOPE y DC-chol/DOPE. En cultivos de células eucariotas se utiliza con frecuencia la lipofectamina, un liposoma de formulación 3:1 (w/w) del lípido policatiónico 2,3-dioleiloxi-N-[2(sperminecarboxamido)etil]-N,N-dimetil-1-propanaminio trifluoroacetato (DOSPA) y el lípido neutro dioleoil fosfatidil etanolamina (DOPE) en agua.
La buena eficiencia en el reparto de ADN in vivo de liposomas policatiónicos aunque presentan una baja eficiencia de transfección, constituye una alternativa atractiva a los métodos de transferencia viral al no presentar limitaciones en el tamaño del ADN a transducir y tener una baja inmunogenicidad. Los liposomas suelen ser administrados por vía intravenosa, con la ayuda de catéteres, presentando muy buenos resultados en las células de pulmón e hígado, quizás debido a que los complejos transfectantes se unen a partículas de gran tamaño, lo que impide que puedan abandonar eficazmente el sistema vascular, siendo retenidas mecánicamente por filtros naturales, como los pulmones y el hígado.
Como último ejemplo de los vectores químicos, citaremos la transferencia de genes mediante receptores. La inserción de moléculas, que serán reconocidas por receptores presentes en el tipo celular elegido al vector del material génico, hace de esta técnica un método direccionable, al ser posible establecer una interacción vector/célula muy específica. La naturaleza de los ligandos es muy variada y comprende azúcares, péptidos y hormonas. Hoy día, se utilizan ligandos capaces de desestabilizar las membranas de los endosomas sólo a pH ácidos, con lo que se evita la degradación de los vectores por los complejos enzimáticos del lisosoma.
El primero de los vectores físicos que vamos a estudiar se conoce como disparo de partículas, biolística o bombardeo de microproyectiles. En él, el plásmido de ADN a transferir es situado sobre la superficie de pequeñas gotas de 1 a 3 micras de diámetro de oro o tungsteno que posteriormente son aceleradas, «disparadas» bien mediante una descarga eléctrica o por un pulso de gas, hacia la célula diana. La fuerza física del impacto supera la barrera de la membrana celular. Aún así, la capacidad de penetración es limitada y se utilizan con frecuencia en cultivos de líneas celulares, epidermis, músculo e hígado.
Los microproyectiles constituyen un método efectivo de transferir genes en modelos tanto in vitro como in vivo. Entre las ventajas que presenta este método, y que le confieren un potencial de aplicabilidad general, destacan su fácil manejo y que un único disparo puede producir integraciones múltiples. Sin embargo, presenta algunas desventajas, como que en la zona de descarga se produce muerte celular; además, dependiendo de la rigidez de los tejidos, la procedencia del ADN extraño y la capacidad de transcripción intrínseca aparecen grandes variaciones en la eficiencia de la expresión de los genes. Así, la expresión conseguida suele ser transitoria y con una frecuencia relativamente baja, cercana a 104, tan sólo se logra la integración efectiva en el genoma 10-8 de las células expuestas, lo que hace que se requieran grandes dosis para alcanzar el éxito. Este hecho limita la biobalística en la aplicación de la terapia génica. Sin embargo, ensayos con animales muestran que podría ser aplicado de forma directa como parte de protocolos de vacunación. Además, presenta una utilización potencial en la transformación de células vegetales, en la creación de plantas transgénicas tanto monocotiledóneas (maíz, arroz, trigo, avena y caña de azúcar) como en dicotiledóneas (soja, tabaco y algodón).
Cuando se lleva a cabo la inyección directa de la parte codificadora a un tejido se conoce como técnica «ADN desnudo»
Otro método físico es la microinyección, en el que el ADN es introducido por inyección directamente en el núcleo de las células gracias a la ayuda de un micromanipulador, evitando de este modo la degradación citoplasmática y lisosomal. Las células que sobreviven este daño y han insertado el material genético presentan una alta eficacia de su expresión. Esta técnica es muy laboriosa y necesita células aisladas para su realización. Se suele utilizar con frecuencia en estudios ex vivo, aunque también en la terapia génica germinal, un método in vivo donde se lleva a cabo la microinyección directa de «ADN desnudo» en los pronúcleos del óvulo recién fecundado o en el citoplasma. En vertebrados inferiores e invertebrados es la técnica de transferencia de genes más utilizada y en mamíferos ha resultado exitosa. Los embriones suelen tolerar la microinyección de genes para, posteriormente, ser cultivados in vitro hasta un estado de desarrollo más avanzado, blastocito, y ser transferidos en las hembras adoptivas. Aunque los primeros individuos transgénicos obtenidos mediante este método fueron ratones, se realiza con éxito en vacunos, ovejas, cabras, conejos y cerdos. La eficiencia inicial de integración génica obtenida fue tan sólo de un 2%, aunque hoy día se alcanzan niveles cercanos al 30% del total de embriones tratados.
Cuando se lleva a cabo la inyección directa de la parte codificadora a un tejido se conoce como técnica «ADN desnudo». En ella, el ADN es vehiculizado en una solución salina o sérica y normalmente administrado mediante inyección intramuscular. El mecanismo por el que entra en la célula diana permanece siendo un enigma. Esta técnica presenta un porcentaje bajo de transfección y no se logra la integración en el genoma. Se utiliza en la terapia génica in vivo, aunque los calores y persistencia de la expresión de genes son probablemente demasiado cortos (días). Entre sus ventajas destacan el ser un método directo, simple, económico y con una baja toxicidad. El «ADN desnudo» está siendo utilizado como procedimiento de vacunación, ya que aunque el valor de expresión de los genes es bajo, resulta suficiente para alcanzar una respuesta inmunológica.
Como último ejemplo de vector físico citaremos la electroporación. La aplicación de una corriente eléctrica a células es capaz de abrir poros en la membrana celular que permiten la entrada del gen en su interior. Entre sus ventajas se encuentran que las células pueden ser aisladas del organismo y sometidas a un control de calidad en el que se realiza una selección de las mejores células que son cultivadas en el laboratorio antes de ser implantadas en el paciente. Entre sus desventajas está el hecho de que muchas células mueren al no soportar el choque eléctrico, por lo que no es la forma más indicada en algunos tipos celulares, aunque sí en células con una alta tasa de proliferación.
Vectores virales
Hasta hace unos años, cuando pensábamos en los virus nos imaginábamos un agente infeccioso responsable de numerosas enfermedades o unas partículas extremadamente pequeñas que sólo pueden observarse gracias al microscopio electrónico y que, aunque presentan material genético propio, son incapaces de replicarse por sí mismos. Sin embargo, hoy día este concepto empieza a cambiar y los virus empiezan a ser considerados como herramientas de trabajo, vectores, que sirven para introducir material genético con fines terapéuticos en las células diana.
En la tabla 3 se resumen las ventajas y desventajas presentadas por los vectores virales utilizados en terapia génica entre los que destacaremos los retrovirus, adenovirus y el herpes simple.
Los virus no pueden ser utilizados directamente como se encuentran en la naturaleza, necesitan ser modificados para poder ser utilizados como vectores. Es necesario convertirlos en entes deficientes en replicación en el interior de la célula diana. Se trata, por tanto, de producir una anulación parcial del genoma viral. Frecuentemente se retiran regiones codificadoras de algunas proteínas estructurales como gag, pol y env en los vectores retrovirales, o de los elementos E1 en adenovirus, que son remplazadas por el gen o genes de interés. Estas partículas son incapaces de replicarse, pero mantienen la capacidad de infectar. Así, el vector viral sólo podrá multiplicarse o crecer en cultivos de líneas celulares modificadas genéticamente que sobreexpresan la parte genoma viral que ha sido delecionado; a estas células se las conoce como «células de empaquetamiento». La cantidad de ADN que puede ser insertado en un vector viral varía dependiendo del tipo. Con todo, los vectores virales presentan el inconveniente de que, junto a la información genética que pretendemos transducir, se encuentra el material genético propio del virus y que, en algunos casos, al igual que los adenovirus, pueden resultar inmunogenéticas.
Los vectores retrovirales fueron la estrategia pionera en la terapia genética, en las técnicas ex vivo
De forma muy breve revisaremos algunas de las características más interesantes de los vectores virales más utilizados. En la tabla 3 se muestra una relación de esas ventajas e inconvenientes.
Los vectores retrovirales fueron la estrategia pionera en la terapia genética, en las técnicas ex vivo. Sin embargo, los niveles de expresión en una variedad de tipos celulares eran considerablemente mayores en cultivo que después de ser trasplantados, presentando además una expresión transitoria en las células transducidas in vivo. Las formas deficientes en replicación de estos vectores se obtienen remplazando las regiones codificadoras para las proteínas estructurales gag, pol y env por el gen o genes de interés, lo que permite la incorporación de cADN de hasta 8 kb. El uso de vectores retrovirales presenta entre sus principales ventajas su eficaz transducción, su integración genómica y la expresión persistente. Cabe resaltar que estos vectores presentan como desventajas la derivación oncogénica, rara inserción y dependencia de la división celular.
Los vectores adenovirales son virus no envueltos de doble cadena de ADN. Son deficientes en replicación y requieren de un sistema de complementación que es la línea celular HEK293 (Human Embryonic Kidney 293) modificada para que produzca constitutivamente los elementos E1 virales, que son suprimidos en el vector adenoviral.
Entre las ventajas de este vector viral destacamos que pueden insertar hasta 20 kb de gen, además de transducir células con gran número de partículas virales y de infectar células tanto en reposo como en división. Sin embargo, presentan el inconveniente de expresar varias proteínas virales que resultan inmunogenéticas, lo que conduce a una separación más rápida del vector y las células transducidas. Además, la transducción repetida no es satisfactoria normalmente, a menos que la exposición inicial esté acompañada de una modulación inmunológica para suprimir la respuesta inicial a las proteínas de la cápsula adenoviral. Debido a la falta de integración del vector, la expresión de los niveles disminuye en el curso de pocas semanas hasta varios meses, haciendo necesaria la administración reiterada de vectores adenovirales en algún momento que puede resultar en respuestas inmunes e inactivación del vector.
Los vectores no virales resultan más económicos y más fáciles de producir que los virales
Hoy día, disponemos de virus asociados a los adenovirus que son capaces de integrar de forma específica en el cromosoma 19 humano. Sin embargo, éstos se han visto relegados a un plano más discreto cuando se observó que esta integración específica no ocurría con los vectores derivados de estos virus, el tamaño del gen a transducir es bastante limitado (menos de 4 kb), y sólo transducirían células en presencia de un adenovirus. Actualmente se están construyendo vectores VAA adenovirales híbridos, que presentan la habilidad de los vectores VAA de integrar con la ventaja de poder acomodar grandes fragmentos de ADN.
Como último ejemplo de vector viral estudiaremos aquellos que derivan del herpes virus, que resultan interesantes debido a su tropismo específico por el sistema nervioso central, el tamaño del gen que pueden vectorizar y su alto título. Sin embargo, es un sistema que apenas está desarrollado; los producidos hasta el momento sólo permiten expresión transitoria del gen de interés y su eficiencia de transducción es baja.
Conclusiones
El éxito de la terapia génica se fundamenta en los siguientes requisitos:
Una transferencia eficaz en las células diana.
La estabilidad de los genes introducidos, que deben integrarse, preferiblemente, en un lugar específico del genoma de la célula blanco.
La consecución de una expresión estable y apropiada de la información genética introducida.
A pesar de los avances obtenidos en el diseño de los diferentes tipos de vectores, hasta el momento ningún sistema vectorial cumple con todas las condiciones para convertirlo en ideal. Los vectores no virales resultan más económicos y más fáciles de producir que los virales; además, su falta de antigenicidad hace posible que puedan ser administrados repetidamente y con menores riesgos patológicos que los vectores virales. Con todo, los sistemas virales resultan más eficientes y presentan niveles de expresión más altos y duraderos en el tiempo. Los vectores retrovirales son los más utilizados, por lo que debido a su eficiencia y seguridad se han iniciado ya los primeros ensayos clínicos.
Bibliografía general
Blease M, Culver K, Anderson WF, et al. T lymphocyte-directed gene therapy for ADA-SCID. Initial trial results after 4 years. Science 1995;270:475-80.
Bordignon C, Notarangelo LD, Nobali N, et al. Gene therapy in peripheral blood lymphocytes and bone marrow for ADA Immunodeficient patients. Science 1995;270.
Feldman SH. Components of gene therapy experimentation that contribute to relative risk. Comp Med 2003;53(2):147-58.
Garry PN, Allan RS. Expression vectors and delivery systems. Current Opinion in Biotechnology 1998;447-50.
Grossman M, Raper S, Kozarsky K, et al. Successful ex vivo gene therapy directed to liver in a patient with familial hypercholesterolaemia. Nat Genet 1994;6:335-41.
Johnson-Saliba M, Jans DA. Gene therapy: optimising DNA delivery to the nucleus. Curr Drug Targets 2001;2(4):371-99.
Meyer F, Finer M. Gene therapy: progress and challenges. Cell Mol Biol (Noisy-le-grand) 2001;47(8):1277-94.
Rosenberg SA. TNF/TIL human gene therapy protocol. Hum Gene Ther 1990;1:443-62.
Strayer DS. Viral gene delivery. Expert Opin Investig Drugs 1999;8(12):2159-72.