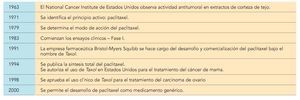
El paclitaxel es uno de los agentes antitumorales más prometedores desarrollados en las últimas décadas. Recientemente se cumplieron 30 años desde el descubrimiento del modo de acción de este fármaco, obtenido a partir de un extraco vegetal, y 15 desde la aprobación de su uso para el tratamiento del cáncer de mama. En este trabajo se recuerda el proceso que hizo posible que hoy dispongamos de esta valiosa opción terapéutica.
Imagen del tejo presente en los jardines del edificio histórico de la universitat de Barcelona.
El paclitaxel es un agente antitumoral que se emplea para el tratamiento de algunos tipos de cáncer debido a su capacidad de inhibir la multiplicación de las células tumorales. Identificado y extraído inicialmente a partir de la corteza del tejo (Taxus brevifolia), actualmente su uso está recomendado en el tratamiento del cáncer de mama (tabla 1) y en combinación con otros compuestos (cisplatino), constituye la quimioterapia de primera línea para el tratamiento del cáncer de ovario.
El descubrimiento del paclitaxel es un ejemplo muy ilustrativo de cómo los conocimientos adquiridos durante siglos en la medicina tradicional y en el estudio de los productos naturales pueden ser aplicados por la industria farmaceútica y la comunidad científica para el desarrollo de nuevos fármacos y constituye una muestra más de la importancia que puede llegar a tener en el futuro el preservar la biodiversidad de nuestro planeta.
IDENTIFICACIÓN
El paclitaxel se aisló como resultado de un programa público de identificación de nuevos compuestos antitumorales desarrollado en Estados Unidos a finales de la década de los 60 y principios de los 70 del siglo xx. En este programa se tomaron muestras de miles de plantas de diferentes partes del mundo y se seleccionaron en función de su actividad. Entre ellas se encontraban muestras de corteza del tejo del Pacífico (Taxus brevifolia) que crece en la costa occidental de los Estados Unidos y de Canadà. Dichas muestras presentaron una potente actividad citotóxica y antileucémica.
Al analizar el principio activo del extracto se identificó el paclitaxel. Visto con la prespectiva del tiempo, no es de extrañar que a partir del tejo se hayan obtenido moléculas interesantes desde el punto de vista farmacológico. Nadie podía entonces prever que se fuera a obtener precisamente el paclitaxel, pero cuando en los parrafos siguientes se describan las características y la historia del árbol europeo (Taxus baccata), el descubrimiento no parecerá tan sorprendente.
CARACTERÍSTICAS BOTÁNICAS DEL TEJO
El tejo es un árbol que puede alcanzar un gran tamaño, una altura de hasta 20 m y un tronco de hasta 1,5 m de diámetro (véase la imagen de apertura de este artículo). Además de por su tamaño, el tejo destaca por que es muy longevo: algunos ejemplares han superado los 1.500 años de vida y se consideran los árboles más antiguos de Europa. Las hojas del tejo son perennes, tienen entre 10 y 30 mm de longitud y están dispuestas en dos hileras opuestas, de color verde oscuro por la cara superior y amarillento por el envés. Su fruto es carnoso y de un color rojo vivo y brillante.
Otra particularidad interesante del tejo es que tanto las hojas, las ramas como la madera contienen alcaloides muy tóxicos, denominados en su conjunto taxinas, que actúan sobre el sistema nervioso central, paralizándolo. De hecho en el tejo todo es venenoso salvo la envoltura roja que rodea el fruto. La ingestión de tejo causa en un principio la aceleración del pulso cardiaco, y después éste se va volviendo más lento e irregular hasta que finalmente se produce la muerte por parálisis respiratoria.
APUNTES HISTÓRICOS
La toxicidad del tejo y su extraordinaria longevidad, que le hace parecer inmortal, ha hecho que, desde tiempo inmemorial, fuese considerado como un árbol sagrado. Así los pueblos celtas lo veneraban y sus sacerdotes, los druidas, lo usaban en sus rituales. Otros pueblos de la península ibérica como los antiguos cántabros y astures, así como algunos de los pobladores de la Galia, lo utilizaban como veneno cuando eran capturados por sus enemigos. Uno de los casos mejor documentados es el que describe Julio César en su tratado sobre la Guerra de las Galias (libro IV), en el cual narra como «Catocoluus, jefe de los eburones, se ha suicidado tomando extracto del tejo». Hoy sabemos que los eburones eran una tribu de descendencia germánica que habitó el norte de la Galia, entre el río Mosa y el Rin.
La llegada del cristianismo no cambió el aura mística asociada con el tejo. Los cristianos, al adaptar algunas de las tradiciones paganas, construyeron iglesias y cementerios junto a los tejos en lugares que ya habían sido sagrados para los celtas. El tejo se plantaba debido a su follaje perenne y su longevidad, como símbolo de la vida eterna. Durante siglos también fue costumbre plantarlo al construir grandes monumentos para que perdurara y fuera testigo de su historia.
La madera del tejo es de color rojizo y de una dureza extraordinaria, lo que la hace muy apta para ebanistería y talla. No obstante la escasez de piezas de suficiente grosor, debido al lento crecimiento del árbol, limita su uso para estos fines. Su dureza, unida a su resistencia al frotamiento, ha hecho que durante siglos la madera de tejo haya sido muy utilizada también para fabricar los ejes de los carros. Además, durante la Edad Media fue muy empleada para la elaboración de arcos y ballestas, por su resistencia y flexibilidad. Cuenta la leyenda que la ballesta de Guillermo Tell era de esta madera. Hubo un tiempo en que los bosques de tejos tenían una enorme importancia estratégica. Tener muchos tejos significaba que el suministro de armas en tiempos de guerra estaba garantizado.
EL PROCESO QUE HA PERMITIDO DISPONER DEL PACLITAXEL COMO AGENTE QUIMIOTERAPEÚTICO ES UN EJEMPLO MUY ILUSTRATIVO DE CÓMO LOS CONOCIMIENTOS ADQUIRIDOS DURANTE SIGLOS PUEDEN SER APLICADOS PARA EL DESARROLLO DE NUEVOS FÁRMACOS
La importancia de este árbol a lo largo de la Historia ha quedado reflejada también en la geografia. Sin ir más lejos, son numerosos los topónimos de pueblos españoles que derivan del tejo, como Teixeiro, Teixido o El Tejo. Estos pueblos le deben su nombre y son un reflejo de la importancia que tuvo éste árbol en épocas pasadas.
En cuanto a sus propiedades curativas, son conocidas desde hace milenios. El emperador romano Claudio publicó un edicto en el que señalaba al tejo como el mejor antídoto contra las picaduras de las serpientes. A lo largo de la historia se ha usado también como abortivo. No obstante, con el tiempo, la utilidad medicinal del tejo fue quedando en desuso hasta el descubrimiento del paclitaxel a principios de la década de los 70 del siglo pasado.
ESTRUCTURA DEL PACLITAXEL
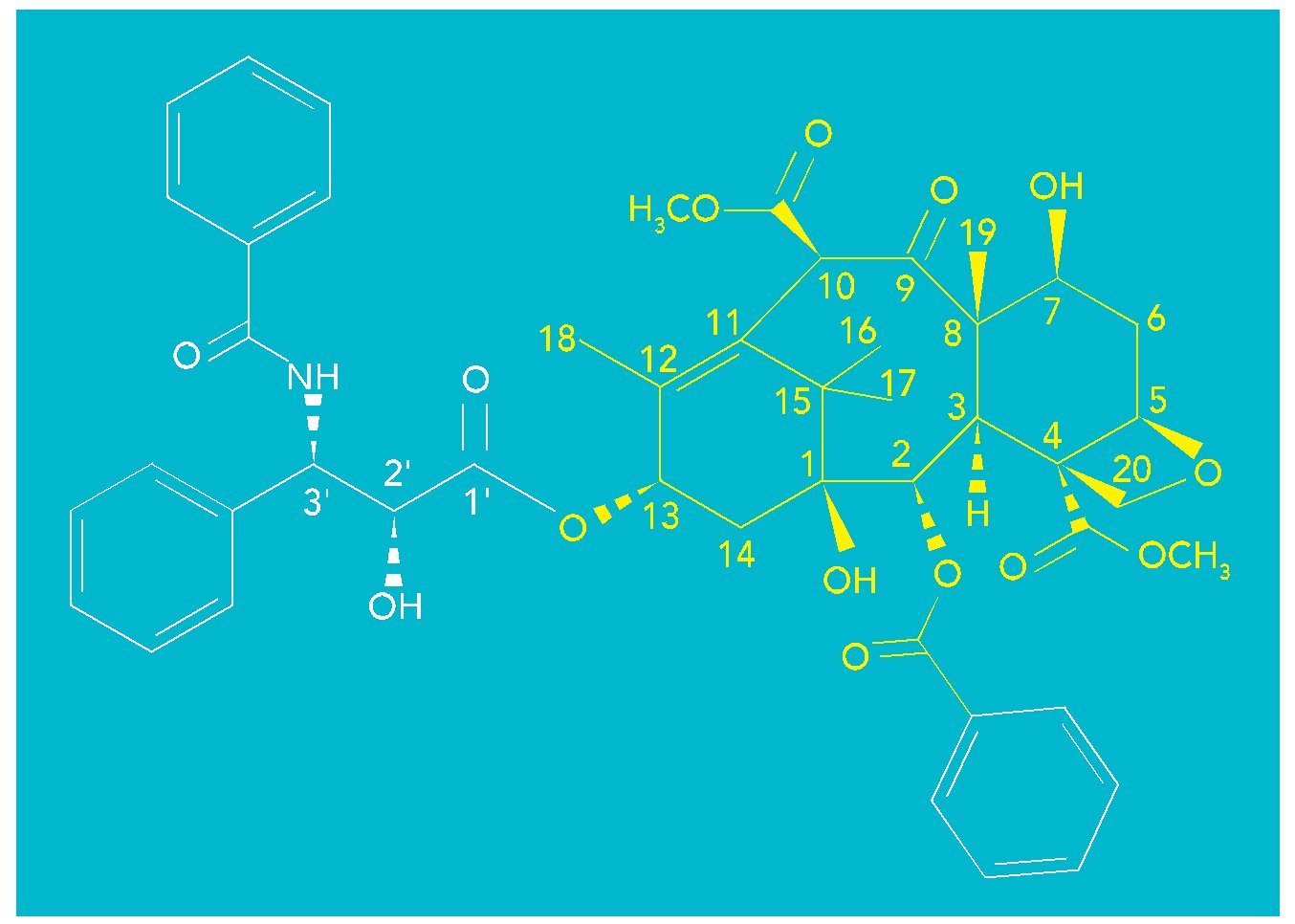
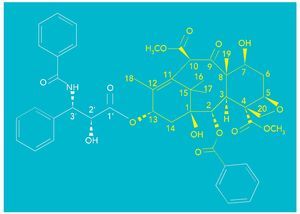
El paclitaxel tiene una estructura química muy compleja en la que destaca un esqueleto hidrocarbonado formado por tres ciclos de 6, 8 y 6 carbonos (fig. 1, en amarillo) polisustituido con cuatro metilos y ocho funciones oxigenadas (entre ellas, una de b-fenilisoserina que esterifica la posición C-13). La molécula posee un total de once estereocentros.
Fig. 1. Estructura del paclitaxel
La determinación de su estructura en 1971 a partir del análisis mediante difracción por rayos X fue todo un reto para los científicos de la época; así como lo fue también posteriormente su síntesis total publicada en 1994.
MECANISMO DE ACCIÓN
El paclitaxel, debido a su actividad biológica, se clasifica dentro del grupo de las denominados fármacos antimitóticos. Para entender mejor su modo de acción conviene recordar que, si no se duplican, las células se encuentran en estado de reposo, también llamado fase G0. Por el contrario las células que proliferan siguen un ciclo, denominado ciclo celular, que consta de dos etapas: la mitosis, también llamada fase M o de división, y la interfase, que incluye a su vez las fases G1, S y G2. En la interfase se produce el crecimiento celular con síntesis de proteínas y ácidos nucleicos necesario para que, durante la fase M, la célula se pueda dividir en dos células hijas.
La interfase consta de la fase G1 o fase de crecimiento (en la que se sintetiza RNA y proteínas), la fase S o fase de síntesis de DNA y la fase G2 o segunda fase de crecimiento (en la que se sintetiza más RNA y proteínas). En la fase M o mitosis se produce la división celular, y consta de cuatro etapas: profase, metafase, anafase y telofase.
Una parada o bloqueo del ciclo celular puede inhibir la proliferación celular y, por tanto, interrumpir el crecimiento de células no deseadas, por ejemplo las cancerosas. La parada del ciclo puede efectuarse en la interfase o en la mitosis, aunque la mayoría de los compuestos antitumorales, entre ellos el paclitaxel, actúan sobre la mitosis, es decir son compuestos antimitóticos.
Durante la profase desaparece la membrana nuclear y el nucleolo y se hacen patentes un cierto número de cromosomas constituidos por 2 cromátidas unidas por un estrangulamiento denominado centrómero. Cada cromátida es una larga cadena de ADN. Durante la metafase se hace visible el huso donde, a través del centrómero, se insertan los cromosomas que se desplazan hasta situarse en el ecuador del huso. Durante la anafase el centrómero se divide y cada cromosoma se separa en sus dos cromátidas. Los centrómeros avanzan a lo largo de las fibras del huso en direcciones opuestas, arrastrando cada uno una cromátida. Finalmente, durante la telofase las cromátidas se descondensan, se reconstituye la membrana nuclear alrededor de cada conjunto cromosómico y tiene lugar la división del citoplasma. Para entender el efecto del paclitaxel es importante conocer cómo se forma y se degrada el huso mitótico, puesto que esta estructura celular es de gran importancia durante la proliferación celular. Si no es posible formar el huso, las células no podrán duplicarse, evitandose así su proliferación.
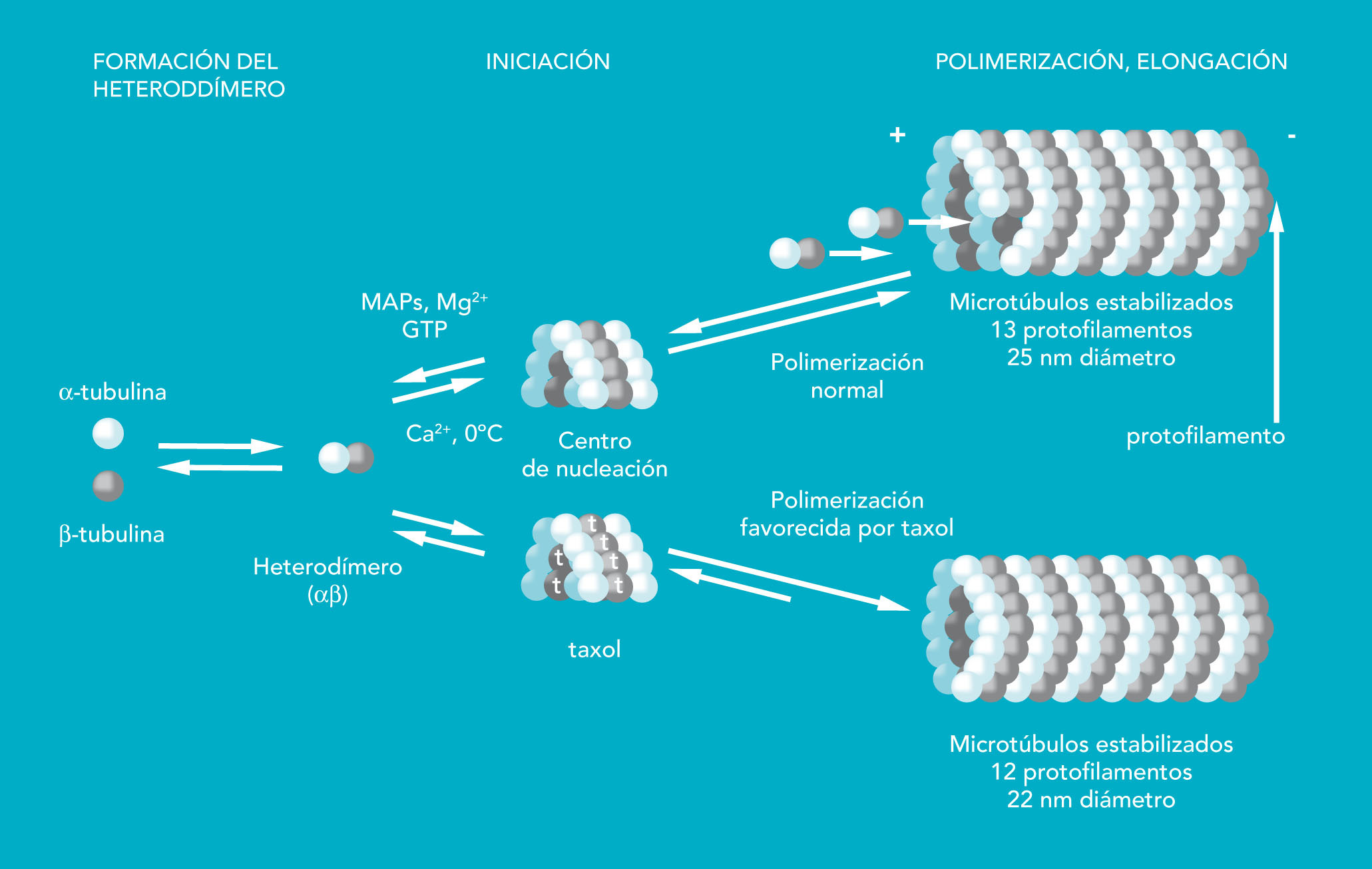
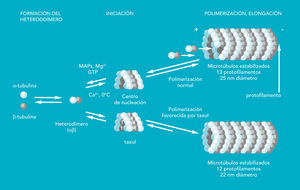
El huso mitótico está formado por microtúbulos, que son tubos formados por combinacion de 2 tipos de proteínas: a-tubulina y b-tubulina (fig. 2). Estas proteínas forman heterodímeros ab, capaces de agruparse en polimeros (microtúbulos) en presencia de otras proteínas denominadas MAPs (del inglés microtubul associated protein, proteínas asociadas a microtúbulos), de GTP y de Mg2+. Los microtúbulos poseen dos extremos. En uno de ellos, identificado con un signo matemático (-), es donde se inicia la nucleación y en el otro (+) el microtúbulo va creciendo. Una vez iniciado el crecimiento del microtúbulo, éste adopta un aspecto cilíndrico, de unos 25 nm de diámetro, con 13 protofilamentos que forman el círculo del microtúbulo.
Fig. 2. Mecanismo de polimerización de los microtúbulos. En la parte inferior del esquema se observa la modificación de los microtúbulos en presencia de paclitaxel
Los microtúbulos son estrucutras dinámicas, lo que significa que se pueden alargar añadiéndose más heterodímeros (tubulina-GTP) en el extremo (+); pero también pueden acortarse (si el GTP se hidroliza) y liberarse heterodímeros (tubulina-GDP) del extremo (-). Durante la interfase, los microtúbulos forman una red desde el centro por todo el citoplasma, pero al comenzar la mitosis, los microtúbulos se disgregan para poder formar el huso mitótico. En este momento, los microfilamentos se encuentran en un estado poco habitual de rápido ensamblaje y desensamblaje, lo cual explica la extrema sensibilidad del huso a distintos compuestos que se unen a la tubulina.
EL DESCUBRIMIENTO DEL PACLITAXEL CONSTITUYE UNA MUESTRA MÁS DE LA IMPORTANCIA DE PRESERVAR LA BIODIVERSIDAD DE NUESTRO PLANETA, YA QUE EN LAS ESPECIES EN PELIGRO DE EXTINCIÓN SE PUEDE ENCONTRAR LA CLAVE PARA EL DESARROLLO DE LOS FÁRMACOS QUE NECESITE LA HUMANIDAD EN EL FUTURO
ANTIMITÓTICOS
Los fármacos anticancerígenos responsables de afectar la dinámica de los microtúbulos o de unirse a tubulina son los denominados fármacos antimitóticos, pues alteran el buen funcionamiento del huso mitótico. Entre estos antimitóticos destacan los fármacos responsables de inhibir el ensamblaje del microtúbulo (familias de la colchicina y la vinblastina) y los responsables de promover la unión y estabilizar el microtúbulo (familia del paclitaxel).
La colchicina, un alcaloide que se extrae del azafrán silvestre, se une al heterodímero y evita su polimerización, con lo que no es posible formar el huso mitótico. El modo de acción del paclitaxel también evita la formación del huso mitótico, pero en este caso provocando la formación de un polímero demasiado largo. El paclitaxel se une a la b-tubulina, y con ello favorece la formación de largos polímeros, incluso en presencia de GDP, que no podrán acortarse. El microtúbulo estabilizado con paclitaxel posee 12 protofilamentos (en lugar de los 13 protofilamentos normales) y un diámetro inferior al normal (de 22 nm). La estabilización de los microtúbulos provoca la pérdida de función del huso, la consiguiente parada del ciclo celular en la transición metafase/anafase y, finalmente, la muerte celular.
BIOSÍNTESIS
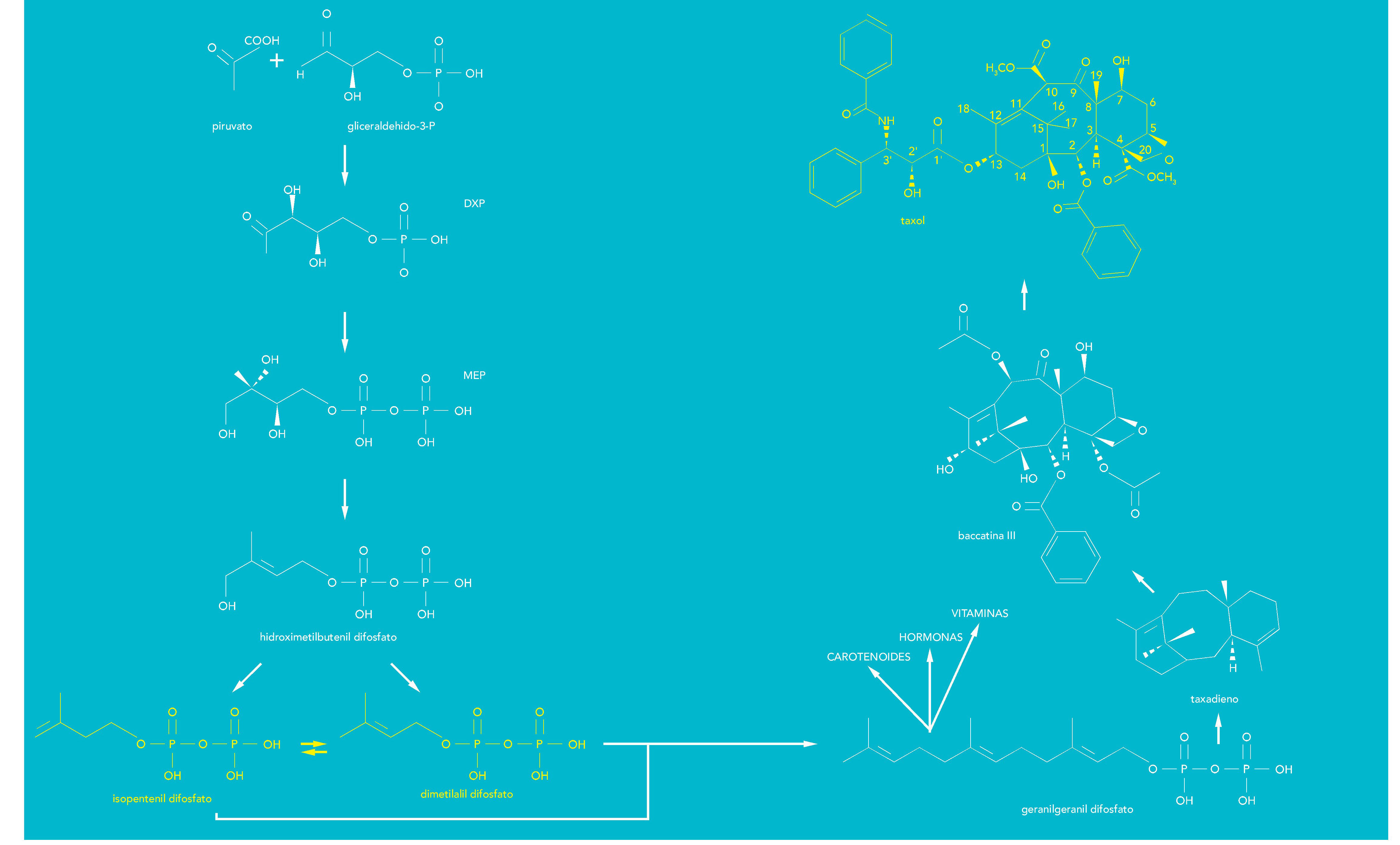
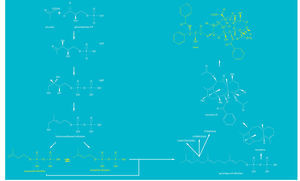
El paclitaxel es un compuesto de naturaleza isoprenoide. Los isoprenoides constituyen una familia compleja de compuestos (más de 35.000 identificados hasta el momento) que presentan una gran variedad de estructuras y funciones. No obstante, a pesar de su gran diversidad, todos los isoprenoides derivan de dos precursores estructurales comunes de cinco átomos de carbono, el isopentenil difosfato y su isómero, el dimetilalildifosfato (fig. 3).
Fig. 3. Esquema simplificado de la biosíntesis del paclitaxel a partir de isopentenil difosfato y dimetilaldifosfato. El paclitaxel se sintetiza a partir de GGPP, formado en los cloroplastos a través de la via metabólica del metileritritol fosfato (MEP).
El esqueleto central de la molécula de paclitaxel es un anillo de taxano de naturaleza isoprenoide y deriva del geranilgeranil difosfato (GGPP), el precursor común de los isoprenoides de 20 átomos de carbono (diterpenos), entre los que se encuentran compuestos tales como los carotenoides, la cadena de fitol de las clorofilas o las giberelinas, que participan en el crecimiento y desarrollo de las plantas.
La primera etapa específica de la biosíntesis de paclitaxel es la ciclación del GGPP en taxa-4(5),11(12)-dieno, reacción catalizada por la enzima taxadieno sintasa. Posteriormente el esqueleto de taxano es modificado oxidativamente en un proceso que transcurre en unas diez etapas para dar lugar a la baccatina III. En las últimas etapas de la ruta de síntesis de paclitaxel tiene lugar la unión de la cadena lateral de N-benzoil-3-fenilisoserina.
OBTENCIÓN
A pesar de su interés como agente quimioterapeútico, el uso del paclitaxel se ha visto restringido como consecuencia de las limitaciones de disponibilidad derivadas de las dificultades para su obtención. Entre ellas cabe destacar su baja concentración en la corteza del tejo (0,007% del peso seco) y el elevado coste del proceso de extracción. Así, se requiere procesar unos 750 árboles para obtener 1 kg de paclitaxel. Además, como ya se ha indicado, el tejo es un árbol de crecimiento muy lento que necesita unos 70 años para alcanzar los 7-9 m de altura y los 25 cm de diámetro necesarios para la correcta explotación de la corteza. A ello hay que añadir que la tala indiscriminada del tejo podría causar la rápida extinción de la especie, a la vez que comprometería la propia fuente natural del paclitaxel. La escasez y las dificultades de extracción del paclitaxel a partir de su fuente natural trae como consecuencia que dicho compuesto tenga un precio muy elevado y ha conducido a la búsqueda de fuentes alternativas para su obtención.
Una de ellas es la síntesis química, aunque resulta compleja, laboriosa y no es comercialmente rentable debido a los altos costes del proceso. Actualmente una alternativa para la obtención de paclitaxel y de compuestos análogos es la semisíntesis a partir de intermediarios de la vía de biosíntesis como la baccatina III y la 10-desacetil-baccatina III, mucho más asequibles al estar presente en las distintas especies de Taxus o en tejidos renovables como las hojas o los frutos y cuya recolección no requiere años de cultivo ni compromete su viabilidad. En este tipo de síntesis enantioselectiva se han conseguido rendimientos de hasta el 75%.
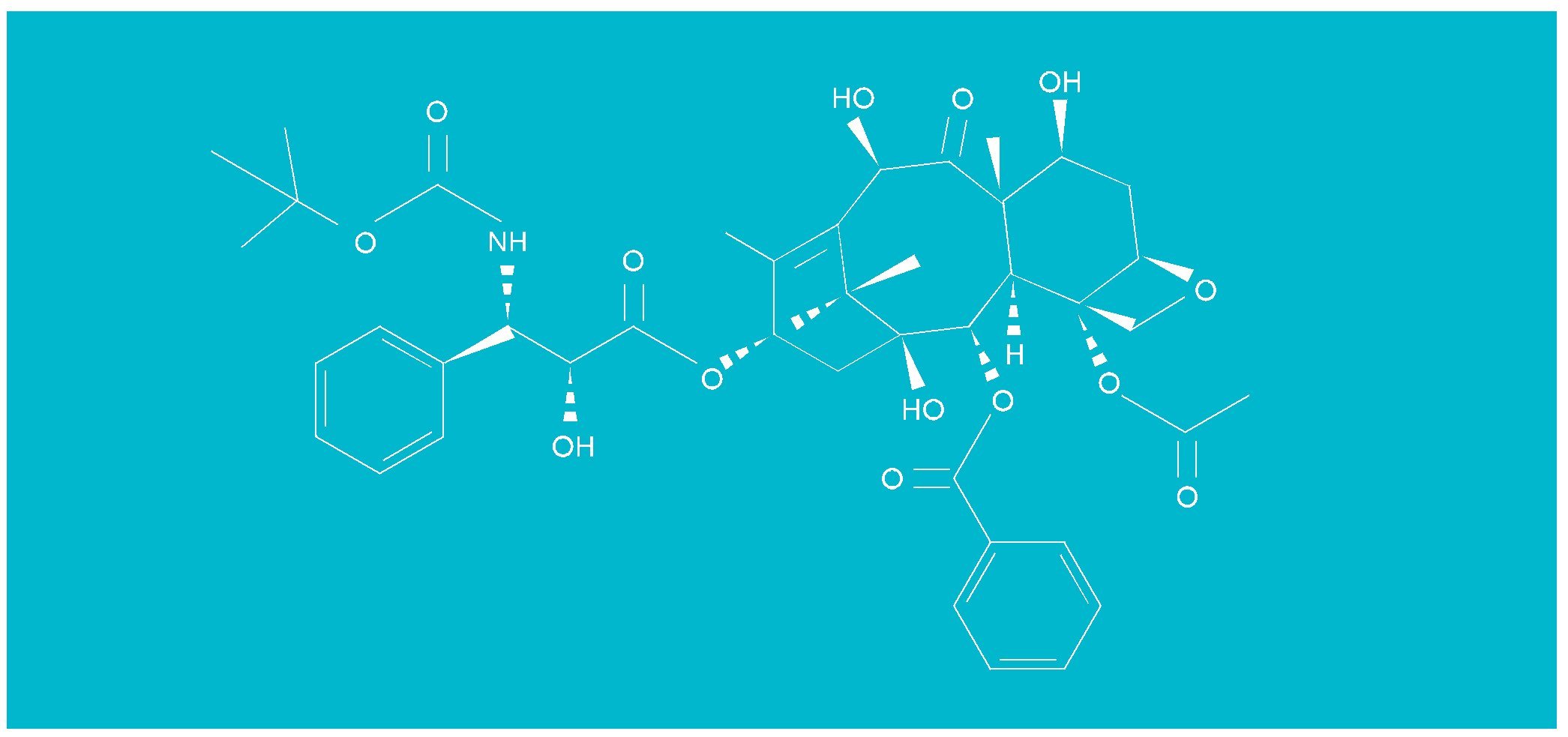
También se están buscando análogos estructurales del paclitaxel que podrían tener efectos parecidos sobre los microtúbulos y que pudieran permititr mejorar las propiedades farmacológicas del paclitaxel. Entre ellos destaca el docetaxel (fig. 4).
Fig. 4. Estructura del docetaxel.