Después de abordar en la primera parte del trabajo los antecedentes legislativos españoles en el campo de la dispensación y los cambios que se han producido con la entrada en vigor de los precios de referencia, el autor analiza el concepto de bioequivalencia, los conjuntos homogéneos y la posibilidad de sustitución del medicamento prescrito.
Para completar el análisis que iniciamos en la primera parte de este trabajo, analizaremos el concepto de bioequivalencia, conjunto homogéneo y sustitución a la luz de la normativa sobre precios de referencia que entró en vigor en España el 1 de diciembre de 2000.
Bioequivalencia
El concepto de bioequivalencia es una característica propia de la EFG y de la EQ, por lo que vamos a dedicar algo de atención a este concepto técnico-sanitario, ya que en él se basa el fundamento científico de la sustitución de medicamentos.
El concepto de bioequivalencia entre medicamentos se refiere al similar resultado terapéutico que presentan dos medicamentos cuando se administran a un paciente. Dos medicamentos con el mismo principio activo son bioequivalentes cuando presentan la misma biodisponibilidad en biofase (lugar de acción). Las biodisponibilidades se miden fundamentalmente hallando los parámetros cuantía de la absorción y velocidad de absorción. Cuando dos medicamentos presentan la misma magnitud o extensión de absorción, y la velocidad con que se ha alcanzado ésta es igual en ambos, se dice que tienen la misma disponibilidad y, consecuentemente, son bioequivalentes, es decir, que tienen el mismo efecto terapéutico. Pero no siempre ocurre así, sino que en la realidad, a veces, se presenta el problema que resumimos en la pregunta: «¿Por qué dos medicamentos con la misma dosis de un principio activo puede presentar diferentes respuestas terapéuticas?»
Antes de abordar la respuesta a esta pregunta debemos hablar brevemente del lugar de acción del medicamento: la biofase. El concepto de biofase es habitualmente utilizado en el argot farmacológico para designar el lugar donde el fármaco desarrolla su acción terapéutica y las concentraciones de principio activo alcanzadas en biofase son las que van a determinar la respuesta terapéutica esperada.
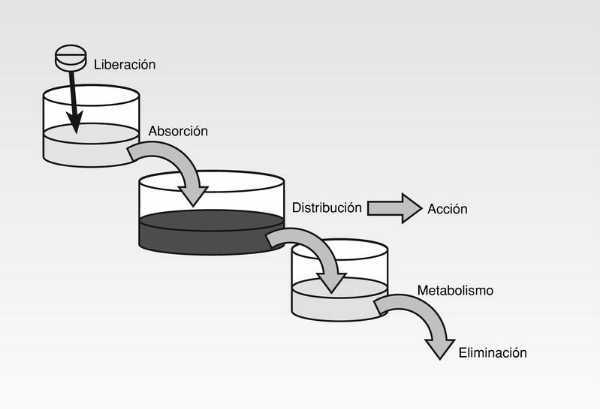
Desde que se administra el medicamento hasta que el principio activo llega a biofase el fármaco se ve implicado en una serie de procesos fisiológicos y bioquímicos que pueden verse afectados por diferentes factores claramente expuestos en la serie de LADME (fig. 1):
Liberación del principio activo desde la forma farmacéutica empleada hasta el lugar de absorción.
Absorción a través de la pared intestinal si se ha utilizado la vía oral.
Incorporación a la circulación sanguínea con capacidad de acceso a cualquier tejido del organismo.
Distribución y llegada a biofase, estableciéndose un equilibrio de concentraciones entre circulación sistémica y biofase; o, si se prefiere, entre diferentes tejidos u órganos y circulación sanguínea.
Metabolismo y eliminación de metabolitos por orina o heces.
Las características fisicoquímicas del principio activo y las peculiaridades de la formulación utilizada puede influir directamente en el proceso de liberación del fármaco y condicionar de alguna manera los procesos antes indicados que se desarrollan de forma continua y consecutiva en el organismo. Esto explica por qué pueden producirse fallos terapéuticos durante el tratamiento con un determinado medicamento si se intercambian fármacos que no han demostrado su bioequivalencia.
De la misma manera, parece razonable considerar que si dos especialidades farmacéuticas presentan una incorporación similar de principio activo a la circulación sanguínea, también van a alcanzar análogas concentraciones en biofase, registrándose la misma respuesta terapéutica; es decir, a una determinada concentración en sangre corresponde igual concentración en biofase, y a igualdad de concentraciones corresponde la misma respuesta terapéutica.
El parámetro biofarmacéutico que cuantifica la llegada de principio activo a biofase es la biodisponibilidad. Este concepto abarca la cantidad de fármaco que se incorpora a la circulación sistémica, así como la velocidad con la que se realiza esta incorporación: dos medicamentos que presentan la misma biodisponibilidad son bioequivalentes, porque sus parámetros farmacocinéticos (absorción y velocidad de absorción) son iguales.
Definición de la bioequivalencia
Los estudios de bioequivalencia están orientados a comparar las biodisponibilidades de dos medicamentos. Uno de los fármacos se utiliza como referencia en el ensayo y el otro se considera como producto problema. Se puede decir que un estudio de bioequivalencia lo que hace es determinar la biodisponibilidad relativa del medicamento problema con respecto a la del medicamento tomado como referencia cuya eficacia terapéutica está contrastada por el uso clínico del mismo, comprobándose hasta qué punto las biodisponibilidades son similares.
La biodisponibilidad se define como la extensión y la velocidad con que un principio activo es absorbido a partir de la forma farmacéutica utilizada y llega disponible a la biofase.
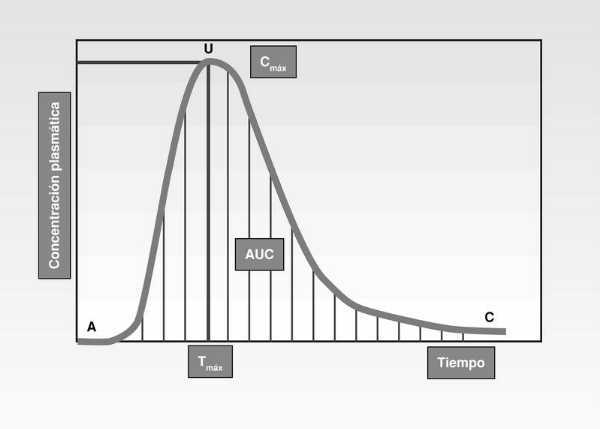
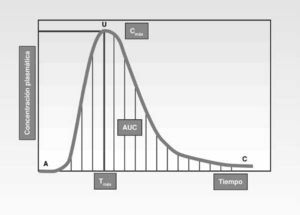
El ensayo se hace con dos lotes humanos a los que se administra, a uno de ellos, la sustancia problema y luego la de referencia, y a otro lote la de referencia y posteriormente la problema. Se hacen extracciones de sangre cada equis tiempo y se determinan las concentraciones plasmáticas del principio activo. Estos valores se llevan a un sistema de ejes cartesianos y se obtiene la curva de concentración plasmática-tiempo (fig. 2).
El estudio de la curva de concentración plasmática-tiempo nos proporciona los parámetros farmacocinéticos precisos y suficientes para determinar la bioequivalencia entre dos formulaciones medicamentosas. La curva ABC (en inglés, AUC) de concentraciones plasmáticas y el eje de abscisas delimitan un área cuya superficie calculada por el método trapezoidal lineal nos mide la magnitud de la absorción, que es además directamente proporcional a la fracción de dosis que ha alcanzado la circulación sanguínea.
El cociente obtenido al dividir el área correspondiente a la formulación problema por el área de la formulación de referencia nos da la biodisponibilidad relativa de aquélla, cuyo valor será aproximadamente la unidad para aquellas formulaciones con comportamientos biofarmacéuticos muy semejantes.
La concentración máxima que alcanza el fármaco en plasma (Cmáx) y el tiempo en que tarda en conseguirse esta situación (Tmáx) son dos datos farmacocinéticos que se consideran de elección para calcular la velocidad de absorción. El tiempo máximo es inversamente proporcional a la velocidad de absorción: a más tiempo máximo menor velocidad de absorción.
Con los parámetros farmacocinéticos obtenidos (área bajo la curva igual a extensión de la absorción y velocidad de absorción, calculada con los datos Cmáx y Tmáx), tenemos los elementos necesarios para saber la biodisponibilidad del medicamento problema y establecer su bioequivalencia, afirmando o no su igualdad terapéutica con el medicamento de referencia. Ya lo hemos dicho anteriormente: a igualdad de biodisponibilidades en los dos medicamentos, tenemos la misma bioequivalencia y, consecuentemente, el mismo efecto terapéutico (tabla 1).
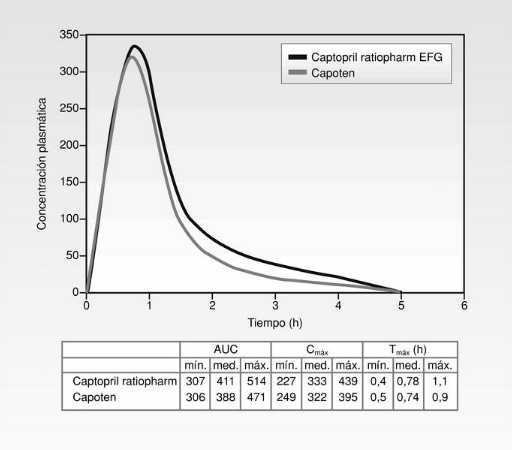
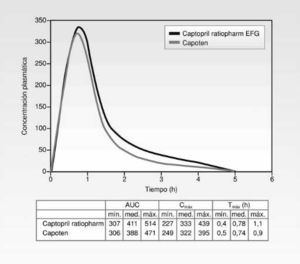
La figura 3 muestra las curvas de dos medicamentos bioequivalentes.
Puede haber un doble camino para el farmacéutico: atenerse a la legislación sobre EFG y precios de referencia o seguir lo dispuesto en el artículo 89 de la Ley del Medicamento cuando el médico prescribe una DOE
Conjuntos homogéneos
El RD 1.035/1999, de 18 de junio, que regula el sistema de precios de referencia en la financiación de medicamentos, es desarrollado por la Orden Ministerial de 13 de julio de 2000, que establece los conjuntos homogéneos de presentaciones de especialidades farmacéuticas y aprueba los precios de referencia.
Para definir un conjunto homogéneo ha de tenerse en cuenta que los medicamentos reúnan las siguientes características:
Misma presentación.
Misma composición cualitativa y cuantitativa.
Misma forma farmacéutica.
Misma dosis y vía de administración.
Calificación oficial de equivalencia terapéutica.
En el conjunto homogéneo debe existir al menos una EFG.
Esto explica por qué la amoxicilina 500 mg 12 cápsulas pertenece a un conjunto homogéneo distinto de la amoxicilina 500 mg 24 cápsulas, pues la presentación de ambos medicamentos es distinta. Otros ejemplos de conjuntos homogéneos podemos encontrarlos en la tabla 2.
Así, se han aprobado 114 conjuntos homogéneos con 42 moléculas distintas.
Las presentaciones de las especialidades farmacéuticas que tengan la calificación de bioequivalentes y que estén incluidas en un conjunto homogéneo, llevarán incorporadas las siglas EQ en el cupón-precinto. Lo anterior será, asimismo, de aplicación a las presentaciones de las EFG.
Las siglas EQ deberán aparecer en el cupón-precinto situadas inmediatamente a continuación del nombre, forma farmacéutica, presentación y siglas EFG. Dichas siglas irán separadas por un guión y tanto el guión como las siglas EQ irán resaltadas en negrita.
Sustituciones
Antes de nada, debemos decir que toda la legislación publicada para regular las EFG y los precios de referencia no afecta a la dispensación de especialidades farmacéuticas no comprendidas en los conjuntos homogéneos; es decir, los criterios de dispensación para estos medicamentos son los mismos que venían rigiendo anteriormente. Hay que manifestar también que la aportación del asegurado en la adquisición de medicamentos sigue siendo la misma que venía rigiendo con anterioridad.
Dicho esto, debemos manifestar que el precio de referencia marca una frontera en la actuación del farmacéutico al dispensar un fármaco: por encima del precio de referencia, según el artículo quinto del RD 1.035/1999, el farmacéutico deberá sustituir la especialidad prescrita por una especialidad farmacéutica genérica del mismo conjunto homogéneo que no supere el precio de referencia. Con dos excepciones: cuando el asegurado, debidamente informado, opte por pagar la diferencia entre el precio de referencia y la especialidad dispensada, además de efectuar, en su caso, el pago de la aportación correspondiente calculada sobre el importe del precio de referencia del medicamento dispensado; y cuando el médico acompañe a la prescripción un informe pormenorizado en el que justifique fehacientemente la improcedencia de la sustitución por razones de alergia, intolerancia u otra incompatibilidad al cambio de excipiente.
Si el medicamento prescrito tiene un precio igual o por debajo del de referencia, el farmacéutico puede sustituir, por causa legítima, por otra EFG de igual o inferior precio al de referencia y del mismo conjunto homogéneo, diligenciado en la receta la causa de la sustitución.
Siempre que se sustituya un medicamento por otro debe ser con conocimiento del asegurado.
La sustitución por causa legítima es la que más dudas presenta. Por eso vamos a dedicarle un estudio pormenorizado. La Ley 13/1996 modifica, como ya hemos dicho, el apartado 1 del artículo 90 de la Ley del Medicamento, pero esta modificación, considerada aisladamente y 6 años después de publicada la Ley del Medicamento, puede inducir a errores interpretativos: «Cuando el médico prescriptor identifica en la receta una EFG, sólo podrá sustituirse por otra EFG.» Entiendo que para que no haya posibilidad de error este texto debe leerse e interpretarse en el contexto integro del modificado artículo 90 de la Ley del Medicamento, que literalmente dice:
«Sustitución por el farmacéutico.
1. Cuando por causa legítima en la oficina de farmacia no se disponga de la especialidad farmacéutica de marca o denominación convencional prescrita, el farmacéutico podrá con conocimiento y conformidad del interesado, sustituirla por otra con denominación genérica u otra especialidad farmacéutica de marca que tenga igual composición, forma farmacéutica, vía de administración y dosificación.
Cuando el médico prescriptor identifica en la receta una EFG, sólo podrá sustituirse por otra EFG.
2. En estos casos, el farmacéutico anotará al dorso de la receta la especialidad que dispense, la fecha, su firma y su rúbrica.
3. Quedarán exceptuadas de esta posibilidad de sustitución aquellas especialidades que, por razón de sus características de biodisponibilidad, y estrecho rango terapéutico, determine el Ministerio de Sanidad y Consumo.»
Es decir, a igualdad de precio con el de referencia, o por debajo de éste, se puede sustituir una EFG por otra del mismo conjunto homogéneo (por ejemplo, por desabastecimiento) y debe diligenciarse la receta como dispone el artículo anteriormente transcrito.
Otro caso que puede ocurrir es que el médico prescriba sólo el nombre del principio activo, sin poner «apellidos» al medicamento genérico. En este caso, entiendo que puede haber un doble camino para el farmacéutico: atenerse a la legislación sobre EFG y precios de referencia o seguir lo dispuesto en el artículo 89 de la Ley del Medicamento cuando el médico prescribe una DOE (como es el caso que nos ocupa, pues se ha prescrito omeprazol 20 mg 14 cápsulas). Si el farmacéutico se ajusta en la dispensación a la legislación sobre EFG y precios de referencia (RD 1.035/1999 y Orden de 13 de julio de 2000), debe dispensar una EFG de estas características contenida en los conjuntos homogéneos publicados, pero si se atiene al artículo 89 de la Ley del Medicamento, que es más permisivo, el farmacéutico puede dispensar más libremente. El artículo 89 dice textualmente:
«Precripción DOE. En los casos en que el prescriptor indique en la receta simplemente una denominación oficial española, el farmacéutico dispensará, si la hubiera, una especialidad farmacéutica de las autorizadas bajo tal denominación. Y si no la hubiere, una bajo denominación convencional a su criterio profesional.»
Anexo III de la Orden de 13 de julio de 2000
Las especialidades farmacéuticas relacionadas en este anexo no son conjunto homogéneo, por lo que se siguen dispensando bajo los mismos criterios con que se venía actuando antes de publicarse la referida orden ministerial.
Estas especialidades figuran en esta orden en su anexo III porque se han tenido en cuenta para calcular los precios de referencia y porque han bajado su precio al de referencia en aplicación del artículo 2 del Real Decreto-Ley 12/1999, de 31 de julio, de medidas urgentes para la contención del gasto farmacéutico en el SNS, que establece que cuando el precio de las presentaciones de especialidades farmacéuticas no bioequivalentes utilizadas para el cálculo de precios de referencia supere éste, se reducirá aquél hasta la cuantía fijada para el de referencia.
Esta modificación obligatoria de precios para las especialidades del anexo III, así como la modificación voluntaria de precios de especialidades para adecuarlo al nivel que se corresponde con el de referencia, tuvieron un plazo de 3 meses para hacerlo a contar desde la fecha de entrada en vigor (14 de julio de 2000) de la Orden de 13 de julio de 2000.
Concierto entre los colegios farmacéuticos y el SNS
El legislador, a la hora de redactar una norma, no puede precisar los múltiples detalles que tiene la prestación farmacéutica y siempre quedan flecos por concretar, ya que hay que regular a otro nivel (nos referimos al concierto). Esto es lo que ha ocurrido con las escasas recetas con precio superior al de referencia que lleven informe del médico desaconsejando la sustitución por intolerancia al excipiente. La manera de facturación de estas recetas debe tratarse en la Comisión Mixta Provincial de Farmacia. Lo mismo sucede en algún caso muy raro que puede darse de prescripción de una EFG por debajo del precio de referencia, pero que por motivos muy concretos no se dispone de la especialidad y la sustitución hay que hacerla por una EFG por encima del precio de referencia. En estos supuestos conviene hacer la facturación de estas recetas separadas de los bloques generales, porque si no se hace así la Seguridad Social siempre abonará el precio de referencia.