Legislación farmacéutica en 2003 (I).
M. PILAR MARTÍN BAREA
M. Pilar Martín Barea
Doctora en Farmacia y licenciada en Derecho. Profesora titular de LegislaciÓn y DeontologÍa Farmacéutica. Facultad de Farmacia. Universidad de Barcelona.
Aproximación a la normativa farmacéutica española generada durante el año pasado
El año 2003 ha sido uno de los más prolijos en materia de legislación farmacéutica, tanto en lo que se refiere a novedades como en la modificación de normas anteriores. En esta primera parte, la autora revisa y comenta la Ley de Cohesión y Calidad del SNS, los establecimientos sanitarios, la ejecución de la legislación del Estado sobre productos farmacéuticos, el Formulario Nacional y la Real Farmacopea Española, la clasificación anatómica de medicamentos y las autorizaciones de comercialización.
Desde el punto de vista de la legislación sanitaria, 2003 ha sido un año importante y, más concretamente, en materia de legislación farmacéutica. Se ha aprobado la Ley de Cohesión y Calidad del Sistema Nacional de Salud (SNS), necesaria para complementar el modelo sanitario establecido en la Ley General de Sanidad. A su vez, se han introducido cambios notables en la Dirección General de Farmacia y Productos Sanitarios y en la Agencia Española de Medicamentos y Productos Sanitarios. Se ha aprobado la primera edición del Formulario Nacional y se ha modificado sustancialmente el sistema de precios de referencia. Es momento de recordarlos de forma resumida, resaltando sus aspectos más significativos.
Ley de Cohesión y Calidad del SNS
La Ley 16/2003, de 28 de mayo de Cohesión y Calidad del SNS1 tiene por objeto establecer el marco legal para las acciones de coordinación y cooperación de las administraciones públicas sanitarias, como medio para asegurar a los ciudadanos el derecho a la protección de la salud en el ejercicio de sus respectivas competencias, de modo que se garantice la equidad, la calidad y la participación social en el SNS:
* Equidad, entendida como desarrollo del principio constitucional de igualdad.
* Calidad, en el sentido de conjugar la incorporación de sistemas innovadores con su seguridad y efectividad.
* Participación ciudadana desde una doble vertiente, como responsable de sus decisiones individuales en el ejercicio del principio de autonomía y como parte integrante del colectivo de usuarios del sistema sanitario.
Para desarrollar estos objetivos hay que establecer un nuevo modelo. En este sentido, la Ley define los ámbitos de colaboración entre las administraciones públicas sanitarias, como son prestaciones del SNS, farmacia, profesionales sanitarios, investigación, sistema de información sanitaria y calidad del sistema sanitario.
A su vez, la Ley ofrece mecanismos de cooperación y coordinación, tanto en la organización de la asistencia sanitaria como en salud pública, y se dota de una serie de órganos especializados como son las agencias de evaluación de tecnologías, la Agencia Española de Medicamentos y Productos Sanitarios, la Comisión de Recursos Humanos, la Comisión Asesora de Investigación en Salud, el Instituto de Salud Carlos III, el Instituto de Información Sanitaria, la Agencia de Calidad del SNS y el Observatorio del SNS.
La Ley de Cohesión y Calidad del SNS dedica el capítulo II a la farmacia, en el que incluye aspectos relativos a la organización y ejercicio de las competencias del Estado en materia de farmacia (artículo 30 a 32) y a la colaboración de las oficinas de farmacia (artículo 33).
Respecto a las oficinas de farmacia, establece su colaboración con el SNS en el desempeño de la prestación farmacéutica, a fin de garantizar el uso racional del medicamento. Para ello, los farmacéuticos actuarán coordinadamente con los médicos y otros profesionales sanitarios. Se tenderá a la dispensación individualizada de medicamentos y a la implantación de la receta electrónica, en cuyo desarrollo participarán las organizaciones colegiales médica y farmacéutica. En este sentido, se definirán los datos básicos de farmacia relativos a la gestión, por medios informáticos, de la información necesaria para el desempeño de las actividades anteriormente mencionadas, y para la colaboración con las estructuras asistenciales del SNS. Estos aspectos se han incorporado en la Ley del Medicamento mediante su modificación (tabla 1) a través de la Ley de medidas fiscales, administrativas y del orden social2.
Cabe reseñar que, en materia de dispensación de antibióticos en dosis unitarias por las oficinas de farmacia, se han firmado convenios de colaboración entre el Ministerio de Sanidad y Consumo y los departamentos de sanidad de diversas comunidades autónomas (Extremadura, Galicia, País Vasco, Madrid, Comunidad Valenciana) para la puesta en marcha de un estudio piloto.
Corresponde al Ministerio de Sanidad y Consumo, previo acuerdo del Consejo Interterritorial del SNS, establecer los criterios generales y comunes para el desarrollo de la colaboración de las oficinas de farmacia, por medio de conciertos que garanticen a los ciudadanos la dispensación en condiciones de igualdad efectiva en todo el territorio nacional, independientemente de su comunidad autónoma de residencia.
En relación con las Competencias de la Administración General del Estado en materia de farmacia corresponde al Ministerio de Sanidad y Consumo las relativas a la evaluación, registro, autorización, vigilancia y control de los medicamentos de uso humano y veterinario y de los productos sanitarios, así como la decisión sobre su financiación pública y la fijación del precio correspondiente, sin perjuicio de las competencias ejecutivas de las comunidades autónomas. El ejercicio de las competencias del Estado en materia de farmacia corresponde al Ministerio de Sanidad y Consumo, a través de la Dirección General de Farmacia y Productos Sanitarios y del organismo autónomo Agencia Española de Medicamentos y Productos Sanitarios.
En el marco de la Ley de Cohesión y Calidad del SNS, la DGF establecerá los criterios generales y comunes para el desarrollo de la colaboración de las oficinas de farmacia por medio de conciertos
Dirección General de Farmacia
La Dirección General de Farmacia y Productos Sanitarios (DGF) es el órgano al que corresponde la dirección, desarrollo y ejecución de la política farmacéutica del Ministerio de Sanidad y Consumo, el ejercicio de las funciones que competen al Estado en materia de financiación pública y fijación del precio de los medicamentos y productos sanitarios, y las condiciones especiales de prescripción y dispensación de medicamentos en el SNS, en particular, el establecimiento de visados previos a la dispensación. Le corresponde, asimismo, ejercer la potestad sancionadora cuando realice funciones inspectoras3.
En el marco de la Ley de Cohesión y Calidad del SNS, la DGF establecerá los criterios generales y comunes para el desarrollo de la colaboración de las oficinas de farmacia por medio de conciertos.
Para el desarrollo de sus funciones, la DGF se estructura en las siguientes unidades:
* Subdirección General de Estudios y Análisis Económicos.
* Subdirección General de Financiación y uso Racional de Medicamentos y Productos Sanitarios.
Agencia Española de Medicamentos y Productos Sanitarios
La Agencia Española del Medicamento (AEM), que, de acuerdo con lo dispuesto en los artículos 31 y 32 de la Ley de Cohesión y Calidad del SNS, pasa a denominarse Agencia Española de Medicamentos y Productos Sanitarios (AEMyPS), es un organismo público, con el carácter de organismo autónomo, adscrito al Ministerio de Sanidad y Consumo a través de la Dirección General de Farmacia y Productos Sanitarios, que desarrolla las funciones establecidas en el artículo 5 de su Estatuto (RD 520/1999, de 26 de marzo) y en el artículo 10 del RD 1.087/2003, de 29 de agosto, por el que se establece la estructura orgánica del Ministerio de Sanidad y Consumo3.
La AEMyPS asume, como organismo técnico especializado, las actividades de evaluación, registro, autorización, inspección, vigilancia y control de medicamentos de uso humano y veterinario y productos sanitarios, cosméticos y de higiene personal, y la realización de los análisis económicos necesarios para la evaluación de estos productos, sin perjuicio de las competencias ejecutivas de las comunidades autónomas.
La estructura de la AEMyPS cambia en relación con la de la AEM. Se consolidan las Subdirecciones Generales de Medicamentos de Uso Humano y de Uso Veterinario y se incorporan a la nueva estructura la Subdirección General de Inspección y Control de Medicamentos y la Subdirección General de Productos Sanitarios. Del Director de la AEMyPS depende directamente la Secretaría General. También, como novedad, se adscribe a la AEMyPS el Comité Asesor de Cosmetología.
Se crea en el Ministerio de Sanidad y Consumo el Registro General de Centros, Servicios y Establecimientos Sanitarios, con carácter público e informativo
Establecimientos sanitarios
En desarrollo de la Ley General de Sanidad y de la Ley de Cohesión y Calidad del SNS, se aprueba el RD 1.277/2003, de 10 de octubre, por el que se establecen las bases generales sobre autorización de centros, servicios y establecimientos sanitarios4.
Con este real decreto se pretende establecer las bases para alcanzar las garantías de seguridad y calidad de la atención sanitaria. Para ello, fija estos tres objetivos:
* Regular las bases generales del procedimiento de autorización de centros, servicios y establecimientos sanitarios por las comunidades autónomas.
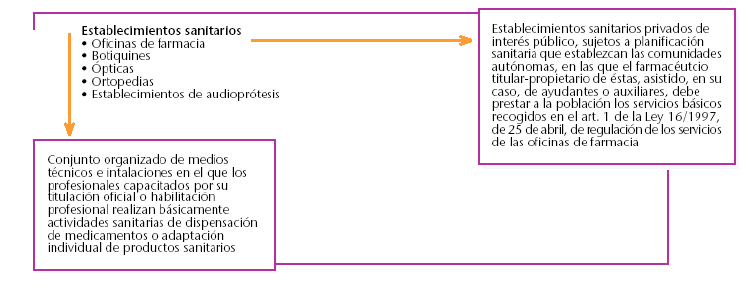
* Establecer una clasificación, denominación y definición común para todos los centros, servicios y establecimientos sanitarios, públicos y privados, imprescindible para la creación de un registro general.
* Establecer el catálogo y registro general de centros, servicios y establecimientos sanitarios.
Se excluyen de la aplicación de este reglamento:
* Los establecimientos dedicados a la distribución, importación o elaboración de medicamentos o productos sanitarios.
* Los servicios y unidades técnicas de protección radiológica.
La clasificación, las denominaciones y las definiciones de los centros, servicios y establecimientos sanitarios se incluyen en los anexos I y II de este real decreto (fig. 1). Reglamentariamente se establecerán los requisitos mínimos comunes de autorización, que podrán ser complementados por las comunidades autónomas en aspectos relativos a sus competencias.
Fig. 1. Definición de establecimiento sanitario y oficina de farmacia.
Se crea en el Ministerio de Sanidad y Consumo el Registro General de Centros, Servicios y Establecimientos Sanitarios, con carácter público e informativo. Su estructura y contenido se establecerán mediante una orden y las comunidades autónomas deberán facilitar la información necesaria para mantenerlo actualizado. Con carácter periódico podrá publicarse un catálogo en el que se incluya información relativa al Registro General.
Ejecución de la legislación del Estado sobre productos farmacéuticos
Este año, ha correspondido el traspaso de funciones y servicios de la Administración del Estado en materia de ejecución de la legislación del Estado sobre productos farmacéuticos a la Comunidad de Extremadura5.
Formulario Nacional y Real Farmacopea Española
Después de varios años de espera, se aprueba el Formulario Nacional (FN)6, cuya entrada en vigor se demora hasta finales de febrero de 2004.
La primera edición del FN comprende: 81 monografías de materias primas, 21 monografías de fórmulas magistrales tipificadas, 48 monografías de preparados oficinales y diferentes procedimientos normalizados de trabajo (procedimientos generales, procedimientos de elaboración de formas farmacéuticas, procedimientos de operaciones farmacéuticas y procedimientos de controles de producto).
Como medida transitoria hasta la próxima actualización del FN, se dispone en la orden que las oficinas de farmacia y los servicios farmacéuticos podrán continuar elaborando los preparados oficinales, no incluidos expresamente en esta primera edición del FN, previa solicitud (modelo incluido en el anexo II) y autorización de la AEMyPS. Los preparados oficinales, para los que se solicita autorización, deben cumplir los siguientes requisitos:
* Deben contener sustancias de reconocida utilidad terapéutica y demostrar más de 10 años de uso y respaldo bibliográfico.
* Han de estar indicados para tratamiento o prevención de síntomas menores que no requieran atención médica.
* No deben ser preparaciones parenterales.
Fórmulas magistrales
En materia de normas de correcta elaboración y control de calidad de fórmulas magistrales y preparados oficinales, se concede, mediante el RD 905/2003, de 11 de julio7, un nuevo plazo para su adaptación a las oficinas de farmacia y servicios farmacéuticos hasta el 1 de enero de 2004.
En relación con la Real Farmacopea Española, cabe reseñar que se ha aprobado el suplemento 2.1 de su segunda edición8 y se han incluido 48 monografías nuevas, 128 monografías revisadas y corregidas, más un capítulo general nuevo y 7 revisados y corregidos.
Clasificación anatómica de medicamentos
Con objeto de homologar el sistema de clasificación anatómica de medicamentos utilizado en España, que en la actualidad emplea la mayor parte de los países de la Unión Europea, se aprueba el RD 1.348/2003, de 31 de octubre9.
La adaptación de la actual clasificación anatómica de medicamentos a la clasificación ATC (Anatomical, Therapeutic, Chemical Classification System), recomendada internacionalmente por el Drug Utilization Research Grup (DURG) de la OMS, conlleva implícito el cambio de algunas especialidades de subgrupo o grupo terapéutico (anexo I). Este hecho, incide notablemente en la normativa por la que se regula la selección de los medicamentos a efectos de su financiación por el SNS y, en consecuencia, requiere su modificación.
Cabe indicar que los anexos II y III del reglamento incluyen, respectivamente, los grupos y subgrupos terapéuticos excluidos de la financiación pública y los grupos y subgrupos terapéuticos de aportación reducida. En el anexo IV, se incluyen las especialidades farmacéuticas que cambian de aportación: de normal a reducida, de reducida a normal y de excluidas a incluidas en la financiación.
Es interesante resaltar lo establecido en la disposición adicional única del citado RD en materia de financiación de nuevas especialidades. Concretamente, especialidades farmacéuticas que cubran lagunas terapéuticas o que se destinen a enfermedades graves o medicamentos huérfanos, independientemente de que puedan incluirse en grupos o subgrupos terapéuticos excluidos de la prestación farmacéutica del SNS, podrán financiarse con cargo a fondos públicos, ahora bien, la financiación podrá limitarse a determinadas indicaciones o a colectivos específicos.
Con tal de adaptarse a la nueva clasificación ATC, la Orden, de 28 de mayo de 1986, por la que se establecen los medicamentos prescritos que no pueden ser sustituidos por otros en la dispensación10 y la Orden, de 23 de mayo de 1994, sobre modelos oficiales de receta médica para la prestación farmacéutica del SNS, ambas del Ministerio de Sanidad y Consumo, han modificado parte de su articulado (tablas 2 y 3).
El 1 de enero de 2004 es la fecha establecida para la entrada en vigor del nuevo sistema de clasificación anatómica de medicamentos.
Autorizaciones de comercialización de medicamentos
El RD 767/1993, de 21 de mayo, regula la evaluación, autorización, registro y condiciones de dispensación de las especialidades farmacéuticas y otros medicamentos de uso humano fabricados industrialmente. La Orden SCO/3.461/2003, de 26 de noviembre11, actualiza el anexo II del citado real decreto mediante la incorporación de la normativa comunitaria a nuestro ordenamiento jurídico.
El anexo II comprende las normas y protocolos analíticos, farmacotoxicológicos y clínicos relativos a la realización de pruebas de medicamentos. Se estructura en cuatro partes:
* Parte I. Incluye el formato de la solicitud, el resumen de las características del producto, el etiquetado, el prospecto y los requisitos de presentación de las solicitudes normalizadas (módulos 1 a 5).
* Parte II. Comprende las excepciones que se aplicarán a las solicitudes específicas (uso médico suficientemente comprobado, medicamentos esencialmente similares, medicamentos de combinación fija, medicamentos biológicos similares, circunstancias excepcionales y solicitudes mixtas).
* Parte III. Corresponde a los requisitos particulares de las solicitudes de autorización de comercialización (medicamentos biológicos, radiofármacos, medicamentos homeopáticos, medicamentos a base de plantas y medicamentos huérfanos).
* Parte IV. Trata de los medicamentos de terapia avanzada.
Asimismo, la Orden hace referencia al procedimiento para la realización de los estudios complementarios, en el caso de autorizaciones sometidas a condiciones especiales.