La farmacología se ha centrado, en los últimos años, en la búsqueda de nuevas dianas sobre las que actuar en el campo de los procesos degenerativos, que abarca patologías tan dispares como las enfermedades neurodegenerativas, algunas miopatías, la diabetes y los procesos de envejecimiento. En el presente trabajo se aborda el papel de la mitocondria como diana farmacológica en los procesos neurodegenerativos. Los expertos aseguran que dentro de unos años podríamos estar hablando de una auténtica «farmacología mitocondrial».
La mitocondria tuvo en el pasado un interés restringido a los estudiosos de la citología, la bioquímica metabólica y la bioenergética. Sin embargo, desde hace unos años la mitocondria se encuentra en un primer plano de la actualidad de las ciencias biomédicas. Así, en la última década, muchas investigaciones se han dirigido hacia el estudio de esta organela, al ser considerada como el lugar donde convergen diferentes vías de señalización de muerte celular, tanto apoptóticas como necróticas.
Mitocondria
La mitocondria es una organela citoplasmática de características muy especiales, quizá debido a su origen endosimbiótico, que la convierten en un componente enormemente importante en la vida de la célula.
Estructura
Las mitocondrias presentan una estructura con dos compartimentos bien definidos --matriz y espacio intermembranal-- delimitados por dos membranas --interna y externa-- con características morfológicas, funcionales y de permeabilidad muy diferentes.
La membrana interna se caracteriza morfológicamente por presentar unas invaginaciones (crestas) con multitud de complejos enzimáticos y proteínas que regulan el paso de metabolitos. Esta membrana resulta especialmente impermeable a iones, debido a su alto contenido en el fosfolípido cardiolipina y a la gran cantidad de bombas y transportadores específicos (como el translocador de nucleótidos de adenina, ANT). Por el contrario, la membrana externa carece de crestas y, en condiciones fisiológicas, su permeabilidad es menos selectiva, gracias a la presencia de una proteína denominada porina o canal aniónico dependiente de voltaje (VDAC) que permite el paso de iones y metabolitos con pesos moleculares inferiores a 6.000 Da.
Función
Durante muchas décadas se pensó que la mitocondria tan sólo desempeñaba la función de abastecer a la célula de energía, debido a que en su interior tiene lugar la fosforilación oxidativa, donde se genera poder reductor que será transformado, por una serie de complejos enzimáticos --I, II, III y IV, que forman la cadena transportadora de electrones-- en un gradiente electroquímico sobre la membrana interna mitocondrial, mediante el paso de protones hacia el espacio intermembranal. Este gradiente es convertido en energía por la enzima ATPsintasa (o complejo V), en forma de moléculas de ATP.
El empleo de los antibióticos ionóforos y la espectroscópica del flujo y recambio de iones, en diversos sistemas experimentales, demostraron que la mitocondria realiza un proceso bien definido de captación de Ca2+. El movimiento de Ca2+ hacia el interior de la mitocondria es impulsado por el gradiente de potencial eléctrico. Estos experimentos ponían de manifiesto que la mitocondria es capaz de regular las concentraciones citoplasmáticas de este catión. Posteriormente se describió como la mitocondria posee la capacidad de precipitar Ca2+ en su interior, y de esta manera participar --junto con el retículo endoplasmático y las bombas y canales de la membrana celular-- en la regulación de las concentraciones citoplasmáticas de calcio libre.
Por otro lado, como resultado de una reducción defectuosa del oxígeno durante la fosforilación oxidativa puede tener lugar, en la matriz mitocondrial, la generación de especies reactivas del oxígeno (EROS), como el superóxido que, como revisaron Paredes y Roca en esta misma revista, constituyen una pieza clave en el envejecimiento celular. Por último, en la última década del siglo xx se describió que la mitocondria es diana de muchas proteínas que presentan translocación desde otros organelos o compartimentos celulares como el núcleo y el citoplasma en su interior y que regulan su permeabilidad iónica.
La mitocondria en las enfermedades neurodegenerativas
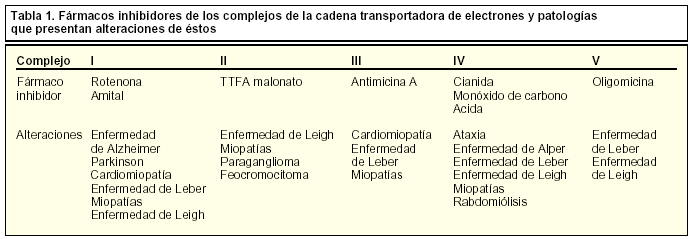
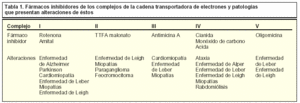
En los últimos años, algunas enfermedades neurodegenerativas se han relacionado con disfunciones mitocondriales de diferente tipo (tabla 1). Mutaciones en proteínas mitocondriales pueden conducir a un descenso en la producción de ATP, formación de radicales libres y alteraciones en la homeostasis del calcio en la célula. Por ejemplo, en la paraplejia espástica hereditaria, se encuentra mutada la paraplegina, una metaloproteasa mitocondrial que da lugar a defectos en la fosforilación oxidativa. Otro ejemplo es la ataxia de Friedreich, en la que se encuentra mutada la proteína mitocondrial frataxina requerida para el mantenimiento de la homeostasis de hierro y el contenido en ADN. Disfunciones mitocondriales también desempeñan un papel esencial en otras enfermedades neurodegenerativas como las enfermedades de Parkinson, Huntington y Alzheimer. Además, en sistemas donde no se lleva a cabo un «reemplazamiento» o «renovación» celular, como es el sistema nervioso, se pueden acumular mutaciones somáticas mitocondriales que, sumadas al descenso en la función mitocondrial, pueden ser la causa del envejecimiento y la senescencia.
La actividad de las reacciones enzimáticas que abastecen energéticamente a la célula puede verse reducida o comprometida debido a un aporte inadecuado de oxígeno a las células como ocurre en procesos de arteriosclerosis, anemia o alcoholismo. En algunos casos, esta actividad puede verse también reducida por alteraciones genéticas, como se han descrito en pacientes con neuropatía óptica hereditaria de Leber que presentan mutaciones en el complejo I, y una reducción de su actividad se ha observado en pacientes de Parkinson. En este sentido, algunas neurotoxinas o sus metabolitos pueden ser causa o contribuir a la enfermedad de Parkinson, como la 1-metil-4-fenil-1,2,3,6-tetrahidropiridina (MPTP), y su metabolito MMP+, inhibidores de estos complejos enzimáticos, y que hoy día constituyen parte de las herramientas farmacológicas utilizadas como inductores en modelos experimentales para el estudio de los mecanismos celulares que tienen lugar en estas enfermedades degenerativas.
Por último, en la encefalopatía hepática se ha descrito que las acumulaciones de amonio provocan una inhibición de la enzima alfa-cetoglutarato deshidrogenasa que participa en el ciclo de los ácidos tricarboxílicos.
En la Fundación para la Investigación sobre el Cáncer en California se obtuvo la primera indicación de que la mitocondria desempeña un papel importante en la inducción de la apoptosis
La mitocondria en la apoptosis
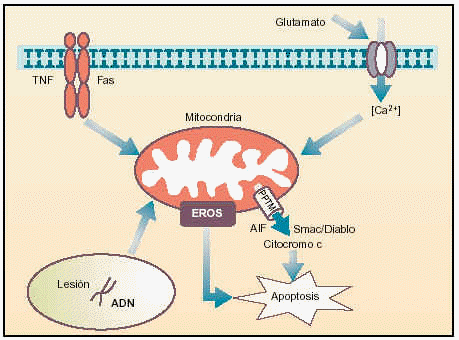
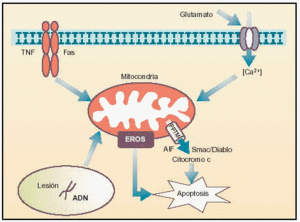
Los procesos de apoptosis se ejecutan normalmente durante el desarrollo para suprimir las células innecesarias o para eliminar las células que han sido dañadas por distintos agentes estresantes, tales como la radiación o la oxidación. Si la apoptosis no está operando correctamente, sin embargo, pueden presentarse tumores, inmunodeficiencia, autoinmunidad o trastornos neurodegenerativos. En la última década del siglo pasado, en el laboratorio del Prof. J.C. Reed en la Fundación para la Investigación sobre el Cáncer en California se obtuvo la primera indicación de que la mitocondria desempeña un papel importante en la inducción de la apoptosis, al demostrar que la presencia de esta organela era necesaria para inducir apoptosis en un tubo de ensayo. Desde entonces los estudios se han dirigido a analizar diferentes características de esta organela que son esenciales para que ejerza este papel, tales como su capacidad de regular la permeabilidad de sus membranas, controlando la liberación de componentes proteicos al citoplasma y la producción de radicales libres como el superóxido (fig.1).
Fig. 1. Papel de la mitocondria en la transmisión de las señales apoptóticas.
Vías de señalización de la apoptosis
Existen tres vías principales para la transmisión de una señal apoptótica:
La primera ocurre cuando el sistema nervioso es sobreexcitado por glutamato, como ocurre en los procesos isquémicos. En ellos se ha observado una entrada masiva y prolongada del ión Ca2+ al citoplasma, que es «detectada» por la mitocondria.
La unión de ligandos a receptores «de muerte» --como el TNF-R1 o Fas-- localizados en la membrana citoplasmática activa rutas de señalización que se dirigen a la mitocondria. Además, la célula también posee receptores de factores tróficos y citocinas, que, en el caso de que dejen de estimularse, desencadenan cascadas que conducen a modificaciones en la permeabilidad de las membranas de la mitocondria.
Por último, el daño en el genoma celular puede ser detectado por ciertos factores de transcripción, como p53, que inducen el incremento de las concentraciones citoplasmáticas de ciertas proteínas que se translocan a la mitocondria para ejercer efecto proapoptótico.
La apertura del poro de permeabilidad transitoria mitocondrial
Todos estos procesos se ven traducidos a nivel mitocondrial en la formación de una estructura multiproteica, en las zonas de unión de sus membranas, que se conoce como «poro de permeabilidad transitoria mitocondrial» (PPTM), y que se presenta como el eje del desencadenamiento de una señal apoptótica. Cuando estos estímulos llegan a la mitocondria, diferentes proteínas, entre las que destaca el ANT y el VDAC, se ven modificadas para la generación de un poro de dimensiones exageradas y por el cual se produce la liberación, entre otras sustancias, de compuestos con conocida actividad pro-apoptótica, como citocromo C, la proteína Smac/Diablo, el factor inductor de apoptosis y algunos miembros de la familia de las caspasas (ejecutoras más importantes de las últimas fases de la apoptosis gracias a su actividad catalítica).
Este proceso está altamente regulado por multitud de proteínas que interaccionan con los componentes esenciales del PPTM, entre las que destacan la ciclofilina D, que se encuentra en la matriz y cuya interacción con ANT parece esencial para la apertura del poro; la creatina cinasa, que se encuentra en el espacio intermembranal; el receptor de benzodiazepinas, que se encuentra en la membrana externa, y algunos miembros de una familia de proteínas denominada «familia de Bcl-2», entre los que se encuentran unos que promueven la apertura del PPTM -- Bad, Bid, etc.-- y otros con conocida función antiapoptótica --Bcl-2 o Bcl-Xl-- que ocluyen el mismo para impedir la salida de sustancias a su través.
Fase de ejecución
En esta etapa, las sustancias liberadas por la mitocondria activan diferentes rutas apoptóticas. Así, mientras el citocromo C entra a formar parte de un complejo multiproteico (apoptosoma, requerido para la activación de la caspasa-9), el AIF desencadena procesos de condensación de la cromatina y fragmentación del ADN, y la proteína Smac/Diablo es capaz de inhibir diferentes vías que impiden la activación de algunas caspasas.
Farmacología de la mitocondria
La capacidad reguladora de los procesos de muerte celular por parte de la mitocondria la convierte en la organela de estudio de fármacos con actividades tanto proapoptóticas, con el fin de matar la célula, como antiapoptóticas, con el fin de prevenir su muerte. En este trabajo revisaremos el mecanismo de acción de algunos fármacos que modulan la función mitocondrial, entre los que se incluyen algunos antitumorales, inmunosupresores, antivirales, y agonistas de canales de potasio localizados en la membrana mitocondrial, así como sulfonilureasas y anestésicos (tabla 2), sin olvidar un gran número de toxinas, como se ha revisado extensamente en el trabajo de Wallace y Starkov (2000).
Fármacos proapoptóticos
Entre los mecanismos de acción de los fármacos proapoptóticos existe la manipulación de la concentración de calcio en el interior de las células, por ejemplo, mediante el uso de la tapsigargina (inhibidor de la ATPasa-Ca2+ del retículo endoplasmático) que previene la acumulación de calcio en el retículo y que induce apoptosis en varios tipos celulares. Otros promotores de la apoptosis, como ya se ha comentado, son las EROS. La producción excesiva de radicales libres puede ser inducida por un gran número de xenobióticos, iones de metales de transición y radiaciones ionizantes y ultravioleta.
La activación del PPTM o la modificación de la estabilidad de la membrana mitocondrial constituyen parte del mecanismo de acción de gran número de fármacos anticancerígenos entre los que se incluye el etoposido, doxorrubicina, 1-beta-D-arabinofuranosilcitosina, lonidamina, ácido betulínico, arsenito, CD437 y péptidos alfahelicoidales catiónicos anfifílicos.
Fármacos antiapoptóticos. Modulación del estrés oxidativo
Con el fin de proteger a la mitocondria contra el daño producido por las EROS, son varias las aproximaciones que se están realizando (entre las que destacamos el aumento de los valores de glutatión) mediante el uso de precursores de su síntesis como puede ser la N-acetilcisteína, que además tiene, por sí sola, propiedades antioxidantes. Este efecto también se produce con el incremento en el contenido de coenzima A mediante la administración de su precursor, el ácido pantocénico, o mediante la curcumina --pigmento amarillo del picante curri indio-- o con el analgésico flupirtina.
Otros antioxidantes intracelulares generales son el ácido ascórbico, el alfatocoferol, el betacaroteno y el alfaácido lipoico. En los últimos años se está introduciendo el ubiquinol, la forma reducida de la coenzima Q, un antioxidante natural que, además de la mitocondria, tiene como diana otras membranas celulares y se están desarrollando estudios sobre sus propiedades contra el envejecimiento y para retardar y/o reducir los síntomas de las enfermedades de Alzheimer y de Parkinson así como en la corea de Huntington.
Interacción con canales de potasio
Los agonistas de canales de potasio son fármacos, descubiertos a principios de los ochenta, que estimulan el flujo iónico a través de estos canales. Cromacalima, nocorandil y diazóxido son algunos miembros de la familia de estos compuestos. Su utilidad ha variado conforme se ha esclarecido su mecanismo de acción. Primeramente utilizados por sus propiedades antianginosas y antihipertensivas, pasaron a ser utilizados como antiasmáticos, agentes cardioprotectores, y recientemente han sido utilizados para regular la hipertensión vascular y pulmonar.
Inicialmente se postuló que la acción de estos fármacos era mediada fundamentalmente por sus efectos sobre los canales de potasio localizados en la membrana celular. Sin embargo, en los últimos años se ha observado que son capaces de modular también los canales de potasio localizados en las membranas intracelulares, entre las que destaca la membrana mitocondrial que posee gran cantidad de ellos.
Sulfonilureasas y mitocondria
Es bien conocido que las sulfonilureasas antidiabéticas como la glibenclamida o la glipicida presentan una alta afinidad por los receptores de sulfonilureas de la membrana plasmática de varios tipos celulares. No obstante, también se han descrito canales de potasio de localización mitocondrial, que son bloqueados por estos fármacos.
El receptor de benzodiazepinas
Las benzodiazepinas son fármacos extensamente utilizados por sus propiedades como ansiolíticos, anticonvulsionantes, relajantes musculares y sedantes. Como se ha comentado anteriormente, el receptor de estos compuestos se encuentra en la membrana externa mitocondrial, interaccionando tanto con el VDAC como con el ANT. El papel fisiológico que desempeña este receptor es todavía incierto, pero está implicado en algunas importantes funciones mitocondriales. Además, se ha observado que un agonista de estos receptores, el Ro5-4864, protege contra la apoptosis inducida por el factor de necrosis tumoral alfa en una línea celular humana.
Fármacos inmunosupresores
La ciclosporina A es un fármaco inmunosupresor que bloquea la transcripción de genes en células T activadas. Comercializado como Sandimmun por Novartis, es ampliamente utilizado para evitar los rechazos en transplante de órganos. Estudios recientes han puesto de manifiesto su capacidad para formar un complejo con la ciclofilina D, inhibiendo su actividad isomerasa. Además, la ciclosporina A es capaz de inhibir la actividad de la calcineurina.
A nivel mitocondrial, la ciclosporina A es capaz de bloquear la formación del PPTM, y éste parece ser el mecanismo por el cual este fármaco es eficaz en la protección de las células frente a una lesión isquémica.
Fármacos antivirales
La mitocondria se ha presentado como una diana potencial en la toxicidad inducida por análogos de nucleósidos usados como fármacos antivirales. Por ejemplo, el AZT, que es utilizado en el tratamiento del síndrome de inmunodeficiencia adquirida (sida), presenta efectos en el metabolismo mitocondrial en tejido cardíaco, produciendo un descenso en la relación ATP/ADP y cardiomiopatía.
Fármacos antiinflamatorios no esteroides
Los fármacos antiinflamatorios no esteroides, como los salicilatos y el ibuprofeno, muy comúnmente prescritos, presentan efectos secundarios que parecen estar mediados por un proceso que incluye daño mitocondrial e inhibición de ciclooxigenasas. A este nivel, hoy sabemos que estos fármacos antiinflamatorios modifican la fosforilación oxidativa, inhibiendo la producción de ATP y alterando la permeabilidad de la membrana interna. El hecho de que los salicilatos induzcan la formación del PPTM en mitocondria aislada está siendo motivo de estudio por su implicación en el síndrome infantil de Reye. Además, el ibuprofeno, de una forma directa, también induce la apertura del PPTM.
Anestésicos locales
Junto al bloqueo de la conducción del impulso nervioso causando una parálisis sensorial, los anestésicos locales pueden afectar al metabolismo energético mitocondrial probablemente debido al desacople de la fosforilación oxidativa. Además, también producen una inhibición de la ATPasa mitocondrial y de los complejos enzimáticos que generan el gradiente electroquímico, habiéndose postulado estos mecanismos como los responsables de los efectos tóxicos observados durante la analgesia.
Modulación del metabolismo lipídico
Muchas etapas cruciales en el metabolismo lipídico tienen lugar en la mitocondria. Estas rutas pueden ser alteradas por la administración de fármacos que modulan la función mitocondrial. Un ejemplo son los inhibidores de la carnitina acetiltransferasa que producen una reducción de la translocación de ácidos grasos «activados» al interior de la mitocondria.
Otros fármacos
Además de los ya revisados, numerosos compuestos usados en medicina humana y veterinaria pueden interaccionar con la mitocondria de un modo más o menos accidental. Así, algunos fármacos antiarrítmicos, como amiodarona, y algunos antibióticos, como el cloranfenicol, no sólo inhiben la síntesis proteica bacteriana, sino también la mitocondrial.
Conclusión
Esta revisión es tan sólo una muestra de cómo la modulación de la función mitocondrial puede suponer un gran avance farmacológico. Conocer cómo activar o inactivar la muerte celular programada, por ejemplo, nos podría permitir preservar los tejidos cerebrales y cardíacos que de otra manera morirían por la falta de oxígeno durante apoplejías y ataques cardíacos. Por todo ello, cabe esperar que en unos años hablemos de una «farmacología mitocondrial».
Bibliografía general
Cooper JM, Schapira AH. Mitochondrial dysfunction in neurodegeneration. J Bioenerg Biomembr 1997;29(2):175-83.
Green DR, Reed JC. Mitochondria and apoptosis. Science 1998;281(5381):1309-12.
Jordán J, Galindo MF, Cena V, González-García C. Cisteína proteasas y Neurodegeneración. Rev Neurol 2000;31(4):333-40.
Kroemer G, Reed JC. Mitochondrial control of cell death. Nat Med 2000;6(5):513-9.
O-Rourke B. Pathophysiological and protective roles of mitocondrial ion channels. J Physiol;529:23-36.
Paredes F, Roca JJ. Influencia de los radicales libres en el envejecimiento celular. Offarm 2002;21(7):96-100.
Skulachev VP. Mitochondrial physiology and pathology; concepts of programmed death of organelles, cells and organisms. Mol Aspects Med 1999; 20(3):139-84.
Szewczyk A, Wojtczak L. Mitochondria as a Pharmacological Target. Pharmacol Rev 2002;54:101-27.
Tornero D, Ceña V, González-García C, Jordán J. Papel del poro de permeabilidad transitoria mitocondrial en los procesos neurodegenerativos. Rev Neurol 2002;35(4):354-61.
Wallance KB, Starkov AA. Mitochondrial targets of drug toxicity. Annu Rev Pharmacol Toxicol 2000;40:353-88.