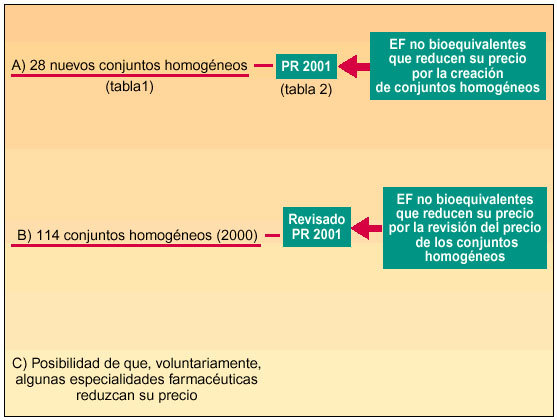
El Ministerio de Sanidad y Consumo, mediante la Orden de 27 de diciembre de 20011, aprueba la incorporación de nuevos conjuntos homogéneos de presentaciones de especialidades farmacéuticas a los ya existentes y, a su vez, revisa los precios de referencia aprobados en 2000 (fig. 1).
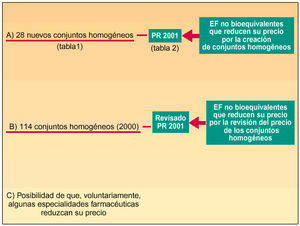
Fig. 1. Esquema que resume la Orden de 27 de diciembre de 2001.
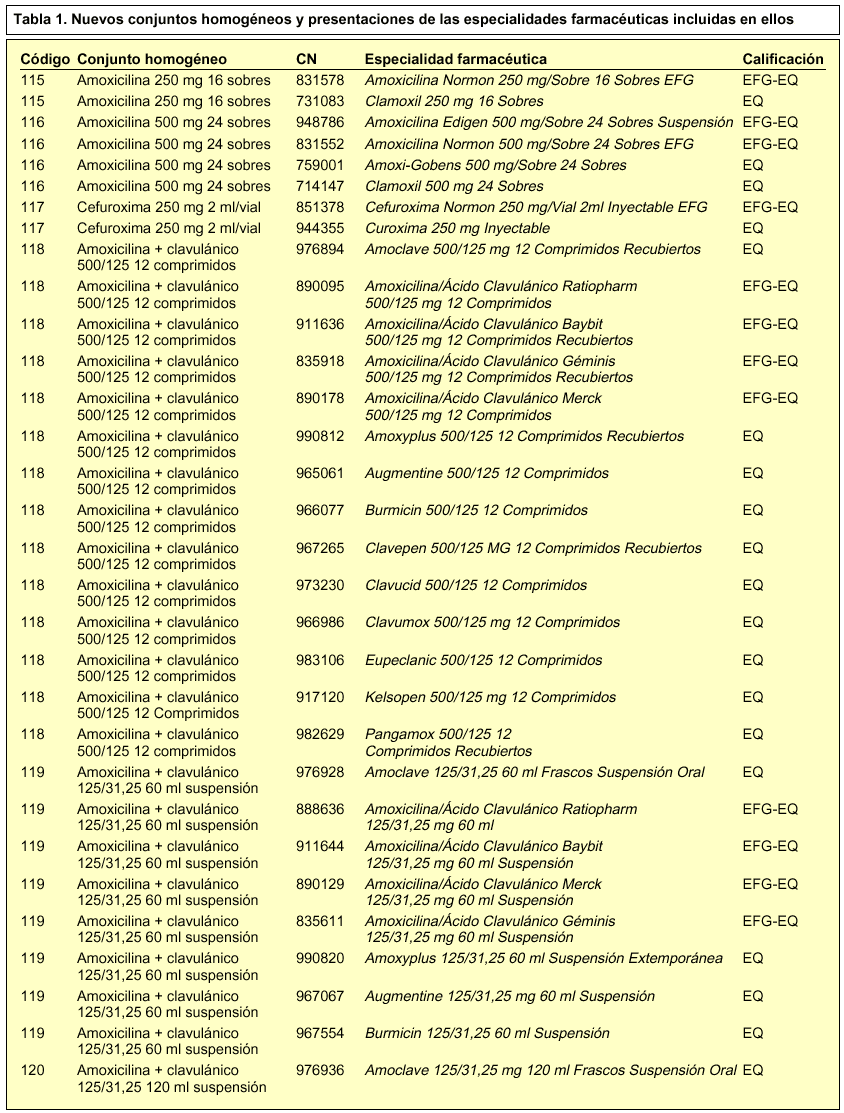
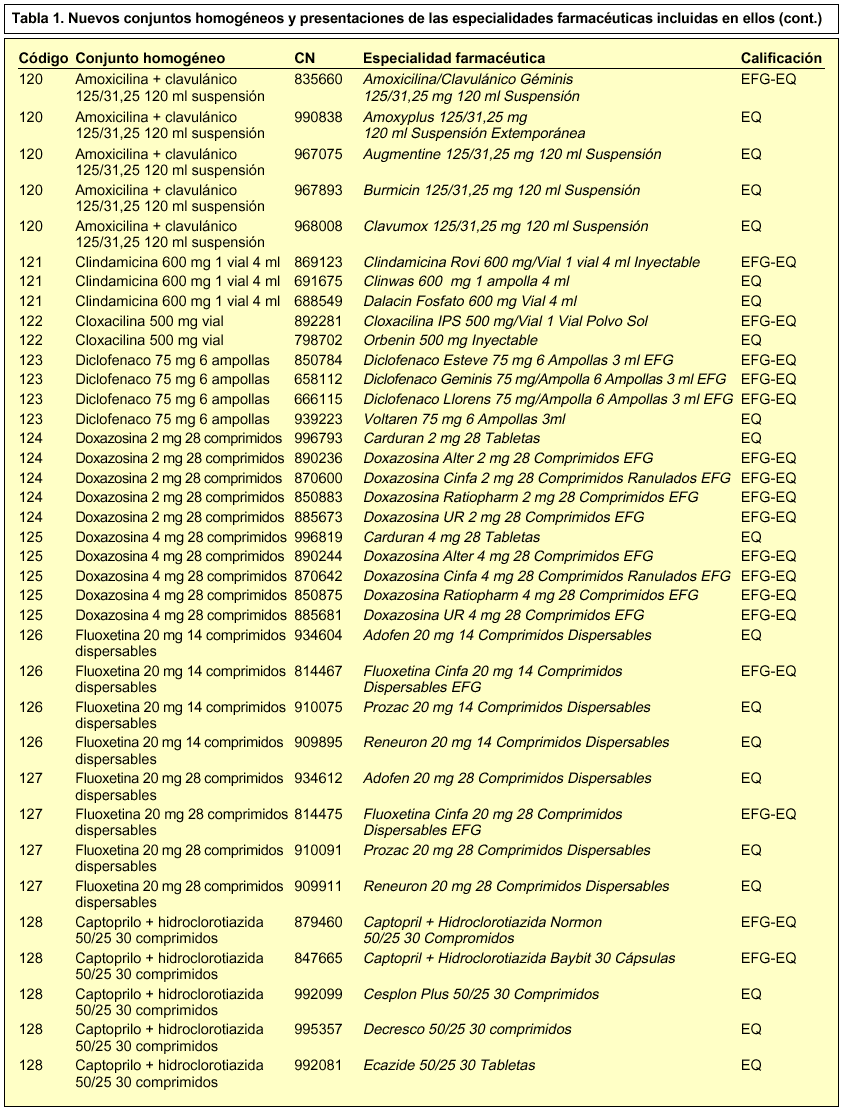
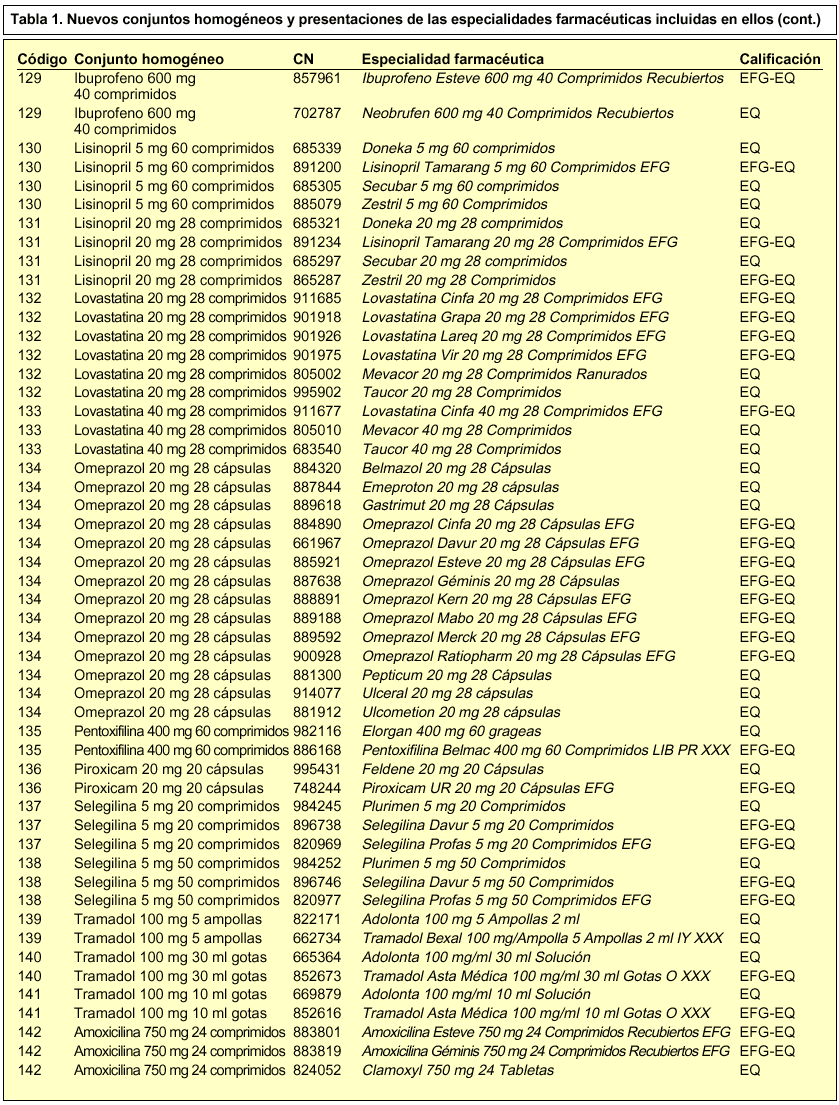
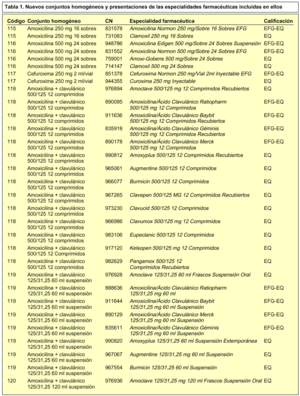
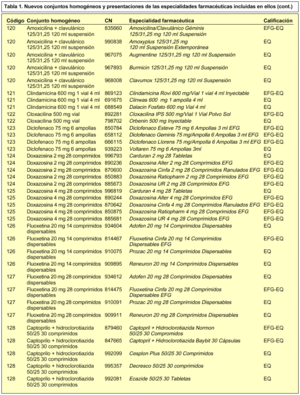
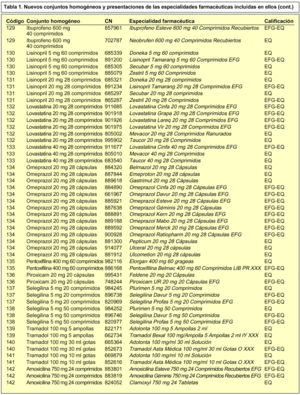
En concreto, se incorporan 28 nuevos conjuntos homogéneos a los 114 establecidos en la Orden de 13 de julio de 20002, por lo que en la actualidad contamos con un total de 142 conjuntos homogéneos. En la tabla 1 se incluye la relación de los nuevos conjuntos homogéneos con sus respectivos códigos y las especialidades farmacéuticas incluidas en cada uno de ellos.
A partir del 1 de mayo de 2002, las facturaciones de todas las especialidades farmacéuticas afectadas por la Orden de 27 de diciembre de 2001se liquidarán con los nuevos precios
A los conjuntos homogéneos de nueva creación se les asigna su correspondiente precio de referencia, representados en la tabla 2.
Las presentaciones de las especialidades farmacéuticas que tienen la calificación de bioequivalentes y que están incluidas en un conjunto homogéneo deben llevar las siglas EQ en el cupón-precinto, con tal de garantizar su correcta identificación y permitir su posible sustitución. Recordemos que las siglas EQ deben aparecer en el cupón-precinto situadas inmediatamente a continuación del nombre, forma farmacéutica, presentación y de las siglas EFG (si las llevara por tener esta condición). Las siglas EQ se encontrarán separadas por un guión y tanto el guión como las siglas se resaltarán en negrita.
Los laboratorios afectados por la inclusión de sus especialidades en los nuevos conjuntos homogéneos han de ajustarse a lo reglamentado3 por ello se les concede un plazo de 3 meses (finaliza el 30 de marzo de 2002) para la incorporación de las siglas EQ en el cupón-precinto, mediante reetiquetado de las actuales con etiquetas adhesivas o bien utilizando nuevos cartonajes. A partir de la fecha establecida, los laboratorios sólo podrán suministrar a los almacenes de distribución y a las oficinas de farmacia las especialidades farmacéuticas con las siglas EQ en el cupón-precinto.
A su vez, los titulares de presentaciones de especialidades farmacéuticas incluidas en un conjunto homogéneo deben actualizar el contenido de la ficha técnica y/o prospecto, con tal de asegurar la homogeneidad de información del conjunto.
Como ya hemos señalado anteriormente, también se han revisado, mediante la Orden de 27 de diciembre de 2001, los precios de referencia de los conjuntos homogéneos aprobados por la Orden de 13 de julio de 2000.
Podemos concretar diciendo que en materia de precios de referencia de los conjuntos homogéneos la Orden de 27 de diciembre de 2001 abarca dos cuestiones: por una parte, asigna precio de referencia a los conjuntos homogéneos de nueva creación; por otra, somete a los ya existentes, con su precio de referencia aprobado en julio de 2000, a una revisión que en términos medios aproximados se estima en una reducción del 10% sobre los precios anteriores.
Para las oficinas de farmacia se fija el 1 de mayo de 2002 como fecha a partir de la cual han de tener a disposición de los usuarios la relación actualizada de conjuntos homogéneos incluyendo los precios de referencia aplicables a cada uno de ellos. En esa misma fecha, comienza la obligación por parte del farmacéutico de sustituir la especialidad farmacéutica bioequivalente prescrita cuando supere la cuantía establecida como precio de referencia y deba financiarse con cargo a los fondos de la Seguridad Social o a fondos estatales afectos a la sanidad, por una especialidad farmacéutica genérica del mismo conjunto homogéneo cuyo precio no supere el de referencia, salvo los supuestos previstos en los artículos 5.2 y 6.3 del Real Decreto 1.035/1999, de 18 de junio3.
También cabe señalar que en aplicación del Real Decreto-Ley 12/1999 de 31 de julio4, cuando el precio de las presentaciones de especialidades farmacéuticas no bioequivalentes utilizadas para el cálculo del precio de referencia supere éste, se reducirá aquél hasta la cuantía fijada para el de referencia. La Orden de 27 de diciembre de 2001 incluye la relación de las presentaciones de especialidades farmacéuticas no calificadas como bioequivalentes, cuyo precio supera al de referencia (de nueva creación), para que se suministren por los laboratorios al precio industrial que se corresponda con el de referencia.
A las presentaciones de especialidades farmacéuticas no calificadas como bioequivalentes, cuyo precio supera al de referencia revisado en la Orden de 27 de diciembre de 2001, se les aplican las mismas medidas que en el supuesto anterior.
A su vez, existe la posibilidad de que los laboratorios decidan voluntariamente comercializar las presentaciones de especialidades farmacéuticas a un precio inferior al autorizado para adecuarlo a un nivel igual o inferior al de referencia, sin modificar el código nacional; para ello deben comunicarlo al Ministerio de Sanidad y Consumo en el plazo de 30 días a partir de la entrada en vigor de esta orden. También deben comunicarlo, en este mismo plazo, los laboratorios que tengan presentaciones de especialidades farmacéuticas afectadas por la revisión de precios.
A los laboratorios afectados por estas medidas se les concede un plazo de 3 meses desde la fecha de entrada en vigor de la presente orden (finaliza el 30 de marzo de 2002) para suministrar las especialidades farmacéuticas con el nuevo precio y para efectuar la correspondiente modificación del cartonaje, mediante la utilización de etiquetas adhesivas o la fabricación de unos nuevos, pero no supone modificación alguna del código nacional de la especialidad.
En las oficinas de farmacia, durante el tiempo en que coincidan especialidades farmacéuticas de precio antiguo con las de precio renovado, correspondientes a las presentaciones de especialidades farmacéuticas no calificadas como bioequivalentes (o las que de forma voluntaria decidieron reducir su precio), el cliente satisfará el importe de éstas de acuerdo con el que figure en el envase exterior, pero si la dispensación se realiza con cargo al Sistema Nacional de Salud, MUFACE, ISFAS o MUGEJU, las cantidades que deba satisfacer el beneficiario se calcularán con base a los nuevos precios. Por el contrario, el Sistema Nacional de Salud, MUFACE, ISFAS y MUGEJU mantendrán, a efectos de facturación, hasta el 30 de abril de 2002, el precio anterior de las presentaciones de estas especialidades farmacéuticas.
A partir del 1 de mayo de 2002, las facturaciones de todas las especialidades farmacéuticas afectadas por esta Orden se liquidarán con los nuevos precios. *
Notas
1. Orden de 27 de diciembre de 2001 por la que se determinan nuevos conjuntos homogéneos de presentaciones de especialidades farmacéuticas, se aprueban los correspondientes precios de referencia y se revisan los precios de referencia aprobados por Orden de 13 de julio de 2000 (BOE de 29 de diciembre de 2001).
2. Orden de 13 de julio de 2000 por la que se determinan los conjuntos homogéneos de presentaciones de especialidades farmacéuticas y se aprueban los precios de referencia (BOE de 25 de julio).
3. Real Decreto 1.035/1999, de 18 de junio, por el que se regula el sistema de precios de referencia en la financiación de medicamentos con cargo a fondos de la Seguridad Social o a fondos estatales afectos a la sanidad (BOE de 29 de junio).
4. Real Decreto-Ley 12/1999, de 31 de julio, de medidas urgentes para la contención del gasto farmacéutico en el Sistema Nacional de Salud (BOE de 16 de agosto).