Patogenia, diagnóstico y tratamiento
El glaucoma es una enfermedad crónica, evolutiva y muy grave, ya que su curso natural es la ceguera. De hecho, es la principal causa de ceguera irreversible en el mundo, pues se estima que 66,8 millones de personas tienen glaucoma de los que 6,7 millones presentan ceguera bilateral por esta causa. En el presente trabajo, los autores abordan la patogenia, diagnóstico y tratamiento de los diferentes tipos de glaucoma.
El glaucoma es un conjunto de procesos que tiene en común una neuropatía óptica adquirida, caracterizada por una excavación de la papila óptica y un adelgazamiento del borde neurorretiniano. Esta excavación está producida por la pérdida de axones de las células ganglionares de la retina que forman las fibras del nervio óptico. Cuando la pérdida de tejido del nervio óptico es significativa, se desarrolla una disminución del campo visual que puede dar lugar a una ceguera total si la pérdida de fibras es completa.
La presión intraocular elevada es un factor de riesgo para el glaucoma, pero no es necesaria para que exista la enfermedad. La presión intraocular normal varía entre 11 y 21 mmHg; no obstante, algunas personas pueden desarrollar lesión del nervio óptico con una presión intraocular normal (glaucoma de tensión normal o baja) y, por otro lado, hay muchos pacientes con presiones mayores de 21 mmHg sin lesiones en el nervio óptico y se dice que tienen hipertensión ocular.
La mayoría de los casos de glaucoma son asintomáticos hasta que la lesión del nervio óptico avanza y se desarrolla la pérdida del campo visual.
Patogenia
El glaucoma puede clasificarse según la existencia de obstrucción en el sistema de drenaje del humor acuoso, como glaucoma de ángulo abierto o de ángulo cerrado. Además, puede subdividirse según su etiología en primario o secundario.
El principal sistema de drenaje del ojo (sistema convencional) se localiza en el ángulo de la cámara anterior y se encarga del 83-96% de este drenaje en condiciones normales. Consiste en el flujo de humor acuoso a través de la malla trabecular, el canal de Schlemm, los canales intraesclerales y las venas epiesclerales y conjuntivales. En el glaucoma de ángulo abierto con aumento de la presión intraocular, la elevación de la tensión se debe a que el drenaje es inadecuado, a pesar de que el ángulo iridocorneal se mantiene abierto y parece relativamente normal en la exploración gonioscópica. En el glaucoma de ángulo cerrado, el aumento de la presión intraocular se produce cuando el drenaje normal del humor acuoso disminuye en grado suficiente por una obstrucción física del iris periférico.
Las vías secundarias (alternativas) de drenaje del humor acuoso, también conocidas como sistema de drenaje uveoscleral, eliminan el 5-15% del humor acuoso formado. Consiste en la salida de humor acuoso a través de la cara anterior del cuerpo ciliar y los músculos ciliares hasta alcanzar el espacio supracoroideo (p. ej., entre la coroides y la esclera), en el que abandona finalmente el ojo a través de canales esclerales.
Cuando el drenaje del humor acuoso no es el correcto, en la cámara anterior del ojo se produce un aumento de presión, que se transmite a la cámara posterior (humor vítreo) produciendo una disminución del flujo sanguíneo retiniano. Esto, a su vez, provoca una mala irrigación arterial de la papila óptica que se traduce en una degeneración progresiva de las fibras del nervio óptico y, por tanto, en una ceguera progresiva.
Diagnóstico
Es esencial realizar una exploración oftalmológica exhaustiva para efectuar tempranamente el diagnóstico y el tratamiento. El diagnóstico debe incluir la visualización del ángulo iridocorneal mediante un prisma o lente de contacto especial (gonioscopia), la medida de la presión intraocular (tonometría), la exploración del campo visual (campimetría) y, sobre todo, el examen del nervio óptico. Una prueba de detección selectiva de glaucoma basada sólo en la toma de la presión intraocular tiene poca sensibilidad, especificidad y valor predictivo positivo.
La visualización del ángulo de la cámara anterior permite diferenciar entre el glaucoma de ángulo abierto y de ángulo cerrado. No obstante, al ser opacos el limbo y la esclera situados por encima, el ángulo sólo puede verse mediante gonioscopia.
Si la decisión de tratar el glaucoma se basa sólo en el aumento de la presión intraocular, algunos pacientes con glaucoma de tensión normal se verán privados del tratamiento que precisan, mientras que otros con hipertensión ocular recibirán un tratamiento innecesario de por vida que les puede causar efectos secundarios. Alrededor del 90% de los pacientes con hipertensión ocular (>21 mmHg) nunca desarrollarán glaucoma. Aunque muchas personas con hipertensión ocular pueden tolerar valores tensionales elevados, si la presión intraocular excede de 27-30 mmHg conviene iniciar el tratamiento, sobre todo en personas con factores de riesgo asociados.
Tipos
El glaucoma de mayor prevalencia en el mundo occidental se asocia a un ángulo iridocorneal abierto, por lo que la resistencia al drenaje del humor acuoso se localiza en el interior de la trabécula. Si un paciente presenta glaucoma asociado a un aumento de la presión intraocular sin una causa identificada, la enfermedad se llama glaucoma primario o crónico de ángulo abierto.
Los pacientes con neuropatía óptica de origen glaucomatoso y pérdida del campo visual, pero sin antecedentes de aumento de la presión intraocular, tienen un glaucoma normotensivo.
Como ya se ha dicho anteriormente, los pacientes con aumento de la presión intraocular sin lesión glaucomatosa tienen hipertensión ocular.
Cuando el glaucoma de ángulo abierto se asocia a una causa identificable como el uso de corticoides, se denomina glaucoma secundario de ángulo abierto.
Por otra parte, cuando hay una obstrucción de la salida del humor acuoso a través del retículo trabecular, estamos hablando de un glaucoma de ángulo cerrado.
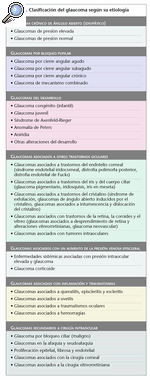
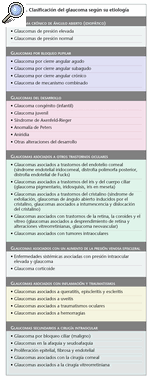
En la tabla 1 se muestran los tipos de glaucoma según su etiología.
Glaucoma primario de ángulo abierto (GPAA)
Es con diferencia el tipo de glaucoma con mayor prevalencia en occidente. En el GPAA se han encontrado alteraciones en los haces trabeculares, en el endotelio, en el tejido yuxtracanicular y en el canal de Schlemm. Algunos estudios han demostrado cambios similares a los observados en el proceso de envejecimiento. Los haces de la trabécula pueden estar engrosados, provocando disminución del espacio intratrabecular.
Es una enfermedad asintomática hasta las fases tardías de su evolución, y cuando el paciente se da cuenta de la pérdida de campo visual, el grado de atrofia del nervio óptico suele ser muy acusado. La visión central es habitualmente la última en afectarse, perdiéndose primero la visión periférica. No obstante, algunos pacientes pueden referir síntomas, como problemas al bajar escaleras si se afecta el campo visual inferior, dificultad para conducir o pérdida de algunas palabras cuando leen.
El signo principal es la atrofia glaucomatosa del nervio óptico con pérdida asociada del campo visual. Por definición, los pacientes con GPAA tienen presiones intraoculares mayores de 21 mmHg y un ángulo iridocorneal abierto con una trabécula de apariencia normal. El GPAA es bilateral, pero puede ser asimétrico.
Factores de riesgo principales
* Edad. En algunos estudios la edad es un factor de riesgo incluso más importante que el aumento de presión intraocular. El GPAA es infrecuente en individuos menores de 40 años.
* Raza negra. Tiene una prevalencia 4-16 veces mayor para presentar glaucoma en relación con la raza blanca. La tasa de ceguera es hasta ocho veces mayor.
* Antecedentes familiares positivos. El 20-25% de pacientes con GPAA tienen antecedentes familiares de glaucoma.
* Presión intraocular elevada. El riesgo de presentar glaucoma aumenta de forma paralela al aumento de la presión intraocular, aun cuando este aumento se encuentra dentro del rango de la normalidad. Cuando la presión intraocular supera los 21 mmHg, el riesgo de GPAA aumenta entre 6-10 veces en comparación con una presión inferior a 15 mmHg.
Factores de riesgo menores
* Miopía. Existe mayor prevalencia de GPAA en miopes. En los pacientes con hipertensión ocular, los que presentan miopía tienen mayor probabilidad de desarrollar lesión glaucomatosa en relación con aquellos con visión emétrope.
* Diabetes mellitus. La diabetes aumenta la sensibilidad del nervio óptico por la lesión que produce sobre los vasos de pequeño calibre.
Diagnóstico temprano
Es preciso hacer un diagnóstico temprano en todo individuo mayor de 40 años o que presente factores de riesgo.
En atención primaria, lo podemos sospechar al encontrar una presión intraocular elevada o una alteración de las papilas en un sujeto asintomático, tras lo que deberemos remitir al paciente a la consulta de oftalmología. Los instrumentos disponibles en una consulta de atención primaria son:
* Exploración de la agudeza visual.
* Visualización de fondo de ojo mediante oftalmoscopio directo. Este es el método más valioso, debido a los cambios en la apariencia del nervio óptico, antes de que exista pérdida de campo visual. El acopamiento de la papila es la característica unificadora de todas las formas de glaucoma. Otras enfermedades que provocan la muerte axonal del nervio óptico conducen a palidez, pero el glaucoma es casi la única en que esta muerte produce además excavación de la papila.
* Tonometría. La presión intraocular aumentada es el único factor de riesgo para el glaucoma que puede tratarse. La tonometría se usa en atención primaria mediante dos métodos de cuantificación: la indentación con el tonómetro de Schiotz y la tonometría de aplanación (tonómetro de Perkins y tonometría de no contacto).
Tratamiento
La mayoría de los pacientes con GPAA diagnosticados tempranamente en su curso evolutivo y que reciben un tratamiento adecuado tienen una buena evolución. El tratamiento principal es farmacológico y debe ir dirigido fundamentalmente a mejorar la irrigación arterial de la papila óptica mediante la disminución de la presión intraocular y aumento del flujo sanguíneo.
Los pacientes que se administran hipotensores tópicos deben aprender a realizar el cierre pasivo de los párpados con oclusión del punto lagrimal para reducir la absorción sistémica y los efectos secundarios asociados.
Los efectos colaterales de los bloqueadores beta tópicos (timolol, carteolol, levobunolol, etc.) comprenden broncospasmo y falta de aliento (que los pacientes atribuyen con frecuencia a sobreesfuerzos), depresión y fatiga (que muchos pacientes achacan a su edad), confusión, impotencia, caída de cabello, hipoacusia y bradicardia.
Los agonistas adrenérgicos no selectivos tópicos (dipivefrina) presentan una alta incidencia de reacciones tóxicas o alérgicas y en muchos pacientes no consiguen reducir la presión intraocular aunque, no obstante, pueden ser beneficiosos en ciertos pacientes. Los agonistas adrenérgicos a-2 selectivos (apraclonidina y brimonidina) bajan eficazmente la presión intraocular, aunque, debido a la alta frecuencia de reacciones alérgicas y de taquifilaxia, la apraclonidina parece más útil en la prevención de las elevaciones de presión intraocular posláser y posquirúrgicas y al control tensional a corto plazo, más que para tratamientos prolongados. Las reacciones alérgicas y la taquifilaxia parecen menos frecuentes con la brimonidina, aunque algunos pacientes pueden presentar sequedad de boca.
Los agonistas colinérgicos tópicos (acetilcolina, pilocarpina) siguen siendo una opción excelente en ciertos pacientes, como los seudoafáquicos, en los que ni la miosis ni la catarata son ya un problema. Los inhibidores de la anhidrasa carbónica orales (acetazolamida) son muy eficaces en la reducción de la presión intraocular, pero sus frecuentes efectos secundarios (como fatiga, anorexia, depresión, parestesias, alteraciones electrolíticas en plasma, litiasis renal o discrasias sanguíneas) limitan su empleo. Algunos pacientes que reciben inhibidores tópicos de la anhidrasa carbónica se quejan de sabor amargo tras la instilación de las gotas.
Los análogos de prostaglandinas tópicos (latanoprost, travoprost, bimatoprost) reducen eficazmente la presión intraocular durante 24 h con una única aplicación diaria. Parecen ser bien tolerados y presentan pocos efectos sistémicos. El principal efecto secundario ocular es el aumento de la pigmentación del iris, especialmente en los iris de color verdoso y un enrojecimiento ocular.
Si a pesar de combinar varios tipos de colirios no se consigue controlar la presión intraocular, se intenta abrir una vía de drenaje artificial, primero mediante una trabeculoplastia con láser y, si ésta no fuera eficaz, con trabeculectomía quirúrgica que es mucho más eficaz.
Glaucoma por cierre angular
El glaucoma por cierre angular es el asociado a un ángulo iridocorneal cerrado. Puede ser primario, por bloqueo pupilar, o secundario, debido a tracción del iris hacia el ángulo o a lesiones que empujan el iris hacia delante. Las dos situaciones más frecuentes en las que el iris es arrastrado hacia el ángulo son el glaucoma neovascular en pacientes con diabetes u oclusión de la vena central de la retina y los precipitados inflamatorios que provocan sinequias anteriores del iris en el ángulo. Hay muchas etiologías posibles que pueden empujar el iris hacia delante y producir cierre angular, siendo la más frecuente el bloqueo pupilar primario, sobre el que se centrará el resto de este apartado.
La prevalencia de glaucoma primario por cierre angular difiere según el grupo étnico o racial. Es muy frecuente entre los esquimales y los asiáticos. El cierre angular primario es más común en las mujeres, los hipermétropes y los ancianos, así como en pacientes con historia familiar de glaucoma de ángulo cerrado.
Durante el envejecimiento normal, el cristalino se vuelve más grueso, produciendo una mayor aposición con el borde pupilar. En los ojos anatómicamente predispuestos, este fenómeno puede impedir el flujo del humor acuoso desde la cámara posterior hacia la anterior, lo que origina un aumento de presión en la cámara posterior. Esta diferencia de presión provoca que el iris periférico se abombe hacia delante, obstruyendo el ángulo y causando cierre angular. El ángulo se puede ocluir parcial o intermitentemente, lo que puede provocar glaucoma por cierre angular intermitente, subagudo o crónico. Además, el ángulo puede quedar bloqueado completamente de forma brusca, lo que desencadena un glaucoma agudo. La raza y ciertas características anatómicas del ojo determinarán quién desarrollará glaucoma por cierre angular agudo o crónico.
La mayoría de las personas predispuestas al glaucoma por cierre angular agudo, crónico, subagudo o intermitente no tienen signos ni síntomas. No obstante, algunos pueden presentar signos sutiles, como enrojecimiento ocular, dolor, visión borrosa o cefalea. En ocasiones, estas molestias oculares mejoran al dormir, quizá debido a la miosis inducida por el sueño, que puede resolver un ataque intermitente o subagudo de glaucoma.
Los síntomas de glaucoma agudo por cierre angular son por lo general evidentes: dolor ocular intenso, hiperemia, descenso de visión, visión de halos coloreados, cefalea, náuseas y vómitos. Los pacientes que acuden a urgencias con un ataque de glaucoma agudo a veces son diagnosticados erróneamente, atribuyéndose sus síntomas a problemas neurológicos o gastrointestinales. La exploración de un paciente con glaucoma agudo revela la presencia de lagrimeo, edema palpebral, inyección conjuntival, velamiento corneal, pupila fija en semimidriasis y con frecuencia una inflamación leve en cámara anterior. Puede ser complicado realizar la gonioscopia a causa de la opacificación corneal aunque, no obstante, la exploración del otro ojo mostrará un ángulo estrecho susceptible de ocluirse. Si el ojo contralateral presenta un ángulo completamente abierto, deben considerarse otros diagnósticos en vez de glaucoma por cierre angular.
Tratamiento
El tratamiento de un ataque agudo de glaucoma se debe iniciar inmediatamente, porque puede instaurarse con rapidez una pérdida de visión definitiva. El tratamiento inicial es farmacológico con bloqueadores beta tópicos, hiperosmóticos, inhibidores de la anhidrasa carbónica tópicos y agonistas a-2 adrenérgicos selectivos. A continuación se añade pilocarpina al 1-2% dos veces, con 15 min de intervalo. Los mióticos no suelen ser efectivos si la presión intraocular es mayor de 40-50 mmHg, debido a anoxia del esfínter pupilar.
La iridotomía periférica con láser es el tratamiento definitivo del glaucoma agudo y como el otro ojo tiene un riesgo del 80% de desarrollar un ataque de glaucoma agudo, debe realizarse una iridotomía profiláctica en ese ojo.
El tratamiento definitivo en pacientes con glaucoma por cierre angular intermitente, subagudo o crónico también es la iridotomía periférica con láser. Además, debe realizarse una iridotomía periférica en pacientes en los que se detecte un ángulo potencialmente ocluible mediante gonioscopia, incluso en ausencia de síntomas, para prevenir el glaucoma por cierre angular. El riesgo de complicaciones de la iridotomía periférica con láser es extremadamente bajo en comparación con sus efectos beneficiosos. Es posible que se presente diplopía, que puede ser molesta si la iridotomía no se hace suficientemente periférica como para que la cubra el párpado superior.
Conclusiones
* Los medicamentos de elección para el tratamiento de todos los tipos de glaucoma son los bloqueadores beta usados en combinación con otros hipotensores oculares por su excelente eficacia para el control de la presión intraocular.
* El objetivo de la terapia farmacológica es el tratamiento hipotensor preventivo y paliativo de una enfermedad que se prolongará durante toda la vida. Una de las mayores dificultades consiste en conseguir mantener el cumplimiento de la terapia por parte de los pacientes, debido a la falta de síntomas de la enfermedad y a la presencia de importantes efectos secundarios oculares y sistémicos de la mayoría de los hipotensores.
* Como profesionales sanitarios, los farmacéuticos pueden conseguir que los pacientes presenten una buena adherencia al tratamiento mediante una adecuada exposición de las características de la enfermedad al paciente (que debe comprender que se trata de una enfermedad crónica e irreversible) y un adecuado y riguroso seguimiento farmacoterapéutico.
Bibliografía general
Berkow R. The Merck Manual. 11th ed. London: 2000.
Fauci AS, et al. Harrison; Principios de Medicina Interna. 15ª ed. Madrid: Interamericana, 2002.
Flórez J, Armijo JA, Mediavilla A. Farmacología humana. 3ª ed. Barcelona: Masson, 1997.
Pineda A, Quesada E. Glaucoma. Guías clínicas 2002. Fisterra.com
Catálogo General de Especialidades Farmacéuticas del Consejo General de COF, 2003.
Método DÁDER. Guía de seguimiento farmacoterapéutico. Grupo de investigación en Atención Farmacéutica. Universidad de Granada, 2003.