El término glaucoma designa a un grupo fisiopatológicamente heterogéneo de enfermedades oculares que se caracterizan por un aumento de la presión intraocular que finalmente conduce a la lesión del nervio óptico y a la ceguera. El glaucoma constituye una de las primeras causas de ceguera en el mundo por lo que tiene una importancia relevante establecer un diagnóstico oportuno. Según la OMS, alrededor de 4,5-5 millones de personas están afectadas de ceguera a causa de glaucoma.
La prevalencia del glaucoma aumenta con la edad, desde un 2,4% en personas mayores de 40 a más del 7% en personas por encima de los 75 años. El objetivo fundamental del tratamiento de esta enfermedad es evitar la progresión de la neuropatía óptica glaucomatosa y, por tanto, la discapacidad visual. El tratamiento farmacológico está dirigido básicamente a disminuir la producción de humor acuoso en el epitelio ciliar y a aumentar su evacuación por la vía uveoescleral o por la vía trabecular.
ANATOMÍA DEL OJO Y DRENAJE DEL HUMOS ACUOSO
El ojo se divide en dos segmentos: anterior y posterior. El segmento anterior está formado por las siguientes estructuras: córnea, limbo, cámaras anterior y posterior, red trabecular, canal de Schlemm, iris, cristalino, zónulas y cuerpo ciliar. El segmento posterior comprende: humor vítreo, retina, coroides, esclerótica y nervio óptico.
La córnea es un tejido transparente y avascular, dividido en cinco capas: epitelio, membrana de Bowman, estroma, membrana de Descemet y endotelio. El epitelio, que constituye una importante barrera frente a agentes extraños (incluso fármacos), yace en una membrana basal adyacente a la membrana de Bowman, una capa de fibras de colágeno. El estroma, que representa alrededor del 90% del grosor corneal, es una capa hidrófila con láminas de colágeno sintetizadas por queratinocitos. Por debajo del estroma se encuentra la membrana de Descemet, la membrana basal del endotelio corneal. En un plano posterior se sitúa el endotelio, una monocapa de células adheridas entre sí por medio de uniones estrechas. Estas células conservan la integridad corneal mediante procesos de transporte activo y sirven de barrera hidrófoba. Por tanto, la absorción de fármacos a través de la córnea requiere la penetración de éstos a través de dominios trilaminares hidrófobo-hidrófilo-hidrófobo de las diversas capas anatómicas.
En la periferia de la córnea y adyacente a la esclerótica se encuentra el limbo, una zona de transición de 1-2 mm de ancho. El limbo incluye el epitelio conjuntival que contiene las células madre, la cápsula de Tenon, la epiesclera, el estroma corneoescleral, el canal de Schlemm y la red trabecular. Los vasos sanguíneos del limbo, así como las lágrimas, proporcionan nutrientes y un mecanismo de defensa inmunitario para la córnea. La cámara anterior contiene aproximadamente unos 250 µl de humor acuoso. El ángulo de la cámara anterior periférica está formado por la córnea y la raíz del iris. La red trabecular y el canal de Schlemm están situados por encima del vértice de este ángulo. La cámara posterior, que contiene alrededor de 50 µl de humor acuoso, está definida por los límites de los procesos del cuerpo ciliar, la superficie posterior del iris y la superficie del cristalino.
El humor acuoso es una solución incolora con una fisiología compleja que regula su composición y su dinámica. Entre sus funciones destacan sus propiedades ópticas; el establecimiento de la presión intraocular; la conservación de su propia transparencia; el intercambio de metabolitos con córnea, cristalino y humor vítreo, y la eliminación de restos hemáticos y productos de inflamación. El humor acuoso se secreta por los procesos ciliares, que están formados por una densa red capilar, un estroma conectivo y una doble barrera epitelial que los separa de la cámara posterior. El humor acuoso fluye desde la cámara posterior hacia la cámara anterior a través de la pupila, y la abandona de forma pasiva por una de las siguientes vías de drenaje:
Vía convencional o trabecular. A través del tejido trabecular difunde hacia el canal de Schlemm y, posteriormente, hacia el plexo venoso epiescleral y la circulación general. Esta vía convencional explica el flujo mayoritario (80-95%) de salida del humor acuoso y es la diana principal de fármacos colinérgicos que actualmente se utilizan en el tratamiento del glaucoma.
Vía uveoescleral, extracanalicular o no convencional. El humor acuoso fluye a través de los músculos ciliares y hacia el espacio supracoroideo. Esta vía no convencional explica el flujo minoritario de salida del humor acuoso y es la diana de prostanoides selectivos utilizados en el tratamiento del glaucoma.
El flujo del humor acuoso no es constante y experimenta, dentro de unos límites estrechos, variaciones horarias, diarias y en función del ciclo vital. Diversos factores están involucrados en la regulación de su dinámica, como el sistema nervioso central, el sistema nervioso autónomo, influencias hormonales, el sistema vascular y la propia actividad metabólica. Los procesos ciliares poseen inervación simpática y parasimpática en el estroma y en su sistema vascular. Existe una inervación similar en las células del tejido trabecular. Por tanto, el sistema autónomo puede actuar sobre la dinámica del humor acuoso a diferentes niveles de forma simultánea.
FORMAS DE GLAUCOMA
El glaucoma es una neuropatía óptica que se caracteriza por alteraciones de la presión intraocular que producen un daño irreversible en las fibras del nervio óptico con pérdida gradual de la visión.
Entre los factores de riesgo relacionados con el daño glaucomatoso del nervio destacan el aumento de la presión intraocular, antecedente familiar positivo de glaucoma, miopía e hipertensión. Aunque la presión intraocular no es un indicador preciso de enfermedad, la presión intraocular elevada es un factor de riesgo de glaucoma. La disminución de la presión intraocular puede retardar el daño glaucomatoso del nervio óptico o del campo visual. Una presión intraocular notablemente elevada (mayores de 30 mmHg) suele causar daño del nervio óptico, no obstante algunos pacientes parecen tolerar presiones intraoculares entre 25 y 30 mmHg; estos enfermos se denominan hipertensos oculares. Otros pacientes presentan daño glaucomatoso progresivo del nervio óptico a pesar de presentar presiones intraoculares dentro del margen normal. Una disminución del 30% de la presión intraocular reduce el avance de la enfermedad en un 10-35%, incluso en pacientes con glaucoma de tensión normal.
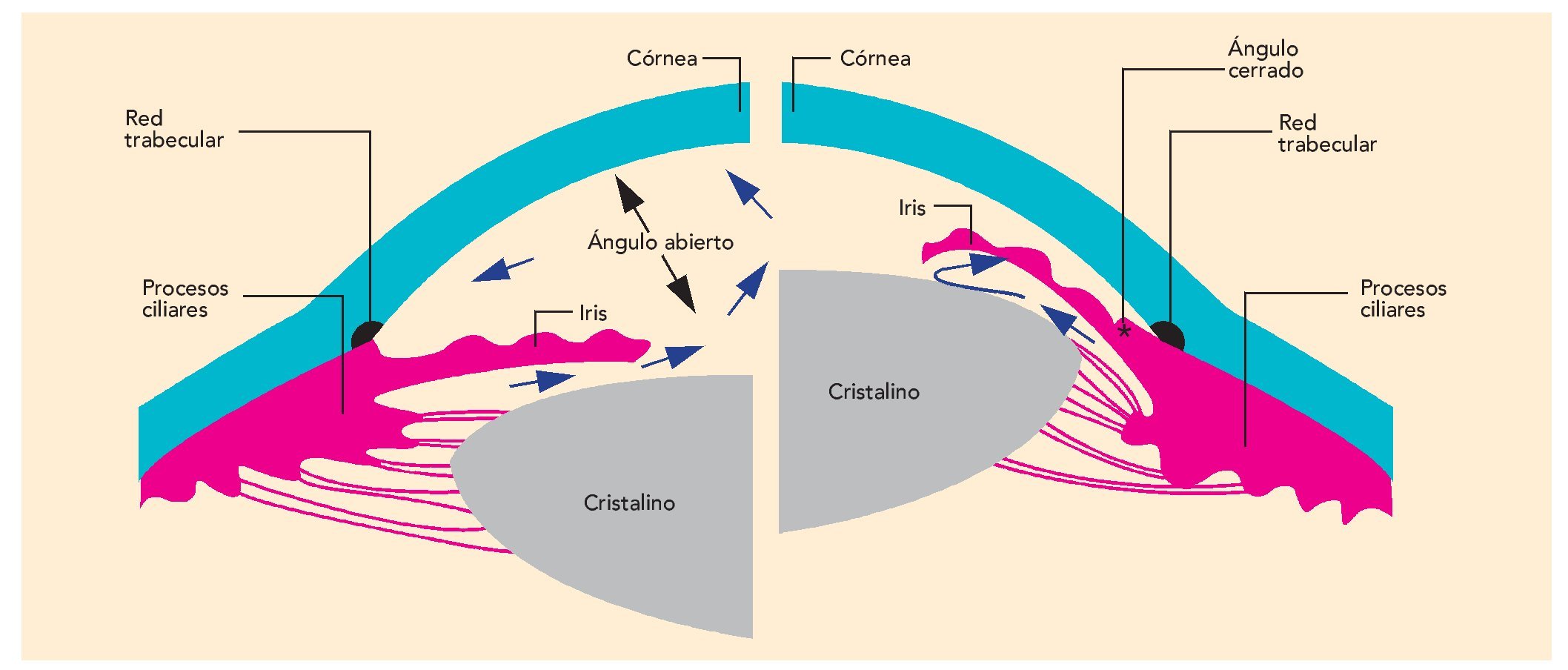
La cámara anterior periférica permite diferenciar dos formas de glaucoma: de ángulo abierto, la más frecuente, y de ángulo cerrado (fig. 1). Cada subgrupo se divide en primario, cuando la cámara anterior y el ojo son normales y no hay una causa aparente de glaucoma; y secundario, si el glaucoma es causado por condiciones oculares o sistémicas subyacentes.
Fig. 1. Glaucoma de ángulo abierto y ángulo cerrado.
GLAUCOMA DE ÁNGULO ABIERTO
El glaucoma de ángulo abierto se presenta por defecto del sistema de drenaje del ángulo de la cámara anterior del ojo, que impide el flujo de salida del humor acuoso con el aumento de la presión intraocular. Teniendo en cuenta que los problemas en la evacuación se encuentran en la red trabecular y el canal de Schlemn, cabe esperar que estas estructuras sean la diana principal del tratamiento farmacológico. El glaucoma primario de ángulo abierto se ha dividido a su vez en glaucoma crónico de ángulo abierto, que se presenta en personas mayores de 40 años, y glaucoma de ángulo abierto juvenil, cuya edad de aparición está entre los 3 años y la tercera década de la vida.
El glaucoma de ángulo abierto es la forma más común de la enfermedad. Se caracteriza por un comienzo insidioso y progresivo, que durante el período inicial suele ser asintomático, por lo que el diagnóstico se suele establecer tardíamente cuando ya se han producido lesiones irreversibles del disco óptico y alteraciones del campo visual. El evento patológico crucial del glaucoma primario de ángulo abierto es la muerte de las células ganglionares, por diversas causas como insuficiencia nutricional, toxicidad intrínseca de moléculas que afectan a neuronas y vasos, apoptosis por disminución de la estimulación neurotrófica y contribución genética.
GLAUCOMA DE ÁNGULO CERRADO
El glaucoma de ángulo cerrado se puede presentar en ojos anatómicamente predispuestos que poseen un ángulo estrecho entre el iris y la córnea (ángulo de la cámara anterior). El ataque agudo se puede desencadenar por la administración de fármacos anticolinérgicos, simpaticomiméticos o antihistamínicos, que pueden originar dilatación parcial de la pupila y un cambio en los vectores de fuerza entre el iris y el cristalino. Esta situación puede provocar un bloqueo del paso del humor acuoso de la cámara posterior a la anterior a través de la pupila (bloqueo pupilar). El cambio de la relación cristalino-iris origina un aumento de la presión en la cámara posterior, la cual comprime la base del iris contra la pared del ángulo, de forma que el ángulo de filtración se cierra y la presión intraocular aumenta notablemente. El contacto prolongado del iris periférico con la red trabecular puede generar adherencias, sinequias anteriores periféricas y daño funcional de la red trabecular. La presión intraocular se ejerce sobre todas las paredes del globo ocular, incluyendo el nervio óptico (disco óptico) y los vasos que lo nutren. El aumento de la presión intraocular interfiere con la perfusión del nervio óptico, y por tanto, se produce un daño irreversible en esta vía nerviosa. Un ataque agudo de glaucoma de ángulo cerrado conlleva un alto riesgo de pérdida de visión si no se instaura el tratamiento oportuno. Por consiguiente, un episodio de glaucoma de ángulo cerrado constituye una urgencia oftalmológica.
TRATAMIENTO FARMACOLÓGICO DEL GLAUCOMA
La Sociedad Europea de Glaucoma recomienda que la diana terapéutica para el control de la presión intraocular se establezca en función del grado preexistente de lesión del nervio óptico, de la edad del paciente, la velocidad de la progresión y el nivel basal de la presión intraocular antes del tratamiento. Se contemplan dos enfoques para la reducción farmacológica de la presión intraocular:
Reducción de la producción de humor acuoso, mediante: bloqueadores b, inhibidores de la anhidrasa carbónica o simpaticomiméticos.
Aumento del drenaje del humor acuoso, con la utilización de colinérgicos/parasimpaticomiméticos y derivados de prostaglandinas (red trabecular), simpaticomiméticos (flujo de salida uveoescleral) o derivados de prostaglandina (flujo de salida uveoescleral).
Las ventajas de la mejora de drenaje del humor acuoso son las siguientes: corregir el déficit del flujo de salida que es la principal causa de una presión intraocular elevada, mejorar la protección frente a las fluctuaciones y picos peligrosos en la presión intraocular, mantener la producción fisiológica del humor acuoso y preservar sus funciones (p. ej., nutrición de la lente y la córnea y eliminación de productos metabólicos de desecho).
De acuerdo con las directrices de la Sociedad Europea de Glaucoma, los análogos de prostaglandina PGF2a, los bloqueadores a, agonistas a2, y los inhibidores de la anhidrasa carbónica de administración tópica son los fármacos de primera elección.
ENTRE LOS FACTORES DE RIESGO RELACIONADOS CON EL DAÑO GLAUCOMATOSO DEL NERVIO DESTACAN EL AUMENTO DE LA PRESIÓN INTRAOCULAR, ANTECEDENTE FAMILIAR POSITIVO DE GLAUCOMA, MIOPÍA E HIPERTENSIÓN
ANÁLOGOS DE LA PROSTAGLANDINA PGF2a
Los análogos de prostaglandina PGF2a de administración tópica se encuentran entre los fármacos más eficaces para reducir la presión intraocular, con un efecto en la disminución de hasta un 33%. Presentan una serie de ventajas frente a los bloqueadores b tópicos: requieren una sola aplicación al día, generalmente por la noche; reducen la presión intraocular a través de una mejora en el flujo de salida del humor acuoso (uveoescleral y trabecular); producen un efecto prolongado en la disminución de la presión intraocular que puede durar hasta 48 h, y la incidencia de reacciones adversas sistémicas es muy baja.
Entre los análogos de la prostaglandina PGF2a se encuentran latanoprost, tavoprost y bimatoprost. La propia prostaglandina PGF2a disminuye la presión intraocular pero tiene la desventaja de provocar reacciones locales intolerables. Las modificaciones de la estructura de la PGF2a han dado lugar a análogos con un perfil de reacciones adversas más aceptable. La PGF2a y sus análogos (profármacos que por acción de las esterasas de la córnea se hidrolizan a PGF2a) se unen a receptores FP acoplados a proteína Gq11 y con ello a la vía fosfolipasa C-trifosfato de inositol (IP3)-Ca2+. Esta vía es activa en células de músculo ciliar humano aisladas. Otras células del ojo también pueden expresar receptores FP. La disminución de la presión intraocular por la PGF2a se explica por una alteración de la tensión del músculo ciliar e incluso por la liberación de metaloproteasas de matriz y la digestión de materiales de la matriz extracelular que pueden obstruir las vías de flujo.
Hasta el 50% de las personas tratadas con análogos de prostaglandinas desarrollan hiperpigmentación iridial irreversible. Se debe, además, advertir del riesgo de aumento en el crecimiento de las pestañas. El riesgo de edema macular quístico (depósito de agua en el centro de la retina que afecta a la agudeza visual central) debido al tratamiento es de magnitud incierta, según los datos actuales. Si el edema macular se desarrolla durante el tratamiento, éste se debe interrumpir.
BLOQUEADORES b
En la actualidad, los antagonistas b-adrenérgicos son el siguiente tratamiento farmacológico de administración tópica más frecuente. La reducción de la presión intraocular con estos fármacos es del 20-25% sobre el nivel basal. Hay dos clases de bloqueadores b tópicos. Entre los no selectivos, que se unen tanto a receptores b1 como b2, se encuentran el timolol, el levobunolol, y el carteolol. Existe un antagonista selectivo b1, el betaxolol, disponible para uso oftálmico, pero es menos eficaz que los bloqueadores b no selectivos, ya que los receptores b del ojo son en gran parte del subtipo b2. Sin embargo, debido a que los receptores b1 se encuentran preferentemente en el corazón, en tanto que los b2 se hallan en los pulmones, es menos probable que el betaxolol cause dificultades respiratorias. En el ojo, los tejidos diana son el epitelio del cuerpo ciliar y vasos sanguíneos, en tanto que los receptores b2 constituyen el 75-90% de la población total. No se conoce con certeza la forma en que el bloqueo b disminuye la producción acuosa y reduce la presión intraocular. Al parecer se activa la producción de humor acuoso por una vía AMPc-PKA (adenosín monofosfato cíclico-proteína cinasa A) mediada por receptor b; el bloqueo b amortigua la actividad adrenérgica de esta vía previniendo la estimulación del receptor b por catecolaminas y disminuyendo, en consecuencia, el AMPc intracelular. Otra hipótesis es que los bloqueadores b disminuyen el flujo sanguíneo ocular, lo que reduce la ultrafiltración que causa la producción acuosa.
Entre las contraindicaciones en el uso de bloqueadores b tópicos se incluyen bradicardia sinusal, bloqueo atrioventricular de grado II/III, insuficiencia cardíaca congestiva, asma bronquial y enfermedad pulmonar obstructiva crónica (EPOC). Con el fin de minimizar la reabsorción sistémica del fármaco a través de la mucosa nasal, el conducto lacrimal debe ser comprimido manualmente tras la instilación de las gotas en el ojo.
El tratamiento con bloqueadores b tópicos provoca a menudo un empeoramiento local debido a síntomas de sequedad. La indicación de los bloqueadores b tópicos en los niños pequeños y en las mujeres embarazadas debe ser considerada con precaución, así como en madres lactantes, ya que el fármaco se puede acumular en la leche materna.
Hay preparados combinados de análogo de prostaglandina y bloqueador b (latanoprost + timolol; travoprost + timolol; bimatoprost + timolol), colirios en solución que se aplican una vez al día, por la mañana, cuando la producción del humor acuoso se encuentra en su nivel más alto.
AGONISTAS a
Cuando los análogos de la prostaglandina o los bloqueadores b están contraindicados, puede utilizarse como terapéutica de primera línea un agonista a2-adrenérgico por vía tópica. Pueden disminuir la presión intraocular hasta en un 27%. Los agonistas a2 adrenérgicos mejoran el perfil farmacológico del fármaco simpaticomimético no selectivo adrenalina y su derivado, dipivefrina. La adrenalina estimula receptores adrenérgicos a y b. Al parecer, reduce la presión intraocular mejorando las vías de flujo de salida convencionales (a través de un mecanismo del receptor b2) y del flujo uveoescleral (tal vez por producción de prostaglandina) del ojo. Aunque la adrenalina resulta eficaz, no se tolera bien ya que produce irritación e hiperemia locales. La dipivefrina es un profármaco de la adrenalina que sufre hidrólisis por las esterasas de la córnea. Se tolera mucho mejor, pero aún así tiende a producir reacciones adversas similares a la adrenalina. El agonista a2 clonidina resulta eficaz para disminuir la presión intraocular, sin embargo, atraviesa fácilmente la barrera hematoencefálica y produce hipotensión sistémica; por esta razón ya no se utiliza en el tratamiento del glaucoma. En cambio, la apraclonidina es un agonista a2 adrenérgico relativamente selectivo que se ioniza a pH fisiológico y, por tanto, no cruza la barrera hematoencefálica. La brimonidina es un agonista a2 adrenérgico lipófilo que atraviesa fácilmente la barrera hematoencefálica. Tanto la apraclonidina como la brimonidina disminuyen la producción acuosa y pueden mejorar el flujo de salida uveoescleral. Al parecer, ambos fármacos se unen a receptores a2 pre- y postsinápticos. Mediante la unión a receptores a2 presinápticos, el fármaco disminuye la liberación de neurotransmisor, y por ello disminuye la presión intraocular. Con la unión a receptores a2 postsinápticos se estimula la vía G1 al reducir la producción celular de AMPc y disminuir así la producción de humor acuoso.
Los agonistas a2 adrenérgicos están contraindicados en niños de hasta 8 años de edad debido a su potencial efecto sedante central. Se acumulan en la leche materna y, por tanto, no deben administrarse a mujeres embarazadas y madres lactantes.
EL GLAUCOMA DE ÁNGULO ABIERTO SUELE SER ASINTOMÁTICO EN EL PERÍODO INICIAL, POR LO QUE EL DIAGNÓSTICO SE SUELE ESTABLECER TARDÍAMENTE CUANDO YA SE HAN PRODUCIDO LESIONES IRREVERSIBLES DEL DISCO ÓPTICO Y ALTERACIONES DEL CAMPO VISUAL
PARASIMPATICOMIMÉTICOS (MIÓTICOS)
Históricamente, los fármacos mióticos de administración tópica han tenido una gran importancia en el tratamiento del glaucoma, pero en la actualidad no son de uso frecuente. Por ejemplo, la pilocarpina, que se ha utilizado desde 1870 para reducir la presión intraocular, está disponible en concentraciones que oscilan desde el 0,5 al 6%, y provoca una disminución de la presión intraocular de un 20%. Los mióticos disminuyen la presión intraocular al producir contracción del músculo ciliar por inducción muscarínica, lo que facilita el flujo acuoso. No afectan a la producción de líquido. Ejercen una acción directa sobre la porción longitudinal del músculo ciliar, desplazando el espolón escleral y el trabéculo filtrante, mejorando la facilidad de salida del humor acuoso por el canal de Schlemm (vía convencional). Actualmente, estos fármacos no tienen otras indicaciones que las del glaucoma de ángulo cerrado o el síndrome del iris plateau, en los que sirven para mantener abierta la red trabecular. Se utilizan para inmovilizar el iris en el glaucoma pigmentario de dispersión y el glaucoma de pseudoexfoliación, lo que reduce la liberación de pigmento y la pseudoexfoliación, respectivamente, además de mejorar el drenaje del humor acuoso a través de la red trabecular. La miosis inducida puede, sin embargo, causar espasmos dolorosos del cuerpo ciliar. Por otra parte, la contracción del músculo ciliar puede inducir miopía de hasta unas 8 dioptrías. La miosis también puede dar lugar a una deficiencia visual marcada, sobre todo con poca luz y en presencia de una catarata. Los mióticos están disponibles en forma de preparados combinados, sobre todo con bloqueadores b.
INHIBIDORES DE LA ANHIDRASA CARBÓNICA
Los inhibidores de la anhidrasa carbónica de administración tópica tienen un buen perfil de reacciones adversas. La dorzolamida y la brinzolamida inhiben la anhidrasa carbónica que se encuentra en el epitelio del cuerpo ciliar, disminuyendo así la formación de iones bicarbonato, y por tanto reduciendo el transporte de líquidos y, como consecuencia la presión intraocular. Reducen la presión intraocular en un 20-25%. Están disponibles en combinaciones fijas con bloqueadores b (brinzolamida + timolol), así como en formulaciones libres de conservantes.
Cuando el tratamiento tópico combinado no produce la presión intraocular deseada, no detiene el daño glaucomatoso del nervio óptico o no es tolerado, se puede acudir a la terapéutica sistémica con inhibidores de la anhidrasa carbónica, antes de recurrir a un tratamiento quirúrgico (por vía oral o intravenosa sólo en casos de presión intraocular elevada de forma aguda). El preparado oral que mejor se tolera es la acetazolamida en cápsulas de liberación sostenida, seguida de la metazolamida. La dosis y duración del tratamiento se ven limitados por los efectos secundarios del fármaco: alteraciones electrolíticas (reposición de potasio), parestesias, confusión, fatiga, cálculos renales, problemas circulatorios, náuseas, diarrea y un sabor amargo.
Los inhibidores de la anhidrasa carbónica, tanto tópicos como sistémicos, no se deben administrar a personas alérgicas a las sulfonamidas. Estos fármacos no producen ningún efecto adicional cuando se administran en combinación con inhibidores sistémicos. Por ello, la administración simultánea, tópica y sistémica, no se recomienda.
AGENTES HIPEROSMOLARES
La administración intravenosa de un agente hiperosmolar (manitol) se reserva para el tratamiento de emergencia a corto plazo, por ejemplo, en un ataque agudo de glaucoma con presión intraocular extremadamente elevada.
TRATAMIENTO DEL GLAUCOMA EN PERSONAS NORMOTENSAS
Actualmente, se encuentran en debate diversos tratamientos para el glaucoma con uso potencial en personas con presión intraocular normal. Los estudios realizados hasta la fecha, sin embargo, no proporcionan una evidencia elevada que apoye su uso. Entre los tratamientos recomendados se encuentran la administración de dosis bajas de antagonistas del calcio (nimodipino, nifedipino) a personas con manifestaciones vasoespásticas y de dosis bajas de mineralocorticoides (fludrocortisona) a personas con hipotensión arterial marcada. Agentes neuroprotectores, como por ejemplo los antagonistas del receptor de glutamato, aún no han mostrado eficacia en el glaucoma.
TRATAMIENTO DEL GLAUCOMA DE ÁNGULO CERRADO
El tratamiento preferente en el glaucoma de ángulo cerrado es la iridectomía quirúrgica por medio de láser o mediante incisión, aunque también se requiere tratamiento farmacológico a corto plazo para romper el bloqueo pupilar, disminuir la presión intraocular y el edema corneal y limpiar la córnea antes de la intervención quirúrgica. Quizá sea necesario disminuir la presión intraocular a largo plazo, sobre todo si el iris periférico ha cubierto permanentemente la red trabecular.
TERAPIA COMBINADA
Para muchas personas, el tratamiento con un solo fármaco no es suficiente para reducir la presión intraocular, y el régimen de tratamiento incluye dos, tres o más fármacos con diversos mecanismos de acción. El número y uso de combinaciones fijas para el tratamiento del glaucoma ha crecido sustancialmente en los últimos años. Estas combinaciones contienen dos fármacos en un mismo envase y ofrecen grandes ventajas: conveniencia en la administración, mayor adherencia al tratamiento y mejora en la seguridad del paciente por una menor exposición diaria a conservantes. La adherencia al tratamiento es una preocupación importante ya que alrededor de hasta un 80% de personas con glaucoma pueden eludir la administración de alguna dosis de la medicación por la inconveniencia asociada a la instilación de las gotas de la solución oftálmica.
NUEVAS PERSPECTIVAS
La mayoría de los fármacos que se han utilizado o que se utilizan actualmente ejercen sus efectos sobre la producción del humor acuoso (bloqueadores b), sobre el músculo ciliar (colinérgicos) o sobre la vía uveoescleral (análogos de prostaglandinas), y prácticamente ninguno ejerce efectos específicos sobre la vía trabecular.
Hasta hace unos años, la red trabecular era un tejido considerado como un mero filtro pasivo del humor acuoso sin ninguna participación en la regulación de su evacuación. Sin embargo, en los últimos años se ha demostrado que esa red modula activamente el flujo de evacuación del humor acuoso hacia el canal de Schelmn. Las células de este tejido poseen receptores que responden a numerosas sustancias presentes en el humor acuoso (bradiquinina, endotelina), secretadas por la inervación periférica (VIP, CGRP, acetilcolina, noradrenalina) o secretadas en diferentes tejidos (epitelio ciliar, iris, endotelio de la córnea...) o por las mismas células trabeculares de forma paracrina (PGE2, ATP). Además, la contracción y relajación de las células trabeculares o los cambios de volumen celular modifican la evacuación del humor acuoso. Se han caracterizado algunos de los canales iónicos de las células trabeculares, como el canal de potasio de alta conductancia (BKCa) que puede ser modulado por el calcio intracelular, el óxido nítrico, los cannabinoides o la tensión de la membrana; el canal de potasio rectificador de entrada (Kir) que es modulado por el AMPc; o el canal de cloro que se activa por el aumento de volumen celular. Por otro lado, el patrón de expresión de numerosos genes de las células trabeculares se modifica por la hipertensión ocular y el volumen celular.
El mejor entendimiento de la fisiología de la red trabecular y su relación con la fisiopatología del glaucoma ha conducido al estudio y diseño de nuevos fármacos específicos que podrían aumentar la funcionalidad de la vía trabecular.
BIBLIOGRAfíA GENERAL
Castañeda-Díez R, Mayorquín-Ruiz M, Jiménez-Román J. Glaucoma de ángulo cerrado. Perspectiva actual. Rev Mex oftalmol. 2007;81(5):272-82.
Dietlein TS, Hermann MM, Jordan JF. The medical and surgical treatment of glaucoma. Dtsch Arztebl Int. 2009;106(37):597-606.
Higginbotham EJ. Considerations in glaucoma therapy: fixed combinations versus their component medications. Clin ophthalmol. 2010;4:1-9.