Etravirina: Reacciones cutáneas y de hipersensibilidad graves
Etravirina es un inhibidor de la transcriptasa inversa no análogo de nucleósidos (ITINN) del virus de la inmunodeficiencia humana (VIH-1). Se une directamente a la transcriptasa inversa (TI) y bloquea las actividades de la polimerasa del ADN dependiente del ARN y del ADN mediante el bloqueo de la región catalítica de la enzima.
La inhibición de la TI evita la formación de la cadena de ADN que posteriormente se integrará en el genoma humano.
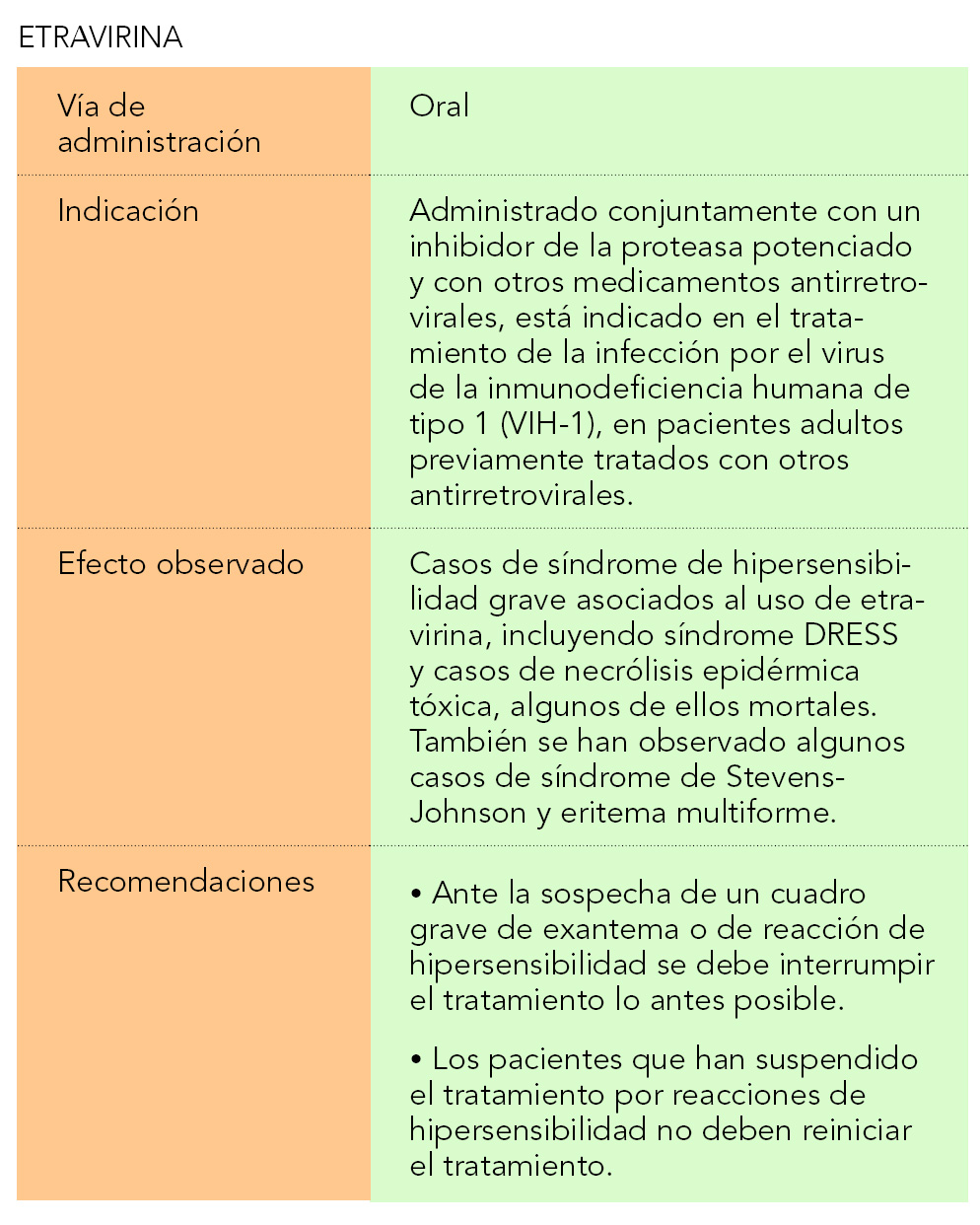
Etravirina está indicado, conjuntamente con un inhibidor de la proteasa potenciado y con otros medicamentos antirretrovirales, en el tratamiento de la infección del VIH-1 en pacientes adultos previamente tratados con antirretrovirales. Fue autorizado en Europa en septiembre de 2008.
Presenta mejoras en cuanto a los efectos adversos neuropsiquiátricos de los ITINN, pero la incidencia de sarpullido ha sido sensiblemente superior que la del grupo control.
Las reacciones adversas notificadas con más frecuencia (incidencia ≥ 10% en el grupo de etravirina) que se dieron en los estudios en fase III (DUET-1 y DUET-2) fueron: exantema (17,0% en el grupo de etravirina y 9,4% en el de placebo), diarrea (15,0% y 20,4%) y náuseas (13,9% y 11,1%). Las tasas de abandonos debidas a alguna reacción adversa fueron del 5,8% en los pacientes tratados en el brazo de etravirina y de 4,5% en los tratados en el grupo control. La reacción adversa al medicamento (RAM) más frecuente que ocasionó el abandono fue el exantema (2,0% en el grupo de etravirina y 0% en el de placebo).
En la ficha técnica ya se advertía sobre el riesgo mayor de desarrollar exantema y otras reacciones cutáneas, pero la mayoría de ellas fueron leves o moderadas y ocurrieron principalmente en la segunda semana de tratamiento.
Recientemente se han notificado casos de síndrome de hipersensibilidad grave asociados al uso de etravirina, incluyendo síndrome de exantema medicamentoso con eosinofilia y síntomas sistémicos (síndrome DRESS) y casos de necrólisis epidérmica tóxica, algunos de ellos mortales. También se han observado algunos casos de síndrome de Stevens-Johnson y eritema multiforme.
Atendiendo a estas notificaciones se ha decidido actualizar la ficha técnica de Intelence. A su vez, la Agencia Española del Medicamento recomienda a los profesionales sanitarios seguir estrictamente las recomendaciones de la ficha técnica y en particular recuerda que:
Ante la sospecha de un cuadro grave de exantema o de reacción de hipersensibilidad se debe interrumpir inmediatamente el tratamiento.
El retraso en la interrupción del tratamiento tras la aparición de erupción grave puede provocar una reacción que ponga en riesgo la vida del paciente.
Los pacientes que han suspendido el tratamiento debido a reacciones de hipersensibilidad no deben reiniciar el tratamiento con etravirina.
Se debe advertir a los pacientes que acudan al médico en el caso de aparición de erupción grave o reacciones de hipersensibilidad.
Contrastes de gadolinio:Fibrosis sistémica nefrogénica
La fibrosis sistémica nefrogénica (FSN), inicialmente conocida como dermopatía fibrosante nefrogénica, fue descrita por primera vez en el año 1997 y después se confirmó y documentó en la literatura científica durante el año 2000 como una enfermedad escleromixedematosa fibrosante que se presentaba en pacientes con afecciones renales.
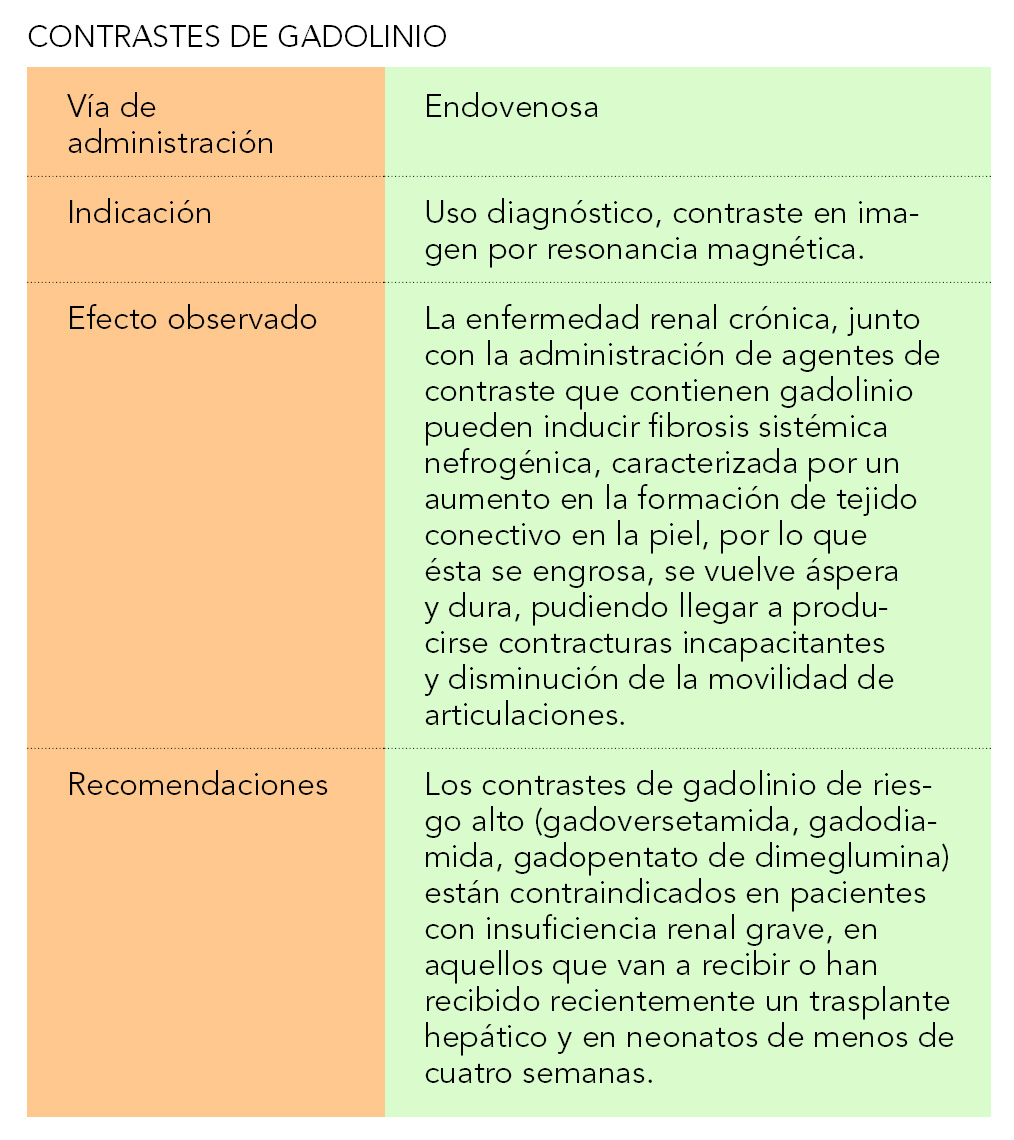
Se caracteriza por un aumento en la formación de tejido conectivo en la piel, por lo que ésta se engrosa, se vuelve áspera y dura, pudiendo llegar a producirse contracturas incapacitantes y disminución de la movilidad de articulaciones. Se desarrolla en un período de días o semanas. La FSN puede tener afectación sistémica de otros órganos, habiéndose estimado que el 5% de los pacientes tienen una evolución rápida, progresiva y fulminante.
El fracaso renal agudo y la enfermedad renal crónica, junto con la administración de agentes de contraste que contienen gadolinio (GD) son los factores de riesgo más importantes que pueden hacer desarrollar la enfermedad.
Los agentes de contraste para resonancia magnética con gadolinio autorizados en España son los siguientes: gadobenato de dimeglumina (Multihance), gadobutrol (Gadovist, Gadograf), gadodiamida (Omniscan), gadofosveset (Vasovist), gadopentetato de dimeglumina (Magnograf, Magnevist), gadoterato de meglumina (Dotarem), gadoteridol (Prohance) y gadoxetato disódico (Primovist).
La mayoría de los casos descritos están relacionados con la administración de gadodiamida, aunque se ha comunicado un número reducido de casos relacionados con la administración de gadopentato de dimeglumina y gadoversetamida (este último no comercializado en España).
En febrero de 2007, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ya informó a los profesionales sanitarios sobre esta asociación, y en coordinación con otras agencias reguladoras europeas, adoptó una serie de medidas para minimizar dicho riesgo hasta tener las conclusiones definitivas. Dichas conclusiones, notificadas en noviembre de 2009, fueron las siguientes:
1. Contrastes de gadolinio de riesgo alto (gadoversetamida, gadodiamida, gadopentato de dimeglumina):
Su uso está contraindicado en pacientes con insuficiencia renal grave, en aquellos que van a recibir o han recibido recientemente un trasplante hepático y en neonatos de menos de cuatro semanas.
La dosis utilizada debe restringirse a la mínima recomendada en pacientes con insuficiencia renal moderada y en niños de hasta un año de edad. Adicionalmente debe respetarse un período de, al menos, una semana entre resonancias.
Como medida de precaución se debe suspender la lactancia materna durante, al menos, 24 horas después de que la paciente haya recibido el contraste de riesgo alto.
Antes de recibir estos contrastes, debe evaluarse en todos los pacientes la posible existencia de alteraciones renales mediante pruebas de laboratorio.
2. Contrastes de gadolinio de riesgo medio (gadofosveset trisódico, ácido gadoxético, gadobenato de dimeglumina) y riesgo bajo (gadoterato de dimeglumina, gadoteridol, gadobutrol):
La dosis utilizada debe restringirse a la mínima recomendada en pacientes con insuficiencia renal grave, pacientes que van a recibir trasplante hepático y neonatos y niños de hasta un año de edad. Adicionalmente debe respetarse un período de, al menos, una semana entre resonancias.
La decisión de continuar o suspender la lactancia materna durante, al menos, 24 horas después de la resonancia debe ser adoptada por la mujer y el médico que la atiende.
Se recomienda que, antes de recibir estos contrastes, se evalúe en estos pacientes la posible existencia de alteraciones renales mediante pruebas de laboratorio.
3. Para todos los contrastes de gadolinio se incluirá en la ficha técnica información referente a:
Advertencias relativas a que los pacientes de edad avanzada pueden tener un riesgo especial de desarrollar FSN, dado que, por las características de su función renal, la eliminación del contraste de gadolinio puede ser más lenta.
No hay evidencia que apoye el uso de la hemodiálisis para prevenir o tratar la FSN en pacientes que no la están recibiendo.
BIBLIOGRAFÍA GENERAL ETRAVIRINA
CGCOF. Catálago de Especialidades Farmacéuticas. Madrid: Publicaciones del Consejo General de Colegios oficiales de Farmacéuticos; 2009.
Comunicación sobre riesgos de medicamentos de la agencia Española de Medicamentos y Productos Sanitarios. Subdirección general de medicamentos de uso humano. ref: 2009/11. 21 de octubre de 2009.
Etravirina en pacientes VIH previamente tratados. informe para la Guía Farmacoterapéutica de Hospitales de andalucía. www.genesis.es Etravirina. Ficha Técnica: Intelence.
Lazzarin A, Campbell T, Clotet B, et al. Efficacy an safety of TMC125 (etravirine) in treatment-experienced Hiv-1 infected patient in DUET-2:24-week results from a randomised, double-blind, placebo-controlled trial. Lancet. 2007; 370:39-48.
Madruga J, Cahn P, Haubrich r, et al. Efficacy and safety of TMC125 (etravirine) in treatment-experienced Hiv-1 infected patients in DUET-1: 24-week results from a randomised, double-blind, placebo-controlled trial. Lancet. 2007;370:29-38.
Micromedex inc. Englewood: Micromedex Healthcare series; 2008.
BIBLIOGRAFÍA GENERAL GADOLINIO
AEMPS. Comunicación sobre riesgos de medicamentos de la agencia Española de Medicamentos y Productos Sanitarios. Subdirección General de Medicamentos de Uso Humano. ref: 2007/03. 8 de febrero de 2007.
AEMPS. Comunicación sobre riesgos de medicamentos de la agencia Española de Medicamentos y Productos Sanitarios. Subdirección general de medicamentos de uso humano. ref: 2009/12. 20 de noviembre de 2009. CGCOF. Catálago de Especialidades Farmacéuticas. Madrid: Consejo General de Colegios oficiales de Farmacéuticos; 2009.
Micromedex inc. Englewood: Micromedex Healthcare series; 2008. ortega lM, Contreras G, lenz o. ¿Dermopatía fibrosante neurogénica o fibrosis sistémica neurogénica? ¿Qué es lo que sabemos y qué debemos aprender? nefrología. 2009;29(2):109-17.