Recepción, control de conformidad y almacenamiento de materias primas
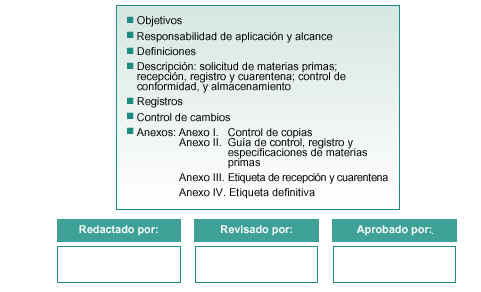
ÍNDICE
OBJETIVO
Se trata de describir los pasos a seguir para una correcta recepción de las materias primas y su aceptación previo control de conformidad, así como establecer un sistema de organización de la zona de la oficina de farmacia o servicio farmacéutico destinada a almacenamiento, que nos permita una localización rápida y fácil, así como un máximo aprovechamiento del espacio respetando las condiciones de conservación.
RESPONSABILIDAD DE APLICACIÓN Y ALCANCE
Recae sobre todo en el personal (farmacéutico, auxiliar) que proceda a la recepción, control de conformidad y almacenamiento de materias primas.
DEFINICIONES
Cuarentena
Situación de las materias primas, de los productos intermedios, a granel o terminados, y de los materiales de acondicionamiento que se encuentran aislados físicamente, o de otra forma efectiva, mientras se toma la decisión de su aprobación o rechazo.
Materia prima
Toda sustancia, activa o inactiva, empleada en la fabricación de un medicamento, ya permanezca inalterada, se modifique o desaparezca en el transcurso del proceso (Ley 25/1990, de 20 de diciembre, del Medicamento, artículo 8, 4).
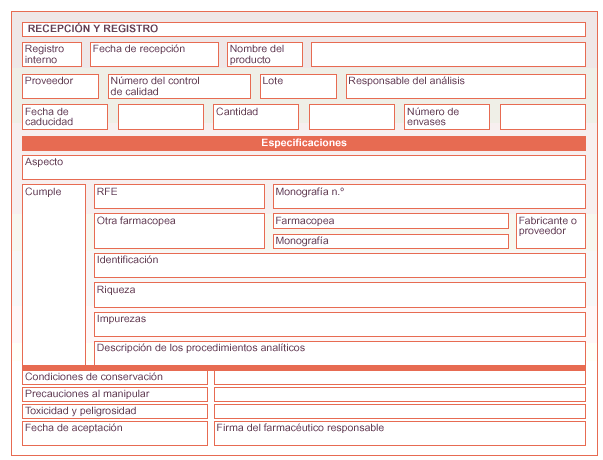
Guía de control, registro y especificaciones de materias primas
Recopilación manual o informática de todos los datos relativos a las materias primas aceptadas por el servicio de farmacia u oficina de farmacia (fig. 1).
Fig. 1. Guía de control, registro y especificaciones de materias primas.
Número de lote
Combinación característica de números, letras o ambos que identifica específicamente un lote.
Centro autorizado
Proveedores de materias primas que cumplen las especificaciones del RD 2.259/94 y, por tanto, remiten por cada lote, número de control de calidad y boletín de análisis.
SOLICITUD DE MATERIAS PRIMAS
Todas la materias primas empleadas por este servicio farmacéutico serán solicitadas a centros autorizados, según RD 2.259/94, y sólo aquellas que cumplan la Ley del Medicamento en cuanto a sustancias de acción e indicación reconocidas legalmente en España. En caso excepcional se solicitará su uso compasivo.
La solicitud será por escrito y debidamente archivada.
Caso de no existir materia prima suministrada por centro autorizado para la elaboración de una fórmula magistral, se cubrirá esa necesidad terapéutica del paciente obteniendo la sustancia de una especialidad farmacéutica comercializada, previa autorización del médico prescriptor y del paciente. Esta práctica será excepcional y siempre estará destinada a cubrir una necesidad terapéutica puntual.
RECEPCIÓN, REGISTRO Y CUARENTENA
Recepción
El personal que recepciona la materia prima debe realizar la comprobación de que lo recepcionado se corresponde con el material pedido. Para ello debe comprobar que:
* El albarán de entrega coincide con el material pedido (albarán de solicitud).
* El material recibido se corresponde con lo indicado en el albarán de entrega.
* El estado de envases, embalajes y etiquetado es el correcto.
* Se ha remitido el boletín de análisis con su número de referencia de control.
Después de esta primera inspección, las materias primas que cumplan con los requisitos citados con anterioridad se registran y pasan a la zona de cuarentena.
Registro
Contiene los datos mínimos que identifican cada materia prima que existe en la oficina de farmacia o servicio farmacéutico en el período de cuarentena y antes de la posible conformidad, y figuran en la guía de control, registro y especificaciones de materias primas.
Se ha desarrollado un aplicativo informático que gestiona estos datos, y que proporciona gran información en corto espacio de tiempo.
En la fase de registro previa a la cuarentena se especificarán los siguientes datos de la guía de control, registro y especificaciones (el resto quedará pendiente de la conformidad):
* Número de registro interno.
* nombre del producto: expresado en DOE o en su defecto en DCI.
* Proveedor.
* Número de lote: el indicado por el proveedor.
* Número de control de calidad: el indicado por el proveedor.
* Fecha de recepción: en la que se recibe el producto.
* Cantidad y número de envases.
Mediante el aplicativo informático se imprimirá una etiqueta donde figuren los datos descritos y una leyenda indicando «Materia prima en cuarentena» (fig. 2). La etiqueta se pega en el envase de la materia prima, siempre sin tapar la etiqueta original del proveedor.
Fig. 2. Etiqueta de materias primas en cuarentena.
Cuarentena
Una vez registradas las materias primas, éstas se colocarán en la zona de almacenamiento destinada a materias primas «en cuarentena», con su correspondiente etiqueta de cuarentena, en la que figurarán los datos del registro hasta su conformidad definitiva o rechazo.
Se ubicará en una estantería exclusiva para zona de cuarentena.
CONTROL DE CONFORMIDAD
Todas las materias primas se solicitarán a proveedores autorizados, según el RD 2.259/94. Estos fabricantes describen la farmacopea a la que se adapta la materia prima o, en su defecto, serán válidas las especificaciones del fabricante.
El farmacéutico responsable de estudiar la posible conformidad de la materia prima comprobará el boletín de análisis y especificaciones del fabricante. Pueden darse las siguientes circunstancias:
* Si se trata de una materia prima descrita en la Real Farmacopea Española. Se completarán los datos correspondientes a las especificaciones de la Guía a partir de dicha monografía.
* Si no se describe en la Real Farmacopea Española. Puede recurrirse a una farmacopea de reconocido prestigio, por el siguiente orden: Farmacopea Europea, USP, Farmacopea Británica u otras farmacopeas. Se complementarán los datos de la guía de esas farmacopeas.
* Si no se describe en farmacopea alguna. Se podrán aceptar las especificaciones del fabricante o proveedor completando los datos de la guía.
Una vez estudiados estos datos, el farmacéutico decidirá sobre la conformidad. Si la materia prima es aceptada, se le otorga un número de registro interno, el correspondiente a la guía de control, registro y especificaciones. Mediante aplicativo informático se obtendrá una etiqueta definitiva con los datos básicos de la guía y firma del farmacéutico responsable de la aceptación (fig. 3). La etiqueta, una vez firmada, se pegará en los envases de las materias primas que están situados en la zona de cuarentena, intentando no cubrir la etiqueta original del proveedor y retirando previamente la etiqueta de cuarentena. Posteriormente pasarán, según el orden de registro, a la zona de almacenamiento. Esta etiqueta será válida como guía de control, registro y especificaciones, dado que contiene todos los datos y la firma del farmacéutico responsable; de esta forma se simplifica el archivo de documentación.
Fig. 3. Etiqueta definitiva de materias primas aceptadas.
Por el contrario, si la materia prima es rechazada, deberá devolverse al proveedor a la mayor brevedad posible.
ALMACENAMIENTO
La zona de almacenamiento consta de estanterías que permiten un cómoda disposición por orden de registro interno. Mediante el aplicativo informático se obtendrán listados por orden alfabético de materias primas y número de registro interno, lo que permitirá una rápida búsqueda de las materias primas. Éstas se deben almacenar en condiciones que aseguren su buena conservación fisicoquímica y microbiológica, así como la ausencia de contaminación cruzada.
El servicio deberá contar con áreas perfectamente delimitadas para los productos en cuarentena y los rechazados. Dispondrá también de una nevera y un congelador con capacidad y temperatura adecuadas y dotadas de los correspondientes sistemas de registro de temperatura.
Los estupefacientes, sustancias psicotropas y otros productos sometidos a control especial, se almacenarán en áreas con las debidas medidas de seguridad y estarán bajo la responsabilidad del farmacéutico, que deberá cumplir con la normativa específica que regula estos productos.
Se tendrán en cuenta estos principios básicos de almacenamiento:
* Las materias primas quedarán almacenadas en perfecto orden de número de registro interno.
* Deben almacenarse sobre estanterías de cómodo acceso, nunca sobre el suelo o sobre la mesa de trabajo.
* Evitar almacenar en sitios de paso.
* No deben recibir luz natural directa.
* Las temperaturas recomendadas son: una temperatura ambiente inferior a 30º C; en nevera o refrigerador, 5 ± 3º C, y en congelador, inferior a 15º C.
* Deben mantenerse libres de basura, plagas y polvo.
* Deberá estar bien ventilado.
* No almacenar productos peligrosos, voluminosos o pesados en altura.
* Etiquetado legible y dispuesto hacia el usuario.
* Separación por incompatibilidades.
* Alejar productos sensibles al agua de tomas o conducciones y de material inflamable.
Al menos una vez al año el farmacéutico realizará una evaluación del estado de los productos almacenados, quedando registrada esa comprobación.
Se tendrá en cuenta la legislación vigente aplicable a productos químicos.
REGISTROS
Guía de control, registro y especificaciones de materias primas (fig. 1).
CONTROL DE CAMBIOS
Se utilizará el modelo que muestra la tabla 1.