¿Una perversión de la ingeniería genética?
Los genes controlan, a través de señales químicas, el desarrollo y la reparación de los músculos por su desgaste habitual. En el presente trabajo se describe cómo el músculo, que se pierde por la edad o la enfermedad, puede remplazarse mediante la inserción de un gen sintético que estimule o bloquee esas señales químicas, y cómo los atletas podrían recurrir a estas mismas técnicas para aumentar el tamaño, el vigor y la resistencia muscular. Es lo que los expertos han bautizado como «dopaje génico».
Durante los últimos años, los expertos en genética han empezado a descubrir variantes de genes que, de forma más o menos sutil, priman ciertos rasgos atléticos. Entre los atletas existen ejemplos de individuos con mutaciones naturales que les dan ventaja ante sus competidores.
En 2003, un equipo de investigadores australianos examinó el gen ACTN3 en un grupo de velocistas de elite, y encontraron que este grupo de deportistas tenía una abundancia, anormalmente elevada, de la versión activa del mencionado gen, que era seguramente el responsable de su excepcionalidad, puesto que codifica para una proteína específica de las fibras musculares rápidas. Otros grupos de investigación identificaron otras variantes de ese gen ACTN3 que, al parecer, proporcionaban a los atletas una clara ventaja; como la maximización de la captación de oxígeno, el rendimiento cardíaco, el rendimiento energético y la resistencia, entre otros.
En junio de 2004 se publicó, en la prestigiosa revista New England Journal of Medicine, la descripción de una mutación genética en humanos que eliminaba la producción de una molécula llamada miostatina. La supresión de la síntesis de miostatina supone un notable desarrollo muscular y fortaleza. En esos momentos, corrían rumores de que un campeón europeo de levantamiento de pesos tenía esta mutación codificada en sus genes. Otro ejemplo era el del esquiador de fondo finlandés Eero Mäntyranta, que a igual que el resto de su familia, tiene una mutación génica que causa una respuesta excesiva a la eritropoyetina y, por tanto, da lugar a cifras extraordinariamente elevadas de hematíes, las células sanguíneas transportadoras de oxígeno, lo que le daba, como ventaja ante sus competidores, una destacada resistencia. De hecho, otros miembros de su familia también destacaron en otras modalidades deportivas por su resistencia.
Está claro que estos genes, adquiridos de forma «natural», ofrecen ciertas ventajas a algunos deportistas. Conociendo estas ventajas, ¿justificaría ello que sus adversarios recurrieran, por ejemplo, a fármacos inhibidores de la miostatina, o se sometieran a terapia génica para competir en igualdad de condiciones? ¿No llevaría este argumento a reclutar a los niños que tuvieran esta dotación génica para ciertos deportes, mientras que a otros, carentes de la combinación correcta de genes, se les negaría la oportunidad de dedicarse profesionalmente al deporte? En este sentido, incluso hay quien se atreve a predecir la «mejora genética selectiva de superatletas».
Lo cierto es que las nuevas prácticas de dopaje que se plantean actualmente han aparecido como consecuencia de los avances en la medicina clínica. Del mismo modo que la eritropoyetina aportó un enorme beneficio a los enfermos renales crónicos, y después fue utilizada para aumentar la resistencia de los deportistas, la futura amenaza del dopaje genético para aumentar la fuerza física parte también de las investigaciones destinadas al tratamiento de otra patología: la distrofia muscular, un grupo de trastornos caracterizados por debilidad muscular progresiva y pérdida de tejido muscular.
Las técnicas que regeneran músculo pretenden aumentar su resistencia y protegerlo de la degradación. De este modo, con la terapia génica se podrá, mediante la introducción de un gen sintético al paciente, promover la fibrilación durante años a partir de la síntesis de cantidades elevadas de sustancias que participan en la histogénesis muscular.
Este tipo de terapia, con capacidad potencial para transformar la vida de personas de edad avanzada y las que sufren distrofia muscular, podría facilitar también el desarrollo muscular de los atletas que no han tenido la suerte de heredar esos genes. Además, las moléculas implicadas no pueden distinguirse de sus homólogos naturales, se podrían generan exclusivamente en el tejido muscular y serían indetectables en los controles de dopaje. Parece que las nuevas prácticas de dopaje consistirán en «inyecciones de genes» que modifiquen la información genética de las células y sean capaces de sintetizar determinadas proteínas de forma permanente y generar masa muscular adicional allá donde se necesite.
Según estudios recientes, esta variedad de dopaje conseguiría aumentar la fuerza muscular de un deportista hasta en un 27% sin ningún tipo de entrenamiento.
Imaginemos, por ejemplo, a un ciclista que quiere aumentar su masa muscular en el cuádriceps para mejorar su velocidad punta. Según las técnicas de entrenamiento actual, se debería centrar en realizar entrenamientos con pesas y series de trabajo de velocidad en la bicicleta.
En un futuro, este ciclista podría administrarse algo similar a una «inyección genética» dirigida al desarrollo de un músculo determinado sin añadir peso en ninguna otra parte del organismo.
Aprovechar los propios mecanismos celulares
Tal como se ha comentado, la idea de recurrir a la terapia génica para mejorar el tamaño y la resistencia muscular no surgió de las necesidades de los atletas de elite. El Dr. Lee Sweeney, catedrático de Fisiología de la Facultad de Medicina de la Universidad de Pennsylvania (EE.UU.), que dirige un proyecto que estudia la distrofia muscular, ha explicado que su trabajo comenzó en su entorno familiar. Sus antepasados vivieron hasta los 80 y 90 años y gozaban de buena salud; sin embargo, veían su calidad de vida mermada a causa de la debilidad muscular senil, puesto que el vigor y la masa de los músculos decaen hasta un tercio entre los 30 y 80 años.
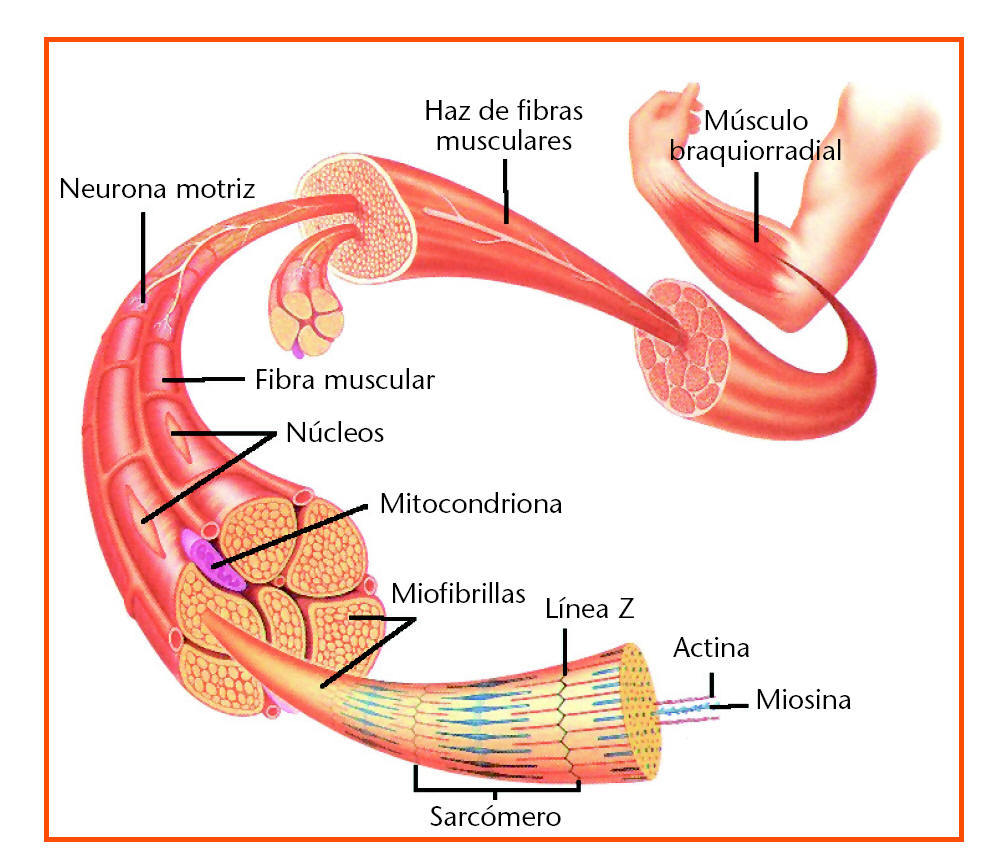
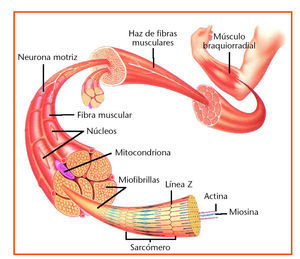
Nuestro organismo cuenta con tres tipos de músculo: el liso, que reviste las paredes de cavidades internas como el tracto intestinal; el cardíaco, situado en el corazón, y el esquelético, que constituye nuestro mayor órgano (fig. 1). Este último músculo es el que decae con la edad. Es importante saber que los músculos están capacitados para repararse, pero en el músculo senescente los mecanismos de reparación han perdido la capacidad de respuesta. A medida que envejecemos perdemos músculo esquelético debido a la incapacidad creciente de reparar el desgaste asociado a su uso normal. Es lo mismo que le sucede, pero a un ritmo más rápido, a una persona que presenta distrofia muscular.
Fig. 1. Estructura del músculo.
Durante el proceso de envejecimiento, a igual que en la distrofia muscular de Duchenne (la más común y grave), las fibras musculares mueren y se reemplazan por tejido fibroso infiltrante y grasa. En concreto, la distrofia muscular de Duchenne se caracteriza por la ausencia, debido a una mutación génica, de una proteína denominada distrofina, que es la encargada de proteger las fibras musculares del daño que produce en el músculo el movimiento habitual.
Para influir en el desarrollo muscular, los expertos se centran en el mecanismo molecular de producción y pérdida del músculo en condiciones normales. Pero para entender cómo actúa la terapia génica en la regeneración muscular, antes vamos a repasar, de forma breve, el funcionamiento del músculo.
A diferencia de las células típicas, con un núcleo y un citoplasma, las células musculares están constituidas por cilindros alargados y con múltiples núcleos; el citoplasma está formado por unas fibras muy delgadas y alargadas denominadas miofibrillas. A su vez, estas miofibrillas están formadas de unidades contráctiles menores denominadas sarcómeros. El acortamiento colectivo de los sarcómeros comporta la contracción muscular.
La fuerza generada por las contracciones de los sarcómeros se transmite al exterior de las fibras a través de proteínas que abarcan la membrana celular y se conectan con el tejido de la matriz extracelular. La distrofina, una de esas proteínas, absorbe el impacto de los choques protegiendo la membrana celular frente a posibles lesiones.
Pese a la acción protectora de la distrofina, las fibras musculares se deterioran en su uso normal. Y además, se supone que éste constituye el mecanismo mediante el cual el ejercicio promueve el desarrollo de la masa y resistencia muscular; es decir, los desgarros microscópicos de las fibras causados por el esfuerzo liberan una alarma química que dispara la regeneración del tejido en el músculo. Esto no significa producir nuevas fibras musculares sino reparar la membrana externa de las fibras preexistentes y rellenar su interior con nuevas miofibrillas, lo que genera un engrosamiento de la fibra muscular.
En la regulación de todo este proceso intervienen factores promotores e inhibidores del crecimiento. En respuesta al factor de crecimiento I, semejante a la proteína IGF-I, determinadas células experimentan un mayor número de divisiones celulares, mientras que otras proteínas, como la miostatina, inhiben su proliferación.
Inserción del gen sintético IGF-I
Inspirados en los mecanismos que se han explicado anteriormente, un grupo de investigadores de la Universidad de Pennsylvania, en colaboración con otro de la Universidad de Harvard, empezó a estudiar la posibilidad de utilizar el IGF-I para alterar la función muscular. Teniendo en cuenta que las células musculares se caracterizan por su longevidad, si introducían el gen de la IGF-I en las células musculares de personas de avanzada edad, se mantendría activo el resto de su vida.
Pero insertar un gen determinado en un tejido concreto constituye una de las mayores dificultades técnicas de la terapia génica. Para ello, estos grupos de investigación, liderados por la Dra. Nadia Rosenthal, utilizaron el virus adenoasociado (VAA), cuya ventaja principal reside en que infecta fácilmente los músculos humanos, pero no causa ninguna enfermedad conocida. Modificaron el virus con un gen sintético que producía IGF-I sólo en músculo esquelético.
Los ensayos con murinos fueron espectaculares. Observaron que la masa muscular total y el ritmo de crecimiento eran un 15-30% superiores a los valores normales, aun tratándose de individuos sedentarios. Además, los ratones de mediana edad, que recibieron la inyección, alcanzaron la edad senil sin experimentar debilitación muscular reseñable. Experimentos posteriores demostraron que la sobreproducción de IGF-I aceleraba la reparación muscular, incluso en ratones que sufrían una distrofia muscular grave.
A pesar de los extraordinarios resultados obtenidos con animales, la seguridad de la técnica aún está en entredicho, ya que, por ejemplo, se conoce que los tumores también son sensibles a la sobreproducción del factor de crecimiento IGF-I. Por otro lado, tampoco está claro si en humanos resulta mejor administrar el virus AAV a través de la sangre o mediante inyección directa al músculo. Los investigadores dicen que aún tardaran unos años para obtener la aprobación administrativa de los tratamientos basados en terapia génica con AAV-IGF-I.
Genes que vigorizan los músculos
De forma general, se podría decir que en un músculo normal los múltiples núcleos de una fibra muscular dirigen la síntesis de nuevas proteínas. Cuando se necesita reparar el tejido debido al desgaste normal de las contracciones, las señales químicas de la zona lesionada atraen células denominadas satélite, que proliferan antes de fusionarse con la fibra para contribuir con sus núcleos al esfuerzo. La agregación de núcleos adicionales y miofibrillas nuevas deja la fibra reparada más voluminosa que antes de la lesión.
El objetivo de la terapia génica es estimular y aumentar la reparación normal del tejido mediante la manipulación de las señales químicas implicadas. De este modo, el gen sintético se añade al músculo mediante un vector que lo transporta hasta el interior de un núcleo, donde induce la síntesis de una determinada proteína. Así, en la reparación normal del músculo, la proteína IGF-I transmite una señal a las células satélite para que proliferen, mientras que la miostatina, otra proteína, les ordena detenerse. Por tanto, la introducción de un gen IGF-I o el de una proteína que bloquee la comunicación entre la miostatina y las células satélites tendrá el mismo efecto: una mayor proliferación de las células satélite y, como consecuencia, una fibra muscular engrosada.
Un gen sintético puede simular una señal de lesión que fomenta la actividad reparadora de las células, de forma que las fibras musculares crecen más fuertes y voluminosas. Activar un gen silenciado (sin actividad) o añadir uno nuevo podría cambiar las fibras musculares de un tipo en otro.
A diferencia de los fármacos sistémicos, la terapia génica permite dirigirse a grupos musculares determinados, según las exigencias biomecánicas de cada deporte. Así, la activación del gen de la miosina 2B, silenciado en el hombre, transforma una fibra lenta en rápida. Por su parte, el gen de la forma activa de la proteína calcineurina permite conseguir más fibras lentas. Este tratamiento estaría indicado para los saltadores de altura o los lanzadores de pesos.
En resumen, se podría decir que la terapia génica podría aportar notables mejorar a los deportistas de elite, como un extraordinario desarrollo de la musculatura deseada, la modificación de su composición y el aumento de su resistencia.
La eritropoyetina es una proteína que promueve el desarrollo de los hematíes, las células que transportan el oxígeno en la sangre. La transferencia génica para acelerar la síntesis de eritropoyetina se ha ensayado ya en animales; sin embargo, los resultados no fueron los esperados. Se transfirieron genes de eritropoyetina sintéticos en monos y beduinos (en ambos casos el recuento de hematíes se dobló en unas 10 semanas), pero las sangre de estos animales se volvió tan densa que tenía que diluirse con regularidad para evitar un paro cardíaco.
Éste es sólo uno de los muchos ejemplos que demuestran que, por ahora, el dopaje genético no es seguro. Quedan todavía algunas investigaciones más para conseguir que las técnicas de transferencia de genes se puedan aplicar, al menos, con un mínimo de garantías.
Consideraciones éticas
Uno de los problemas que se plantean ante el posible uso del dopaje génico es que el producto del gen se encontraría en el interior de la célula del músculo y, por tanto, sería indetectable en la sangre y menos aún en la orina. Sólo una biopsia muscular, en el mejor de los casos, permitiría detectar la presencia de un gen sintético o un vector vírico.
De este modo, la única posibilidad de detección de esta forma de dopaje debería centrarse en el análisis directo de los músculos de los deportistas, a los que habría que extraerles muestras de tejido muscular.
La realización de biopsias musculares en el ámbito de la lucha antidopaje no parece factible debido al riesgo que comporta la técnica antes de una competición, y ni siquiera queda claro qué músculos habría que analizar. Además, en el caso del virus AVV, puesto que es inocuo, podría haber llegado al organismo mediante una infección normal, por lo que esa prueba tampoco tendría validez.
Por ahora, la transferencia génica no está al alcance de cualquiera, ya que requiere técnicas muy complicadas que aún están en fase de experimentación. Sin embargo, los comités responsables temen, como ocurrió en el caso de los esteroides artificiales, que pronto emerja un mercado ilegal de potenciación génica. Aun así, quizás en los próximos años algunas de estas terapias génicas ofrezcan seguridad suficiente para ser extendidas a la población en general y, por tanto, no tardarán en ser utilizadas por el mundo de la alta competición.
Las cuestiones éticas relacionadas con la mejora genética son tantas y tan complejas que su aplicación exigirá, seguramente, un cambio en la opinión pública acerca de la manipulación de los genes humanos.
Bibliografía general
Andersen L, Schjerling P, Saltin G. Bioquímica del rendimiento atlético. Investigación y ciencia. Madrid: 2000; p. 26-31.
Barton-Davis B et al. Proceedings of the National Academy of Science USA 1998;95;26;15603-7.
Sukho et al. Viral expression of insulin-like growth factor-i enhances muscle hypertrophy in resistance-trained rats. Journal of Applied Physiology 2004;96(3):1097-104.
Sweeney HL. Dopaje génico. Investigación y ciencia. Madrid: 2004; p. 19-25.
Taubes G. Toward molecular talent scouting. Scientific American Presents: Building the Elite Athlete 2000;11(3);26-31.