Daclizumab es un anticuerpo monoclonal IgG1 humanizado, obtenido mediante ingeniería genética que se une a la subunidad Tac del receptor de interleucina-2, expresado en los linfocitos T humanos activados. Está indicado en la prevención del rechazo agudo en pacientes receptores de trasplantes renales alogénicos.
El tratamiento inmunosupresor actual tiene dos aplicaciones principales en el trasplante: prevención del rechazo agudo/crónico y tratamiento del rechazo agudo. La experiencia clínica establece que la clasificación terapéutica de un agente inmunosupresor está determinada por la eficacia de su aplicación en vez de por su clase bioquímica.
Anticuerpos quiméricos y humanizados
Los anticuerpos policlonales, tales como ALG y ATG, son sueros con actividad inmunosupresora potente que se producen en conejos y caballos. Producen una linfopenia profunda y una depleción de linfocitos T prolongada, efectos que dan lugar a un aumento del riesgo de desarrollo de neoplasias e infecciones oportunistas. Uno de los principales problemas derivados de la administración de anticuerpos policlonales es la inmunosupresión excesiva, que está asociada a la falta de especificidad de los anticuerpos. Se puede manifestar en forma de infección, particularmente de tipo viral, como el citomegalovirus, y da lugar a una morbilidad y mortalidad significativa de los pacientes.
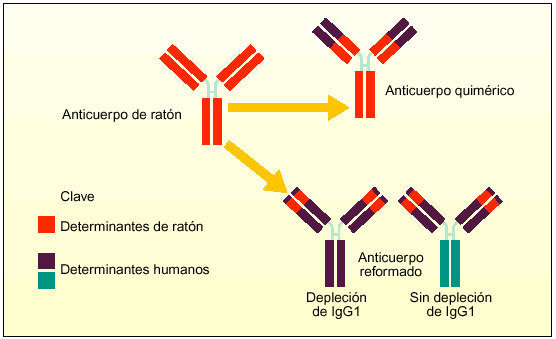
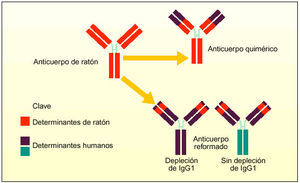
Los anticuerpos monoclonales, desarrollados desde principios de los años ochenta, van dirigidos contra varios procesos de la activación de los linfocitos T. Se han desarrollado diversos anticuerpos monoclonales contra el IL-2R de alta afinidad. Algunos de ellos han mostrado su eficacia aunque en muchos casos los resultados han sido decepcionantes. Las limitaciones terapéuticas parece que se deben a su origen murino o a que no están dirigidos contra un antígeno adecuado. Por ello, se están creando anticuerpos monoclonales murinos nuevos mediante ingeniería genética, en forma de anticuerpos monoclonales quiméricos o humanizados.
Daclizumab es un anticuerpo monoclonal humanizado, diseñado racionalmente mediante ingeniería genética, de vida media circulante larga, inmunogenicidad reducida y actividad citotóxica in vitro dependiente del anticuerpo elevada.
Los anticuerpos monoclonales humanizados conservan sólo los componentes mínimos necesarios del anticuerpo del ratón, sólo el lugar de unión al antígeno se combina con la estructura de la región V humana y las secuencias de la región C humana. Estos anticuerpos monoclonales conservan la capacidad de reconocer secuencias diana, pero son menos inmunogénicos que los anticuerpos de ratón o quiméricos. Estas características del diseño mejoran las propiedades farmacocinéticas del anticuerpo y reducen su inmunogenicidad, lo que permite prolongar el período de tratamiento y administrar tratamientos repetidos. La vida media sérica larga de estos anticuerpos monoclonales implica que se pueden manipular como una proteína endógena.
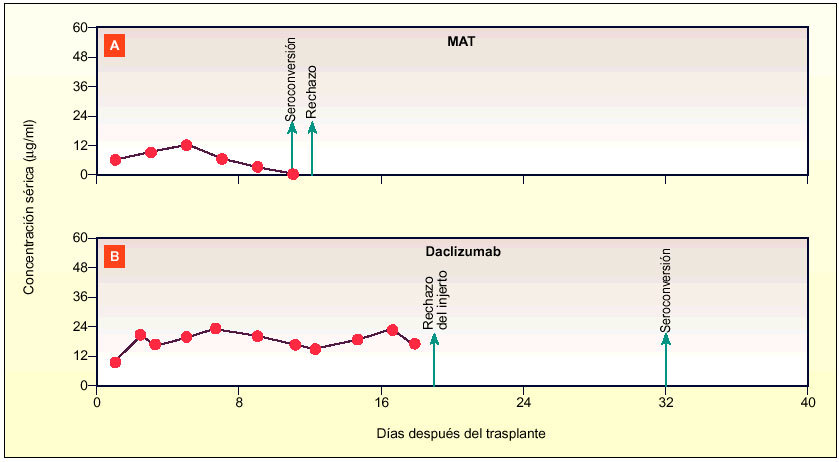
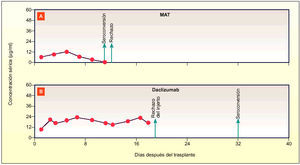
Concentraciones séricas de MAT (A) y daclizumab (B) en monos Cynomolgus
Se han tratado con oxaliplatino más de 1.700 pacientes con cáncer colorrectal en el marco de ensayos clínicos, por lo que existe una amplia experiencia sobre su tolerabilidad.
Mecanismo de acción
Daclizumab ejerce sus efectos inmunosupresores bloqueando la unión de IL-2 al receptor IL-2 de alta afinidad en los linfocitos T. Esto da lugar a la inactivación o destrucción selectiva de los linfocitos portadores de Tac (antígeno de activación de las células T) estimulados por el aloantígeno.
La actividad inmunosupresora de daclizumab se demuestra por su eficacia. Se han evaluado también una serie de parámetros farmacodinámicos y farmacocinéticos.
Farmacodinamia
Se estudió la unión y la actividad biológica in vitro de daclizumab y se comparó con la de Mat (anti-Tac murino). Se utilizaron sistemas de cultivo de células humanas ya que la unión de daclizumab es estrictamente específica de la especie.
El resumen de los estudios muestra que daclizumab tiene una afinidad alta por IL-2R (un receptor celular de superficie) y bloquea con eficacia la activación y la proliferación de las células T. También posee la propiedad adicional de promover ADCC (células dependientes de anticuerpos) con células mononucleares humanas in vitro.
Farmacocinética
La farmacocinética de daclizumab se determinó en pacientes que recibían su primer trasplante renal. Se utilizó una técnica para obtener muestras séricas limitadas (aproximadamente cinco muestras por paciente).
La farmacocinética se obtuvo en tres estudios clínicos en pacientes sometidos a trasplante renal.
Las características farmacocinéticas principales de daclizumab en receptores de trasplante renal son las siguientes:
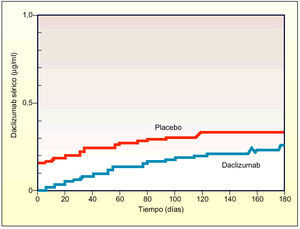
La vida media de eliminación es de 20 días y es equivalente a la comunicada para Ig en humanos sanos.
El aclaramiento sistémico es bajo y está parcialmente influido por el peso corporal y, en menor medida, por la edad, el sexo, la raza y las proteínas urinarias. Por consiguiente, la dosis de daclizumab basada en mg/kg es apropiada, y en las subpoblaciones de pacientes sometidos a trasplante renal no es necesario realizar otros ajustes que no sean los basados en el peso corporal.
El volumen de distribución es reducido, aproximadamente 6 l, el fármaco se distribuye por todo el espacio vascular y también penetra en el espacio extravascular.
Con el régimen de administración recomendado (1,0 mg/kg cada 14 días, hasta un total de cinco dosis), se mantienen niveles séricos suficientes para proporcionar una actividad inmunosupreso ra, al menos, durante los 3 meses críticos posteriores al trasplante.
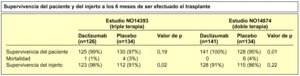
Tasa de incidencia de rechazo agudo demostrado por biopsia, según estimaciones de Kaplan-Meier
No se han realizado estudios de metabolismo/catabolismo de daclizumab ya que es una proteína YgG humanizada y por ello se espera que su disposición sea similar a la de la proteína IgG endógena. La tasa de catabolismo de una inmunoglobulina está controlada por la región Fc de la inmunoglobulina.
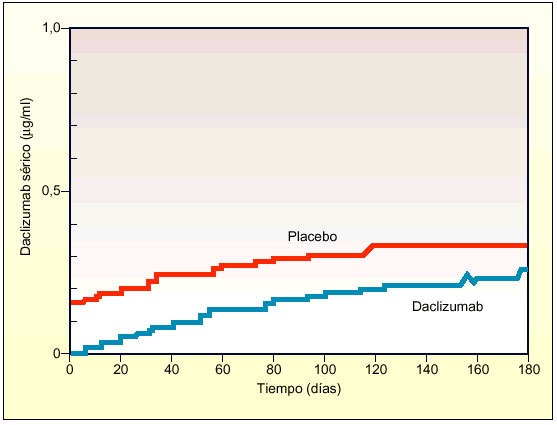
IgG es la inmunoglobulina predominante en el suero. Aproximadamente, el 50% del reservorio total de IgG en el organismo se encuentra en el espacio intravascular, y el resto en el espacio extravascular-extracelular. Se estima que la vida media de eliminación de IgG es de 18-23 días en personas sanas y es dependiente de la concentración. Sin embargo, la tasa de catabolismo de IgG no resulta afectada por la concentración de otras inmunoglobulinas, ni está relacionada con el número de células plasmáticas que sintetizan las moléculas de inmunoglobulina. La similitud observada entre daclizumab e IgG con respecto al tiempo de vida media y volumen de distribución, sugiere que daclizumab se comporta de manera similar a la IgG endógena y, por consiguiente, debería mostrar pocas de las consecuencias clínicas asociadas con una proteína extraña, es decir, inmunogenicidad y reacciones a la primera dosis.
Tolerancia y seguridad
La seguridad de daclizumab se determinó en cuatro estudios clínicos, tres de los cuales fueron ensayos clínicos de selección aleatoria, controlados, en 629 pacientes que recibieron aloinjertos renales. De la muestra total, 336 pacientes recibieron daclizumab, mientras que 293 recibieron placebo.
En comparación con el placebo, daclizumab no aumentó significativamente el perfil de toxicidad del régimen inmunosupresor concomitante. Los efectos adversos comunicados estaban relacionados con el procedimiento del trasplante y los otros fármacos del régimen inmunosupresor.
Se comunicaron efectos adversos en el 95% de los pacientes del grupo tratados con placebo y en el 96% de los pacientes del grupo al que se administró daclizumab. La proporción de pacientes que se retiró prematuramente de los estudios combinados debido a los efectos adversos fue del 8,5% en el grupo tratado con placebo y del 8,6% en el grupo tratado con daclizumab. La administración del fármaco no se asoció con un aumento de la incidencia de efectos adversos graves, infecciones o neoplasias.
Los efectos adversos comunicados con más frecuencia fueron trastornos gastrointestinales con incidencia similar en el grupo tratado con el fármaco y en el tratado con placebo.
Daclizumab no aumentó la incidencia de episodios infecciosos (72% en el grupo placebo y 68% en el grupo daclizumab). Los tipos de infecciones comunicadas fueron similares en ambos grupos. La adición de daclizumab no aumentó el número de linfomas después del trasplante, que se produjeron con una frecuencia del 1% en los grupos tratados con placebo y daclizumab.
Conclusión
Daclizumab es un anticuerpo monoclonal humanizado diseñado por ingeniería genética; el 90% de las secuencias que lo componen son humanas, lo cual le confiere importantes ventajas como una vida media circulante más larga e inmunogenicidad reducida. Se utiliza conjuntamente con terapia inmunosupresora doble o triple y reduce significativamente la incidencia de rechazo agudo. Es eficaz y bien tolerado cuando se administra a una dosis de 1,0 mg/kg cada dos semanas, hasta un total de 5 dosis en pacientes sometidos a trasplante renal alogénico. Su administración no da lugar a la producción de anticuerpos clínicamente relevantes y se ha demostrado que utilizado en combinación con ciclosporina, corticosteroides y micofenolato mofetil, tiene un perfil de tolerancia y seguridad favorable