Las larvas de cestodos, también conocidas como tenias, son las responsables de las cestodosis larvarias. En el presente trabajo se aborda la etiología, epidemiología, sintomatología, diagnóstico, prevención y tratamiento de tres cestodosis larvarias: hidatidosis, esparganosis y cisticersosis.
Las cestodosis larvarias son enfermedades parasitarias producidas por larvas de cestodos (tenias). El hombre puede ser hospedador intermediario normal o accidental de algunas tenias, es decir, puede albergar las formas larvarias de estos parásitos. Es hospedador intermediario normal en el ciclo biológico de la tenia Vampirolepis nana y hospedador accidental en el ciclo de Taenia solium y Echinococcus granulosus, adquiriendo las enfermedades denominadas cisticercosis e hidatidosis, respectivamente. Más esporádicamente puede verse afectado por las larvas de algunas tenias de animales, como es el caso de la esparganosis
Hidatidosis
Es una zoonosis parasitaria producida por el desarrollo de larvas, hidátides, de especies de cestodos (tenias), del género Echinococcus Rudolphi, 1801.
Dentro del género Echinococcus hay tres especies de las que el hombre puede ser hospedador intermediario: Echinococcus granulosus, E. multilocularisy E. vogeli. El agente etiológico de esta parasitosis en el hombre es mayoritaria, aunque no únicamente, el cestodo Echinococcus granulosus Batsch, 1786.
Etiología
En el desarrollo de esta especie se diferencian dos fases o estadios:
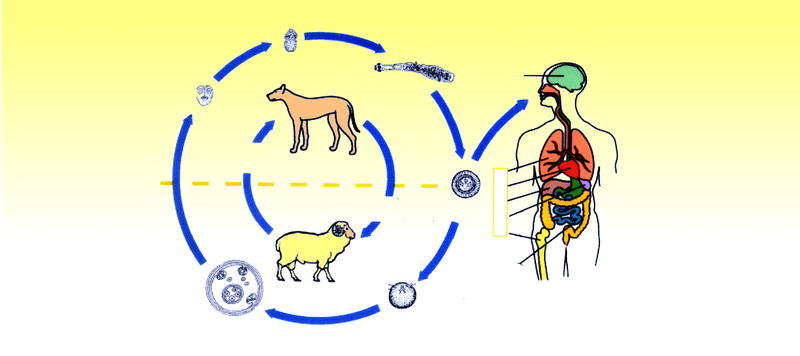
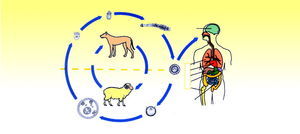
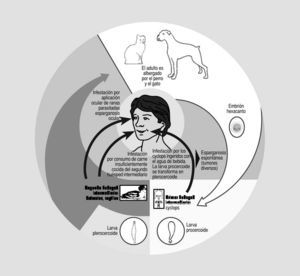
Adulto. Gusano de tamaño microscópico, aproximadamente 7 mm, que vive adherido al intestino delgado del hospedador definitivo, en donde puede vivir hasta 2 años. Dentro de los hospedadores definitivos el más frecuente es el perro, aunque también destaca el zorro y el lobo. El hospedador definitivo al defecar expulsa el último segmento de la tenia, que contiene en su interior huevos que contaminan el suelo, agua, pastos, verduras, etc. Estos huevos presentan una viabilidad elevada, que oscila de meses a años según las condiciones. Una vez que los huevos salen al exterior deben ser ingeridos por el hospedador intermediario; entre los hospedadores intermediarios más frecuentes están la oveja, el cerdo, reno, canguro, caballo, jirafa, mono y el hombre. Los huevos, una vez que llegan al intestino delgado del hospedador intermediario, dejan en libertad el embrión (fig. 1).
Larva. Se libera el embrión, como hemos dicho anteriormente, en el intestino delgado del hospedador intermediario y pasa a las venas mesentéricas, a los capilares y posteriormente se instala en distintos órganos mayoritariamente en el hígado y en menor medida en los pulmones, riñón1, aparato genitourinario2, músculo3 y cerebro4. Una vez instalado el embrión, a partir de él se desarrollan las larvas que pueden llegar a transformarse en quistes. Estos quistes hidatídicos, sí presentan protoescólex viables, al ser ingeridos por los hospedadores definitivos les transmiten la parasitosis.
Epidemiología
Echinococcus granulosus es un parásito de distribución cosmopolita. La infección humana es menos común que en otros reservorios, aunque en determinadas zonas geográficas esta parasitosis puede considerarse endémica5,6.
En América del Sur un alto porcentaje de perros alberga el gusano adulto y origina un importante problema de salud pública debido a la alta parasitación de los humanos. Un problema similar, aunque a menor escala sucede en el Sur de Australia donde el perro es también un importante reservorio de la parasitosis.
Grecia, España e Inglaterra son los países europeos con mayor incidencia de la enfermedad.
Patogénesis y sintomatología
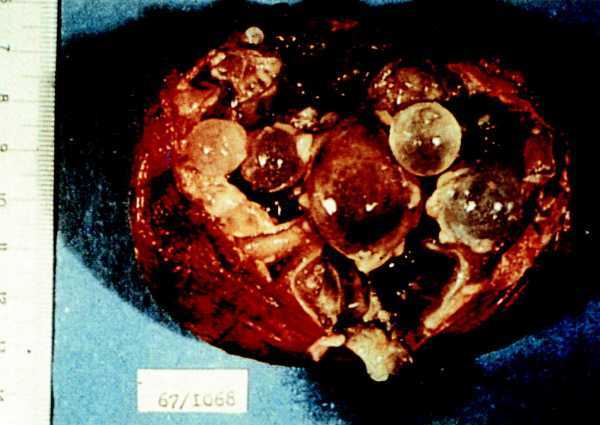
La aparición de síntomas está condicionada por la localización y el tamaño del quiste. El quiste hidatídico crece muy lentamente y durante mucho tiempo sin originar síntomas aparentes y cuando ha alcanzado un gran tamaño o se rompe, es cuando la persona parasitada empieza a encontrarse mal.
La localización más frecuente del quiste es la hepática, donde generalmente presenta un curso asintomático, que puede transformarse en sintomático al aumentar de tamaño o al presionar un conducto biliar. Los quistes localizados en los pulmones, al aumentar de tamaño, provocan tos, dolor en el pecho o respiración entrecortada.
Diagnóstico
Un examen radiológico o una ecografía pueden evidenciar la existencia de quistes hidatídicos que habían pasado desapercibidos por la inexistencia de síntomas previos.
Si bien, también es de utilidad la realización de tomografías computarizadas o de pruebas con ultrasonidos. Pruebas serológicas como la hemaglutinación indirecta o la técnica ELISA pueden ser útiles, aunque hay que tener precaución ya que existen reacciones cruzadas con la cisticercosis y la esparganosis.
Tratamiento
El tratamiento farmacológico se realiza con la administración de derivados benzimidazólicos, mebendazol y albendazol. Su objetivo final es conseguir la erradicación de la parasitosis, aunque si se consigue detener el crecimiento larvario ya sería un éxito significativo, ya que los resultados conseguidos con terapia farmacológica no han sido muy importantes. El uso del mebendazol en la hidatidosis se centra, ante todo, en quistes inoperables o en recaídas tras la extirpación quirúrgica, siendo los resultados variables de unos casos a otros. El tratamiento quirúrgico, constituye actualmente la solución más eficaz para eliminar los quistes hidatídicos7, ya que cualquier quiste calcificado puede tener capacidad germinativa, pudiendo producir abscesos hepáticos o romper después de un golpe traumático8, provocando así la propagación de la arena hidatídica con la consiguiente diseminación de los quistes.
En los hospedadores definitivos el tratamiento más eficaz consiste en la administración de praziquantel cada 30 días. Las heces eliminadas por el perro a las 72 horas posteriores a la administración del tratamiento deben ser recogidas y posteriormente incineradas.
Prevención
La educación sanitaria de la población constituye la medida más importante para controlar la evolución de la parasitosis.
Lavarse las manos antes de comer y con especial esmero si se ha tocado un perro.
Se debe mantener a los hospedadores definitivos alejados de la habitación, de las huertas y de las fuentes de agua para evitar infecciones masivas.
Consumir solamente agua potable.
Lavar las frutas, verduras y hortalizas minuciosamente bajo un chorro fuerte de agua.
Evitar el contacto de los perros domésticos con perros vagabundos.
No alimentar a perros con vísceras.
En algunas comunidades españolas se viene desarrollando desde 1990 programas de control y prevención destinado en la eliminación de perros vagabundos y en la administración de antihelmínticos para erradicar los quistes.
Esparganosis
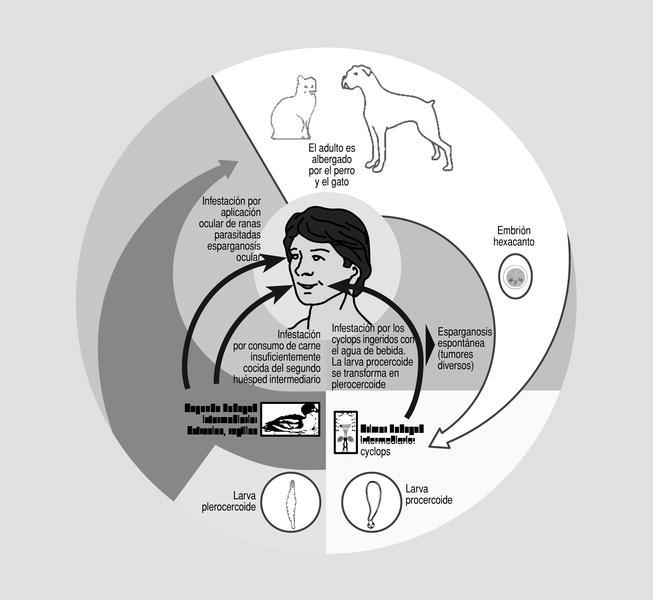
Es una zoonosis parasitaria producida por la larva espargano o plerocercoide de tenias pertenecientes al género Spirometra Mueller, 1937, muy relacionadas con las del género Diphillobothrium Lühe, 1910, cuyos adultos se encuentran en los mamíferos, especialmente en perros y gatos.
Epidemiología
La esparganosis ha sido descrita en animales y en el hombre en países de Lejano Oriente, Estados Unidos, Australia y Sudáfrica. Aunque existe esparganosis animal en Latinoamérica y en Europa, no se han denunciado casos humanos. Las especies más conocidas, responsables de esparganosis, son: Spirometra mansoni Joyeux y Houdemer, 1927 prevalente en Asia sudoriental y Spirometra moansonoides Mueller, 1935, descrita en Estados Unidos.
Etiología
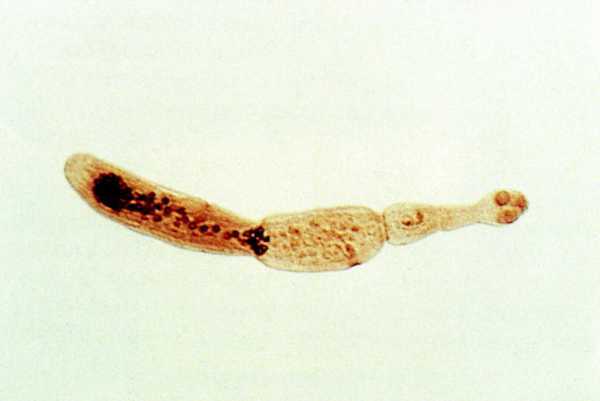
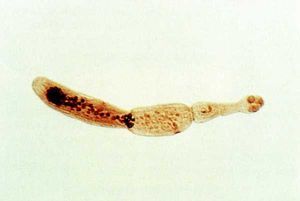
Las larvas procercoide de estos cestodos se desarrollan en copépodos (pequeños crustáceos acuáticos) y las larvas plerocercoide o espargano en peces, anfibios o mamíferos (fig. 2).
El hombre puede infestarse, ocasionalmente, por vía oral, al ingerir copépodos infestados con larvas procercoides o al comer pescado o anfibios (ranas o serpientes) crudos con larvas plerocercoides. Estas larvas atraviesan entonces la pared intestinal y se desplazan por el interior del organismo humano, mas o menos tiempo, hasta que se inmovilizan.
También puede adquirirse la infestación al aplicar con fines terapéuticos sobre las heridas especialmente las localizadas a la altura de los ojos, emplastos de carne cruda de rana parasitada con larvas espargano. Estas larvas, atraídas por el calor del cuerpo humano, penetran y se encapsulan en el ámbito ocular.
La esparganosis humana no suele ser demasiado peligrosa, excepto si afecta la órbita ocular. Los estados larvarios al movilizarse en los tejidos o subcutáneamente, provocan dolor, edema y una elevada eosinofilia.
Clínicamente se distinguen dos tipos de esparganosis: la común, consecuencia de la ingestión de larvas, éstas migran dentro del hospedador, dando lugar a prurito (escozor) y dolor. La inmovilización de las larvas se traduce en la aparición de tumores, de localización variable, generalmente subcutáneos, aunque también pueden ser musculares, mucosos o vesicales. En la biopsia de estos tumores se observa la presencia de larvas plerocercoide, rodeadas por una fuerte reacción inflamatoria.
La esparganosis ocular, consecuencia de la aplicación de carne de rana parasitada en contacto con el ojo, es bien conocida por los oftalmólogos de Extremo Oriente. La penetración ocular de la larva va seguida de un período de 6-12 días sin síntomas, tras los cuales aparecen picores y molestias durante el movimiento de los ojos, así como trastornos en la visión. Los dolores son de intensidad variable. Estos síntomas coinciden con la aparición de inflamación pruriginosa y tumefacción en el ojo. En ocasiones se producen infecciones secundarias que complican la evolución y pueden conducir a la pérdida del ojo.
Tratamiento
El tratamiento quirúrgico ha resultado ser el más eficaz sobre todo en la subcutánea, con una rápida recuperación. En la esparganosis ocular se recomendó9 la inyección de alcohol etílico con procaína, para destruir el parásito y poder ser absorbido. También se ha probado con éxito la inyección intravenosa con novarsenovenzol10. Cuando las larvas están en movimiento la terapéutica quirúrgica es impracticable y se ha probado el mebendazol sin éxito y el praziquantel mal tolerado por el paciente11.
Prevención
En la esparganosis común, consiste en evitar el consumo de carne cruda de renacuajos, ranas, culebras, y mamíferos parasitada con larvas espargano. En la esparganosis ocular, abandonar los métodos terapéuticos ancestrales, como la aplicación de cataplasmas en las heridas. También en áreas endémicas el agua de bebida con posibilidad de contaminación con copépodos parasitados, debe ser hervida o filtrada adecuadamente.
Cisticercosis
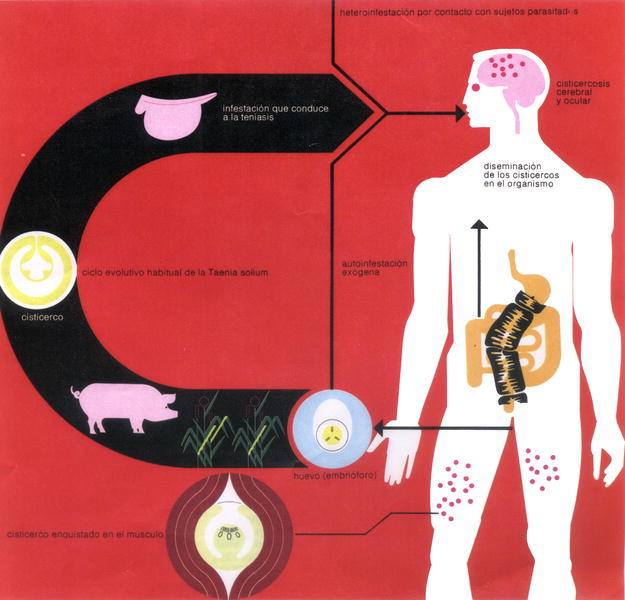
Infestación producida por la larva cisticerco de Taenia solium. El hombre adquiere esta parasitosis cuando de forma accidental entra en contacto con el cisticerco convirtiéndose en hospedador intermediario de dicho cestodo.
Etiología
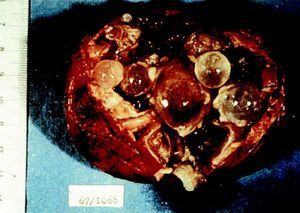
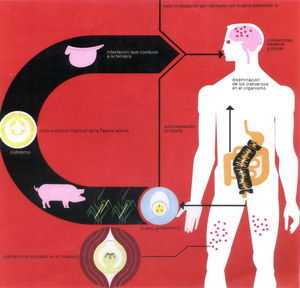
La fuente de transmisión en la cisticercosis es, en casi todos los casos, el hombre. La infestación humana puede producirse de varias formas: autoinfestación exógena, en la que un paciente infestado por Taenia solium ingiere de forma accidental las proglótides que expulsa; también se ha sugerido la posibilidad de que los huevos de Taenia presentes en el aparato digestivo pudieran eclosionar provocando una autoinfestación endógena. La forma más probable de contagio se centra en la ingestión de alimentos contaminados con heces de personas parasitadas por Taenia solium (fig. 3).
Epidemiología
Las principales formas de contagio humano incluyen la ingestión de comida contaminada con huevos de Taenia solium12 y la transmisión ano-mano-boca en individuos portadores de este parásito en su intestino, pudiendo autoinfestarse o infestar a otra persona.
Esta parasitosis constituye un serio problema de salud pública en diferentes países de América Latina, África y Asia13,14,15,16. En África y Asia la importancia de esta enfermedad varía mucho de unas países a otros, debido a sus diferentes hábitos alimenticios y a su tendencia religiosa. En los países musulmanes esta parasitosis es casi inexistente, debido a que el Corán prohíbe el consumo de carne de cerdo, hospedador definitivo de este parásito. Por el contrario en la India y África Central, donde la carne es consumida sin control higiénico, la cisticercosis es una enfermedad endémica17,18.
Debido al incipiente aumento de turismo y los grandes movimientos migratorios de individuos procedentes de áreas endémicas la incidencia de la cisticercosis ha aumentado en los países desarrollados19,20, especialmente en Estados Unidos donde la entrada de inmigrantes procedentes de América Latina ha condicionado un aumento importante de la incidencia de esta enfermedad21,22. A pesar de todo, la prevalencia exacta de esta parasitosis no se puede determinar debido a la inespecificidad de sus manifestaciones clínicas.
Patogenia y sintomatología
Las manifestaciones clínicas asociadas a la cisticercosis dependen del número y localización de los parásitos en el hombre, así como en la variabilidad de la respuesta inmune del hospedador frente al parásito.
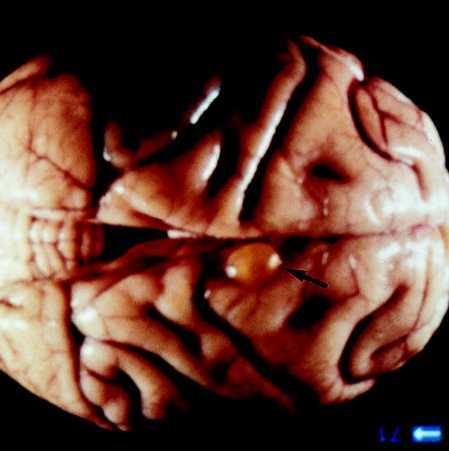
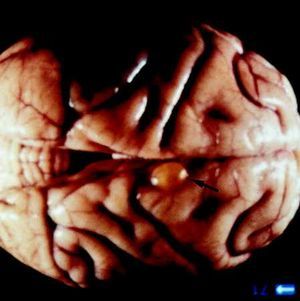
Este parásito tiene una predisposición particular a afectar el sistema nervioso, produciendo una patología que se conoce con el nombre de neurocisticercosis23,24.
En los enfermos con neurocisticercosis los síntomas más frecuentes son déficit motor, movimientos involuntarios y la manifestación clínica más frecuente es la epilepsia caracterizada por crisis tónico-clónicas generalizadas25. Si los cisticercos se localizan dentro de los ventrículos cerebrales pueden producir una hidrocefalia que generalmente conduce a la muerte.
Debido al incipiente aumento de turismo y los grandes movimientos migratorios de individuos procedentes de áreas endémicas la incidencia de la cisticercosis ha aumentado en los países desarrollados
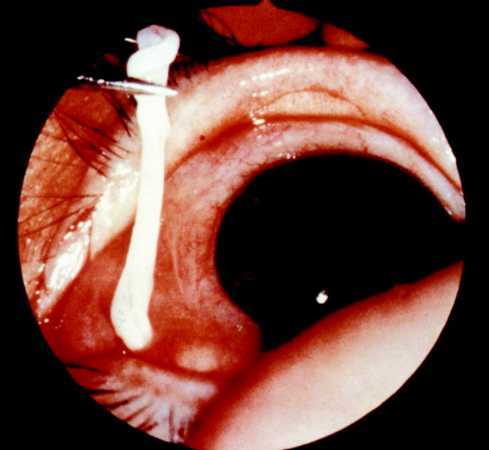
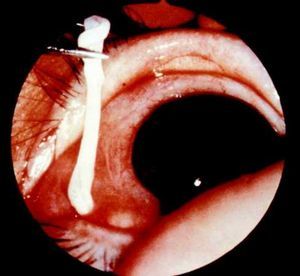
Además de en el cerebro, los cisticercos pueden localizarse en el ojo donde al desarrollarse pueden conducir a una disfunción en la agudeza visual.
En los músculos, generalmente los quistes calcifican sin producir trastornos aunque, puede producirse una pseudohipertrofia muscular acompañada de fiebre alta y eosinofilia.
La muerte de los cisticercos suele conducir a menudo a una exacerbación de los síntomas y a una reacción inflamatoria extensa alrededor de los parásitos muertos o moribundos.
Diagnóstico
La interpretación de los exámenes de neuroimagen e inmunológicos permite el diagnóstico de la cisticercosis.
Si el cisticerco está localizado en el ojo puede ser descubierto con un examen oftalmoscópico26.
Si éste está localizado en el tejido subcutáneo puede identificarse mediante radiografías o incluso por palpación27,28.
Tratamiento
Debido a la gran variedad de casos que existen de cisticercosis no es posible un solo esquema de tratamiento.
Tanto en praziquantel como el albendazol son drogas de elección en el tratamiento de estas parasitosis. La eficacia del albendazol es superior a la del praziquantel, ya que el primero es capaz de destruir a los 8 días de tratamiento del 75 al 90% de los quistes parenquimatosos.
Existen formas de neurocisticercosis que no pueden ser tratadas con productos cestocidas, ya que el uso de esos medicamentos puede exacerbar el edema que acompaña a esas manifestaciones.